Aciphex 10mg, 20mg Rabeprazole 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
アシフェックス 10mg とは何ですか?
アシフェックス 10mg は、胃食道逆流症 (GERD)、ヘリコバクター ピロリ、および腸潰瘍の症状を治療するために使用される処方薬です。アシフェックス 10mg は、単独で使用することも、他の薬と併用することもできます。
アシフェックスはプロトンポンプ阻害剤です。
アシフェックス 20mg 遅延放出錠が 12 歳未満の子供に安全かつ有効であるかどうかは不明です。アシフェックス 10mg 遅延放出錠 (スプリンクル) が 1 歳未満の子供に安全で効果的かどうかはわかっていません。
アシフェックス 10mg の副作用の可能性は何ですか?
アシフェックスは、次のような重大な副作用を引き起こす可能性があります。
- 激しい胃痛、
- 血便、
- 突然の痛み、股関節、手首、または背中の動きの困難、
- 発作(けいれん)、
- いつもより少ない排尿、
- 尿に血が混じる
- 腫れ、
- 急激な体重増加、
- 関節痛、
- 日光によって悪化した頬や腕の皮膚発疹、
- めまい、
- 速いまたは不規則な心拍数、
- 筋肉の動きを震わせたりけいれんさせたりする(震え)、
- ぎくしゃくした感じ、
- 手や足の筋肉のけいれんやけいれん、
- 咳、
- 嚥下困難または窒息、
- 頭痛、
- 弱点、
- あざ、
- 異常な出血(鼻血、歯茎)、
- 赤またはピンクの尿、
- 月経量が多い、
- 血便またはタール便
- コーヒーかすのような吐血や吐血、
- 制御が困難な出血、
上記の症状がある場合は、すぐに医療機関を受診してください。
アシフェックスの最も一般的な副作用は次のとおりです。
- 頭痛、
- 吐き気、
- 嘔吐、
- 下痢、
- 便秘、
- 胃痛、
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらはアシフェックスの考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
説明
アシフェックス 20mg 遅延放出錠の有効成分は、プロトンポンプ阻害剤であるラベプラゾールナトリウムです。これは、2-[[[4-(3 メトキシプロポキシ)-3-メチル-2-ピリジニル]-メチル]スルフィニル]-1H-ベンズイミダゾール ナトリウム塩として化学的に知られている置換ベンズイミダゾールです。実験式は C18H20N3NaO3S で、分子量は 381.42 です。ラベプラゾールナトリウムは、白色からわずかに黄白色の固体です。水、メタノールに極めて溶けやすく、エタノール、クロロホルム、酢酸エチルに溶けやすく、エーテル、n-ヘキサンに不溶。ラベプラゾールナトリウムの安定性はpHの関数です。酸性媒体では急速に分解され、アルカリ性条件下ではより安定します。構造図は次のとおりです。
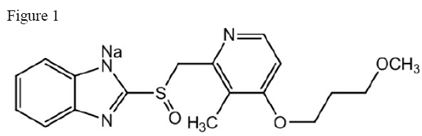
ACIPHEX は、20 mg のラベプラゾール ナトリウムを含む遅延放出腸溶性錠剤として経口投与できます。
20 mg 錠剤の不活性成分は、カルナウバ ワックス、クロスポビドン、ジアセチル化モノグリセリド、エチルセルロース、ヒドロキシプロピル セルロース、フタル酸ヒプロメロース、ステアリン酸マグネシウム、マンニトール、プロピレン グリコール、水酸化ナトリウム、フマル酸ステアリル ナトリウム、タルク、および二酸化チタンです。黄色酸化鉄は、錠剤コーティングの着色剤です。酸化鉄の赤はインクの顔料です。
適応症
成人のびらん性または潰瘍性 GERD の治癒
ACIPHEX 20mg 遅延放出錠剤は、びらん性または潰瘍性胃食道逆流症 (GERD) の治癒および症状緩和における短期 (4 ~ 8 週間) 治療に適応されます。 8 週間の治療後に治癒しなかった患者には、ACIPHEX の追加の 8 週間のコースが考慮される場合があります。
成人におけるびらん性または潰瘍性 GERD の治癒の維持
ACIPHEX 徐放性錠剤は、びらん性または潰瘍性胃食道逆流症 (GERD 維持) 患者の治癒を維持し、胸やけ症状の再発率を低下させるために使用されます。対照研究は 12 か月を超えない。
成人における症候性GERDの治療
ACIPHEX 20mg 遅延放出錠は、最大 4 週間の成人の GERD に関連する日中および夜間の胸やけおよびその他の症状の治療に適応されます。
成人の十二指腸潰瘍の治癒
ACIPHEX 20mg 遅延放出錠剤は、十二指腸潰瘍の治癒および症状緩和における短期 (最大 4 週間) 治療に適応されます。ほとんどの患者は 4 週間以内に治癒します。
成人の十二指腸潰瘍再発のリスクを軽減するためのヘリコバクター・ピロリ除菌
ACIPHEX 10mg 徐放錠は、アモキシシリンおよびクラリスロマイシンと組み合わせた 3 剤レジメンで、H. pylori 感染および十二指腸潰瘍疾患 (活動性または過去 5 年以内の病歴) を有する患者の H. pylori を根絶するための治療に適応されます。 . H. pylori の除菌は、十二指腸潰瘍の再発リスクを低下させることが示されています。
治療に失敗した患者では、感受性試験を実施する必要があります。クラリスロマイシンに対する耐性が示された場合、または感受性試験が不可能な場合は、代替の抗菌療法を開始する必要があります[ 臨床薬理学 およびクラリスロマイシンの完全な処方情報]。
成人のゾリンジャー・エリソン症候群を含む病理学的過剰分泌状態の治療
ACIPHEX 徐放錠は、ゾリンジャー・エリソン症候群を含む病理学的過剰分泌状態の長期治療に適応されます。
12 歳以上の思春期患者における症候性 GERD の治療
ACIPHEX 20mg 遅延放出錠は、12 歳以上の青少年の症候性 GERD の治療に最大 8 週間適応されます。
投薬と管理
表 1 は、12 歳以上の成人および思春期患者における ACIPHEX 遅延放出錠の推奨用量を示しています。 ACIPHEX 遅延放出錠剤の使用は、1 歳から 12 歳未満の小児患者には推奨されません。 1 歳から 12 歳未満の小児患者には、別のラベプラゾール製剤を使用してください。
管理手順
- アシフェックス 20mg 遅延放出錠を丸ごと飲み込んでください。錠剤を噛んだり、つぶしたり、割ったりしないでください。
- 十二指腸潰瘍の治療には、食後にアシフェックス遅延放出錠を服用してください。
- ヘリコバクター ピロリの除菌には、アシフェックス 20mg 遅延放出錠を食事と一緒に服用してください。
- 他のすべての適応症については、ACIPHEX 遅延放出錠は食事の有無にかかわらず服用できます。
- 飲み忘れた分はできるだけ早く服用してください。次の服用時間が近い場合は、忘れた分を飛ばして通常のスケジュールに戻してください。同時に2回服用しないでください。
供給方法
剤形と強度
ACIPHEX 10mg 遅延放出錠剤は、1 つの強度である 20 mg で提供されます。錠剤は、円形、淡黄色、腸溶性コーティング、両凸錠剤です。 「ACIPHEX 20」は錠剤の片面に赤色で刻印されています。
保管と取り扱い
アシフェックス 20mg 徐放性の淡黄色の腸溶性コーティング錠として提供されます。片面に名前と強さ(ミリグラム単位)(ACIPHEX 20)が刻印されています。
30本のボトル( NDC 69784-243-30)
25°C (77°F) で保管してください。 15 ~ 30°C (59 ~ 86°F) まで許容されるエクスカーション [参照 USP制御の室温 ]。湿気から保護してください。
配布元:エーザイ株式会社、Woodcliff Lake、NJ 07677。改訂:2022 年 3 月
副作用
次の重篤な有害反応は、以下およびラベルの他の場所で説明されています。
- 急性尿細管間質性腎炎 [参照 警告と注意事項 ]
- クロストリジウム・ディフィシル関連下痢[参照 警告と注意事項 ]
- 骨折 [参照 警告と注意事項 ]
- 重度の皮膚有害反応 [参照 警告と注意事項 ]
- 皮膚および全身性エリテマトーデス [参照 警告と注意事項 ]
- シアノコバラミン (ビタミン B-12) 欠乏症 [参照 警告と注意事項 ]
- 低マグネシウム血症とミネラル代謝 [参照 警告と注意事項 ]
- 胃底ポリープ [参照 警告と注意事項 ]
臨床研究経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
大人
下記のデータは、最大 8 週間暴露した 1064 人の成人患者における ACIPHEX 遅延放出錠剤への暴露を反映しています。これらの研究は主に、びらん性または潰瘍性胃食道逆流症(GERD)、十二指腸潰瘍、および胃潰瘍の成人患者を対象としたプラセボおよび実薬対照試験でした。集団の平均年齢は 53 歳 (範囲は 18 歳から 89 歳) で、男性が約 60%、女性が 40% の比率でした。人種分布は、86%が白人、8%がアフリカ系アメリカ人、2%がアジア人、5%がその他でした。ほとんどの患者は、ACIPHEX 20mg 遅延放出錠剤を 1 日あたり 10mg、20mg、または 40mg 服用しました。
ACIPHEX 10mg 徐放性錠剤で治療された患者の 2% 以上 (n=1064) に現れ、北米およびヨーロッパの急性期治療試験でプラセボ (n=89) より高い頻度で現れた有害反応の分析により、次のことが明らかになりました。副作用: 痛み (3% 対 1%)、咽頭炎 (3% 対 2%)、鼓腸 (3% 対 1%)、感染 (2% 対 1%)、便秘 (2% 対 1%) 1%)。
つの長期維持研究は、合計 740 人の成人患者で構成されていました。成人患者の少なくとも 54% が ACIPHEX 20mg 遅延放出錠剤に 6 か月間暴露され、少なくとも 33% が 12 か月間暴露されました。成人患者 740 人のうち、247 人 (33%) と 241 人 (33%) の患者がそれぞれ 10 mg と 20 mg のアシフェックス 20 mg 遅延放出錠を投与され、169 人 (23%) の患者がプラセボを投与され、83 人 (11%) が投与されました。オメプラゾール。
成人の維持試験におけるラベプラゾールの安全性プロファイルは、急性試験で観察されたものと一致していました。
対照臨床試験で見られるあまり一般的ではない副作用 (ACIPHEX 20mg 遅延放出錠剤で治療された患者の 2% 未満で、プラセボよりも多い) で、ラベプラゾールとの因果関係の可能性があるものには、以下が含まれます: 頭痛、腹痛、下痢、口渇、めまい、末梢浮腫、肝酵素上昇、肝炎、肝性脳症、筋肉痛、関節痛。
アモキシシリンとクラリスロマイシンによる併用療法
ラベプラゾールとアモキシシリンおよびクラリスロマイシン(RAC)の併用療法を使用した臨床試験では、この薬物の組み合わせに特有の副作用は観察されませんでした。米国の多施設研究では、RAC 療法を 7 日または 10 日間受けた患者で最も多く報告された薬物関連の副作用は、それぞれ下痢 (8% および 7%) と味覚異常 (6% および 10%) でした。
薬物の組み合わせに特有の臨床的に重大な臨床検査値の異常は観察されませんでした。
アモキシシリンまたはクラリスロマイシンによる有害反応または実験室の変更に関する詳細については、それぞれの処方情報、有害反応のセクションを参照してください。
小児科
症候性 GERD または内視鏡検査で GERD と臨床診断された 12 歳から 16 歳の思春期の患者を対象とした多施設共同非盲検試験では、有害事象のプロファイルは成人と同様でした。アシフェックス 20mg 遅延放出錠との関連性に関係なく報告された 111 人の患者の 2% 以上で発生した副作用は、頭痛 (9.9%)、下痢 (4.5%)、悪心 (4.5%)、嘔吐 (3.6%)、嘔吐 (3.6%) でした。腹痛 (3.6%)。患者の 2% 以上で発生した関連する報告された副作用は、頭痛 (5.4%) と吐き気 (1.8%) でした。この研究では、これまで成人では観察されなかった有害反応は報告されていません。
市販後の経験
以下の有害反応は、ラベプラゾールの承認後の使用中に確認されています。これらの反応は不確実な規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることが常に可能であるとは限りません。
血液およびリンパ系の障害: 無顆粒球症、溶血性貧血、白血球減少症、汎血球減少症、血小板減少症
耳と迷路の障害: めまい
目の病気: ぼやけた視界
胃腸障害: 胃底腺ポリープ
一般的な障害および投与部位の状態: 突然死
肝胆道疾患: 黄疸
免疫系障害: アナフィラキシー、血管性浮腫、全身性エリテマトーデス、スティーブンス・ジョンソン症候群、中毒性表皮壊死症(致死的なものもある)、DRESS、AGEP
感染症と蔓延: クロストリジウム・ディフィシルによる下痢
調査: プロトロンビン時間/INRの増加(ワルファリン併用患者)、TSH上昇
代謝および栄養障害: 高アンモニア血症、低マグネシウム血症、低カルシウム血症、低カリウム血症 [警告と注意事項 5.8]、低ナトリウム血症
筋骨格系障害: 骨折、横紋筋融解症
神経系障害: 昏睡
精神障害: せん妄、見当識障害
腎および尿路疾患: 間質性腎炎
呼吸器、胸部および縦隔の障害: 間質性肺炎
皮膚および皮下組織の疾患: 皮膚の水疱性および他の薬疹、皮膚エリテマトーデス、多形紅斑を含む重度の皮膚反応
薬物相互作用
表 2 には、ACIPHEX 10mg 遅延放出錠と併用投与した場合に臨床的に重要な薬物相互作用と診断薬との相互作用を伴う薬物と、それらを予防または管理するための指示が含まれています。
PPI との相互作用に関する詳細な情報を得るには、併用薬のラベルを参照してください。
警告
の一部として含まれています 予防 セクション。
予防
胃悪性腫瘍の存在
成人では、ACIPHEX 10mg による治療に対する症候性反応は、胃の悪性腫瘍の存在を排除するものではありません。 PPIによる治療を完了した後、最適ではない反応または初期の症状の再発がある成人患者では、追加のフォローアップおよび診断テストを検討してください.
ワーファリンとの相互作用
ラベプラゾールとワルファリンの定常状態での相互作用は、患者で十分に評価されていません。プロトンポンプ阻害剤とワルファリンを併用している患者では、INR とプロトロンビン時間の増加が報告されています。 INR とプロトロンビン時間の増加は、異常出血や死に至ることさえあります。 ACIPHEX 10mg 遅延放出錠剤とワルファリンを併用して治療された患者は、INR とプロトロンビン時間の増加について監視する必要がある場合があります [参照 薬物相互作用 ]。
急性尿細管間質性腎炎
急性尿細管間質性腎炎 (TIN) は、PPI を服用している患者で観察されており、PPI 治療中の任意の時点で発生する可能性があります。患者は、症候性過敏症反応から、腎機能低下の非特異的症状(例、倦怠感、吐き気、食欲不振)まで、さまざまな徴候や症状を示すことがあります。報告された症例シリーズでは、一部の患者は生検で診断され、腎外症状(例、発熱、発疹、関節痛)がない状態で診断されました。
ACIPHEX を中止し、急性 TIN が疑われる患者を評価する [参照 禁忌 ]。
クロストリジウム・ディフィシル関連下痢症
公表された観察研究は、ACIPHEX のような PPI 療法が、特に入院患者において、クロストリジウム・ディフィシル関連下痢のリスク増加と関連している可能性があることを示唆しています。この診断は、下痢が改善しない場合に考慮する必要があります [参照 有害反応 ]。
患者は、治療する状態に適した最低用量と最短期間の PPI 療法を使用する必要があります。
クロストリジウム ディフィシル関連下痢症 (CDAD) は、ほぼすべての抗菌剤の使用で報告されています。 ACIPHEX と併用する抗菌剤 (クラリスロマイシンおよびアモキシシリン) の詳細については、対応する処方情報の警告および使用上の注意のセクションを参照してください。
骨折
成人を対象としたいくつかの公開された観察研究は、PPI 療法が股関節、手首、または脊椎の骨粗鬆症関連骨折のリスク増加と関連している可能性があることを示唆しています。骨折のリスクは、高用量(1 日複数回の投与と定義)および長期の PPI 療法(1 年以上)を受けた患者で増加しました。患者は、治療する状態に適した最低用量と最短期間の PPI 療法を使用する必要があります。骨粗鬆症関連の骨折のリスクがある患者は、確立された治療ガイドラインに従って管理する必要があります[参照 投薬と管理 、 有害反応 ]。
重度の皮膚有害反応
PPI の使用に関連して、スティーブンス・ジョンソン症候群 (SJS) や中毒性表皮壊死融解症 (TEN)、好酸球増加症や全身症状を伴う薬物反応 (DRESS)、急性汎発性発疹性膿疱症 (AGEP) などの重度の皮膚副作用が報告されています。 [見る 有害反応 ]。重度の皮膚有害反応の最初の兆候または症状、または過敏症の他の兆候が見られた場合は、ACIPHEX の使用を中止し、さらなる評価を検討してください。
皮膚および全身性エリテマトーデス
ラベプラゾールを含む PPI を服用している患者では、皮膚エリテマトーデス (CLE) および全身性エリテマトーデス (SLE) が報告されています。これらの事象は、既存の自己免疫疾患の新たな発症と悪化の両方として発生しています。 PPI 誘発性エリテマトーデスの症例の大部分は CLE でした。
PPI で治療された患者で報告された CLE の最も一般的な形態は亜急性 CLE (SCLE) であり、乳児から高齢者までの範囲の患者で継続的な薬物療法の後、数週間から数年以内に発生しました。一般に、組織学的所見は臓器の関与なしに観察されました。
全身性エリテマトーデス (SLE) は、PPI を投与されている患者では CLE ほど一般的ではありません。 PPI 関連の SLE は通常、非薬物誘発性 SLE よりも軽度です。 SLE の発症は、通常、主に若年成人から高齢者までの範囲の患者で、治療を開始してから数日から数年以内に発生しました。発疹を呈した患者の大部分。しかし、関節痛と血球減少症も報告されました。
医学的に指示されているよりも長い PPI の投与は避けてください。 CLE または SLE と一致する徴候または症状が ACIPHEX の投与を受けている患者に見られる場合は、薬剤の使用を中止し、評価のために適切な専門医に患者を紹介してください。ほとんどの患者は、4 ~ 12 週間で PPI のみを中止すると改善します。血清学的検査 (ANA など) は陽性である場合があり、血清学的検査結果の上昇は、臨床症状よりも解消に時間がかかる場合があります。
シアノコバラミン (ビタミン B-12) 欠乏症
長期間(例えば、3年以上)にわたる酸抑制薬による毎日の治療は、低酸症または酸欠乏症によって引き起こされるシアノコバラミン(ビタミンB-12)の吸収不良につながる可能性があります.酸抑制療法で発生するシアノコバラミン欠乏症のまれな報告が文献で報告されています.この診断は、シアノコバラミン欠乏症と一致する臨床症状が ACIPHEX で治療された患者で観察された場合に考慮されるべきです。
低マグネシウム血症とミネラル代謝
症候性および無症候性の低マグネシウム血症は、ほとんどの場合、1 年間の治療後に、少なくとも 3 か月間 PPI で治療された患者でまれに報告されています。重篤な有害事象には、テタニー、不整脈、および発作が含まれます。低マグネシウム血症は、低カルシウム血症および/または低カリウム血症につながる可能性があり、リスクのある患者の潜在的な低カルシウム血症を悪化させる可能性があります。ほとんどの患者で、低マグネシウム血症の治療にはマグネシウムの補充と PPI の中止が必要でした。
長期の治療が予想される患者、またはジゴキシンなどの薬剤または低マグネシウム血症を引き起こす可能性のある薬剤(利尿薬など)と一緒に PPI を服用している患者の場合、医療専門家は、PPI 治療の開始前および定期的にマグネシウム濃度をモニタリングすることを検討してもよい [参照 有害反応 ]。
ACIPHEX の開始前、および低カルシウム血症のリスクがある患者 (副甲状腺機能低下症など) の治療中は定期的にマグネシウムとカルシウムのレベルを監視することを検討してください。必要に応じてマグネシウムやカルシウムを補給してください。低カルシウム血症が治療に抵抗性である場合は、PPI の中止を検討してください。
メトトレキサートとの相互作用
文献によると、PPI とメトトレキサートの併用 (主に高用量。メトトレキサート処方情報を参照) は、メトトレキサートおよび/またはその代謝産物の血清濃度を上昇および延長させ、メトトレキサート毒性を引き起こす可能性があることを示唆しています。高用量のメトトレキサート投与では、一部の患者では PPI の一時的な中止が考慮される場合があります [ 薬物相互作用 ]。
胃底ポリープ
PPI の使用は、特に 1 年以上の長期使用に伴って増加する胃底腺ポリープのリスク増加と関連しています。胃底腺ポリープを発症したほとんどの PPI ユーザーは無症候性であり、内視鏡検査で偶発的に胃底腺ポリープが特定されました。治療中の状態に適した最短期間の PPI 療法を使用してください。
患者相談情報
患者に、FDA 承認の患者ラベル ( 投薬ガイド )。
急性尿細管間質性腎炎
患者または介護者に、急性尿細管間質性腎炎に関連する徴候および/または症状が見られた場合は、直ちに患者の医療提供者に連絡するようにアドバイスしてください。 警告と注意事項 ]。
クロストリジウム・ディフィシル関連下痢症
下痢が改善しない場合は、直ちに患者の医療提供者に電話するよう患者または介護者に助言する[参照 警告と注意事項 ]。
骨折
患者または介護者に、骨折、特に股関節、手首、または脊椎の骨折については、患者の医療提供者に報告するように助言してください [ 警告と注意事項 ]。
重度の皮膚有害反応
患者または介護者に ACIPHEX 20mg の使用を中止し、重度の皮膚有害反応の徴候や症状、または過敏症の他の徴候があれば医療提供者に報告するようにアドバイスします [参照 警告と注意事項 ]。
皮膚および全身性エリテマトーデス
患者または介護者に、皮膚または全身性エリテマトーデスに関連する新たな症状または症状の悪化については、直ちに患者の医療提供者に連絡するようにアドバイスしてください。 警告と注意事項 ]。
シアノコバラミン (ビタミン B-12) 欠乏症
アシフェックス 20mg を 3 年以上服用している場合は、シアノコバラミン欠乏症に関連する可能性のある臨床症状を患者の医療提供者に報告するよう、患者または介護者に助言してください。 警告と注意事項 ]。
低マグネシウム血症とミネラル代謝
患者または介護者に、低マグネシウム血症、低カルシウム血症、低カリウム血症、および低ナトリウム血症に関連する可能性のある臨床症状があれば、少なくとも 3 か月間 ACIPHEX を投与されている場合は、患者の医療提供者に報告するようアドバイスしてください [ 警告と注意事項 ]。
薬物相互作用
リルピビリン含有製品を服用している場合は、医療提供者に報告するよう患者に助言する [ 禁忌 ]、ワルファリン、ジゴキシンまたは高用量メトトレキサート[参照 警告と注意事項 ]。
管理
- アシフェックス 10mg 遅延放出錠を丸ごと飲み込んでください。錠剤を噛んだり、つぶしたり、割ったりしないでください。
- 十二指腸潰瘍の治療には、食後にアシフェックス遅延放出錠を服用してください。
- ヘリコバクター ピロリの除菌には、アシフェックス 20mg 遅延放出錠を食事と一緒に服用してください。
- 他のすべての適応症については、ACIPHEX 10mg 遅延放出錠剤は食事の有無にかかわらず服用できます。
- 飲み忘れた分はできるだけ早く服用してください。次の服用時間が近い場合は、忘れた分を飛ばして通常のスケジュールに戻してください。同時に2回服用しないでください。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
CD-1 マウスにおける 88/104 週間の発がん性試験では、100 mg/kg/日までの経口用量のラベプラゾールは、腫瘍発生の増加を引き起こしませんでした。試験された最高用量は、GERD の推奨用量 (20 mg/日)。 p53+/-トランスジェニック マウスでの 28 週間の発がん性試験では、20、60、および 200 mg/kg/日の経口用量のラベプラゾールは、腫瘍の発生率の増加を引き起こしませんでしたが、すべての用量で胃粘膜過形成を引き起こしました。 200 mg/kg/日でのラベプラゾールの全身暴露は、GERD の推奨用量でのヒト暴露の約 17 ~ 24 倍です。 Sprague-Dawley ラットでの 104 週間の発がん性試験で、雄は 5、15、30、60 mg/kg/日、雌は 5、15、30、60、120 mg/kg/日で経口投与されました。 .ラベプラゾールは、最低試験用量を含むすべての用量で、雄および雌ラットで胃腸クロム様(ECL)細胞過形成を、雌ラットで ECL 細胞カルチノイド腫瘍を生じた。最低用量 (5 mg/kg/日) では、約 0.1 μg·hr/mL のラベプラゾールへの全身曝露 (AUC) が生じました。これは、GERD の推奨用量でのヒト曝露の約 0.1 倍です。雄ラットでは、60 mg/kg/日までの用量で治療に関連する腫瘍は観察されず、約 0.2 μg·hr/mL のラベプラゾール血漿曝露 (AUC) が得られました (GERD の推奨用量でのヒト曝露の 0.2 倍)。
ラベプラゾールは、エイムズ テスト、チャイニーズ ハムスター卵巣細胞 (CHO/HGPRT) 前方遺伝子変異試験、およびマウス リンパ腫細胞 (L5178Y/TK+/–) 前方遺伝子変異試験で陽性でした。その脱メチル化代謝物もエイムズ試験で陽性でした。ラベプラゾールは、in vitro チャイニーズハムスター肺細胞染色体異常試験、in vivo マウス小核試験、in vivo および ex vivo ラット肝細胞不定期 DNA 合成(UDS)試験で陰性でした。
30 mg/kg/日までの静脈内用量のラベプラゾール (8.8 μg•hr/mL の血漿 AUC、GERD の推奨用量でのヒト曝露の約 10 倍) は、雄およびメスのネズミ。
特定の集団での使用
妊娠
リスクの概要
妊娠中の女性における ACIPHEX 10mg の使用に関する利用可能な人間のデータはなく、薬物に関連するリスクを通知します。示された集団の主要な先天性欠損症および流産の背景リスクは不明です。しかし、米国の一般集団における重大な先天性欠損症のバックグラウンド リスクは、臨床的に認識された妊娠の 2 ~ 4% であり、流産のリスクは 15 ~ 20% です。ラベプラゾールを器官形成期にヒトの GERD の推奨用量の 13 倍および 8 倍でラベプラゾールをラットおよびウサギに投与した動物生殖研究では、発生への悪影響の証拠は見られなかった[参照 データ ]。
骨形態の変化は、妊娠中および授乳中のほとんどを通じて、異なる PPI の経口投与で処理されたラットの子孫で観察されました。母体への投与が妊娠期間のみに限定された場合、どの年齢の子においても骨端の形態に影響はありませんでした。 データ ]。
データ
動物データ
胚・胎児発生研究は、ラベプラゾールを 50 mg/kg/day までの静脈内投与で器官形成中のラットで実施されています (血漿 AUC は 11.8 μg·hr/mL、GERD の推奨経口投与量でのヒト暴露の約 13 倍)。 30mg/kg/日までの静脈内用量(7.3μg・hr/mLの血漿AUC、GERDの推奨経口用量でのヒト曝露の約8倍)のウサギと、ラベプラゾール。
妊娠後期および授乳期のラットにラベプラゾールを 400 mg/kg/日 (mg/m² に基づくヒトの経口用量の約 195 倍) の経口用量で投与すると、仔の体重増加が減少しました。
骨の発達を評価するためのエンドポイントを追加したラットの出生前および出生後の発生毒性研究は、体表面積ベースでヒトの経口投与量の約 3.4 ~ 57 倍の異なる PPI で実施されました。大腿骨の長さの減少、皮質骨の幅と厚さの減少、脛骨成長板の厚さの減少、および最小限から軽度の骨髄低細胞性が、体表面積ベースでヒトの経口用量の 3.4 倍以上の用量で認められました。 .大腿骨の骨端異形成は、体表面積ベースでヒトの経口用量の 33.6 倍以上の用量で PPI に子宮内および授乳期に曝露された後、子孫にも観察されました。妊娠中および授乳中のラットの出生前および出生後の毒性試験で、体表面積ベースでヒトの経口投与量の 3.4 ~ 57 倍の経口投与量で PPI を投与した場合、母体の骨への影響が観察されました。ラットに妊娠 7 日から生後 21 日の離乳まで投与した場合、ヒトの経口投与量の 33.6 倍以上の投与量で、母親の大腿骨重量の最大 14% の統計的に有意な減少 (プラセボ治療と比較して) が観察されました。体表面積ベースで。
生後 2 日目から成体期までの子犬の骨の発達を評価するためのさらなる時点でのラットの追跡発生毒性研究が、280 mg/kg/日の経口用量で異なる PPI で実施されました (ヒトの経口用量の約 68 倍)。体表面積ベース)、妊娠7日目または妊娠16日目から分娩までの薬物投与。母体への投与が妊娠期間のみに限定された場合、どの年齢の子孫でも骨端線の形態に影響はありませんでした。
授乳
リスクの概要
母乳中のラベプラゾールの存在、母乳で育てられた乳児に対するラベプラゾールの影響、または乳生産に対するラベプラゾールの影響を評価するための授乳研究は実施されていません。ラベプラゾールはラットミルクに含まれています。母乳育児の発達と健康上の利点は、母親の ACIPHEX に対する臨床的必要性、および ACIPHEX または基礎となる母体の状態から母乳で育てられた乳児への潜在的な悪影響とともに考慮されるべきです。
小児用
ACIPHEX 20mg 遅延放出錠剤の安全性と有効性は、症候性 GERD の治療のための 12 歳以上の思春期患者の小児患者で確立されています。この年齢層における ACIPHEX 20mg 遅延放出錠の使用は、成人を対象とした適切かつ十分に管理された研究、および 12 ~ 16 歳の 111 人の青年患者を対象とした多施設無作為化非盲検並行群間研究によって裏付けられています。患者は、症候性 GERD、または GERD が疑われる、または内視鏡的に証明された GERD の臨床診断を受けており、安全性と有効性を評価するために、最大 8 週間、1 日 1 回 10 mg または 20 mg のいずれかに無作為に割り付けられました。思春期の患者における有害反応プロファイルは、成人の場合と同様でした。患者の 2% 以上で発生した関連する報告された副作用は、頭痛 (5%) と吐き気 (2%) でした。これらの研究では、これまで成人では観察されなかった有害反応は報告されていません。
ACIPHEX 10mg 遅延放出錠の安全性と有効性は、以下の小児患者では確立されていません。
- びらん性または潰瘍性GERDの治癒
- びらん性または潰瘍性GERDの治癒の維持
- 症候性GERDの治療
- 十二指腸潰瘍の治癒
- 十二指腸潰瘍再発のリスクを減らすためのヘリコバクター・ピロリ除菌
- ゾリンジャー・エリソン症候群を含む病理学的過剰分泌状態の治療
ACIPHEX 遅延放出 20 mg 錠剤は、12 歳未満の小児患者への使用は推奨されません。 投薬と管理 ]。 1 歳から 12 歳未満の小児患者には、別のラベプラゾール製剤を検討してください。ラベプラゾールの異なる剤形と投与強度の安全性と有効性は、GERDの治療のための1〜11歳の小児患者で確立されています。
幼獣データ
若年および若年成体のラットおよびイヌにおける試験が実施された。若年動物の研究では、ラベプラゾール ナトリウムをラットに最大 5 週間、イヌに最大 13 週間経口投与し、それぞれ分娩後 7 日目に開始し、その後 13 週間の回復期間を設けました。ラットには 5、25、または 150 mg/kg/日を投与し、イヌには 3、10、または 30 mg/kg/日を投与した。これらの研究から得られたデータは、若い成獣について報告されたものと同等でした。血清ガストリンレベルの上昇や胃の変化など、薬理学的に媒介される変化が、ラットとイヌの両方ですべての用量レベルで観察されました。これらの観察結果は、13 週間の回復期間で回復しました。体重および/または頭頂部の長さは、投与中に最小限に減少しましたが、幼若ラットまたはイヌのいずれにおいても発生パラメータへの影響は認められませんでした。
幼若動物を、体表面積ベースでヒトの 1 日経口投与量の 34 倍以上の異なる PPI で 28 日間治療した場合、全体的な成長が影響を受け、治療に関連した体重の減少 (約 14%) が見られました。および体重増加、ならびに大腿骨重量および大腿骨長の減少が観察された。
高齢者の使用
アシフェックス 20mg 遅延放出錠の臨床試験における被験者総数 (n=2009) のうち、19% が 65 歳以上であり、4% が 75 歳以上でした。これらの被験者と若い被験者の間で安全性または有効性の全体的な違いは観察されず、他の報告された臨床経験では、高齢者と若い患者の間の反応の違いは確認されていませんが、一部の高齢者の感度が高いことは除外できません.
肝障害
軽度から中等度の肝障害 (Child-Pugh クラス A および B) の患者への ACIPHEX 徐放性錠剤の投与は、曝露の増加と排泄の減少をもたらしました [参照 臨床薬理学 ]。軽度から中等度の肝障害のある患者では、用量調整は必要ありません。重度の肝障害 (Child-Pugug クラス C) の患者に関する情報はありません。重度の肝障害のある患者では、ACIPHEX 徐放性錠剤の使用を避けてください。ただし、治療が必要な場合は、副作用がないか患者を監視する [参照 警告と注意事項 、 有害反応 ]。
過剰摂取
ラベプラゾールの偶発的な過剰摂取に関する 7 件の報告が寄せられています。報告された最大の過剰摂取量は 80 mg でした。報告された過剰摂取に関連する臨床徴候や症状はありませんでした。 Zollinger-Ellison 症候群の患者は、1 日 1 回、最大 120 mg のラベプラゾールで治療されています。ラベプラゾールに対する特異的な解毒剤は知られていません。ラベプラゾールは広範囲にタンパク質に結合しており、容易に透析できません。
過剰摂取の場合、治療は対症療法および支持療法でなければなりません。
過剰暴露が発生した場合は、毒物管理センター (1-800-222-1222) に電話して、中毒または過剰摂取の管理に関する最新情報を入手してください。
禁忌
- ACIPHEX 10mg は、ラベプラゾール、代替ベンズイミダゾール、または製剤の任意の成分に対して既知の過敏症のある患者には禁忌です。過敏症反応には、アナフィラキシー、アナフィラキシーショック、血管性浮腫、気管支痙攣、急性尿細管間質性腎炎、蕁麻疹などがあります。 警告と注意事項 、 有害反応 ]。
- ACIPHEX を含む PPI は、リルピビリン含有製品との禁忌である [参照 薬物相互作用 ]。
- アシフェックス 20mg 遅延放出錠との併用で示される抗菌剤 (クラリスロマイシンおよびアモキシシリン) の禁忌に関する情報については、添付文書の禁忌のセクションを参照してください。
臨床薬理学
作用機序
ラベプラゾールは、抗コリン作動性またはヒスタミン H2 受容体拮抗薬の特性を示さないが、胃の分泌面で胃の H+、K+ATPase を阻害することにより胃酸分泌を抑制する抗分泌性化合物 (置換ベンズイミダゾール プロトンポンプ阻害剤) のクラスに属します。頭頂細胞。この酵素は壁細胞内の酸(プロトン)ポンプと見なされているため、ラベプラゾールは胃のプロトンポンプ阻害剤として特徴付けられています。ラベプラゾールは、胃酸分泌の最終段階をブロックします。
胃壁細胞では、ラベプラゾールはプロトン化され、蓄積し、活性なスルフェンアミドに変換されます。 in vitro で研究した場合、ラベプラゾールは pH 1.2 で化学的に活性化され、半減期は 78 秒です。ブタの胃小胞の酸輸送を 90 秒の半減期で阻害します。
薬力学
抗分泌活動
抗分泌作用は、アシフェックス 20mg 遅延放出錠 20mg の経口投与後 1 時間以内に始まります。 24 時間の胃酸に対するラベプラゾールの抑制効果の中央値は、初回投与後の最大値の 88% です。 ACIPHEX 遅延放出錠剤の 20 mg 用量は、基礎およびペプトン食事刺激による酸分泌をプラセボに対してそれぞれ 86% および 95% 抑制し、胃の pH > 3 である 24 時間の割合を 10% から65% (下の表を参照)。短い薬物動態学的半減期 (1 ~ 2 時間) と比較して、この比較的長い薬力学的作用は、H +、K + ATPase の持続的な不活性化を反映しています。
プラセボと比較して、10 mg、20 mg、および 40 mg の ACIPHEX 遅延放出錠剤を 1 日 1 回 7 日間投与すると、4 回の食事に関連する各間隔および 24 時間の期間全体で、すべての用量で胃内酸性度が大幅に減少しました。この研究では、用量間に統計的に有意な差はありませんでした。しかし、胃内酸性度は用量依存的に有意に減少した。ラベプラゾールが平均胃内酸性度を用量依存的に減少させる能力を以下に示す。

20 mg ACIPHEX 20 mg 遅延放出錠を 1 日 1 回 8 日間投与した後、単回投与 (1 日目) および複数回投与 (8 日目) 後に、胃の pH が 3 を超える、または胃の pH が 4 を超える時間の平均割合は、プラセボよりも有意に高い(下の表を参照)。以下に示すように、1 日 1 回 8 日間投与された 20 mg ACIPHEX 10 mg 遅延放出錠剤で観察された胃酸度の低下と胃 pH の上昇を、プラセボの同じパラメータと比較しました。
食道酸暴露への影響
GERD と中等度から重度の食道酸暴露の患者では、ACIPHEX 20mg 遅延放出錠剤を 1 日あたり 20 mg と 40 mg 服用すると、24 時間の食道酸暴露が減少しました。 7 日間の治療後、食道 pH が 4 未満であった時間の割合は、ベースラインの 20 mg の 24.7% および 40 mg の 23.7% から、それぞれ 5.1% および 2.0% に減少しました。 24 時間の食道内酸暴露の正常化は、24 時間の少なくとも 35% で 4 を超える胃 pH と相関していました。このレベルは、ACIPHEX 20 mg を投与された被験者の 90%、ACIPHEX 40 mg を投与された被験者の 100% で達成されました。 ACIPHEX 20 mg および 40 mg/日を使用すると、胃および食道の pH に対する有意な影響が、治療の 1 日後に認められ、治療の 7 日後にはより顕著になりました。
血清ガストリンへの影響
空腹時ガストリン濃度の中央値は、潰瘍性食道炎またはびらん性食道炎に対して ACIPHEX 10mg 遅延放出錠を 1 日 1 回最大 8 週間投与された患者、および疾患の再発を予防するために最大 52 週間投与された患者において、用量依存的に増加しました。グループの中央値は正常範囲内にとどまりました。
20 mg の ACIPHEX 遅延放出錠剤で 4 週間治療された被験者のグループでは、平均血清ガストリン濃度の 2 倍が観察されました。これらの治療対象の約 35% は、正常の上限を超える血清ガストリン濃度を発症しました。
腸クロム親和性 (ECL) 細胞への影響
抗分泌剤に続発する血清ガストリンの増加は、胃の ECL 細胞の増殖を刺激し、時間の経過とともに、ラットやマウスでは ECL 細胞の過形成を引き起こし、ラット、特に雌では胃カルチノイドを引き起こす可能性がある [参照 非臨床毒性学 ]。
ACIPHEX 遅延放出錠剤 (10 または 20 mg) を 1 日 1 回、最大 1 年間投与した 400 人以上の患者では、ECL 細胞過形成の発生率が時間と用量とともに増加しました。これは、プロトンポンプ阻害剤の薬理学的作用と一致しています。胃粘膜の ECL 細胞の腺腫様、形成異常、または腫瘍性変化を発症した患者はいなかった。ラットで観察されたカルチノイド腫瘍を発症した患者はいなかった。
内分泌への影響
ヒトを対象とした最長 1 年間の研究では、内分泌系に対する臨床的に重大な影響は明らかにされていません。 ACIPHEX 遅延放出錠で 13 日間治療された健康な男性被験者では、検査された次の内分泌パラメーターに臨床的に関連する変化は検出されませんでした: 17 β-エストラジオール、甲状腺刺激ホルモン、トリヨードチロニン、チロキシン、チロキシン結合タンパク質、副甲状腺ホルモン、インスリン、グルカゴン、レニン、アルドステロン、卵胞刺激ホルモン、黄体栄養ホルモン、プロラクチン、成長ホルモン、デヒドロエピアンドロステロン、コルチゾール結合グロブリン、尿中 6β-ヒドロキシコルチゾール、血清テストステロン、概日コルチゾール プロファイル。
その他の効果
ACIPHEX 10mg 遅延放出錠剤で最長 1 年間治療されたヒトでは、中枢神経、リンパ系、造血系、腎臓系、肝臓系、心血管系、または呼吸器系への全身的影響は観察されていません。 ACIPHEX 10mg 遅延放出錠による長期治療と眼への影響に関するデータはありません。
薬物動態
20 mg ACIPHEX 10 mg 遅延放出錠剤の経口投与後、ラベプラゾールのピーク血漿濃度 (Cmax) は 2 ~ 5 時間 (Tmax) の範囲で発生します。ラベプラゾールの Cmax と AUC は、10 mg から 40 mg の経口用量範囲で直線的です。 10 mg から 40 mg の用量を 24 時間ごとに投与した場合、顕著な蓄積はありません。ラベプラゾールの薬物動態は、複数回投与によって変化しません。
吸収
ラベプラゾールの 20 mg 経口錠剤の絶対バイオアベイラビリティは (静脈内投与と比較して) 約 52% です。 ACIPHEX 10mg 遅延放出錠剤を高脂肪食と一緒に投与すると、Tmax は変動します。同時に食物を摂取すると、吸収が 4 時間以上遅れる可能性があります。ただし、Cmax とラベプラゾール吸収 (AUC) の程度は大幅に変更されていません。したがって、ACIPHEX 遅延放出錠は、食事のタイミングに関係なく服用できます。
分布
ラベプラゾールは 96.3% がヒト血漿タンパク質に結合しています。
排除
代謝
ラベプラゾールは広範囲に代謝されます。ラベプラゾールのかなりの部分は、全身的な非酵素的還元によってチオエーテル化合物に代謝されます。ラベプラゾールはまた、肝臓でシトクロム P450 を介してスルホンおよびデスメチル化合物に代謝されます。チオエーテルとスルホンは、ヒト血漿で測定される主要な代謝物です。これらの代謝産物は、有意な抗分泌活性を有することが観察されませんでした。 In vitro 研究では、ラベプラゾールは主にシトクロム P450 3A (CYP3A) によってスルホン代謝産物に、シトクロム P450 2C19 (CYP2C19) によってデスメチル ラベプラゾールに代謝されることが実証されています。 CYP2C19 は、いくつかの亜集団 (白人の 3 ~ 5%、アジア人の 17 ~ 20% など) での欠損により、既知の遺伝子多型を示します。これらの亜集団ではラベプラゾールの代謝が遅いため、薬物の低代謝者と呼ばれます。
排泄
14C 標識ラベプラゾール 20 mg の単回経口投与後、薬物の約 90% が主にチオエーテルカルボン酸として尿中に排泄されました。そのグルクロニド、およびメルカプツール酸代謝物。投与量の残りは糞便中に回収された。放射能の総回収率は99.8%でした。尿や糞から未変化体のラベプラゾールは検出されなかった。
特定の集団
高齢患者
20 mg の ACIPHEX 徐放性錠剤を 1 日 1 回 7 日間投与された 20 人の健康な高齢者では、AUC 値は約 2 倍になり、Cmax は同じ若い対照群の値と比較して 60% 増加しました。 1日1回の投与後、薬物蓄積の証拠はありませんでした[参照 特定の集団での使用 ]。
小児患者
ラベプラゾールの薬物動態は、12 歳から 16 歳の GERD の 12 人の思春期患者を対象に、多施設共同研究で研究されました。患者は 20 mg の ACIPHEX 遅延放出錠剤を 1 日 1 回、5 日間または 7 日間投与されました。 1 日投与後の曝露と比較して、投与 5 ~ 7 日後にラベプラゾール曝露の約 40% の増加が認められました。 12 歳から 16 歳の思春期の GERD 患者の薬物動態パラメータは、健康な成人被験者で観察された範囲内でした。
男性と女性の患者と人種または民族グループ
体重と身長を調整した分析では、ラベプラゾールの薬物動態は、男性と女性の被験者間で臨床的に有意な差を示さなかった。ラベプラゾールの異なる製剤を使用した研究では、健康な日本人男性の AUC0-∞ 値は、米国の健康な男性からプールされたデータから得られた値よりも約 50 ~ 60% 大きかった.
腎障害のある患者
維持血液透析(クレアチニンクリアランス≦5mL/分/1.73m²)を必要とする安定した末期腎疾患の10人の患者において、ACIPHEX 20mg遅延放出錠の単回20mg投与後、ラベプラゾールの薬物動態に臨床的に有意な差は観察されなかった。 10人の健康な被験者と比較した場合。
肝障害のある患者
軽度から中等度の肝障害 (Child-Pugh クラス A および B) を持つ 10 人の患者の単回投与研究で、ACIPHEX 10mg 遅延放出錠剤の単回 20 mg 投与が行われ、AUC0-24 は約 2 倍になり、消失は半減期は 2 ~ 3 倍高く、全身クリアランスは健康な男性の値と比較して半分以下に減少しました。
軽度から中等度の肝障害を持つ 12 人の患者を対象に、ACIPHEX 10mg 遅延放出錠 20 mg を 1 日 1 回 8 日間投与した複数回投与試験では、年齢と性別が一致した健常者の値と比較して、AUC0-∞ と Cmax の値が約 20% 増加しました。科目。これらの増加は統計的に有意ではありませんでした。
重度の肝障害 (Child-Pugh クラス C) の患者におけるラベプラゾールの体内動態に関する情報は存在しない [参照 特定の集団での使用 ]。
薬物相互作用研究
抗菌薬との併用投与
CYP2C19 に関して高代謝者として遺伝子型が特定された 16 人の健康な被験者に、20 mg の ACIPHEX 遅延放出錠剤、1000 mg のアモキシシリン、500 mg のクラリスロマイシン、または 4 通りのクロスオーバー試験で 3 つの薬剤すべてが投与されました。 4 つのレジメンのそれぞれが 1 日 2 回、6 日間投与されました。クラリスロマイシンおよびアモキシシリンの AUC および Cmax は、単独投与後の値と比較して、併用投与後の値に差はありませんでした。しかし、ラベプラゾールの AUC と Cmax は、併用投与後にそれぞれ 11% と 34% 増加しました。 14-ヒドロキシクラリスロマイシン (クラリスロマイシンの活性代謝物) の AUC および Cmax も、それぞれ 42% および 46% 増加しました。このラベプラゾールおよび 14-ヒドロキシクラリスロマイシンへの曝露の増加は、安全上の懸念を生じさせないと予想されます。
ラベプラゾールに対する他の薬剤の影響
制酸剤
ACIPHEX 20mg 遅延放出錠剤と制酸剤の同時投与は、血漿ラベプラゾール濃度に臨床的に関連する変化をもたらしませんでした。
他の薬剤に対するラベプラゾールの効果
健康な被験者を対象とした研究では、ラベプラゾールは、単回経口投与で投与されるテオフィリン (CYP1A2)、単回静脈内投与で投与されるジアゼパム (CYP2C9 および CYP3A4)、およびフェニトイン ( CYP2C9 および CYP2C19) を単回静脈内投与 (追加の経口投与) として投与します。ラベプラゾールとこの酵素系によって代謝される他の薬物との定常状態での相互作用は、患者では研究されていません。
クロピドグレル
クロピドグレルは、CYP2C19 によって一部活性代謝物に代謝されます。クロピドグレル 75 mg を 1 日 1 回、プラセボまたは 20 mg のアシフェックス 20 mg 遅延放出錠剤 (n=36) と併用して 7 日間投与する CYP2C19 の高代謝および中間代謝者を含む健康な被験者の研究が実施されました。クロピドグレルの活性代謝物の平均 AUC は、プラセボとクロピドグレルの投与と比較して、ACIPHEX 遅延放出錠剤を同時投与した場合、約 12% 減少しました (平均 AUC 比は 88%、90% CI は 81.7 ~ 95.5%)。 薬物相互作用 ]。
ジゴキシン
健康な成人被験者 (n=16) では、ラベプラゾール ナトリウム遅延放出錠剤 20 mg とジゴキシン 2.5 mg の 1 日 1 回投与を定常状態で同時投与すると、平均 Cmax と AUC(0- 24) ジゴキシンの 薬物相互作用 ]。
ケトコナゾール
健康な成人被験者 (n=19) において、ラベプラゾールナトリウム遅延放出錠剤 20 mg を定常状態で単回経口投与のケトコナゾール 400 mg と同時投与すると、Cmax と AUC(0- inf) ケトコナゾールの [参照 薬物相互作用 ]。
シクロスポリン
ヒト肝ミクロソームを使用した in vitro インキュベーションでは、ラベプラゾールが 62 マイクロモルの IC50 でシクロスポリン代謝を阻害したことが示されました。これは、20 mg の ACIPHEX 10 mg 遅延放出錠剤を 14 日間投与した後の健康なボランティアの Cmax よりも 50 倍以上高い濃度です。この阻害の程度は、同等濃度のオメプラゾールによるものと同様です。
微生物学
以下の in vitro データが利用可能ですが、臨床的意義は不明です。
ラベプラゾール ナトリウム、アモキシシリン、クラリスロマイシンの 3 剤レジメンは、in vitro および臨床感染症において、ヘリコバクター ピロリのほとんどの菌株に対して有効であることが示されています。 適応症と使用法 、 臨床研究 ]。
ヘリコバクター・ピロリ
H. pylori 分離株の感受性試験は、アモキシシリンとクラリスロマイシンについて、寒天希釈法 1 を使用して実施され、最小発育阻止濃度 (MIC) が決定されました。
標準化された感受性試験手順では、実験室手順の技術的側面を管理するために実験室管理微生物を使用する必要があります。
臨床分離株における抗生物質耐性菌の発生率
前処理耐性
ピロリ菌に対するクラリスロマイシン治療前の耐性率 (MIC ≥1 mcg/mL) は、すべての治療群を合わせたベースラインで 9% (51/560) でした。患者の 99% (558/560) 以上が、ベースラインでアモキシシリンに感受性 (MIC ≤0.25 mcg/mL) であると考えられるピロリ菌分離株を持っていました。 2 人の患者はベースラインのピロリ菌分離株で、アモキシシリン MIC は 0.5 mcg/mL でした。
ヘリコバクター ピロリに関する感受性試験の情報については、クラリスロマイシンおよびアモキシシリンの処方情報の微生物学のセクションを参照してください。
ラベプラゾール、アモキシシリン、およびクラリスロマイシン療法の後に持続的なピロリ菌感染を有する患者は、クラリスロマイシン耐性の臨床分離株を有する可能性が高い。したがって、可能であればクラリスロマイシン感受性検査を行う必要があります。クラリスロマイシンに対する耐性が示された場合、または感受性試験が不可能な場合は、代替の抗菌療法を開始する必要があります。
アモキシシリン感受性試験の結果と臨床的/細菌学的結果
米国の多施設研究では、患者の 99% (558/560) 以上がベースラインでアモキシシリンに感受性 (MIC ≤0.25 mcg/mL) であると考えられるピロリ菌分離株を持っていました。他の 2 人の患者はベースラインのピロリ菌分離株で、アモキシシリン MIC は 0.5 mcg/mL であり、両方の分離株はベースラインでクラリスロマイシン耐性でした。あるケースではピロリ菌が根絶されました。 7 日間および 10 日間の治療群では、治療前にアモキシシリン感受性 MIC (≤0.25 mcg/mL) を有していた患者のそれぞれ 75% (107/145) および 79% (112/142) でピロリ菌が根絶されました。 .治療中にアモキシシリン耐性ピロリ菌を発症した患者はいなかった。
ファーマコゲノミクス
CYP2C19 遺伝子型によって分類された日本人成人患者における ACIPHEX 徐放性錠剤を評価する臨床試験 (遺伝子型カテゴリあたり n=6) では、胃酸抑制は、高代謝者と比較して低代謝者で高かった.これは、代謝不良者のラベプラゾール血漿レベルが高いためである可能性があります。これの臨床的関連性は不明です。ラベプラゾール ナトリウムと CYP2C19 によって代謝される他の薬物との相互作用が、高代謝者と低代謝者との間で異なるかどうかは研究されていません。
臨床研究
成人のびらん性または潰瘍性 GERD の治癒
米国の多施設無作為化二重盲検プラセボ対照研究では、103 人の患者がプラセボ、10 mg、20 mg、または 40 mg の ACIPHEX 遅延放出錠を 1 日 1 回投与され、最大 8 週間治療されました。 GERD 治癒に関するこの研究およびすべての研究では、GERD 症状があり、少なくともグレード 2 の食道炎 (修正 Hetzel-Dent グレーディング スケール) を有する患者のみが登録に適格でした。内視鏡による治癒は、グレード 0 または 1 として定義されました。ラベプラゾールの各投与量は、4 週間および 8 週間の治療後の内視鏡による治癒において、プラセボよりも有意に優れていました。内視鏡的治癒を示す患者の割合は次のとおりです。
さらに、GERD の胸やけ頻度の完全な解消に関して、4 週目と 8 週目にプラセボと比較して、ACIPHEX 10 mg、20 mg、および 40 mg の投与量を支持する統計的に有意な差がありました (p≤0.026)。すべての ACIPHEX グループは、4 週目と 8 週目に、プラセボと比較して、GERD の日中の胸やけの重症度の完全な解消率が有意に高いことを報告しました (p≤0.036)。 4 週目と 8 週目の両方でプラセボと比較した場合、毎日の制酸剤投与量のベースラインからの平均減少は、すべての ACIPHEX グループで統計的に有意でした (p≤0.007)。
336 人の患者を対象とした北米の多施設無作為化二重盲検実薬対照研究では、4 週間および 8 週間の治療後に内視鏡検査で治癒した患者の割合は、ラニチジンと比較して ACIPHEX 遅延放出錠剤で治療された患者で統計的に優れていました。 :
ACIPHEX 遅延放出錠剤 20 mg の 1 日 1 回投与は、ラニチジン 150 mg の 1 日 4 回投与よりも、4 週目と 8 週目に胸やけが完全に消失した患者の割合において有意に効果的でした (p
ACIPHEX 10mg 遅延放出錠剤の推奨投与量は、4 ~ 8 週間、1 日 1 回 20 mg です。
成人におけるびらん性または潰瘍性GERDの治癒の長期維持
以前に胃の抗分泌療法で治癒したびらん性または潰瘍性 GERD 患者の治癒の長期維持は、52 週間の期間の同一デザインの 2 つの米国多施設無作為化二重盲検プラセボ対照研究で評価されました。 2 つの研究では、1 日 1 回 10 mg または 20 mg の ACIPHEX 遅延放出錠剤またはプラセボのいずれかを投与するように、それぞれ 209 例および 285 例の患者を無作為に割り付けました。以下の表 10 および 11 に示されているように、ACIPHEX 遅延放出錠剤で治療された患者は、GERD の治癒の維持および 52 週で胸やけの症状がない状態を維持している患者の割合に関して、両方の研究でプラセボよりも有意に優れていました。 ACIPHEX 20mg 遅延放出錠の推奨用量は、1 日 1 回 20mg です。
成人における症候性GERDの治療
日中および夜間の胸やけの成人患者 316 人を対象に、2 つの米国多施設二重盲検プラセボ対照研究が実施されました。患者は、無作為化の前の週のプラセボ治療段階で、中等度から非常に重度の胸やけが 5 回以上報告されました。患者は内視鏡検査によって食道びらんがないことが確認されました。
RABUSA-2 試験および RAB-USA 試験の 4 週間の試験において、日中および/または夜間の胸やけのない期間の割合は、プラセボと比較して 20 mg ACIPHEX 20 mg 遅延放出錠でより高かった (47% 対 23%)。 3 (52% 対 28%)。平均日中および夜間の胸やけスコアのベースラインからの平均減少は、4 週目のプラセボと比較して ACIPHEX 20 mg で有意に大きかった。毎日の平均日中および夜間スコアを示すグラフ表示を図 2 ~ 5 に示します。
図 2: 日中の平均胸焼けスコア RAB-USA-2
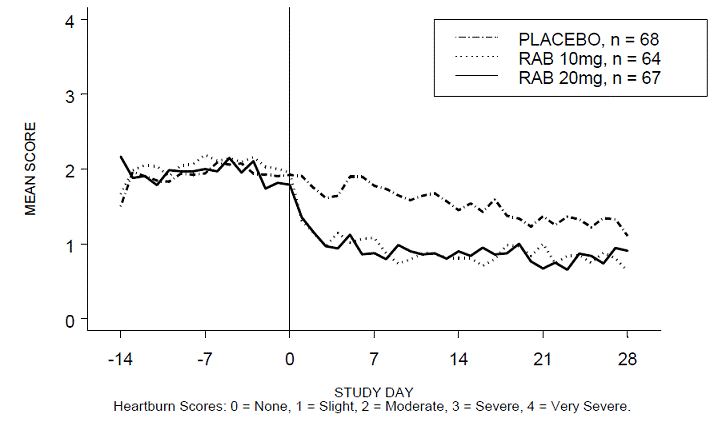
図 3: 平均夜間胸焼けスコア RAB-USA-2
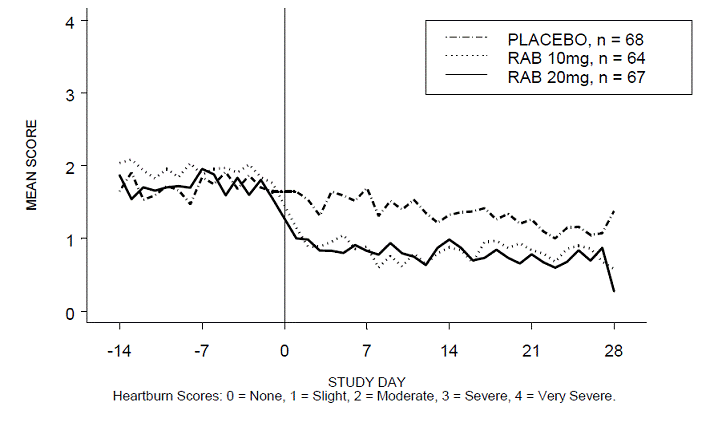
図 4: 平均日中胸焼けスコア RAB-USA-3 図 3: 平均日中胸焼けスコア RAB - USA -3
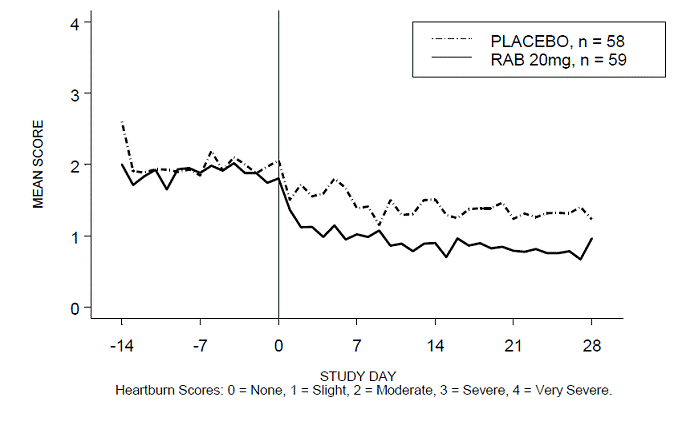
図 5: 平均夜間胸焼けスコア RAB-USA-3
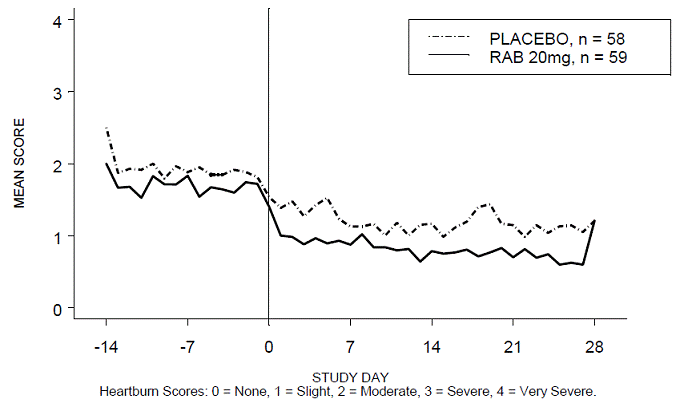
さらに、これら 2 つの研究を組み合わせた分析では、20 mg の ACIPHEX 10 mg 遅延放出錠剤が、プラセボと比較して 4 週目までに他の GERD 関連症状 (逆流、げっぷ、早期満腹感) を大幅に改善したことが示されました (すべての p 値
20 mg ACIPHEX 20 mg 遅延放出錠剤の用量も、プラセボと比較して 4 週間にわたって 1 日あたりの制酸薬の消費量を大幅に減少させました (p
ACIPHEX 遅延放出錠剤の推奨用量は、1 日 1 回 20 mg を 4 週間服用することです。
成人の十二指腸潰瘍の治癒
内視鏡的に定義された十二指腸潰瘍を治癒するための 1 日 1 回 20 mg および 40 mg の ACIPHEX 10 mg 遅延放出錠剤とプラセボの有効性を評価する米国の無作為化二重盲検多施設研究では、100 人の患者が最大 4 週間治療されました。 ACIPHEX は、十二指腸潰瘍の治癒においてプラセボよりも有意に優れていました。内視鏡治療を受けた患者の割合を以下に示します。
週目と 4 週目には、ACIPHEX 20 mg と 40 mg 群の有意に多くの患者が、潰瘍の痛みの頻度 (p≤0.018)、日中の痛みの重症度 (p≤0.023)、および夜間の痛みの重症度 (p≤0.035) の完全な解消を報告しました。プラセボ患者。唯一の例外は、十二指腸潰瘍の痛みの頻度に関する 2 週目の 40 mg 群とプラセボ群でした (p=0.094)。研究の最初の週の終わりまでに、プラセボと比較して、日中と夜間の痛みの解消に両方の ACIPHEX グループで有意差が認められました。 2 週目と 4 週目でプラセボと比較して、両方の ACIPHEX 群で毎日の制酸剤使用量の有意な減少も認められました (p
205 人の患者を対象に、1 日 1 回のアシフェックス遅延放出錠 20 mg と 1 日 1 回のオメプラゾール 20 mg を比較する国際無作為化二重盲検実薬対照試験が実施されました。この試験は、両群で 4 週間の治癒反応率が 93% であると仮定して、ACIPHEX 10mg とオメプラゾールの間の少なくとも 10% の差を排除するために、少なくとも 80% の力を提供するように設計されました。内視鏡的に定義された十二指腸潰瘍の患者で最大 4 週間治療された場合、ACIPHEX は十二指腸潰瘍の治癒においてオメプラゾールと同等でした。 2 週間および 4 週間で内視鏡治癒した患者の割合を以下に示します。
ACIPHEX 20mg とオメプラゾールは、症状を完全に解消する点で同等でした。
ACIPHEX 20mg 遅延放出錠の推奨用量は、1 日 1 回 20mg を 4 週間服用することです。
成人の消化性潰瘍疾患または症候性非潰瘍性疾患の患者におけるヘリコバクター・ピロリの除菌
米国の多施設試験は、ACIPHEX 遅延放出錠、アモキシシリン、およびクラリスロマイシンを 3、7、または 10 日間投与した場合と、オメプラゾール、アモキシシリン、およびクラリスロマイシンを 10 日間投与した場合の二重盲検並行群間比較でした。治療は、ラベプラゾール 20 mg 1 日 2 回、アモキシシリン 1000 mg 1 日 2 回、およびクラリスロマイシン 500 mg 1 日 2 回 (RAC) またはオメプラゾール 20 mg 1 日 2 回、アモキシシリン 1000 mg 1 日 2 回、およびクラリスロマイシン 500 mg 1 日 2 回 (OAC) で構成されていました。 H. pylori 感染患者は、消化性潰瘍疾患 (活動性または過去 5 年間の潰瘍の病歴) [PUD] および症状はあるが消化性潰瘍疾患のない患者 [NPUD] に対して 1:1 の比率で層別化されました。上部消化管内視鏡検査で判明。治療終了から 6 週間以上の H. pylori の 13C-UBT が陰性であると定義される全体的な H. pylori 除菌率を次の表に示します。 7 日間および 10 日間の RAC レジメンの根絶率は、Intent-to-Treat (ITT) または Per-Protocol (PP) 集団を使用した 10 日間の OAC レジメンと同様であることがわかりました。 RAC 3 日間レジメンでの根絶率は、他のレジメンよりも劣っていました。
ACIPHEX 20mg 遅延放出錠剤の推奨投与量は、7 日間、アモキシシリンとクラリスロマイシンと共に 20mg を 1 日 2 回服用することです。
成人のゾリンジャー・エリソン症候群を含む病理学的過剰分泌状態
特発性胃分泌過多またはゾリンジャー・エリソン症候群の 12 人の患者が、ACIPHEX 10mg 遅延放出錠を 20 ~ 120 mg の用量で最長 12 か月間使用して治療に成功しました。 ACIPHEX 10mg は、すべての患者の胃酸分泌を十分に抑制し、酸消化性疾患の徴候と症状を完全に解消しました。また、ACIPHEX 20mg は、すべての患者において、胃の分泌過多および酸消化性疾患の症状の再発を予防しました。胃分泌過多の患者のこの小さなコホートを治療するために使用された高用量の ACIPHEX は、十分に許容されました。
ACIPHEX 遅延放出錠剤の推奨開始用量は、1 日 1 回 60 mg です。
参考文献
1. Clinical and Laboratory Standards Institute (CLSI)。好気的に増殖する細菌の希釈抗菌薬感受性試験の方法。承認された標準 - 第 10 版。 CLSI ドキュメント M07-A10、Clinical and Laboratory Standards Institute、950 West Valley Road、Suite 2500、Wayne、Pennsylvania、19087、USA 2015。
患者情報
アシフェックス® (a-se-feks) (ラベプラゾールナトリウム) 遅延放出錠
ACIPHEX 10mg について知っておくべき最も重要な情報は何ですか?
ACIPHEX 20mg は、処方されたとおりに、可能な限り低用量で、必要な最短時間で服用する必要があります。
ACIPHEX 20mg は胃酸関連の症状を改善する可能性がありますが、深刻な胃の問題が残る可能性があります。 医師に相談してください。
ACIPHEX 20mg は、次のような重大な副作用を引き起こす可能性があります。
- 腎臓の問題の一種(急性尿細管間質性腎炎)。 ACIPHEX を含むプロトンポンプ阻害薬 (PPI) 薬を服用している一部の人々は、ACIPHEX による治療中にいつでも発生する可能性のある急性尿細管間質性腎炎と呼ばれる腎臓の問題を発症する可能性があります。尿の量が減ったり、尿に血が混じったりした場合は、すぐに医師に連絡してください。
- 腸内の感染症 (クロストリジウム ディフィシル) によって引き起こされる下痢。 水様便や胃の痛みが治まらない場合は、すぐに医師に連絡してください。熱がある場合とない場合があります。
- 骨折(股関節、手首、または背骨)。 股関節、手首、または脊椎の骨折は、PPI 薬を 1 日複数回、長期間 (1 年以上) 服用している人に発生する可能性があります。特に股関節、手首、脊椎に骨折がある場合は、医師に相談してください。
- 特定の種類のエリテマトーデス。 エリテマトーデスは自己免疫疾患です (体の免疫細胞が体内の他の細胞や臓器を攻撃します)。 ACIPHEX を含む PPI 薬を服用している一部の人々は、特定の種類のエリテマトーデスを発症するか、すでに持っているループスが悪化する可能性があります。関節痛が新たに発生したり、悪化したり、頬や腕に発疹ができたり、太陽の下で悪化したりする場合は、すぐに医師に連絡してください.
これらの深刻な副作用のリスクについて医師に相談してください。
ACIPHEX 10mg には、その他の深刻な副作用がある場合があります。 「ACIPHEX 10mg で考えられる副作用は何ですか?」を参照してください。
アシフェックス20mgとは?
アシフェックス 10mg は、プロトンポンプ阻害剤 (PPI) と呼ばれる処方薬です。
ACIPHEX 20mg は胃酸の量を減らします。
成人では、 アシフェックスは次の目的で使用されます。
- 食道の内層への酸関連の損傷(びらん性食道炎またはEEと呼ばれる)を治癒し、胸やけの痛みなどの症状を緩和するために、8週間から16週間。
- 食道の治癒を維持し、EEに関連する症状を緩和します。 ACIPHEX 20mg を 12 か月 (1 年) 以上使用した場合の安全性と有効性は不明です。
- 胃食道逆流症(GERD)で発生する日中および夜間の胸やけやその他の症状を治療するために最大4週間。
- 十二指腸潰瘍の症状の治癒と軽減のために最大4週間。
- ピロリ菌と呼ばれる細菌による感染症や胃(十二指腸)潰瘍を治療するために、特定の抗生物質を 7 日間服用します。
- 胃酸過多状態の長期治療。これには、ゾリンジャー・エリソン症候群と呼ばれるまれな状態が含まれます。
12歳以上の青年では、 ACIPHEX 10mg は、GERD の症状を治療するために最大 8 週間使用されます。
ACIPHEX が 12 歳未満の子供に他の用途で安全かつ有効であるかどうかはわかっていません。
ACIPHEX 遅延放出錠は、12 歳未満の子供には使用しないでください。
次の場合は、ACIPHEX 10mg を服用しないでください。
- ラベプラゾール、その他の PPI 薬、または ACIPHEX の成分にアレルギーのある方。成分の完全なリストについては、この投薬ガイドの最後を参照してください。
- HIV-1(ヒト免疫不全ウイルス)の治療に使用されるリルピビリン(EDURANT、COMPLERA、ODEFSEY)を含む薬を服用している。
ACIPHEX を服用する前に、次の場合を含め、すべての病状について医師に相談してください。
- 血液中のマグネシウム濃度、カルシウム濃度、カリウム濃度が低い。
- 肝臓に問題があります。
- 妊娠している、または妊娠する予定がある。 ACIPHEX 20mg が胎児に害を及ぼすかどうかはわかっていません。
- 授乳中または授乳を計画している。 ACIPHEX 10mg が母乳に移行するかどうかは不明です。 ACIPHEX を服用する場合は、赤ちゃんに与える最善の方法について医師に相談してください。
服用しているすべての薬について医師に伝えてください。 処方薬および市販薬、ビタミン、ハーブサプリメントを含みます。 特に医師に伝えてください クラリスロマイシンまたはアモキシシリンを含む抗生物質を服用している場合、またはワルファリン(COUMADIN、JANTOVEN)、メトトレキサート(OTREXUP、RASUVO、TREXALL、XATMEP)、ジゴキシン(LANOXIN)、またはウォーターピル(利尿薬)を服用している場合。
アシフェックスの服用方法は?
- ACIPHEX は処方どおりに服用してください。
- ACIPHEX は通常、1 日 1 回服用します。医師は、病状に基づいて、ACIPHEX を服用する時刻を教えてくれます。
- アシフェックス 10mg は食事の有無にかかわらず服用できます。医師は、病状に基づいて、この薬を食事と一緒に服用するか、食事なしで服用するかを指示します。
- アシフェックス 20mg の各錠剤を丸ごと飲み込んでください。 ACIPHEX 10mg 錠を噛んだり、砕いたり、割ったりしないでください。 錠剤を丸ごと飲み込めない場合は、医師に相談してください。
- アシフェックス 10mg を飲み忘れた場合は、できるだけ早く服用してください。次の服用時間が近い場合は、飲み忘れた分は服用しないでください。次の分量は通常の時間に服用してください。 2回分を同時に服用しないでください。
- ACIPHEX 20mg を服用しすぎた場合は、すぐに医師または毒物管理センター (1-800-222-1222) に電話するか、最寄りの緊急治療室に行ってください。
- 医師が ACIPHEX を含む抗生物質を処方している場合は、抗生物質を服用する前に、抗生物質に付属の患者情報をお読みください。
ACIPHEX 20mg の副作用の可能性は何ですか?
ACIPHEX 10mg は、次のような重大な副作用を引き起こす可能性があります。
- 「ACIPHEX 20mg について知っておくべき最も重要な情報は何ですか?」を参照してください。
- ワルファリンとの相互作用。 PPI 薬と一緒にワルファリンを服用すると、出血や死亡のリスクが高まる可能性があります。ワルファリンを服用している場合、医師は出血のリスクが高いかどうかを確認するために血液を検査することがあります. ACIPHEX 20mg による治療中にワルファリンを服用している場合は、次のような出血の兆候や症状がある場合は、すぐに医師に相談してください。
- 痛み、腫れまたは不快感
- 頭痛、めまい、または衰弱
- 異常なあざ(原因不明のあざ、または大きくなるあざ)
- 鼻血
- 歯ぐきの出血
- 切り傷からの出血は止まるまでに時間がかかる
- 通常より重い月経出血
- ピンクまたは茶色の尿
- 赤または黒の便
- 喀血
- 吐血またはコーヒーかすのような嘔吐物
- 低ビタミン B-12 レベル アシフェックス 10mg を長期間 (3 年以上) 服用している人に体内で起こる可能性があります。息切れ、立ちくらみ、不整脈、筋力低下、肌の青白さ、疲労感、気分の変化、腕や脚のうずきやしびれなど、ビタミン B-12 レベルの低下の症状がある場合は、医師に相談してください。
- 体内のマグネシウム濃度が低い アシフェックス 20mg を 3 か月以上服用した人に起こる可能性があります。痙攣、めまい、不整脈、神経質、筋肉痛、筋力低下、手、足、声のけいれんなど、低マグネシウム レベルの症状がある場合は、医師に相談してください。
- 胃の成長(胃底腺ポリープ)。 PPI薬を長期間服用している人は、特にPPI薬を1年以上服用した後、胃底腺ポリープと呼ばれる特定の種類の胃の成長を発症するリスクが高くなります.
- 重度の皮膚反応。 ACIPHEX は、まれではあるが深刻な皮膚反応を引き起こし、体のあらゆる部分に影響を与える可能性があります。これらの深刻な皮膚反応は、病院で治療する必要があり、生命を脅かす可能性があります。
- 皮膚のあらゆる部分(唇、目、口、鼻、性器、手または足を含む)に水ぶくれ、はがれ、または出血がある皮膚発疹。
- また、発熱、悪寒、体の痛み、息切れ、またはリンパ節の腫大がみられることもあります。
ACIPHEX 20mg の服用を中止し、すぐに医師に連絡してください。これらの症状は、重度の皮膚反応の最初の兆候である可能性があります。
成人における ACIPHEX 20mg の最も一般的な副作用は次のとおりです。 痛み、喉の痛み、ガス、感染症、便秘。
12 歳以上の青年における ACIPHEX の最も一般的な副作用は次のとおりです。 頭痛、下痢、吐き気、嘔吐、胃部(腹部)の痛み。
これらは ACIPHEX の考えられる副作用のすべてではありません。副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
アシフェックスの保管方法は?
ACIPHEX 錠剤は、室温 68°F ~ 77°F (20°C ~ 25°C) の乾燥した場所に保管してください。
ACIPHEX 20mg とすべての医薬品は子供の手の届かないところに保管してください。
ACIPHEX の安全で効果的な使用に関する一般情報。
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。処方されていない状態で ACIPHEX を使用しないでください。他の人があなたと同じ症状を持っていたとしても、ACIPHEX を他の人に与えないでください。それらに害を及ぼす可能性があります。
医療専門家向けに書かれた ACIPHEX に関する情報については、医師または薬剤師にお尋ねください。
アシフェックス 10mg の成分は何ですか?
有効成分: ラベプラゾールナトリウム
不活性成分: カルナウバワックス、クロスポビドン、ジアセチル化モノグリセリド、エチルセルロース、ヒドロキシプロピルセルロース、フタル酸ヒプロメロース、ステアリン酸マグネシウム、マンニトール、水酸化ナトリウム、フマル酸ステアリルナトリウム、タルク、二酸化チタン。黄色酸化鉄は、錠剤コーティングの着色剤です。酸化鉄の赤はインクの顔料です。
この医薬品ガイドは、米国食品医薬品局によって承認されています。改訂: 2022 年 3 月
