Prevacid 15mg, 30mg Lansoprazole 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Prevacid とは何ですか?また、どのように使用されますか?
Prevacid 15mg は、胃や腸の潰瘍の症状を治療し、胃で生成される酸の量を減らすために使用される処方薬です。 Prevacid 15mg は、単独で使用することも、他の薬と併用することもできます。
- Prevacid 15mg は、プロトンポンプ阻害剤です。
Prevacid 30mg の副作用の可能性は何ですか?
Prevacid 30mg は、次のような重大な副作用を引き起こす可能性があります。
- 激しい胃痛、
- 血を含む下痢、
- 発作(けいれん、
- 排尿困難、
- 尿に血が混じる
- 腫れ、
- 急激な体重増加、
- めまい、
- 速いまたは不規則な心拍数、
- 揺れ、
- ぎくしゃくした筋肉の動き、
- ぎくしゃくした感じ、
- 手や足の筋肉のけいれんやけいれん、
- 咳、
- あなたが窒息しているような感覚、
- 関節痛など
- 日光で悪化する頬や腕の皮膚発疹
上記の症状がある場合は、すぐに医療機関を受診してください。
Prevacid 15mg の最も一般的な副作用は次のとおりです。
- 吐き気、
- 胃痛、
- 下痢、
- 便秘、および
- 頭痛
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Prevacid の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
PREVACID (ランソプラゾール) 徐放性口腔内崩壊錠
説明
PREVACID 30mg 遅延放出カプセルおよび PREVACID 15mg SoluTab 遅延放出口腔内崩壊錠の有効成分は、置換ベンズイミダゾールであるランソプラゾール、2-[[[3-メチル-4-(2,2,2トリフルオロエトキシ)-2-ピリジル]です。メチル]スルフィニル]ベンゾイミダゾール、胃酸分泌を阻害する化合物。その実験式は C16H14F3N3O2S で、分子量は 369.37 です。ランソプラゾールの構造は次のとおりです。
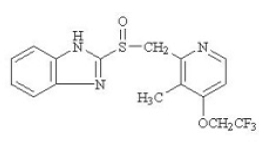
ランソプラゾールは白色から茶色がかった白色の無臭の結晶性粉末で、約 166°C で分解して融解します。ランソプラゾールはジメチルホルムアミドに溶けやすい。メタノールに可溶。エタノールにやや溶けにくい。酢酸エチル、ジクロロメタン、アセトニトリルに溶けにくい。エーテルに極めて溶けにくく、ヘキサンと水にほとんど溶けない。
ランソプラゾールは、最長 2 か月間光にさらされても安定です。水溶液中の化合物の分解速度は、pH の低下とともに増加します。 25℃の水溶液中の原薬の分解半減期は、pH 5.0 で約 0.5 時間、pH 7.0 で約 18 時間です。
PREVACID は遅延放出カプセルで供給され、PREVACID 15mg SoluTab は経口投与用の遅延放出口腔内崩壊錠 (SoluTab) で供給されます。
PREVACID は、1 カプセルあたり 15 mg および 30 mg のランソプラゾールの 2 つの用量強度で利用できます。各遅延放出カプセルには、15 または 30 mg のランソプラゾール (有効成分) と次の不活性成分からなる腸溶コーティング顆粒が含まれています: シュガースフィア、スクロース、メタクリル酸コポリマー、低置換度ヒドロキシプロピルセルロース、デンプン、炭酸マグネシウム、タルク、ポリエチレングリコール、二酸化チタン、ポリソルベート 80、ヒドロキシプロピルセルロース、コロイド状二酸化ケイ素、D&C 赤 28 号、FD&C 青 1 号、FD&C 緑 31 号、および FD&C 赤 40 号。
PREVACID 30mg SoluTab は、1 錠あたり 15 mg と 30 mg のランソプラゾールの 2 種類の用量で利用できます。各遅延放出口腔内崩壊錠には、15 または 30 mg のランソプラゾール (有効成分) および次の不活性成分からなる腸溶性コーティングされた微粒子が含まれています: マンニトール、メタクリル酸、ヒドロキシプロピルセルロース、乳糖一水和物-微結晶セルロース球体、クエン酸トリエチル、クロスポビドン、ポリアクリル酸、炭酸マグネシウム、アスパルテーム 2、モノステアリン酸グリセリル、ヒプロメロース、ステアリン酸マグネシウム、クエン酸、二酸化チタン、タルク、人工いちご香料、ポリエチレングリコール、ポリソルベート 80、酸化鉄。
1PREVACID 15 mg カプセルのみ。 2 フェニルケトン尿薬: PREVACID SoluTab には、15 mg タブレットあたり 2.5 mg のフェニルアラニンと 30 mg タブレットあたり 5.1 mg のフェニルアラニンが含まれています。
適応症
活動性十二指腸潰瘍の治療
PREVACID および PREVACID SoluTab は、活動性十二指腸潰瘍の治癒と症状緩和のための短期治療 (4 週間) が成人に適応となります [参照 臨床研究 ]。
ピロリ菌の除菌で十二指腸潰瘍の再発リスクを軽減
トリプル療法:PREVACID または PREVACID SoluTab/アモキシシリン/クラリスロマイシン
PREVACID または PREVACID 30mg SoluTab とアモキシシリン + クラリスロマイシンの 3 剤併用療法は、H. pylori 感染および十二指腸潰瘍疾患 (活動性または 1 年間の十二指腸潰瘍歴) を有する成人患者の H. pylori を根絶するための治療に適応されます。 H. pylori の除菌は、十二指腸潰瘍の再発リスクを低下させることが示されている [参照 臨床研究 ]。
アモキシシリンとクラリスロマイシンの完全な処方情報を参照してください。
二重療法: PREVACID または PREVACID SoluTab/アモキシシリン
PREVACID または PREVACID 15mg SoluTab とアモキシシリンを二重療法として併用することは、クラリスロマイシンに対するアレルギーまたは不耐性のいずれかであるピロリ菌感染および十二指腸潰瘍疾患 (活動性または十二指腸潰瘍の 1 年間の病歴) を有する成人患者の治療に適応されます。クラリスロマイシンに対する耐性が知られている、または疑われる患者(クラリスロマイシンの処方情報、微生物学のセクションを参照)。 H. pylori の除菌は、十二指腸潰瘍の再発リスクを低下させることが示されている [参照 臨床研究 ]。
アモキシシリンの完全な処方情報を参照してください。
治癒した十二指腸潰瘍の維持
PREVACID および PREVACID SoluTab は、十二指腸潰瘍の治癒を維持するために成人に適応されます。対照研究は 12 か月を超えない [参照 臨床研究 ]。
活動性良性胃潰瘍の治療
PREVACID および PREVACID 30mg SoluTab は、活動性良性胃潰瘍の治癒および症状緩和のための短期治療 (最大 8 週間) が成人に適応されます [参照 臨床研究 ]。
NSAID関連胃潰瘍の治癒
PREVACID 30mg および PREVACID SoluTab は、NSAID の使用を継続している患者の NSAID 関連胃潰瘍の治療のために成人に適応されます。対照研究は 8 週間を超えることはなかった [参照 臨床研究 ]。
NSAID関連胃潰瘍のリスク軽減
PREVACID 15mg および PREVACID SoluTab は、胃潰瘍の既往歴があり、NSAID の使用が必要な患者の NSAID 関連胃潰瘍のリスクを軽減するために成人に適応されます。対照研究は 12 週間を超えて延長されなかった [参照 臨床研究 ]。
症候性胃食道逆流症(GERD)の治療
PREVACID 15mg および PREVACID 30mg SoluTab は、成人および 12 ~ 17 歳 (最大 8 週間) の小児患者および 1 ~ 11 歳 (最大 12 週間) の小児患者の胸やけの治療のための短期治療に適応されます。およびGERDに関連するその他の症状[参照 臨床研究 ]。
びらん性食道炎(EE)の治療
PREVACID 15mg および PREVACID 30mg SoluTab は、成人および 12 歳から 17 歳までの小児患者 (最大 8 週間)、および 1 歳から 11 歳までの小児患者 (最大 12 週間) の治癒および症状緩和のための短期治療に適応されます。 EE のすべての等級の。
PREVACID 30mg または PREVACID 15mg SoluTab を 8 週間 (5 ~ 10%) 使用しても治癒しない成人の場合、さらに 8 週間の治療を行うことが役立つ場合があります。びらん性食道炎が再発した場合は、PREVACID 30mg または PREVACID SoluTab の追加の 8 週間コースを検討してもよい [ 臨床研究 ]。
EEの治癒の維持
PREVACID および PREVACID SoluTab は、EE の治癒を維持するために成人に適応されます。対照研究は 12 か月を超えて延長されなかった [参照 臨床研究 ]。
Zollinger-Ellison Syndrome (ZES) を含む病的な過剰分泌状態
PREVACID 15mg および PREVACID SoluTab は、ゾリンジャー・エリソン症候群を含む病理学的過剰分泌状態の長期治療のために成人に適応されます [参照 臨床研究 ]。
投薬と管理
適応症による成人の推奨用量
適応症別推奨小児用用量
1歳から11歳までの小児患者
臨床研究では、PREVACID は 1 歳から 11 歳までの 12 週間を超えて投与されませんでした。推奨期間よりも長く使用した場合、PREVACID が安全で効果的であるかどうかは不明です。以下に概説するように、小児患者の推奨用量および使用期間を超えないでください [ 特定の集団での使用 ]。
肝障害
推奨用量は、重度の肝障害のある患者(Child-Pugh C)の経口で毎日 15 mg です。 特定の集団での使用 ]。
重要な管理情報
- PREVACID または PREVACID 30mg SoluTab を食事の前に服用してください。
- PREVACID 15mg カプセルまたは PREVACID 30mg SoluTab をつぶしたり、噛んだりしないでください。
- スクラルファートの少なくとも 30 分前に PREVACID または PREVACID 30mg SoluTab を服用してください。 薬物相互作用 ]。
- 制酸剤は、PREVACID または PREVACID SoluTab と併用することができます。
- 飲み忘れ:飲み忘れた場合は、できるだけ早く服用してください。ただし、次回の服用予定日が迫っている場合は、飲み忘れた分は服用せず、時間通りに次の服用を行ってください。飲み忘れた分を補うために、一度に 2 回分を服用しないでください。
プレバシッドカプセル
- 全体を飲み込みます。噛まないでください。
- カプセルを飲み込むのが困難な患者の場合、PREVACID カプセルを開けて、経口または経鼻胃管を介して、以下に指定された柔らかい食品または液体で投与することができます。
- 以下で説明するもの以外の食品または液体での PREVACID の投与は、臨床的に研究されていないため、推奨されません。
ソフト フード (アップルソース、エンシュア プリン、カッテージ チーズ、ヨーグルトまたは濾した梨) への投与:
液体での投与(リンゴジュース、オレンジジュースまたはトマトジュース):
経鼻胃管を介したアップルジュースの投与(フランス16歳以上)
プレバシッド 15mg ソルタブ
- 壊したり切ったりしないでください。
- 錠剤を舌の上に置き、水を加えてまたは加えずに、微粒子が飲み込めるようになるまで錠剤を崩壊させます。微粒子を噛まないでください。
- 通常、錠剤は 1 分以内に崩壊します。
- 別の方法として、子供や錠剤を飲み込むのが困難なその他の患者には、以下のように経口シリンジまたは NG チューブを介して PREVACID SoluTab を水と一緒に投与することができます。
経口注射器による水による投与
NG チューブを介した水による投与 (≥8 フレンチ)
供給方法
剤形と強度
PREVACID 15mg 遅延放出カプセル
- 15mgの強さは、「TAP」と「PREVACID 15」と刻印された不透明なピンクとグリーンのカプセルです。
- 30mgの強さは、「TAP」と「PREVACID 30」と刻印された不透明なピンクと黒のカプセルです。
プレバシッド 30mg SoluTab 徐放性口腔内崩壊錠
- 強度 15 mg は、白色から黄白色のコーティングされていない丸い錠剤で、オレンジ色から暗褐色の斑点があり、片面に「15」と刻印されています。
- 強度 30 mg は、白色から黄白色のコーティングされていない丸い錠剤で、オレンジ色から暗褐色の斑点があり、片面に「30」と刻印されています。
保管と取り扱い
PREVACID 遅延放出カプセル 、15 mg は、カプセルに「TAP」と「PREVACID 15」と刻印された不透明なピンクとグリーンです。 30 mg 遅延放出カプセルは、不透明、ピンク、および黒色で、カプセルに「TAP」および「PREVACID 30」と刻印されています。それらは次のように利用できます。
プレバシッド 30mg SoluTab 徐放性口腔内崩壊錠 、15 mg は、白色から黄白色の丸い素錠で、オレンジ色から暗褐色の斑点があり、錠剤の片面に「15」の文字が刻印されています。 30 mg は白色から黄白色の丸い素錠で、オレンジ色から暗褐色の斑点があり、錠剤の片面に「30」の文字が刻印されています。タブレットは次のように利用できます。
25°C (77°F) で保管してください。 15 ~ 30°C (59 ~ 86°F) まで許容されるエクスカーション[参照 USP制御の室温 ]。
販売元: Takeda Pharmaceuticals America, Inc., Deerfield, IL 60015. 改訂: 2018 年 6 月
副作用
次の重篤な有害反応は、以下およびラベルの他の場所で説明されています。
- 急性尿細管間質性腎炎 [参照 警告と注意事項 ]
- クロストリジウム・ディフィシル関連下痢[参照 警告と注意事項 ]
- 骨折 [参照 警告と注意事項 ]
- 重度の皮膚有害反応 [参照 警告と注意事項 ]
- 皮膚および全身性エリテマトーデス [参照 警告と注意事項 ]
- シアノコバラミン (ビタミン B12) 欠乏症 [参照 警告と注意事項 ]
- 低マグネシウム血症とミネラル代謝 [参照 警告と注意事項 ]
- 胃底ポリープ [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、臨床現場で観察された率を反映していない可能性があります。
世界中で、10,000 人を超える患者が、さまざまな投与量と治療期間を含む第 2 相または第 3 相臨床試験で PREVACID 30mg で治療されています。一般に、PREVACID 30mg 治療は、短期および長期の試験の両方で良好な忍容性を示しています。
以下の有害反応は、担当医によって、PREVACID 治療を受けた患者の 1% 以上で薬物との可能性または可能性のある関係があると報告されており、表 1 のプラセボ治療を受けた患者よりも PREVACID 治療を受けた患者で高い割合で発生しました。
頭痛も 1% を超える発生率で見られましたが、プラセボではより一般的でした。下痢の発生率は、プラセボを投与された患者と 15 mg および 30 mg の PREVACID を投与された患者の間で同様でしたが、60 mg の PREVACID を投与された患者でより高かった (それぞれ 2.9、1.4、4.2、および 7.4%)。
維持療法中に最も一般的に報告された、おそらくまたはおそらく治療関連の有害事象は下痢でした。
NSAID 関連胃潰瘍に対する PREVACID のリスク低減研究では、PREVACID 30mg、ミソプロストール、およびプラセボで治療された患者の下痢の発生率は、それぞれ 5、22、および 3% でした。
患者がCOX-2阻害剤またはランソプラゾールとナプロキセンのいずれかを服用した同じ適応症に関する別の研究では、安全性プロファイルが以前の研究と同様であることが示されました. PREVACID 30mg を使用した他の臨床試験で以前に観察されなかったこの研究からの追加の反応には、挫傷、十二指腸炎、心窩部不快感、食道障害、疲労、空腹、裂孔ヘルニア、嗄声、胃排出障害、化生、および腎障害が含まれます。
国内試験で PREVACID 15mg を投与された患者または被験者の 1% 未満で発生した追加の有害事象を以下に示します。
全身 - 腹部膨満、アレルギー反応、無力症、背中の痛み、カンジダ症、癌腫、胸痛(特に明記しない)、悪寒、浮腫、発熱、インフルエンザ症候群、口臭、感染症(特に明記しない)、倦怠感、首の痛み、首のこわばり、痛み、 骨盤の痛み
心臓血管系 - 狭心症、不整脈、徐脈、脳血管障害・脳梗塞、高血圧・低血圧、片頭痛、心筋梗塞、動悸、ショック(循環不全)、失神、頻脈、血管拡張
消化器系 - 異常便、食欲不振、胃石、心臓痙攣、胆石症、大腸炎、口渇、消化不良、嚥下障害、腸炎、おくび、食道狭窄、食道潰瘍、食道炎、便の変色、鼓腸、胃結節・胃底ポリープ、胃炎、胃腸炎、胃腸異常、胃腸障害、胃腸出血、舌炎、歯肉出血、吐血、食欲増進、唾液分泌亢進、下血、口内潰瘍、吐き気・嘔吐、吐き気・嘔吐・下痢、胃腸障害、直腸障害、直腸出血、口内炎、テネスムス、口渇、舌障害、潰瘍性大腸炎、潰瘍性口内炎
内分泌系 - 真性糖尿病、甲状腺腫、甲状腺機能低下症 血液およびリンパ系 - 貧血、溶血、リンパ節腫脹
代謝と栄養障害 - ビタミン欠乏症、痛風、脱水、高血糖/低血糖、末梢性浮腫、体重増加/減少
筋骨格系 - 関節痛、関節炎、骨障害、関節障害、脚のけいれん、筋骨格痛、筋肉痛、筋無力症、眼瞼下垂、滑膜炎
神経系 - 異常な夢、動揺、記憶喪失、不安、無気力、錯乱、痙攣、認知症、離人症、うつ病、複視、めまい、情緒不安定、幻覚、片麻痺、敵意悪化、多動症、筋緊張亢進、感覚鈍麻、不眠症、性欲減退/増悪、神経過敏、神経症、感覚異常、睡眠障害、傾眠、思考異常、振戦、めまい
呼吸器系 - 喘息、気管支炎、咳嗽増加、呼吸困難、鼻出血、喀血、しゃっくり、喉頭腫瘍、肺線維症、咽頭炎、胸膜障害、肺炎、呼吸器障害、上気道炎・感染症、鼻炎、副鼻腔炎、喘鳴
皮膚と付属物 - にきび、脱毛症、接触皮膚炎、乾燥肌、固定性発疹、毛髪障害、斑状丘疹性発疹、爪障害、そう痒症、発疹、皮膚癌、皮膚障害、発汗、蕁麻疹
特別な感覚 - 視力異常、弱視、眼瞼炎、かすみ目、白内障、結膜炎、難聴、ドライアイ、耳・目の障害、眼痛、緑内障、中耳炎、視感覚異常、羞明、網膜変性・障害、味覚異常、味覚異常、耳鳴り、視覚障害フィールド欠陥
泌尿生殖器系 - 月経異常、乳房肥大、乳房痛、乳房圧痛、月経困難症、排尿障害、女性化乳房、インポテンス、腎結石、腎痛、白帯下、月経過多、月経障害、陰茎障害、多尿症、精巣障害、尿道痛、頻尿、尿閉、尿路感染症、尿意切迫感、排尿障害、膣炎
市販後の経験
PREVACID および PREVACID 30mg SoluTab が上市されて以来、追加の有害な経験が報告されています。これらの症例の大部分は海外からのものであり、PREVACID 15mg または PREVACID SoluTab との関係は確立されていません。これらの反応は未知の規模の集団から自発的に報告されたため、頻度の推定はできません。これらのイベントは、COSTART ボディ システム別に以下にリストされています。
全身 - アナフィラキシー/アナフィラクトイド反応、全身性エリテマトーデス;
消化器系 - 肝毒性、膵炎、嘔吐;
血液とリンパ系 - 無顆粒球症、再生不良性貧血、溶血性貧血、白血球減少症、好中球減少症、汎血球減少症、血小板減少症、および血栓性血小板減少性紫斑病;
感染症と蔓延 - クロストリジウム・ディフィシル関連の下痢;
代謝と栄養障害 - 低マグネシウム血症、低カルシウム血症、低カリウム血症、低ナトリウム血症;
筋骨格系 - 骨折、筋炎;
皮膚と付属物 - 多形性紅斑、SJS/TEN (致死的なものもある)、DRESS、AGEP、皮膚エリテマトーデスを含む重度の皮膚反応;
特別な感覚 - 言語障害;
泌尿生殖器系 - 間質性腎炎、尿閉。
アモキシシリンとクラリスロマイシンの併用療法
PREVACID+アモキシシリン+クラリスロマイシン、PREVACID 30mg+アモキシシリンの併用療法による臨床試験では、これらの併用療法に特有の副作用は認められませんでした。発生した有害反応は、PREVACID 15mg、アモキシシリン、またはクラリスロマイシンで以前に報告されたものに限定されています。
トリプルセラピー:PREVACID/アモキシシリン/クラリスロマイシン
3剤併用療法を14日間受けた患者で最も多く報告された副作用は、下痢(7%)、頭痛(6%)、味覚異常(5%)でした。 10 日間と 14 日間の 3 剤併用療法レジメン間で、報告された有害反応の頻度に統計的に有意な差はありませんでした。 3 剤併用療法では、2 剤併用療法よりも有意に高い率で、治療に伴う副作用は観察されませんでした。
二重療法:PREVACID/アモキシシリン
PREVACID 30mg を 1 日 3 回投与し、アモキシシリンを 1 日 3 回投与した患者で最も多く報告された副作用は、下痢 (8%) と頭痛 (7%) でした。 PREVACID 30mg 1 日 3 回+アモキシシリン 1 日 3 回の二重療法では、PREVACID 15mg 単独よりも有意に高い率で、治療に伴う副作用は観察されませんでした。
PREVACID または PREVACID SoluTab と併用する抗菌薬(アモキシシリンおよびクラリスロマイシン)の副作用に関する情報については、処方情報の有害反応のセクションを参照してください。
検査値
PREVACID 30mg を投与された患者の臨床検査値の以下の変化が副作用として報告されました。
肝機能検査異常、SGOT(AST)上昇、SGPT(ALT)上昇、クレアチニン上昇、アルカリフォスファターゼ上昇、グロブリン上昇、GGTP上昇、白血球上昇・低下・異常、AG比異常、赤血球異常、ビリルビン血症、血中カリウム上昇、血中尿素の増加、結晶尿の存在、好酸球増多、ヘモグロビンの減少、高脂血症、電解質の増加/減少、コレステロールの増加/減少、グルココルチコイドの増加、LDHの増加、血小板の増加/減少/異常、ガストリンレベルの増加、便潜血陽性。蛋白尿、糖尿、血尿などの尿異常も報告されています。追加の孤立した検査室異常が報告されました。
プラセボ対照研究では、SGOT (AST) と SGPT (ALT) が評価されたとき、プラセボと PREVACID をそれぞれ投与された 0.4% (4/978) と 0.4% (11/2677) の患者の酵素上昇が最終治療来院時の正常範囲の上限の 3 倍。 PREVACID 30mg を投与されたこれらの患者は、研究中いつでも黄疸を報告しませんでした。
PREVACID 15mg とアモキシシリンおよびクラリスロマイシンの併用療法、および PREVACID とアモキシシリンの併用療法を使用した臨床試験では、これらの薬物の組み合わせに特有の臨床検査値異常の増加は観察されませんでした。
PREVACID または PREVACID 30mg SoluTab と併用する抗菌薬 (アモキシシリンおよびクラリスロマイシン) による臨床検査値の変化については、処方情報の有害反応のセクションを参照してください。
薬物相互作用
表 2 および 3 には、PREVACID 15mg または PREVACID SoluTab と併用投与した場合に臨床的に重要な薬物相互作用および診断との相互作用を伴う薬物と、それらを予防または管理するための指示が含まれています。
PPI との相互作用に関する詳細な情報を得るには、併用薬のラベルを参照してください。
警告
の一部として含まれています 予防 セクション。
予防
胃悪性腫瘍の存在
成人では、PREVACID 15mg または PREVACID SoluTab による治療に対する症状の反応は、胃の悪性腫瘍の存在を排除するものではありません。 PPIによる治療を完了した後、最適ではない反応または初期の症状の再発がある成人患者では、追加のフォローアップおよび診断テストを検討してください.高齢の患者さんでは、内視鏡検査も考慮してください。
急性尿細管間質性腎炎
急性尿細管間質性腎炎 (TIN) は、PPI を服用している患者で観察されており、PPI 治療中の任意の時点で発生する可能性があります。患者は、症候性過敏症反応から腎機能低下の非特異的症状(例、倦怠感、吐き気、食欲不振)まで、さまざまな徴候や症状を示すことがあります。報告された症例シリーズでは、一部の患者は生検で診断され、腎外症状(例、発熱、発疹、関節痛)がない状態で診断されました。 PREVACID または PREVACID 15mg SoluTab を中止し、急性 TIN が疑われる患者を評価する [参照 禁忌 ]。
クロストリジウム・ディフィシル関連下痢症
公開された観察研究では、PREVACID 30mg や PREVACID 30mg SoluTab などの PPI 療法は、特に入院患者において、クロストリジウム ディフィシル関連下痢症 (CDAD) のリスク増加と関連している可能性があることが示唆されています。この診断は、下痢が改善しない場合に考慮する必要があります [参照 有害反応 ]。
患者は、治療する状態に適した最低用量と最短期間の PPI 療法を使用する必要があります。
CDAD は、ほぼすべての抗菌剤の使用で報告されています。 PREVACID 15mgまたはPREVACID 15mg SoluTabとの併用が指示されている抗菌薬(クラリスロマイシンおよびアモキシシリン)に固有の詳細については、処方情報の警告および使用上の注意のセクションを参照してください。
骨折
いくつかの公開された観察研究は、PPI 療法が股関節、手首、または脊椎の骨粗鬆症関連骨折のリスク増加と関連している可能性があることを示唆しています。骨折のリスクは、高用量(1 日複数回の投与と定義)および長期の PPI 療法(1 年以上)を受けた患者で増加しました。患者は、治療する状態に適した最低用量と最短期間の PPI 療法を使用する必要があります。骨粗鬆症関連の骨折のリスクがある患者は、確立された治療ガイドラインに従って管理する必要があります[参照 投薬と管理 、 有害反応 ]。
重度の皮膚有害反応
PPI の使用に関連して、スティーブンス・ジョンソン症候群 (SJS) や中毒性表皮壊死融解症 (TEN)、好酸球増加症や全身症状を伴う薬物反応 (DRESS)、急性汎発性発疹性膿疱症 (AGEP) などの重度の皮膚副作用が報告されています。 [見る 有害反応 ]。重度の皮膚有害反応の最初の兆候または症状、または過敏症の他の兆候が見られた場合は、PREVACID 30mg または PREVACID SoluTab の使用を中止し、さらなる評価を検討してください。
皮膚および全身性エリテマトーデス
皮膚エリテマトーデス (CLE) および全身性エリテマトーデス (SLE) は、ランソプラゾールを含む PPI を服用している患者で報告されています。これらの事象は、既存の自己免疫疾患の新たな発症と悪化の両方として発生しています。 PPI 誘発性エリテマトーデスの症例の大部分は CLE でした。
PPI で治療された患者で報告された CLE の最も一般的な形態は亜急性 CLE (SCLE) であり、乳児から高齢者までの範囲の患者で継続的な薬物療法の後、数週間から数年以内に発生しました。一般に、組織学的所見は臓器の関与なしに観察されました。
全身性エリテマトーデス (SLE) は、PPI を投与されている患者では CLE ほど一般的ではありません。 PPI 関連 SLE は通常、非薬物誘発性 SLE よりも軽度です。 SLE の発症は、通常、主に若年成人から高齢者までの範囲の患者で、治療を開始してから数日から数年以内に発生しました。発疹を呈した患者の大部分。しかし、関節痛と血球減少症も報告されました。
医学的に指示されているよりも長い PPI の投与は避けてください。 PREVACID 15mg または PREVACID SoluTab を投与されている患者に CLE または SLE と一致する徴候または症状が認められた場合は、薬剤の使用を中止し、評価のために適切な専門医に患者を紹介してください。ほとんどの患者は、4 ~ 12 週間で PPI のみを中止すると改善します。血清学的検査(例、ANA)は陽性である可能性があり、血清学的検査結果の上昇は、臨床症状よりも解消に時間がかかる場合があります。
シアノコバラミン(ビタミンB12)欠乏症
長期間(例えば、3年以上)にわたる酸抑制薬による毎日の治療は、低酸症または無酸症によって引き起こされるシアノコバラミン(ビタミンB12)の吸収不良につながる可能性があります.酸抑制療法で発生するシアノコバラミン欠乏症のまれな報告が文献で報告されています. PREVACID または PREVACID SoluTab で治療された患者にシアノコバラミン欠乏症と一致する臨床症状が観察された場合、この診断を考慮する必要があります。
低マグネシウム血症とミネラル代謝
症候性および無症候性の低マグネシウム血症は、ほとんどの場合、1 年間の治療後に、少なくとも 3 か月間 PPI で治療された患者でまれに報告されています。重篤な有害事象には、テタニー、不整脈、および発作が含まれます。低マグネシウム血症は、低カルシウム血症および/または低カリウム血症につながる可能性があり、リスクのある患者の潜在的な低カルシウム血症を悪化させる可能性があります。ほとんどの患者で、低マグネシウム血症の治療にはマグネシウムの補充と PPI の中止が必要でした。
長期の治療が予想される患者、またはジゴキシンなどの薬剤または低マグネシウム血症を引き起こす可能性のある薬剤(利尿薬など)と一緒に PPI を服用している患者の場合、医療専門家は、PPI 治療の開始前および定期的にマグネシウム濃度をモニタリングすることを検討してもよい [参照 有害反応 ]。
PREVACID 30mg または PREVACID SoluTab の開始前、および低カルシウム血症のリスクがある患者 (副甲状腺機能低下症など) の治療中は、定期的にマグネシウムとカルシウムのレベルを監視することを検討してください。必要に応じて、マグネシウムやカルシウムを補給してください。低カルシウム血症が治療に抵抗性である場合は、PPI の中止を検討してください。
神経内分泌腫瘍の調査との相互作用
血清クロモグラニン A (CgA) レベルは、薬物による胃酸の減少に続いて増加します。増加した CgA レベルは、神経内分泌腫瘍の診断調査で偽陽性の結果を引き起こす可能性があります。医療提供者は、CgA レベルを評価する少なくとも 14 日前にランソプラゾール治療を一時的に中止し、最初の CgA レベルが高い場合はテストを繰り返すことを検討する必要があります。一連の試験を実施する場合(例:モニタリング用)、試験間の参照範囲が異なる可能性があるため、同じ商用試験所を試験に使用する必要があります [参照 薬物相互作用 、 臨床薬理学 ]。
メトトレキサートとの相互作用
文献によると、PPI とメトトレキサート (主に高用量) を併用すると、メトトレキサートおよび/またはその代謝産物の血清レベルが上昇および延長し、メトトレキサート毒性につながる可能性があることが示唆されています。高用量のメトトレキサート投与では、一部の患者では PPI の一時的な中止が考慮される場合があります [ 薬物相互作用 、 臨床薬理学 ]。
フェニルケトン尿症の患者
フェニルアラニンは、フェニルケトン尿症 (PKU) の患者に有害な場合があります。 PREVACID 30mg SoluTab には、アスパルテームの成分であるフェニルアラニンが含まれています。各 15 mg 錠剤には 2.5 mg が含まれ、各 30 mg 錠剤には 5.1 mg のフェニルアラニンが含まれています。 PKU の患者に PREVACID SoluTab を処方する前に、PREVACID 30mg SoluTab を含むすべての供給源からのフェニルアラニンの合計 1 日量を考慮してください。
胃底ポリープ
PPI の使用は、特に 1 年以上の長期使用に伴って増加する胃底腺ポリープのリスク増加と関連しています。胃底腺ポリープを発症したほとんどの PPI ユーザーは無症候性であり、内視鏡検査で偶発的に胃底腺ポリープが特定されました。治療中の状態に適した最短期間の PPI 療法を使用してください。
1歳未満の小児患者における心臓弁肥厚のリスク
PREVACID 30mg および PREVACID SoluTab は、1 歳未満の小児患者には承認されていません。ランソプラゾールによる幼若ラットの非臨床試験では、心臓弁肥厚の悪影響が実証されています。心臓弁損傷のリスクは、1 歳以上の患者には関連していないようです [参照 特定の集団での使用 ]。
患者相談情報
患者に、FDA 承認の患者ラベル ( 投薬ガイド と 使用説明書 )。
患者に次のことをアドバイスします。
急性尿細管間質性腎炎
急性尿細管間質性腎炎に関連する徴候および/または症状を経験した場合は、医療提供者に連絡する[参照 警告と注意事項 ]。
クロストリジウム・ディフィシル関連下痢症
下痢が改善しない場合は、すぐに医療提供者に連絡する [ 警告と注意事項 ]。
骨折
特に股関節、手首、または脊椎の骨折を医療提供者に報告する[参照 警告と注意事項 ]。
重度の皮膚有害反応
PREVACID または PREVACID 30mg SoluTab の使用を中止し、すぐに担当の医療提供者に連絡して、さらなる評価を求める [ 警告と注意事項 ]。
皮膚および全身性エリテマトーデス
皮膚または全身性エリテマトーデスに関連する新たな症状または症状の悪化については、すぐに医療提供者に電話すること [参照 警告と注意事項 ]。
シアノコバラミン(ビタミンB12)欠乏症
• PREVACID または PREVACID SoluTab を 3 年以上服用している場合、シアノコバラミン欠乏症に関連する可能性のある臨床症状を医療提供者に報告すること [ 警告と注意事項 ]。
低マグネシウム血症とミネラル
代謝 PREVACID または PREVACID 15mg SoluTab を少なくとも 3 か月間服用している場合、低マグネシウム血症、低カルシウム血症、および/または低カリウム血症に関連する可能性のある臨床症状を医療提供者に報告すること [ 警告と注意事項 ]。
薬物相互作用
リルピビリン含有製品を服用している場合は、医療提供者に報告するよう患者に助言する [ 禁忌 ] または高用量メトトレキサート [参照 警告と注意事項 ]。
妊娠
妊娠中の女性には、胎児への潜在的なリスクについてアドバイスしてください。妊娠の可能性がある女性に、妊娠が判明している、または妊娠の疑いがあることを医療提供者に知らせるようにアドバイスする[参照 特定の集団での使用 ]。
管理
- 飲み忘れ:飲み忘れた場合は、できるだけ早く服用してください。ただし、次回の服用予定日が迫っている場合は、飲み忘れた分は服用せず、時間通りに次の服用を行ってください。飲み忘れた分を補うために、一度に 2 回分を服用しないでください。
- PREVACID または PREVACID 30mg SoluTab は食事の前に服用する必要があります。
- PREVACID 15mg カプセルまたは PREVACID SoluTab をつぶしたり、噛んだりしないでください。
- スクラルファートの少なくとも 30 分前に PREVACID または PREVACID 30mg SoluTab を服用してください。
- フェニルケトン尿薬: PREVACID 30mg SoluTab タブレット 15 mg あたりフェニルアラニン 2.5 mg、および PREVACID SoluTab タブレット 30 mg あたり 5.1 mg を含みます。
プレバシッドカプセル
- 全体を飲み込みます。噛まないでください。
- カプセルを飲み込むのが困難な患者の場合:
- PREVACID 15mg カプセルは開けて、アップルソース、エンシュア プリン、カッテージ チーズ、ヨーグルト、または濾した洋ナシにふりかけることができます。
- PREVACID 15mg カプセルは、少量のリンゴ ジュース、オレンジ ジュース、またはトマト ジュースのいずれかに移すこともできます。
- あるいは、PREVACID カプセルは、経鼻胃管を介してリンゴジュースと一緒に投与することができます
- すべての準備および投与手順の説明については、使用説明書を参照してください。
PREVACID ソルタブ
- 壊したり切ったりしないでください。
- 錠剤を舌の上に置きます。粒子が飲み込めるようになるまで、水の有無にかかわらず崩壊させます。粒子を噛まないでください。
- 通常、錠剤は 1 分以内に崩壊します。
- あるいは、錠剤を飲み込むのが困難な子供やその他の患者には、使用説明書に記載されているように、プレバシッド 30mg SoluTab を経口注射器または NG チューブを介して水で投与することができます。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
つの 24 か月の発がん性試験で、Sprague-Dawley ラットに 5 ~ 150 mg/kg/日の経口ランソプラゾール投与量を投与しました。平均身長 [1.46 m² 体表面積 (BSA)] の 1 日あたり 30 mg の人間の推奨用量が与えられます。ランソプラゾールは、雄と雌の両方のラットで用量依存性の胃腸クロム親和性 (ECL) 細胞過形成と ECL 細胞カルチノイドを生成しました。また、男女ともに胃上皮の腸上皮化生の発生率を増加させました。オスのラットでは、ランソプラゾールは用量に関連した精巣間質細胞腺腫の増加を引き起こしました。 15 から 150 mg/kg/日 (BSA に基づくヒトの推奨用量の 4 倍から 40 倍) の用量を投与されたラットにおけるこれらの腺腫の発生率は、この系統のラットの低いバックグラウンド発生率 (範囲 = 1.4 から 10%) を超えました。
24 か月の発がん性試験では、CD-1 マウスに 15 ~ 600 mg/kg/日の経口ランソプラゾールを投与しました。これは、BSA に基づくヒトの推奨用量の 2 ~ 80 倍です。ランソプラゾールは、胃 ECL 細胞過形成の発生率を用量依存的に増加させました。また、肝腫瘍(肝細胞腺腫と癌腫)の発生率も増加しました。 300 および 600 mg/kg/日 (BSA に基づく推奨ヒト用量の 40 ~ 80 倍) で処理された雄マウスと、150 ~ 600 mg/kg/日 (推奨ヒト用量の 20 ~ 80 倍) で処理された雌マウスにおける腫瘍発生率。 BSA に基づく用量) は、この系統のマウスの歴史的対照におけるバックグラウンド発生率の範囲を超えていました。ランソプラゾール治療は、75 ~ 600 mg/kg/日 (BSA に基づくヒトの推奨用量の 10 ~ 80 倍) を投与された雄マウスに精巣網の腺腫を引き起こしました。
26 週間の p53 (+/-) トランスジェニック マウスの発がん性試験は陽性ではありませんでした。
ランソプラゾールは、Ames 試験および in vitro ヒトリンパ球染色体異常試験で陽性でした。ランソプラゾールは、ex vivo ラット肝細胞不定期 DNA 合成 (UDS) 試験、in vivo マウス小核試験、またはラット骨髄細胞染色体異常試験で遺伝毒性を示さなかった。
最大 150 mg/kg/日 (BSA に基づくヒトの推奨用量の 40 倍) までの経口用量のランソプラゾールは、雄と雌のラットの生殖能と生殖能力に影響を与えないことが判明しました。
特定の集団での使用
妊娠
リスクの概要
発表された観察研究から得られたデータは、ランソプラゾール治療と妊娠の有害転帰との関連を示していません。 データ )。
動物繁殖研究では、器官形成期のラットにランソプラゾールを人間の最大推奨用量の 6.4 倍で経口投与すると、出生後の子孫の大腿骨重量、大腿骨長、頭頂部長さ、成長板の厚さ (雄のみ) が減少しました。 21 (参照 データ )。これらの効果は、体重増加の減少と関連していました。妊娠中の女性には、胎児への潜在的なリスクについてアドバイスしてください。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2 ~ 4% および 15 ~ 20% です。
PREVACID 15mg または PREVACID 15mg SoluTab をクラリスロマイシンと一緒に投与する場合、クラリスロマイシンの妊娠情報は併用レジメンにも適用されます。妊娠中の使用に関する詳細については、クラリスロマイシンの処方情報を参照してください。
データ
ヒューマンデータ
公表された観察研究から得られた入手可能なデータは、妊娠関連の有害転帰とランソプラゾールの使用との関連性を示すことができませんでした。これらの観察研究の方法論的限界により、妊娠中の薬物関連リスクを確実に確立または除外することはできません。 European Network of Teratology Information Services による前向き研究では、1 日平均 30 mg のランソプラゾールを投与された 62 人の妊婦のグループの結果が、PPI をまったく服用していない 868 人の妊婦の対照グループと比較されました。 PPI にさらされた女性と対照群の間で重大な奇形の発生率に差はなく、相対リスク (RR) = 1.04、[95% 信頼区間 (CI) 0.25-4.21] に相当します。 1996 年から 2008 年までのデンマークのすべての出生を対象とした人口ベースのレトロスペクティブ コホート研究では、794 の出生におけるランソプラゾールへの最初の三半期曝露の分析中に、重大な出生異常の有意な増加はありませんでした。少なくとも妊娠第 1 期に PPI に暴露した 1,530 人の妊婦と、暴露していない 133,410 人の妊婦を比較したメタ分析では、PPI への暴露による先天性奇形または自然流産のリスクの有意な増加は見られませんでした (重大な奇形の場合、オッズ比 (OR)=1.12)。 、[95% CI 0.86-1.45]、自然流産の場合は OR=1.29、[95% CI 0.841.97])。
動物データ
妊娠中のラットにランソプラゾールを 150 mg/kg/日 (体表面積に基づいてヒトの推奨用量 [30 mg/日] の 40 倍) まで経口投与した研究では、胚・胎児の発育に対する悪影響は発生しませんでした。妊娠中のウサギにランソプラゾールを 30 mg/kg/日 (体表面積に基づくヒトの推奨用量の 16 倍) まで経口投与し、器官形成中に投与した。
骨の発達を評価するためのエンドポイントを追加したラットの出生前および出生後の発生毒性研究は、ランソプラゾールを 10 ~ 100 mg/kg/日 (AUC に基づくヒトランソプラゾールの最大推奨用量 30 mg の 0.7 ~ 6.4 倍) の経口用量で実施しました。 [血漿濃度-時間曲線下面積]) 授乳による器官形成中に投与。 100 mg/kg/日 (AUC に基づくヒトランソプラゾールの最大推奨用量 30 mg の 6.4 倍) で観察された母体への影響には、妊娠期間の延長、妊娠中の体重増加の減少、および摂餌量の減少が含まれていました。この用量では死産の数が増加したが、これは母体毒性に続発した可能性がある。出生後 11 日目から 100 mg/kg/日で児動物の体重が減少した。出生後 21 日目に 100 mg/kg/日で大腿骨重量、大腿骨長、および頭臀部長が減少した。 17 ~ 18 週齢の 100 mg/kg/日群。生後 21 日目に 100 mg/kg/日の雄で成長板厚が減少し、17 ~ 18 週齢で 30 および 100 mg/kg/日の雄で増加した。骨パラメーターへの影響は、体重増加の減少と関連していました。
授乳
リスクの概要
母乳中のランソプラゾールの存在、母乳育児への影響、または乳生産への影響に関する情報はありません。ただし、ランソプラゾールとその代謝物はラットのミルクに含まれています。母乳育児の発達上および健康上の利点は、プレバシッド 30mg またはプレバシッド 30mg ソルタブに対する母親の臨床的必要性、およびプレバシッド 30mg またはプレバシッド ソルタブまたは母体の基礎疾患による母乳育児中の子供への潜在的な悪影響とともに考慮されるべきです。
小児用
PREVACID 15mg と PREVACID 30mg SoluTab の安全性と有効性は、1 歳から 17 歳までの小児患者において、症候性 GERD およびびらん性食道炎の短期治療において確立されています。
症候性GERDおよびびらん性食道炎の臨床研究では、1歳から11歳までの患者に12週間を超えてPREVACID 30mgを投与しませんでした。 PREVACID 30mg と PREVACID SoluTab が推奨期間より長く使用された場合に安全で効果的であるかどうかは不明です。小児患者の推奨用量と使用期間を超えないでください( 若年動物毒性データ )。
PREVACID は、多施設二重盲検プラセボ対照試験で、生後 1 か月から 1 歳未満の症候性 GERD の小児患者には効果がありませんでした。したがって、1歳未満の患者に対する安全性と有効性は確立されていません。幼若ラットを対象とした非臨床試験では、ランソプラゾールの最大推奨用量よりも高い用量で、心臓弁肥厚および骨変化の悪影響が実証されています。
新生児~1歳未満
ランソプラゾールの薬物動態は、生後 28 日未満および生後 1 ~ 11 か月の GERD の小児患者で研究されました。 30 mg を投与された健康な成人と比較して、新生児の曝露量は高かった (平均体重ベースの正規化 AUC 値は、0.5 および 1 mg/kg/日の用量でそれぞれ 2.04 倍および 1.88 倍高かった)。生後 10 週以下の乳児のクリアランス値と暴露値は、新生児と同様でした。 1 mg/kg/日を投与された生後 10 週以上の乳児の平均 AUC 値は、30 mg を投与された成人と同様でした。
ランソプラゾールは、病歴に基づく症候性 GERD の生後 1 か月から 12 か月未満の 162 人の患者を対象とした米国およびポーランドの 4 週間多施設二重盲検プラセボ対照並行群間試験で有効であることが判明しませんでした。 7 ~ 14 日間、保存的な GERD 管理 (すなわち、非薬理学的介入) に反応しなかった摂食に関連する泣き声/大騒ぎ/過敏症。受け入れた患者
懸濁液としてのランソプラゾールを毎日 (生後 10 週以下の乳児では 0.2 ~ 0.3 mg/kg/日、生後 10 週間を超える乳児では 1.0 ~ 1.5 mg/kg/日、またはプラセボ)、最大 4 週間の二重盲検治療。
主要な有効性エンドポイントは、摂食後 1 時間以内に泣く/騒ぐ/イライラするエピソードを伴う授乳の割合、または泣く/イライラする/イライラするエピソードの持続時間 (分) のいずれかがベースラインから 50% 以上減少することによって評価されました。
ランソプラゾール小児懸濁液群とプラセボ群の間で反応者の割合に差はありませんでした (両群で 54%)。
小児臨床試験(生後 1 か月から 12 か月未満)では、これまで成人では観察されなかった有害事象は報告されていません。
フェーズ 3 有効性試験の結果に基づいて、ランソプラゾールは有効であることが示されませんでした。したがって、これらの結果は、乳児の症候性 GERD の治療におけるランソプラゾールの使用を支持するものではありません。
1歳から11歳
非対照の非盲検米国多施設共同研究では、66 人の GERD 小児患者 (1 歳から 11 歳) が、体重に基づいて、30 kg 以下の場合は毎日 15 mg の PREVACID の初回投与を受けるように割り当てられました。 PREVACID 30 kg を超える場合は、毎日 30 mg を 8 ~ 12 週間投与します。 PREVACID の用量は、2 週間以上の治療後に 66 人の小児患者のうち 24 人で、症状が残っている場合に増量されました (1 日 2 回 30 mg まで)。ベースラインでは、患者の 85% が軽度から中等度の全体的な GERD 症状 (治験責任医師のインタビューで評価)、58% が非びらん性 GERD、42% がびらん性食道炎 (内視鏡検査で評価) を有していました。
PREVACID 15mg治療の8~12週間後、治療意図分析により、GERD症状の頻度と重症度が約50%減少したことが示されました。
びらん性食道炎患者 27 人中 21 人が内視鏡検査により 8 週間で治癒し、12 週間で 100% の患者が治癒した (表 4)。
歳から 11 歳までの年齢層の 66 人の小児患者を対象とした研究では、プレバシッド 15 mg を 1 日 15 mg から 30 mg の用量で 1 日 2 回経口投与した後、血清ガストリン濃度の上昇は、成人の研究で観察されたものと同様でした。空腹時血清ガストリン濃度の中央値は、ベースライン時の 51 pg/mL から最終来院時の 97 pg/mL [71 ~ 130 pg/mL の四分位範囲 (25 ~ 75 パーセンタイル)] に 89% 増加しました。
PREVACID 30mg カプセルの小児への安全性は、1 歳から 11 歳までの 66 人の小児患者で評価されています。 66 人の GERD 患者のうち、85% (56/66) が PREVACID 30mg を 8 週間服用し、15% (10/66) が 12 週間服用しました。
1 歳から 11 歳の患者 (N=66) で最も頻繁に報告された (2 人以上の患者) 治療関連の副作用は、便秘 (5%) と頭痛 (3%) でした。
12歳から17歳まで
制御されていない非盲検の米国多施設研究では、症候性GERDの87人の思春期患者(12歳から17歳)が8から12週間、PREVACIDで治療されました。ベースラインの上部内視鏡検査では、これらの患者を 2 つのグループに分類しました。64 人 (74%) の非びらん性 GERD と 23 人 (26%) のびらん性食道炎 (EE) です。非びらん性 GERD 患者は PREVACID 15 mg を毎日 8 週間投与され、EE 患者は PREVACID 30 mg を毎日 8 ~ 12 週間投与されました。ベースラインでは、これらの患者の 89% が軽度から中等度の全体的な GERD 症状を示していました (調査員のインタビューによって評価されました)。 PREVACID 15mg による 8 週間の治療で、思春期の患者の GERD 症状の頻度が 63% 減少し、日誌の結果に基づいて GERD 症状の重症度が 69% 減少しました。
思春期びらん性食道炎患者 22 人中 21 人 (95.5%) が、PREVACID 15mg 治療の 8 週間後に治癒しました。 1 人の患者は、12 週間の治療後も治癒しないままでした (表 5)。
これらの 87 人の思春期の患者では、血清ガストリン濃度の上昇は成人研究で観察されたものと類似しており、空腹時血清ガストリン濃度の中央値は、ベースラインの 45 pg/mL から 64 pg/mL まで 42% 上昇しました [四分位範囲 (25 ~ 75 パーセンタイル)]。 44 ~ 88 pg/mL] 最終来院時に。 (正常な血清ガストリン値は 25 ~ 111 pg/mL です。)
PREVACID カプセルの安全性は、これら 87 人の青年患者で評価されています。 87 人の GERD 患者のうち、6% (5/87) が PREVACID 15mg を 6 週間未満、93% (81/87) が 6 ~ 10 週間、1% (1/87) が 10 週間以上服用しました。 .
これらの患者で最も頻繁に報告された (少なくとも 3%) 治療関連の副作用は、頭痛 (7%)、腹痛 (5%)、吐き気 (3%)、めまい (3%) でした。この処方情報では、成人患者の 1% 未満で発生すると報告されている治療関連のめまいは、この研究では、他の反応 (片頭痛、呼吸困難、と嘔吐)。
若年動物毒性データ
心臓弁肥厚
つの経口毒性試験では、僧帽弁の肥厚がランソプラゾールで治療された幼若ラットで発生しました。心臓弁肥厚は主に、生後 7 日目 (ヒトの新生児に相当する年齢) および生後 14 日目 (ヒトの年齢は約 1 歳相当) に 250 mg/kg/日以上の用量 (生後 7 日目) に開始された経口投与で観察されました。生後 14 日、AUC に基づいて、1 歳から 11 歳までの体重 30 kg 以下の小児患者における 15 mg の 1 日小児用量のそれぞれ 6.2 倍および 4.2 倍)。心臓弁肥厚に関連する治療期間は、5 日から 8 週間の範囲でした。調査結果は、4 週間の薬物を使用しない回復期間の後、逆転するか、可逆性に向かう傾向がありました。生後 21 日目(ヒトの年齢で約 2 歳相当)に投与を開始した後の心臓弁肥厚の発生率は、500 mg/kg/日を 4 週間または 8 週間(約AUC に基づいて、1 歳から 11 歳までの体重 30 kg 以下の小児患者では、小児の 1 日用量 15 mg の 5.2 倍)。露出マージンに基づくと、心臓弁損傷のリスクは、1 歳以上の患者には関係がないようです。
骨の変化
生後 7 日目に投与を開始した幼若ラットでの 8 週間の経口毒性試験では、100 mg/kg/日以上の用量 (1 歳から 11 歳、体重 30 歳の小児における小児の 1 日用量 15 mg の 2.5 倍) kg 以下、AUC に基づく) は成長の遅延を引き起こし、生後 10 日目 (新生児と同等の年齢) という早い時期に体重増加の障害が観察されました。治療終了時、100 mg/kg/日以上での成長障害の徴候には、体重の減少 (対照と比較して 14 ~ 44%)、複数の臓器の絶対重量、大腿骨の重量、大腿骨の長さ、および歯冠の減少が含まれていました。しこりの長さ。大腿骨成長板の厚さは、雄でのみ減少し、500 mg/kg/日の用量でのみ減少しました。成長の遅延に関連する影響は、4 週間の回復期間の終わりまで持続しました。長期データは収集されませんでした。
高齢者の使用
PREVACID の臨床試験における患者総数 (n=21,486) のうち、患者の 16% が 65 歳以上で、4% が 75 歳以上でした。これらの患者と若年患者との間で安全性または有効性の全体的な違いは観察されず、他の報告された臨床経験では、高齢患者と若年患者との間の反応に有意な差は確認されていませんが、一部の高齢者の感度が高いことを除外することはできません[参照] 臨床薬理学 ]。

肝障害
さまざまな程度の慢性肝障害を持つ患者では、正常な肝機能を持つ健康な被験者と比較して、ランソプラゾールへの曝露が増加しました[参照 臨床薬理学 ]。軽度(Child-Pugh クラス A)または中等度(Child-Pugh クラス B)の肝障害のある患者には、PREVACID または PREVACID SoluTab の用量調整は必要ありません。重度の肝障害(Child-Pugug クラス C)の患者では、推奨用量は 1 日 15 mg の経口投与です。 投薬と管理 ]。
過剰摂取
ランソプラゾールは、血液透析によって循環から除去されません。報告された過剰摂取の 1 件では、患者が 600 mg の PREVACID 15 mg を摂取しても副作用はありませんでした。ラット [体表面積 (BSA) に基づくヒト用量 30 mg の約 1300 倍] およびマウス (BSA に基づくヒト用量 30 mg の約 675.7 倍) における 5000 mg/kg までの経口ランソプラゾール用量は、死亡または死亡をもたらさなかった。臨床徴候。
過剰暴露の場合、治療は対症療法と支持療法でなければなりません。
過剰暴露が発生した場合は、毒物管理センター (1-800-222-1222) に電話して、中毒または過剰暴露の管理に関する最新情報を入手してください。
禁忌
- PREVACID 15mg および PREVACID 15mg SoluTab は、製剤のいずれかの成分に対して既知の過敏症のある患者には禁忌です。過敏症反応には、アナフィラキシー、アナフィラキシーショック、血管性浮腫、気管支痙攣、急性尿細管間質性腎炎、蕁麻疹などがあります。 警告と注意事項 、 有害反応 ]。
- PREVACID および PREVACID SoluTab を含むプロトンポンプ阻害剤 (PPI) は、リルピビリン含有製品との禁忌です [ 薬物相互作用 ]。
- PREVACID または PREVACID 30mg SoluTab との併用で示される抗菌薬(クラリスロマイシンおよびアモキシシリン)の禁忌に関する情報については、処方情報の禁忌のセクションを参照してください。
臨床薬理学
作用機序
ランソプラゾールは、胃壁細胞の分泌面にある (H+, K+)-ATPase 酵素系を特異的に阻害することによって胃酸分泌を抑制する、抗分泌性化合物である置換ベンズイミダゾールのクラスに属します。この酵素系は、壁細胞内の酸 (プロトン) ポンプと見なされているため、ランソプラゾールは、酸生成の最終段階をブロックするという点で、胃酸ポンプ阻害剤として特徴付けられています。この効果は用量に関連し、刺激に関係なく、胃酸分泌の基礎および刺激の両方を阻害します。ランソプラゾールは、抗コリン作動性またはヒスタミン 2 型アンタゴニスト活性を示しません。
薬力学
抗分泌活動
経口投与後、ランソプラゾールは、基礎酸の排出量を大幅に減少させ、胃の平均 pH と、胃の pH が 3 を超え、4 を超える時間の割合を大幅に増加させることが示されました。ランソプラゾールは、食事刺激による胃酸の排出量と分泌量、およびペンタガストリンによる胃酸排出量も大幅に減少させました。酸の分泌過多の患者では、ランソプラゾールは基礎およびペンタガストリン刺激による胃酸分泌を有意に減少させました。ランソプラゾールは、インスリンによって誘発される分泌量、酸性度、および酸排出量の正常な増加を抑制しました。
ランソプラゾール 15 mg と 30 mg を 1 日 1 回投与した場合の 5 日間にわたる薬力学的クロスオーバー試験の胃内 pH の結果を表 6 に示します。
この研究の最初の投与後、ランソプラゾール 30 mg では 1 ~ 2 時間、ランソプラゾール 15 mg では 2 ~ 3 時間以内に、胃の pH の上昇が見られました。毎日複数回投与した後、ランソプラゾール 30 mg の投与後最初の 1 時間以内、およびランソプラゾール 15 mg の投与後 1 ~ 2 時間以内に、胃の pH の上昇が見られました。
酸抑制は、ヘリコバクター・ピロリ(H. pylori)の根絶における抗菌薬の効果を高める可能性があります。胃の pH が 5 および 6 を超えて上昇した時間のパーセンテージは、毎日、1 日 2 回、および 1 日 3 回投与される PREVACID のクロスオーバー研究で評価されました (表 7)。
胃内pHによって測定される胃酸分泌の阻害は、複数回投与後、2~4日かけて徐々に正常に戻った.胃酸のリバウンドの兆候はありませんでした。
腸クロム親和性 (ECL) 細胞効果
150 mg/kg/日までのランソプラゾールを週 7 日間投与されたラットの生涯暴露中に、顕著な高ガストリン血症が観察され、その後、ECL 細胞の増殖とカルチノイド腫瘍の形成が特に雌ラットで観察されました。少なくとも 1 年間ランソプラゾールで継続的に治療された約 150 人の患者の胃体からの胃生検標本は、ラットの研究で見られたものと同様の ECL 細胞効果の証拠を示さなかった.ランソプラゾールによる長期治療を受けている患者で胃腫瘍の発生リスクが増加する可能性を排除するには、より長期的なデータが必要です。 非臨床毒性学 ]。
ヒトにおけるその他の胃への影響
ランソプラゾールは、胃底の粘膜血流に有意な影響を与えませんでした。胃酸分泌の阻害によって引き起こされる正常な生理学的効果により、前庭部、幽門、および十二指腸球部の血流の約 17% の減少が見られました。ランソプラゾールは、可消化固形物の胃からの排出を大幅に遅らせました。ランソプラゾールは、基礎条件下および食事刺激またはインスリン注射に応答して、血清ペプシノーゲンレベルを上昇させ、ペプシン活性を低下させました。胃内 pH を上昇させる他の薬剤と同様に、胃内 pH の上昇は、胃潰瘍患者の硝酸塩還元細菌の増加および胃液中の亜硝酸塩濃度の上昇と関連していました。ニトロソアミン濃度の有意な増加は観察されませんでした。
血清ガストリン効果
2,100 人以上の患者において、空腹時血清ガストリン濃度の中央値はベースラインから 50 ~ 100% 増加しましたが、15 ~ 60 mg の経口ランソプラゾールによる治療後は正常範囲内にとどまりました。これらの上昇は、治療後 2 か月以内にプラトーに達し、治療中止後 4 週間以内に治療前のレベルに戻りました。
ガストリンの増加は、腸クロム親和性細胞の過形成と血清 CgA レベルの上昇を引き起こします。上昇した CgA レベルは、神経内分泌腫瘍の診断調査で偽陽性の結果を引き起こす可能性があります [参照 警告と注意事項 ]。
内分泌への影響
最長 1 年間のヒトでの研究では、内分泌系に対する臨床的に重大な影響は検出されていません。研究されているホルモンには、テストステロン、黄体形成ホルモン (LH)、卵胞刺激ホルモン (FSH)、性ホルモン結合グロブリン (SHBG)、デヒドロエピアンドロステロン硫酸塩 (DHEA-S)、プロラクチン、コルチゾール、エストラジオール、インスリン、アルドステロン、パラソルモン、グルカゴン、甲状腺刺激ホルモンが含まれます。ホルモン (TSH)、トリヨードチロニン (T3)、サイロキシン (T4)、および成長ホルモン (STH)。ランソプラゾール 15 ~ 60 mg を 1 年間経口投与しても、性機能に臨床的に有意な影響はありませんでした。さらに、ランソプラゾール 15 ~ 60 mg を 2 ~ 8 週間経口投与しても、甲状腺機能に臨床的に有意な影響はありませんでした。 Sprague-Dawley ラットに 150 mg/kg までのランソプラゾールを毎日投与した 24 か月の発がん性試験では、良性新生物を含む精巣のライディッヒ細胞の増殖性変化が、対照ラットと比較して増加しました。
その他の効果
中枢神経系、リンパ系、造血系、腎臓系、肝臓系、心血管系、または呼吸器系に対するランソプラゾールの全身効果は、ヒトでは発見されていません。広範なベースラインの眼の評価を受けた 56 人の患者の中で、最長 58 か月間、ランソプラゾール治療 (最大 180 mg/日) 後、視覚毒性は観察されませんでした。ラットにおけるランソプラゾールの生涯曝露後、限局性膵臓萎縮、胸腺のびまん性リンパ過形成、および自発的な網膜萎縮が見られました。
薬物動態
吸収
PREVACID 15mg と PREVACID SoluTab には、ランソプラゾールの腸溶性コーティング顆粒製剤が含まれているため (ランソプラゾールは酸に不安定であるため)、ランソプラゾールの吸収は顆粒が胃を出た後にのみ開始されます。ランソプラゾールの平均ピーク血漿レベルは、約 1.7 時間で発生します。経口ランソプラゾール 15~60 mg の単回投与後、ランソプラゾールのピーク血漿濃度 (Cmax) およびランソプラゾールの血漿濃度曲線下面積 (AUC) は、投与量にほぼ比例しました。ランソプラゾールは蓄積せず、その薬物動態は複数回投与によって変化しません。絶対バイオアベイラビリティは 80% 以上です。健康な被験者では、平均 (±SD) 血漿半減期は 1.5 (±1.0) 時間でした。ランソプラゾールを食事の 30 分後に投与すると、絶食状態と比較して、Cmax と AUC の両方が約 50 ~ 70% 減少します。ランソプラゾールが食事の前に与えられた場合、重大な食事の影響はありません.
分布
ランソプラゾールは 97% が血漿タンパク質に結合しています。血漿タンパク質結合は、0.05 ~ 5 mcg/mL の濃度範囲で一定です。
排除
代謝
ランソプラゾールは、肝臓で広範囲に代謝されます。血漿中で測定可能な量の 2 つの代謝物が同定されています (ランソプラゾールのヒドロキシル化スルフィニルおよびスルホン誘導体)。これらの代謝産物には、抗分泌活性がほとんどまたはまったくありません。ランソプラゾールは、胃壁細胞の分泌面でプロトンポンプ [(H+, K+)-ATPase 酵素系] を遮断することにより酸分泌を阻害する 2 つの活性種に変換されると考えられています。 2 つの活性種は体循環には存在しません。ランソプラゾールの血漿消失半減期は 2 時間未満ですが、酸抑制効果は 24 時間以上持続します。したがって、ランソプラゾールの血漿消失半減期は、胃酸分泌の抑制期間を反映していません。
排泄
PREVACID の単回経口投与後、未変化のランソプラゾールは実質的に尿中に排泄されませんでした。ある研究では、14 クランソプラゾールの単回経口投与後、投与された放射線の約 3 分の 1 が尿中に排泄され、3 分の 2 が糞便中に回収されました。これは、ランソプラゾール代謝産物の著しい胆汁排泄を意味します。
特定の集団
小児患者
1歳から17歳
ランソプラゾールの薬物動態は、1 ~ 11 歳および 12 ~ 17 歳の GERD の小児患者を対象に、2 つの別々の臨床試験で研究されました。 1 歳から 11 歳の小児では、ランソプラゾールは、体重が 30 kg 以下の被験者には 1 日 15 mg、体重が 30 kg を超える被験者には 1 日 30 mg が投与されました。投与 5 日目に観察された Cmax および AUC の平均値は、2 つの用量群間で類似しており、研究で使用された各体重調整用量群内で体重または年齢の影響を受けませんでした。 12 歳から 17 歳までの思春期の被験者では、ランソプラゾールを毎日 15 mg または 30 mg 投与するように無作為に割り付けられました。ランソプラゾールの平均 Cmax および AUC 値は、体重または年齢の影響を受けませんでした。また、試験の 2 つの用量群間で、平均 Cmax 値と AUC 値のほぼ用量に比例した増加が観察されました。全体として、1 歳から 17 歳までの小児患者におけるランソプラゾールの薬物動態は、健康な成人被験者で観察されたものと同様でした。
高齢患者
高齢者ではランソプラゾールのクリアランスが減少し、排泄半減期が約 50 ~ 100% 増加します。高齢者の平均半減期は 1.9 ~ 2.9 時間であるため、1 日 1 回の反復投与ではランソプラゾールが蓄積しません。高齢者ではピーク血漿レベルは上昇しなかった[参照 特定の集団での使用 ]。
男性と女性の患者
ランソプラゾールを投与された 12 人の男性被験者と 6 人の女性被験者を比較した研究では、薬物動態と胃内 pH の結果に性差は見られませんでした。
人種または民族グループ
米国の 12 の研究 (N=513) からプールされた PREVACID の平均薬物動態パラメーターを、アジアの 2 つの研究 (N=20) の平均薬物動態パラメーターと比較しました。アジアの被験者における PREVACID 30mg の平均 AUC は、プールされた米国のデータで見られる値の約 2 倍でした。しかし、個人差は大きかった。 Cmax 値は同等でした。
腎障害のある患者
重度の腎障害のある患者では、ランソプラゾール 60 mg の投与後、血漿タンパク結合が 1 ~ 1.5% 減少しました。腎機能障害のある患者は、消失半減期が短く、総 AUC (遊離および結合) が減少しました。しかし、血漿中の遊離ランソプラゾールの AUC は、腎障害の程度とは関係がありませんでした。また、Cmax および Tmax (最大濃度に達するまでの時間) は、腎機能が正常な被験者の Cmax および Tmax と差がありませんでした。したがって、ランソプラゾールの薬物動態は、腎機能が正常な健康な被験者と比較して、軽度、中等度、または重度の腎障害を有する患者で臨床的に差がありませんでした。
肝障害のある患者
軽度(Child-Pugh クラス A)または中等度(Child-Pugh クラス B)の肝障害のある患者では、30 mg のプレバシッド 30 mg を複数回経口投与した後、肝機能が正常な健康な被験者と比較して、平均 AUC が約 3 倍増加しました。 7日間。対応するランソプラゾールの平均血漿半減期は、1.5 時間から 4 時間 (Child-Pugh A) または 5 時間 (Child-Pugh B) に延長されました。
代償性および非代償性肝硬変の患者では、PREVACID 30 mg の単回経口投与後、肝機能が正常な健康な被験者と比較して、AUC がそれぞれ約 6 倍および 5 倍増加しました。 投薬と管理 、 特定の集団での使用 ]。
薬物相互作用研究
他の薬剤に対するランソプラゾールの効果
シトクロム P450 相互作用
ランソプラゾールは、シトクロム P450 システム、特に CYP3A および CYP2C19 アイソザイムを介して代謝されます。健康な被験者において、PREVACID 15mg は、ワルファリン、アンチピリン、インドメタシン、イブプロフェン、フェニトイン、プロプラノロール、プレドニゾン、ジアゼパム、またはクラリスロマイシンなど、シトクロム P450 システムによって代謝される他の薬物と臨床的に有意な相互作用を示さないことが研究により示されています。これらの化合物は、CYP1A2、CYP2C9、CYP2C19、CYP2D6、および CYP3A を含むさまざまなシトクロム P450 アイソザイムを介して代謝されます。
テオフィリン
PREVACID 30mg をテオフィリン (CYP1A2、CYP3A) と同時に投与した場合、テオフィリンのクリアランスのわずかな増加 (10%) が見られました。テオフィリンクリアランスに対する影響の大きさと方向性が小さいため、この相互作用は臨床的に懸念される可能性は低い[ 薬物相互作用 ]。
メトトレキサートおよび7-ヒドロキシメトトレキサート
28 名の成人関節リウマチ患者 (週に 7.5 ~ 15 mg のメトトレキサートを慢性的に使用する必要があった) の非盲検、単群、8 日間の薬物動態研究では、7 日間のナプロキセン 500 mg を 1 日 2 回投与し、PREVACID を投与しました。 1 日 30 mg は、メトトレキサートと 7-ヒドロキシメトトレキサートの薬物動態に影響を与えませんでした。この研究は、この薬物の組み合わせの安全性を評価するようには設計されていませんでしたが、重大な副作用は認められませんでした.ただし、この研究は低用量のメトトレキサートで実施されました。高用量のメトトレキサートとの薬物相互作用研究は実施されていない[参照 警告と注意事項 ]。
アモキシシリン
PREVACID 30mg は、アモキシシリンとの臨床的に有意な相互作用がないことも示されています。
スクラルファート
PREVACID 30 mg を単独でスクラルファート 1 グラムと併用して投与した単回投与クロスオーバー研究では、ランソプラゾールの吸収が遅延し、スクラルファートと同時に投与した場合、バイオアベイラビリティーが 17% 低下しました。 投薬と管理 、 薬物相互作用 ]。
制酸剤
臨床試験では、制酸剤は PREVACID 15mg と同時に投与されましたが、PREVACID の有効性に変化の証拠はありませんでした。
クロピドグレル
クロピドグレルは、CYP2C19 によって一部活性代謝物に代謝されます。 CYP2C19 高代謝型の健康な被験者を対象に、クロピドグレル 75 mg を単独で、または PREVACID 30 mg と併用して 1 日 1 回投与する試験 (n=40) を 9 日間実施しました。クロピドグレルの活性代謝物の平均 AUC は、クロピドグレル単独投与と比較して、PREVACID を併用投与した場合、約 14% 減少しました (平均 AUC 比は 86%、90% CI は 80 ~ 92%)。
薬力学的パラメーターも測定され、血小板凝集の阻害の変化 (5 mcM ADP によって誘発される) がクロピドグレル活性代謝物への曝露の変化に関連していることが実証されました。クロピドグレルの活性代謝物への曝露およびクロピドグレルによる血小板阻害への影響は、臨床的に重要であるとは考えられていません。
ランソプラゾールに対する他の薬剤の効果
ランソプラゾールは CYP2C19 および CYP3A4 によって代謝されるため、これらの酵素の誘導剤および阻害剤は、ランソプラゾールの曝露を潜在的に変更する可能性があります。
微生物学
微生物学
ランソプラゾール、クラリスロマイシン、および/またはアモキシシリンは、in vitro および臨床感染において、ヘリコバクター ピロリのほとんどの株に対して活性であることが示されています [参照 適応症と使用法 ]。
ヘリコバクター・ピロリの前処理耐性
クラリスロマイシン治療前耐性 (≥2.0 mcg/mL) は、2 剤および 3 剤療法の臨床試験 (M93-125、M93-130、M93-125、M93-130、 M93131、M95-392、および M95-399)。
アモキシシリン前処理感受性分離株 (≤0.25 mcg/mL) は、E テストおよび寒天希釈による二重療法および三重療法の臨床試験で、それぞれ患者の 97.8% (936/957) および 98.0% (98/100) で発生しました。 E-test では 957 人の患者のうち 21 人 (2.2%)、寒天希釈では 100 人の患者のうち 2 人 (2.0%) で、アモキシシリン治療前の MIC が 0.25 mcg/mL を超えていました。 14 日間の 3 剤療法レジメンの 1 人の患者は、E テストによる未確認の治療前アモキシシリン最小発育阻止濃度 (MIC) が 256 mcg/mL を超え、患者はピロリ菌が根絶されました (表 8)。
ランソプラゾール/アモキシシリン/クラリスロマイシンの 3 剤併用療法でピロリ菌が根絶されなかった患者は、クラリスロマイシン耐性のピロリ菌に感染している可能性があります。したがって、治療に失敗した患者には、可能であればクラリスロマイシン感受性検査を行うべきです。クラリスロマイシン耐性 H. pylori の患者は、ランソプラゾール/アモキシシリン/クラリスロマイシンの 3 剤療法や、クラリスロマイシンを唯一の抗菌剤として含むレジメンで治療すべきではありません。
アモキシシリン感受性試験の結果と臨床的/細菌学的結果
剤および 3 剤療法の臨床試験では、治療前にアモキシシリン感受性 MIC (≤0.25 mcg/mL) を有していた患者の 82.6% (195/236) でピロリ菌が除菌されました。治療前のアモキシシリン MIC が 0.25 mcg/mL を超えていた患者のうち、6 人中 3 人でピロリ菌が根絶されました。合計 30% (21/70) の患者がランソプラゾール 30 mg 1 日 3 回/アモキシシリン 1 g 1 日 3 回の二重療法に失敗し、合計 12.8% (22/172) の患者が 10 日間および 14 日間のトリプル療法に失敗しました。治療レジメン。治療に失敗した 11 人の患者では、治療後の感受性結果が得られませんでした。アモキシシリン治療後 MIC を有し、3 剤療法レジメンに失敗した 11 人の患者のうち 9 人は、クラリスロマイシン耐性ピロリ菌分離株も持っていました。
ヘリコバクター・ピロリの感受性試験
ヘリコバクター ピロリに関する感受性試験の情報については、以下を参照してください。 クラリスロマイシンおよびアモキシシリンの処方情報の微生物学セクション .
臨床研究
十二指腸潰瘍
内視鏡検査で記録された十二指腸潰瘍の 284 人の患者を対象とした米国の多施設共同、二重盲検、プラセボ対照、用量反応 (1 日 1 回 15、30、および 60 mg の PREVACID) 研究では、2 週間および 4 週間後に治癒した患者の割合はプラセボよりも PREVACID のすべての用量で有意に高い。 PREVACID 15 mg と比較して、2 つの高用量での反応が大きい、または早いという証拠はありませんでした。この研究と下記の 2 番目の研究に基づいて、十二指腸潰瘍における PREVACID 15mg の推奨用量は 1 日あたり 15mg です (表 9)。
PREVACID 15 mg は、日中および夜間の腹痛の緩和と 1 日あたりの制酸薬の摂取量の減少において、プラセボよりも有意に効果的でした。
内視鏡検査で記録された十二指腸潰瘍の患者 280 人を対象とした 2 回目の米国多施設共同研究でも、同様に二重盲検、プラセボ対照、用量比較 (1 日 1 回 15 mg と 30 mg の PREVACID 15 mg) が行われ、ラニチジンとの比較が行われました。 4週間後に治癒した患者は、プラセボよりもPREVACID 15mgの両方の用量で有意に高かった.高用量の PREVACID を使用した場合の反応が大きい、または早いという証拠はありませんでした。 15 mg の PREVACID の投与量は 4 週間でラニチジンよりも優れていたが、2 週間で有意差がなく、30 mg の PREVACID とラニチジンの間に差がないため、2 つの薬剤の比較有効性は未決定のままである (表 10) [見る 適応症と使用法 ]。
ピロリ菌の除菌で十二指腸潰瘍の再発リスクを軽減
ピロリ菌および十二指腸潰瘍疾患 (1 年以内の活動性潰瘍または潰瘍の病歴として定義) の患者を対象に米国で実施されたランダム化二重盲検臨床試験では、アモキシシリンおよびクラリスロマイシンと組み合わせた PREVACID の有効性がトリプル 14 として評価されました。ピロリ菌を根絶するための 14 日間の二重療法として、1 日療法またはアモキシシリンとの併用。これらの研究の結果に基づいて、2 つの異なる根絶レジメンの安全性と有効性が確立されました。
トリプルセラピー PREVACID 30mg 1日2回/アモキシシリン 1g 1日2回/クラリスロマイシン 500mg 1日2回
二重療法 PREVACID 30mg 1日3回/アモキシシリン 1g 1日3回
すべての治療は 14 日間行われました。 H. pylori の根絶は、治療終了後 4 ~ 6 週間での 2 回の陰性検査 (培養および組織学) として定義されました。
トリプル療法は、可能なすべてのデュアル療法の組み合わせよりも効果的であることが示されました。デュアル療法は、両方の単独療法よりも効果的であることが示されました。 H. pylori の除菌は、十二指腸潰瘍の再発リスクを低下させることが示されています。
ピロリ菌と十二指腸潰瘍疾患(活動性潰瘍または1年以内の潰瘍の病歴と定義)の患者を対象に米国で実施されたランダム化二重盲検臨床試験では、10日間と14日間のPREVACIDの3剤併用療法の有効性が比較されました。この研究は、ピロリ菌の根絶において、10日間の三重療法が14日間の三重療法と同等であることを立証した(表11および12)[参照 適応症と使用法 ]。
治癒した十二指腸潰瘍の維持
PREVACID は、十二指腸潰瘍の再発を予防することが示されています。内視鏡検査で十二指腸潰瘍の治癒が確認された患者を対象に、2 つの独立した二重盲検多施設対照試験が実施されました。 PREVACID 15mg で治療された患者では、12 か月間プラセボで治療された患者よりも、患者の治癒期間が有意に長く、十二指腸潰瘍の再発回数が有意に少なかった (表 13) [参照 適応症と使用法 ]。
試験 #2 では、寛解維持において PREVACID 15 mg と 30 mg の間に有意差は認められませんでした。
胃潰瘍
内視鏡検査で胃潰瘍が確認された 253 人の患者を対象とした米国の多施設共同二重盲検プラセボ対照試験では、4 週間および 8 週間で治癒した患者の割合は、プラセボよりも PREVACID 15 および 30 mg を 1 日 1 回投与した方が有意に高かった(表 14)。 ) [見る 適応症と使用法 ]。
PREVACID の用量を問わず治療を受けた患者は、プラセボ群と比較して、昼夜を問わず腹痛が大幅に軽減され、制酸剤の使用日数が少なく、1 日あたりの制酸剤の錠剤の使用量も少なかったと報告されています。
PREVACID 30 mg の有効性の独立した実証は、公開データと未公開データのメタ分析によって提供されました。
NSAID関連胃潰瘍の治癒
内視鏡検査で NSAID 関連の胃潰瘍が確認され、NSAID の使用を継続した患者を対象とした 2 つの米国およびカナダの多施設二重盲検実薬対照研究では、8 週間後に治癒した患者の割合は、30 mg の PREVACID を使用した場合よりも統計的に有意に高かった。アクティブ コントロール。合計 711 人の患者が研究に登録され、701 人の患者が治療を受けました。患者の年齢は 18 ~ 88 歳 (中央値 59 歳) で、女性患者が 67%、男性患者が 33% でした。人種は次のように分布していました: 白人 87%、黒人 8%、その他 5%。 PREVACID 30 mg の 1 日 1 回投与と実薬群との間には、症状の軽減 (すなわち、腹痛) に関して統計的に有意な差はありませんでした (表 15) [ 適応症と使用法 ]。
NSAID関連胃潰瘍のリスク軽減
NSAID を慢性的に使用する必要があり、内視鏡検査で胃潰瘍の既往歴がある患者を対象とした米国の多施設共同二重盲検プラセボおよびミソプロストール対照(ミソプロストールは内視鏡検査医のみに盲検化)の 1 つの大規模な研究では、 4、8、および 12 週で胃潰瘍を発症していない患者は、15 mg または 30 mg の PREVACID 15 mg でプラセボよりも有意に高かった.合計 537 人の患者が研究に登録され、535 人の患者が治療を受けました。患者の年齢は 23 歳から 89 歳 (中央値は 60 歳) で、女性患者が 65%、男性患者が 35% でした。人種は次のように分布していました: 白人 90%、黒人 6%、その他 4%。 PREVACID の 30 mg の用量は、15 mg の用量よりも NSAID 関連の胃潰瘍のリスク低減に追加の利益を示さなかった (表 16) [参照 適応症と使用法 ]。
症候性胃食道逆流症 (GERD)
症候性GERD
米国の多施設共同二重盲検プラセボ対照研究では、頻繁に GERD 症状を示すが、内視鏡検査による食道びらんのない患者 214 人を対象に、ランソプラゾール 15 mg を 1 日 1 回、最大 8プラセボより数週間。ランソプラゾール 30 mg を 1 日 1 回投与しても、有意な追加効果は認められませんでした。
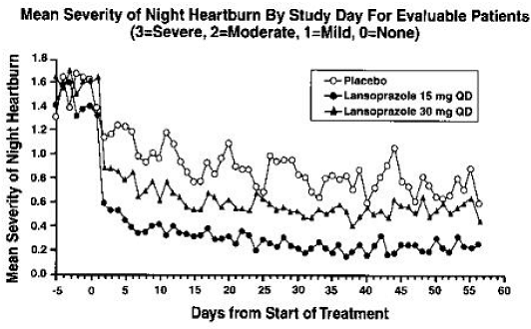
治療意図分析では、昼夜の胸やけの頻度と重症度が大幅に減少したことが示されました。 8 週間の治療期間の頻度と重症度のデータを表 17 と図 1 および 2 に示します。
図 1 : 評価可能な患者の研究日ごとの日中胸やけの平均重症度 (3 = 重度、2 = 中等度、1 = 軽度、0 = なし)
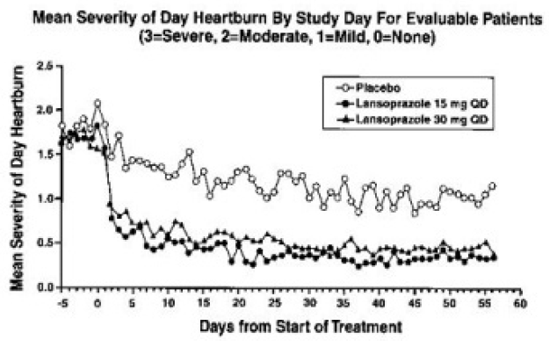
図 2 : 評価可能な患者の研究日ごとの夜間胸やけの平均重症度 (3 = 重度、2 = 中等度、1 = 軽度、0 = なし)
頻繁な GERD 症状を有するが、内視鏡検査による食道びらんのない合計 925 人の患者を対象とした 2 つの米国の多施設二重盲検ラニチジン対照試験では、ランソプラゾール 15 mg は、1 日あたりの頻度と重症度の低下において、ラニチジン 150 mg (1 日 2 回) よりも優れていました。および 8 週間の治療期間中の GERD に伴う夜間の胸やけ。ランソプラゾール 30 mg を 1 日 1 回投与しても、有意な追加効果は観察されませんでした [ 適応症と使用法 ]。
びらん性食道炎
米国の多施設共同二重盲検プラセボ対照研究では、食道炎の内視鏡診断で 2 以上の粘膜グレードとグレード 3 および 4 のびらん性疾患を意味する 269 人の患者が入院し、治癒した患者のパーセンテージが表に示されています。 18:
この研究では、すべての PREVACID グループが、プラセボ グループよりも胸やけの大幅な軽減と昼夜の腹痛の軽減、制酸剤の使用日数の減少、および 1 日あたりの制酸剤の錠剤の摂取量の減少を報告しました。すべての用量で効果がありましたが、より高い 2 つの用量で治癒が早かったことから、推奨用量として 1 日 30 mg が推奨されます。
PREVACID は、米国の多施設二重盲検試験でも、びらん性逆流性食道炎患者 242 人を対象に、低用量のラニチジンと比較されました。以下に示すように、30 mg の用量の PREVACID は、1 日 2 回のラニチジン 150 mg よりも有意に効果的でした (表 19)。
さらに、PREVACID 30 mg で治療された患者は、ラニチジン 150 mg を 1 日 2 回服用している患者よりも、日中および夜間の胸やけが少なく、制酸剤の錠剤を服用する日数が少なかったと報告しています。
この研究はびらん性食道炎の治癒における PREVACID 15mg の有効性を示していますが、食道炎に対するラニチジンの推奨用量は 150mg を 1 日 4 回であり、この研究で使用された用量の 2 倍であるため、ラニチジンとの適切な比較にはなりません。
記載されている 2 つの試験と、中等度から重度のびらん性食道炎の患者を対象としたいくつかの小規模な試験で、PREVACID は上記と同様の治癒率を示しました。
米国の多施設共同二重盲検実薬対照試験では、最低 12 週間の治療で効果が不十分なびらん性逆流性食道炎患者 151 人を対象に、1 日 2 回のラニチジン 150 mg と PREVACID 30 mg 30 mg を比較しました。症状緩和またはそれ以上の指示された用量、すなわちシメチジン 800 mg/日、ラニチジン 300 mg/日、ファモチジン 40 mg/日またはニザチジン 300 mg/日で与えられる 1 つの H2 受容体拮抗薬。 PREVACID 30 mg は、逆流性食道炎の治癒においてラニチジン 150 mg 1 日 2 回よりも効果的であり、治癒した患者の割合は次のとおりでした。すべての患者がヒスタミンH2受容体拮抗薬の治療モードに反応しないことを示したため、この研究はヒスタミンH2受容体拮抗薬の有効性をPREVACID 30mgと比較するものではありません。しかし、これは、ヒスタミンH2受容体拮抗薬で失敗した患者にPREVACID 30mgが有用である可能性があることを示しています(表20)[参照 適応症と使用法 ]。
びらん性食道炎の治癒の維持
内視鏡検査で食道炎が治癒したことが確認された患者を対象に、2 つの独立した二重盲検多施設比較試験が実施されました。 PREVACID 30mg で治療された患者では、プラセボで治療された患者よりも 12 か月間患者の寛解期間が有意に長くなり、びらん性食道炎の再発数が有意に少なかった (表 21)。
びらん性食道炎の初期グレードに関係なく、PREVACID 15 と 30 mg の寛解維持は同程度でした。
米国の無作為化二重盲検試験では、1 日 15 mg の PREVACID (n=100) とラニチジン 150 mg の 1 日 2 回投与 (n=106) を推奨用量で比較しました。 12ヶ月間。 PREVACID 15mg による治療により、びらん性食道炎の治癒 (グレード 0 病変) がラニチジンで治療された患者よりも有意に長い期間患者にもたらされました (p 適応症と使用法 ]。
Zollinger-Ellison 症候群を含む病的な過剰分泌状態
多発性内分泌腺腫の有無にかかわらず、ゾリンジャー・エリソン症候群 (ZES) などの病的な過剰分泌状態の患者 57 人を対象とした公開研究では、PREVACID 15mg が胃酸分泌を有意に抑制し、関連する下痢、食欲不振、および痛みの症状を抑制しました。 1 日おきに 15 mg から 1 日 180 mg の範囲の用量で、胃手術歴のない患者では 10 mEq/hr 未満、胃手術歴のある患者では 5 mEq/hr 未満の基礎酸分泌が維持されました。
初期用量は個々の患者のニーズに合わせて漸増され、一部の患者では時間の経過とともに調整が必要になりました[参照 投薬と管理 ]。 PREVACID は、これらの高用量レベルで長期間 (一部の患者では 4 年以上) 耐容性が良好でした。ほとんどの ZES 患者では、血清ガストリン濃度は PREVACID によって変化しませんでした。しかし、一部の患者では、血清ガストリンがランソプラゾール療法の開始前よりも高いレベルまで上昇した[参照 適応症と使用法 ]。
患者情報
PREVACID (prev-a-sid) (ランソプラゾール) 遅延放出カプセル、経口使用および
PREVACID ソルタブ (プレバシド ソルユータブ) (ランソプラゾール) 徐放性口腔内崩壊錠
PREVACID および PREVACID 15mg SoluTab について知っておくべき最も重要な情報は何ですか?
PREVACID および PREVACID 15mg SoluTab は、処方されたとおりに、可能な限り低用量で、必要な最短時間で服用する必要があります。
PREVACID と PREVACID SoluTab は胃酸関連の症状を改善する可能性がありますが、それでも深刻な胃の問題を抱えている可能性があります。
医師に相談してください。 PREVACID 30mg および PREVACID 30mg SoluTab は、次のような重大な副作用を引き起こす可能性があります。
- 腎臓の問題の一種(急性尿細管間質性腎炎)。 PREVACID 30mg および PREVACID 15mg SoluTab を含むプロトンポンプ阻害薬 (PPI) 薬を服用している一部の人々は、PREVACID および PREVACID SoluTab を含む PPI 薬による治療中にいつでも発生する可能性がある、急性尿細管間質性腎炎と呼ばれる腎臓の問題を発症する可能性があります。尿の量が減ったり、尿に血が混じったりした場合は、すぐに医師に連絡してください。
- 腸内の感染症 (クロストリジウム ディフィシル) によって引き起こされる下痢。 水様便や胃の痛みが治まらない場合は、すぐに医師に連絡してください。熱がある場合とない場合があります。
- 骨折(股関節、手首、または背骨)。 股関節、手首、または脊椎の骨折は、PPI 薬を 1 日複数回、長期間 (1 年以上) 服用している人に発生する可能性があります。特に股関節、手首、脊椎に骨折がある場合は、医師に相談してください。
- 特定の種類のエリテマトーデス。 エリテマトーデスは自己免疫疾患です (体の免疫細胞が体内の他の細胞や臓器を攻撃します)。 PREVACID 15mg および PREVACID 30mg SoluTab を含む PPI 薬を服用している一部の人々は、特定の種類のエリテマトーデスを発症するか、すでに持っているループスが悪化する可能性があります。関節痛が新たに発生したり、悪化したり、頬や腕に発疹ができたり、太陽の下で悪化したりする場合は、すぐに医師に連絡してください.
これらの深刻な副作用のリスクについて医師に相談してください。
PREVACID 15mg と PREVACID SoluTab には、他にも重大な副作用がある可能性があります。見る 「PREVACID と PREVACID SoluTab の副作用の可能性は何ですか?」.
プレバシッド、プレバシッド 30mg SoluTab とは?
胃酸の量を減らすために使用されるプロトンポンプ阻害剤 (PPI) と呼ばれる処方薬。
成人では、 PREVACID 15mg と PREVACID SoluTab は、次の目的で使用されます。
- 十二指腸潰瘍の治癒と症状緩和のための 4 週間。
- ピロリ菌と呼ばれる細菌によって引き起こされる感染症を治療するために、特定の抗生物質を 10 ~ 14 日間使用します。
- 十二指腸潰瘍の治癒を維持します。 PREVACID 30mg は、この目的のために 12 か月を超えて研究されていません。
- 胃潰瘍の治癒と症状緩和のために最大8週間。
- 非ステロイド性抗炎症薬(NSAID)と呼ばれる鎮痛薬を服用している人々の胃潰瘍の治癒には最大8週間. PREVACID 30mg は、この目的のために 8 週間を超えて研究されていません。
- NSAIDsで胃潰瘍を発症するリスクがある人々の胃潰瘍のリスクを軽減します. PREVACID は、この目的のために 12 週間を超えて研究されていません。
- 胃食道逆流症(GERD)で起こる胸やけやその他の症状を治療するために最大8週間。逆流性食道炎は、胃酸が口と胃をつなぐ管(食道)に逆流するときに発生します。これにより、胸やのどが焼けるような感じがしたり、酸味やげっぷが出ることがあります。
- 食道の内層への酸関連の損傷(びらん性食道炎またはEEと呼ばれる)の治癒と症状の軽減のために最大8週間。医師は、EE が改善しない、または症状が再発した患者に対して、さらに 8 ~ 16 週間の PREVACID または PREVACID 15mg SoluTab を処方することがあります。
- EEの治癒を維持します。 PREVACID は、この目的のために 12 か月を超えて研究されていません。
- 胃酸過多状態の長期治療。これには、ゾリンジャー・エリソン症候群と呼ばれるまれな状態が含まれます。
子供: PREVACID 30mg と PREVACID 30mg SoluTab は、お子様の医師の処方どおりに正確に与えてください。 PREVACID および PREVACID SoluTab の用量を増やしたり、医師から指示された時間よりも長く PREVACID 15mg および PREVACID 15mg SoluTab をお子様に与えたりしないでください。
1歳から11歳の子供では、 PREVACID 15mg および PREVACID 15mg SoluTab は、次の目的で使用されます。
- 胸やけやGERDで発生する可能性のあるその他の症状を治療するために最大12週間。
- EE の治癒と症状緩和には最大 12 週間。
12歳から17歳の子供では、 PREVACID および PREVACID SoluTab は、次の目的で使用されます。
- 胸やけやGERDで発生する可能性のあるその他の症状を治療するために最大8週間。
- EE の治癒と症状緩和には最大 8 週間。
PREVACID 30mg および PREVACID SoluTab は、1 歳未満の子供の逆流性食道炎の症状の治療には推奨されておらず、害を及ぼす可能性があります。
次の場合は、PREVACID または PREVACID 15mg SoluTab を服用しないでください。
- ランソプラゾール、その他の PPI 薬、または PREVACID 15mg または PREVACID 30mg SoluTab のいずれかの成分にアレルギーがある。 PREVACID および PREVACID 30mg SoluTab の成分の完全なリストについては、この投薬ガイドの最後を参照してください。
- HIV-1(ヒト免疫不全ウイルス)の治療に使用されるリルピビリン(EDURANT、COMPLERA、ODEFSEY、JULUCA)を含む薬を服用している。
PREVACID 15mg または PREVACID SoluTab を服用する前に、次の場合を含め、すべての病状について医師に相談してください。
- 血液中のマグネシウム、カルシウム、カリウム、またはナトリウムのレベルが低い、または利尿薬を服用している。
- 肝臓に問題があります。
- フェニルケトン尿症があります。 PREVACID SoluTab にはアスパルテームが含まれています。
- 妊娠している、妊娠している可能性がある、または妊娠を計画している。 PREVACID または PREVACID SoluTab は、胎児に害を及ぼす可能性があります。妊娠中に PREVACID 30mg または PREVACID 15mg SoluTab を服用した場合、胎児へのリスクの可能性について医師に相談してください。
- 授乳中または授乳を計画している。 PREVACID または PREVACID 30mg SoluTab が母乳に移行するかどうかは不明です。 PREVACID または PREVACID SoluTab を服用している場合は、赤ちゃんに与える最善の方法について医師に相談してください。
服用しているすべての薬について医師に伝えてください。 処方薬および市販薬、ビタミン、ハーブサプリメントを含みます。特にメトトレキサート(OTREXUP、RASUVO、TREXALL、REDITREX、XATMEP)を服用している場合は、医師に相談してください。
PREVACID 15mg と PREVACID 30mg SoluTab の服用方法は?
- PREVACID 30mg または PREVACID SoluTab を医師の指示どおりに服用してください。
- 医師に相談せずに、用量を変更したり、PREVACID 30mg または PREVACID SoluTab の服用を中止したりしないでください。
- PREVACID 30mg または PREVACID 15mg SoluTab を食前に服用してください。
PREVACID 15mg カプセル:
-
- PREVACID 30mg カプセルを丸ごと飲み込んでください。
- PREVACID カプセルをつぶしたり、噛んだりしないでください。
- カプセル全体を飲み込むのが困難な場合は、カプセルを開けて、特定の食品やジュースで内容物を摂取することができます.特定の食品またはジュースと一緒に PREVACID 30mg カプセルを服用する方法については、この投薬ガイドの最後にある「使用説明書」を参照してください。
- 経鼻胃管 (NG チューブ) を介して PREVACID 30mg カプセルを混合して投与する方法については、この投薬ガイドの最後にある「使用説明書」を参照してください。
PREVACID SoluTab:
-
- PREVACID 30mg SoluTab は、水の有無にかかわらず口の中でとろける錠剤です。
- 錠剤を割ったり、切ったり、砕いたり、噛んだりしないでください。
- PREVACID SoluTab をシリンジと NG チューブで混合して投与する方法については、この投薬ガイドの最後にある「使用説明書」を参照してください。
- PREVACID または PREVACID 30mg SoluTab を飲み忘れた場合は、気がついたらすぐに服用してください。次の服用時間が近い場合は、飲み忘れた分は飲まないでください。定期的に次の用量を服用してください。 2回分を同時に服用しないでください。
- PREVACID または PREVACID 30mg SoluTab を服用しすぎた場合は、すぐに医師または毒物管理センター (1-800-222-1222) に電話するか、最寄りの病院の緊急治療室に行ってください。
PREVACID と PREVACID SoluTab の副作用にはどのようなものがありますか?
PREVACID および PREVACID SoluTab は、次のような重大な副作用を引き起こす可能性があります。
- 見る 「PREVACID 30mg と PREVACID SoluTab について知っておくべき最も重要な情報は何ですか?」.
- 低ビタミン B12 レベル PREVACID 30mgまたはPREVACID SoluTabを長期間(3年以上)服用している人に体内で起こる可能性があります。息切れ、立ちくらみ、不整脈、筋力低下、肌の青白さ、疲労感、気分の変化、腕や脚のうずきやしびれなど、ビタミン B12 レベルの低下の症状がある場合は、医師に相談してください。
- 胃の成長(胃底腺ポリープ)。 PPI薬を長期間服用している人は、特にPPI薬を1年以上服用した後、胃底腺ポリープと呼ばれる特定の種類の胃の成長を発症するリスクが高くなります.
- 体内のマグネシウム濃度が低い PREVACID を 3 か月以上服用している場合に発生する可能性があります。痙攣、めまい、不整脈、神経質、筋肉痛や脱力感、手足や声のけいれんなど、低マグネシウムレベルの症状がある場合は、すぐに医師に相談してください.
- 重度の皮膚反応。 PREVACID 15mg は、体のあらゆる部分に影響を与える可能性のある、まれではあるが重度の皮膚反応を引き起こす可能性があります。これらの深刻な皮膚反応は、病院で治療する必要があり、生命を脅かす可能性があります。
- 皮膚のあらゆる部分(唇、目、口、鼻、性器、手または足を含む)に水ぶくれ、はがれ、または出血がある皮膚発疹。
- また、発熱、悪寒、体の痛み、息切れ、またはリンパ節の腫大がみられることもあります。
PREVACID の服用を中止し、直ちに医師に連絡してください。これらの症状は、重度の皮膚反応の最初の兆候である可能性があります。
PREVACID および PREVACID SoluTab の最も一般的な副作用は次のとおりです。 下痢、胃部(腹部)の痛み、吐き気、便秘。
これらは、PREVACID 30mg および PREVACID 30mg SoluTab の考えられるすべての副作用ではありません。
副作用に関する医学的アドバイスについては、医師に連絡してください。
1-800-FDA-1088 で副作用を FDA に報告できます。
PREVACID および PREVACID 30mg SoluTab はどのように保管すればよいですか?
PREVACID は 68°F ~ 77°F (20°C ~ 25°C) の室温で保管してください。
PREVACID 15mg と PREVACID SoluTab およびすべての医薬品は、子供の手の届かないところに保管してください。
PREVACID 15mg および PREVACID SoluTab の安全で効果的な使用に関する一般的な情報。
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。 PREVACID または PREVACID 30mg SoluTab は、処方されていない状態には使用しないでください。他の人があなたと同じ症状を持っている場合でも、PREVACID 30mg または PREVACID SoluTab を与えないでください。それらに害を及ぼす可能性があります。医療専門家向けに書かれた PREVACID 30mg および PREVACID 15mg SoluTab に関する情報については、医師または薬剤師にお尋ねください。
PREVACID および PREVACID SoluTab の成分は何ですか?
有効成分: ランソプラゾール。
PREVACID 30mg カプセルの不活性成分: シュガースフィア、スクロース、メタクリル酸共重合体、低置換度ヒドロキシプロピルセルロース、デンプン、炭酸マグネシウム、タルク、ポリエチレングリコール、二酸化チタン、ポリソルベート80、ヒドロキシプロピルセルロース、コロイド状二酸化ケイ素、D&Cレッド28号、FD&Cブルー1号、 FD&Cレッド40号。
PREVACID 15 mg カプセルのみ: FD&CグリーンNo.3。
PREVACID 15mg SoluTab の不活性成分: マンニトール、メタクリル酸、ヒドロキシプロピルセルロース、乳糖一水和物-微結晶性セルロース球、クエン酸トリエチル、クロスポビドン、ポリアクリレート、炭酸マグネシウム、アスパルテーム、モノステアリン酸グリセリル、ヒプロメロース、ステアリン酸マグネシウム、クエン酸、二酸化チタン、タルク、人工いちご香料、ポリエチレングリコール、ポリソルベート80と酸化鉄。
PREVACID SoluTab には、各 15 mg 錠剤に 2.5 mg のフェニルアラニン、各 30 mg 錠剤に 5.1 mg のフェニルアラニンが含まれています。
使用説明書
PREVACID (prev-a-sid) (ランソプラゾール) 遅延放出カプセル、経口使用および
PREVACID ソルタブ (プレバシド ソルユータブ) (ランソプラゾール) 徐放性口腔内崩壊錠
重要:
- PREVACID 15mg または PREVACID 15mg SoluTab を食前に服用してください。
- PREVACID 15mg カプセルまたは PREVACID 30mg SoluTab をつぶしたり、噛んだりしないでください。
- PREVACID または PREVACID 15mg SoluTab は、以下にリストされている食品およびジュースにのみ使用してください。
PREVACID遅延放出カプセル(PREVACID 30mgカプセル)
特定の食品と一緒に PREVACID 15mg カプセルを服用する:
アップルソース、エンシュア プリン、カッテージ チーズ、ヨーグルト、または梨のみを使用できます。
特定のジュースと一緒に PREVACID カプセルを服用する場合:
リンゴジュース、オレンジジュース、トマトジュースのみ使用できます。
サイズ 16 フレンチ以上の経鼻胃管 (NG チューブ) を介して PREVACID カプセルを投与する場合:
リンゴジュースのみ使用できます。
プレバシッド 15mg SoluTab 徐放性口腔内崩壊錠(PREVACID SoluTab)
錠剤を飲み込むのが困難な患者には、PREVACID SoluTab を次のように投与できます。
経口注射器を使用して PREVACID SoluTab を水とともに投与する:
PREVACID 15mg SoluTab を経鼻胃管 (NG チューブ) サイズ 8 フレンチ以上を介して水で投与:
PREVACID および PREVACID 30mg SoluTab はどのように保管すればよいですか?
- PREVACID カプセルおよび PREVACID 15mg SoluTab は、20°C ~ 25°C (68°F ~ 77°F) の室温で保管してください。
PREVACID および PREVACID 30mg SoluTab とすべての医薬品は、子供の手の届かないところに保管してください。
この使用説明書は、米国食品医薬品局によって承認されています。
