Pepcid 20mg, 40mg Famotidine 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
ペプシドとは何ですか? また、どのように使用されますか?
ペプシド (ファモチジン) は、胸やけ、GERD、ゾリンジャー・エリソン症候群の治療に使用されます。店頭で入手できます。 Pepcid 20mg はジェネリックとして入手できます。
ペプシドを使用することで起こりうる副作用は何ですか?
副作用はまれですが、次のようなものがあります。
- 倦怠感、
- 嘔吐、
- 吐き気、
- 腹部不快感、
- 食欲不振、
- 口渇、
- 発疹、および
- 筋肉のけいれん
説明
PEPCID® (ファモチジン) の有効成分は、ヒスタミン H2 受容体拮抗薬です。ファモチジンは、N'(アミノスルホニル)-3-[[[2-[(ジアミノメチレン)アミノ]-4-チアゾリル]メチル]チオ]プロパンイミドアミドである。ファモチジンの実験式は C8H15N7O2S3 で、分子量は 337.43 です。その構造式は次のとおりです。
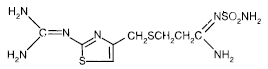
ファモチジンは白色から淡黄色の結晶性化合物で、氷酢酸に溶けやすく、メタノールに溶けにくく、水にほとんど溶けず、エタノールにほとんど溶けません。
経口投与用の各錠剤には、20 mg または 40 mg のファモチジンと次の不活性成分が含まれています。
適応症
PEPCID 40mg は次のように示されています。
投薬と管理
十二指腸潰瘍
急性期治療: 活動性十二指腸潰瘍に対する成人の推奨経口投与量は、1日1回就寝前に40mgです。ほとんどの患者は 4 週間以内に治癒します。 PEPCID をフル用量で 6 ~ 8 週間以上使用する理由はめったにありません。 20 mg 1 日 2 回のレジメンも効果的です。
維持療法: 成人の推奨経口用量は、1日1回就寝前に20mgです。
良性胃潰瘍
急性期治療: 活動性の良性胃潰瘍に対する成人の推奨経口投与量は、1日1回就寝前に40mgです。
胃食道逆流症(GERD)
GERD の症状のある成人患者の治療に推奨される経口投与量は、20 mg を 1 日 2 回、最長 6 週間です。びらんや潰瘍を含む食道炎、および GERD による随伴症状を伴う成人患者の治療に推奨される経口投与量は、20 または 40 mg を 1 日 2 回、最長 12 週間です。 成人における臨床薬理学 、 臨床研究 )。
1 歳未満の小児患者の投与量 胃食道逆流症 (GERD)
見る 予防 、 1歳未満の小児患者。
PRECAUTIONS、Pediatric Patients
1~16歳の小児患者の投与量
見る 予防 、 1~16歳の小児患者。
PRECAUTIONS、Pediatric Patients 1-16 years of age に記載されている研究では、1-16 歳の小児患者における次の開始用量が提案されています。
消化性潰瘍 - 就寝時に 0.5 mg/kg/日 po または最大 40 mg/日まで分割入札。
びらんや潰瘍を含む食道炎を伴うまたは伴わない胃食道逆流症 - 1.0 mg/kg/日 po 分割入札 最大 40 mg 入札
公開された非対照研究は、胃食道逆流症および消化性潰瘍の治療におけるファモチジンの有効性を示唆していますが、小児患者のデータは、用量および治療期間に対する反応率を確立するには不十分です。したがって、治療期間 (当初は成人の推奨期間に基づく) と投与量は、臨床反応および/または pH 測定 (胃または食道) および内視鏡検査に基づいて個別化する必要があります。 1 ~ 16 歳の小児患者を対象とした公開された非対照臨床研究では、消化性潰瘍には最大 1 mg/kg/日、びらんや潰瘍を含む食道炎の有無にかかわらず GERD には最大 2 mg/kg/日の用量が使用されています。
病的な過剰分泌状態(例、ゾリンジャー・エリソン症候群、多発性内分泌腺腫)
病的な過剰分泌状態の患者における PEPCID の投与量は、個々の患者によって異なります。病理学的な過剰分泌状態に対する成人の推奨経口開始用量は、6 時間ごとに 20 mg です。一部の患者では、より高い開始用量が必要になる場合があります。用量は個々の患者のニーズに合わせて調整する必要があり、臨床的に示される限り継続する必要があります。重度のゾリンジャー・エリソン症候群の一部の成人患者には、6時間ごとに最大160mgの用量が投与されています。
制酸剤の併用
必要に応じて制酸剤を併用することもあります。
中等度または重度の腎不全患者の用量調整
中等度 (クレアチニンクリアランス
成人および小児患者における PEPCID の薬物動態パラメーターの比較に基づいて、中等度または重度の腎不全を有する小児患者における用量調整を考慮する必要があります。
供給方法
PEPCID 40mg錠 、20 mg は、ベージュ色の丸みを帯びた正方形のフィルムコーティング錠で、片面に MSD がコード化され、もう片面には無地です。それらは次のように提供されます。
NDC 42998-639-09 使用本数 30本入り NDC 42998-639-98 使用本数 100本入り。
PEPCID 40mg 錠剤 40mg は、黄褐色の丸みを帯びた正方形のフィルムコーティングされた錠剤で、片面に MSD がコードされ、もう片面には無地です。それらは次のように提供されます。
NDC 42998-649-09 使用本数 30本入 NDC 42998-649-98 使用本数 100本入り。
制御された室温で保管してください。
PEPCID® (ファモチジン) 錠剤 20 mg および錠剤 40 mg は、Marathon Pharmaceuticals, LLC, Northbrook, IL 60062, USA のために製造されています。 2014 年 2 月発行。
副作用
国内外の臨床試験において、約2,500名の患者さんを対象に以下の副作用が報告されています。 PEPCID 40mg 錠をプラセボと比較した対照臨床試験では、就寝時に PEPCID 錠 40mg を投与したグループの有害事象の発生率は、プラセボ群と同様でした。
以下の有害反応は、対照臨床試験で PEPCID による治療を受けている患者の 1% 以上で発生することが報告されており、薬物との因果関係がある可能性があります: 頭痛 (4.7%)、めまい (1.3%)、便秘 (1.2%) )および下痢(1.7%)。
その他、臨床試験や上市後、まれに以下の副作用が報告されています。多くの場合、PEPCID 20mg による治療との関係は不明です。各カテゴリー内で、有害反応は重症度の降順でリストされています。
全身: 発熱、無力症、疲労
心臓血管: 不整脈、房室ブロック、動悸。腎機能障害のある患者におけるQT間隔の延長は、非常にまれに報告されています。
胃腸: 胆汁うっ滞性黄疸、肝炎、肝酵素異常、嘔吐、吐き気、腹部不快感、食欲不振、口渇
血液学: 無顆粒球症、汎血球減少症、白血球減少症、血小板減少症のまれなケース
過敏症: アナフィラキシー、血管性浮腫、眼窩または顔面浮腫、蕁麻疹、発疹、結膜注射
筋骨格: 横紋筋融解症、筋肉のけいれんを含む筋骨格系の痛み、関節痛
神経系/精神医学: 大発作;幻覚、混乱、興奮、抑うつ、不安、性欲減退を含む、追跡調査が行われた場合に可逆的であった精神障害。感覚異常;不眠症;眠気。腎機能障害のある患者のけいれんは、非常にまれに報告されています。
呼吸器: 気管支痙攣、間質性肺炎
肌: 中毒性表皮壊死融解症/スティーブンス・ジョンソン症候群 (非常にまれ)、脱毛症、にきび、かゆみ、乾燥肌、潮紅
特別な感覚: 耳鳴り、味覚障害
他の: インポテンスのまれなケースと女性化乳房のまれなケースが報告されています。しかし、対照臨床試験では、発生率はプラセボで見られたものより大きくはありませんでした.
PEPCID 錠剤で報告されている副作用は、経口懸濁液用の PEPCID 20mg でも発生する可能性があります。
小児患者
GERD 症状 [例えば、嘔吐 (吐き出す)、易怒性 (大騒ぎ)] を有する 1 歳未満の小児患者 35 人を対象とした臨床研究では、ファモチジンを服用している 5 人の患者で興奮が観察され、投薬を中止すると解消されました。
薬物相互作用
薬物相互作用は確認されていません。ヒト、動物モデル、およびインビトロでのファモチジンの研究では、シトクロム P450 システムなどの肝ミクロソーム酵素によって代謝される化合物の配置に有意な干渉がないことが示されています。ヒトで試験された化合物には、ワルファリン、テオフィリン、フェニトイン、ジアゼパム、アミノピリン、およびアンチピリンが含まれます。肝臓の薬物抽出の指標としてのインドシアニングリーンはテストされており、有意な効果は発見されていません.
警告
情報が提供されていません
予防
全般的
PEPCID による治療に対する症候性反応は、胃の悪性腫瘍の存在を排除するものではありません。
中等度または重度の腎不全患者
中等度および重度の腎不全の患者で中枢神経系への悪影響が報告されているため、中等度 (クレアチニンクリアランス 成人における臨床薬理学 と 投薬と管理 )。 QT間隔の延長は、ファモチジンの投与量/投与間隔が適切に調整されていない可能性のある腎機能障害のある患者で非常にまれに報告されています.
発がん、突然変異誘発、生殖能力の障害
ラットでの 106 週間の研究およびマウスでの 92 週間の研究で、最大 2000 mg/kg/日 (活動性十二指腸潰瘍に対するヒトの推奨用量の約 2500 倍) を経口投与したところ、発がん性の証拠はありませんでした。 PEPCID。
ファモチジンは、最大 10,000 mcg/プレートの濃度でラット肝酵素活性化の有無にかかわらず、ネズミチフス菌および大腸菌を使用した微生物変異原試験 (Ames 試験) で陰性でした。小核試験および染色体異常試験によるマウスの in vivo 試験では、変異原性効果の証拠は観察されなかった。
最大 2000 mg/kg/日の経口用量または最大 200 mg/kg/日の静脈内用量を与えられたラットを用いた研究では、受胎能および生殖能力に影響はありませんでした。

妊娠
妊娠カテゴリーB
ラットとウサギではそれぞれ最大 2000 および 500 mg/kg/日の経口投与で生殖研究が行われ、両方の種で最大 200 mg/kg/日の IV 投与で実施されました。 PEPCID による受胎能の障害または胎児への害。胎児毒性の直接的な影響は観察されていませんが、200 mg/kg/日 (通常のヒトの用量の 250 倍) 以上の経口用量で、顕著な食物摂取量の減少を示す母親にのみ散発的な流産が見られました。しかし、妊娠中の女性を対象とした十分に管理された研究はありません。動物の生殖研究は常に人間の反応を予測できるわけではないため、この薬は明らかに必要な場合にのみ妊娠中に使用する必要があります.
授乳中の母親
授乳中のラットで行われた研究では、ファモチジンが母乳に分泌されることが示されています。通常の人間の用量の少なくとも 600 倍の母体毒性用量で処理された母親から授乳中の若いラットで、一過性の成長抑制が観察されました。ファモチジンは母乳中に検出されます。授乳中の乳児に PEPCID による深刻な副作用が生じる可能性があるため、母親にとっての薬の重要性を考慮して、授乳を中止するか薬を中止するかを決定する必要があります。
1歳未満の小児患者
歳未満の小児患者における PEPCID 20mg の使用は、成人における PEPCID の適切かつ十分に管理された研究からの証拠、および 1 歳未満の小児患者における以下の研究によって裏付けられています。
歳未満の小児患者 (N=48) を対象とした 2 つの薬物動態研究では、3 か月以上から 1 歳までの患者におけるファモチジンのクリアランスは、年長の小児患者 (1 ~ 15 歳) および成人で見られるものと同様であることが実証されました。 .対照的に、生後 0 ~ 3 か月の小児患者のファモチジンクリアランス値は、年長の小児患者および成人の値よりも 2 ~ 4 倍低かった。これらの研究は、経口投与後の 1 歳未満の小児患者における平均バイオアベイラビリティが、それ以上の小児患者および成人と同様であることも示しています。生後 0 ~ 3 か月の小児患者の薬力学データは、年長の小児患者と比較して酸抑制の期間が長いことを示唆しており、これは生後 0 ~ 3 か月の小児患者のファモチジン半減期が長いことと一致しています。 (見る 小児患者における臨床薬理学 、 薬物動態と薬力学 .)
二重盲検無作為化治療中止研究では、胃食道逆流症と診断された 1 歳未満の小児患者 35 人が、ファモチジン経口懸濁液 (0.5 mg/kg/用量または 1 mg /kg/用量)。静脈内ファモチジン製剤が利用可能でしたが、この研究では静脈内ファモチジンで治療された患者はいませんでした。また、介護者は濃厚な栄養を含む保守的な治療を提供するように指示されました。登録された患者は、主に嘔吐 (吐き出す) と過敏性 (うるさい) の病歴によって診断されました。ファモチジンの投与レジメンは、生後 3 か月未満の患者では 1 日 1 回、生後 3 か月以上の患者では 1 日 2 回でした。 4週間の治療後、患者は無作為に治療を中止し、有害事象と症状についてさらに4週間追跡しました.患者は、嘔吐(吐き出す)、過敏性(うるさい)、および改善の全体的な評価について評価されました。試験に参加した患者の年齢は 1.3 ~ 10.5 か月 (平均 5.6 ± 2.9 か月) で、57% が女性、91% が白人、6% が黒人でした。ほとんどの患者 (27/35) は、研究の治療中止段階に進みました。 2 人の患者は、有害事象のためにファモチジンを中止しました。ほとんどの患者は、研究の最初の治療段階で改善しました。治療中止期の結果は、患者数が少なかったため解釈が困難でした。研究に登録された 35 人の患者のうち、ファモチジンを服用している 5 人の患者で動揺が観察されましたが、投薬を中止すると解消されました。興奮は、プラセボを投与された患者では観察されませんでした。 有害反応 、 小児患者 )。
これらの研究は、ファモチジン経口懸濁液の開始用量 0.5 mg/kg/用量が、生後 3 か月未満の患者では 1 日 1 回、生後 3 か月から 3 か月未満の患者では 1 日 2 回、最大 4 週間の GERD の治療に有益である可能性があることを示唆しています。 1歳; 4 週間を超えるファモチジン治療の安全性と利点は確立されていません。 GERD の治療にファモチジンを考慮するのは、保守的な方法(例:濃厚栄養)が同時に使用され、潜在的な利益がリスクを上回る場合に限られます。
1~16歳の小児患者
1~16 歳の小児患者における PEPCID 40mg の使用は、成人における PEPCID の適切かつ十分に管理された研究からの証拠、および小児患者を対象とした以下の研究によって裏付けられています。歳、ファモチジンのクリアランスは成人に見られるものと同様でした。 11 ~ 15 歳の小児患者では、0.5 mg/kg の経口投与は、40 mg を経口投与した成人に見られるのと同様の平均曲線下面積 (AUC) と関連していました。同様に、1 ~ 15 歳の小児患者では、0.5 mg/kg の静脈内投与は、40 mg で静脈内投与された成人に見られるのと同様の平均 AUC と関連していました。発表された限られた研究では、血清濃度と胃酸抑制の関係は、成人と比較して 1 ~ 15 歳の小児患者でも同様であることが示唆されています。これらの研究では、1 ~ 16 歳の小児患者の開始用量が次のように提案されています。
消化性潰瘍 - 0.5 mg/kg/日 po 就寝時または分割入札 最大 40 mg/日。
びらんや潰瘍を含む食道炎を伴うまたは伴わない胃食道逆流症 - 1.0 mg/kg/日 po 分割入札 最大 40 mg 入札
公開された非対照研究は、胃食道逆流症および消化性潰瘍の治療におけるファモチジンの有効性を示唆していますが、小児患者のデータは、用量および治療期間に対する反応率を確立するには不十分です。したがって、治療期間 (当初は成人の推奨期間に基づく) と投与量は、臨床反応および/または pH 測定 (胃または食道) および内視鏡検査に基づいて個別化する必要があります。小児患者における公開された制御されていない臨床研究では、消化性潰瘍には最大 1 mg/kg/日、びらんや潰瘍を含む食道炎の有無にかかわらず GERD には最大 2 mg/kg/日の用量が使用されています。
高齢者の使用
ファモチジンで治療された臨床研究の 4,966 人の被験者のうち、488 人の被験者 (9.8%) は 65 歳以上であり、88 人の被験者 (1.7%) は 75 歳以上でした。これらの被験者と若い被験者の間で、安全性または有効性の全体的な違いは観察されませんでした。ただし、一部の高齢者の感度が高いことは否定できません。
年齢に基づいて投与量を調整する必要はありません( 成人における臨床薬理学 、 薬物動態 )。この薬は腎臓から実質的に排泄されることが知られており、腎機能が低下している患者では、この薬に対する毒性反応のリスクが高くなる可能性があります。高齢患者は腎機能が低下している可能性が高いため、投与量の選択には注意が必要であり、腎機能のモニタリングが役立つ場合があります。中等度または重度の腎障害の場合は用量調整が必要です( 予防 、 中等度または重度の腎不全患者 と 投薬と管理 、 中等度または重度の腎不全患者の用量調整 )。
過剰摂取
過剰摂取の場合の有害反応は、通常の臨床経験で遭遇する有害反応に類似しています ( 有害反応 )。病理学的な過剰分泌状態の成人患者には、最大 640 mg/日の経口用量が投与されており、深刻な悪影響はありません。過剰摂取の場合、治療は対症療法および支持療法でなければなりません。吸収されなかった物質を胃腸管から除去し、患者を監視し、支持療法を採用する必要があります。
雄および雌のラットおよびマウスにおけるファモチジンの経口 LD50 は 3000 mg/kg を超え、イヌにおける最小致死急性経口用量は 2000 mg/kg を超えた。ファモチジンは、マウス、ラット、ネコ、およびイヌに高用量で経口投与しても明らかな影響をもたらさなかったが、経口で 200 mg/kg/日からウサギに有意な食欲不振と成長抑制を誘発した.マウスおよびラットに対するファモチジンの静脈内 LD50 は 254 ~ 563 mg/kg の範囲であり、犬の最小致死単回 IV 用量は約 300 mg/kg でした。静脈内投与された犬の急性中毒の徴候は、嘔吐、落ち着きのなさ、粘膜の蒼白または口と耳の発赤、低血圧、頻脈、虚脱でした。
禁忌
これらの製品の成分に対する過敏症。このクラスの化合物では交差感受性が観察されています。したがって、PEPCID 40mg は、他の H2 受容体拮抗薬に対する過敏症の既往歴のある患者には投与しないでください。
臨床薬理学
成人における臨床薬理学
GI効果
PEPCID は、ヒスタミン H2 受容体の競合阻害剤です。 PEPCID 40mg の主要な臨床的に重要な薬理学的活性は、胃液分泌の抑制です。酸濃度と胃液分泌量の両方が PEPCID によって抑制されますが、ペプシン分泌の変化は排出量に比例します。
正常なボランティアと過剰分泌者では、PEPCID 20mg は、基礎および夜間の胃分泌、ならびに食物およびペンタガストリンによって刺激される分泌を抑制しました。経口投与後、抗分泌効果は 1 時間以内に発現しました。最大の効果は用量依存的で、1~3時間以内に発生しました。 20 および 40 mg の用量による分泌抑制の持続時間は 10 ~ 12 時間でした。
20 mg および 40 mg の 1 晩の経口投与は、すべての被験者の基礎および夜間の酸分泌を抑制しました。平均夜間胃酸分泌は、少なくとも 10 時間の間、それぞれ 86% と 94% 抑制されました。朝に与えられた同じ用量は、すべての被験者で食物刺激による酸分泌を抑制しました.平均抑制は、投与後 3 ~ 5 時間でそれぞれ 76% および 84%、投与後 8 ~ 10 時間でそれぞれ 25% および 30% でした。しかし、20 mg の用量を投与された一部の被験者では、抗分泌効果が 6 ~ 8 時間以内に消失しました。反復投与による累積効果はありませんでした。夜間の胃内 pH は、夕方に 20 mg および 40 mg の PEPCID を投与することにより、それぞれ平均値 5.0 および 6.4 に上昇しました。朝食後に PEPCID 40mg を投与すると、PEPCID 40mg を 20 mg または 40 mg 摂取してから 3 時間後および 8 時間後の日中の基礎消化間 pH は約 5 に上昇しました。
PEPCID 40mg は、絶食時または食後の血清ガストリン濃度にほとんどまたはまったく影響を与えませんでした。胃内容排出および膵外分泌機能は、PEPCID の影響を受けませんでした。
その他の効果
中枢神経系、心血管系、呼吸器系または内分泌系における PEPCID の全身作用は、臨床薬理学研究では認められませんでした。また、抗アンドロゲン効果は認められませんでした。 (見る 有害反応 .) プロラクチン、コルチゾール、チロキシン (T4)、およびテストステロンを含む血清ホルモンレベルは、PEPCID による治療後も変化しませんでした。
薬物動態
PEPCID 20mg は不完全に吸収されます。経口投与のバイオアベイラビリティは 40 ~ 45% です。バイオアベイラビリティは、食物によってわずかに増加するか、制酸剤によってわずかに減少する可能性があります。ただし、これらの影響は臨床的に重要ではありません。 PEPCID の初回通過代謝は最小限です。経口投与後、1~3時間で血漿レベルがピークに達します。複数回投与後の血漿レベルは、単回投与後の血漿レベルと同様です。血漿中の PEPCID 20mg の 15 ~ 20% がタンパク質に結合しています。 PEPCID の消失半減期は 2.5 ~ 3.5 時間です。 PEPCID は、腎臓 (65 ~ 70%) および代謝 (30 ~ 35%) 経路によって除去されます。腎クリアランスは 250 ~ 450 mL/min であり、尿細管排泄があることを示しています。経口投与では 25 ~ 30%、静脈内投与では 65 ~ 70% が未変化の化合物として尿中に回収されます。人間で確認された唯一の代謝物は S-オキシドです。
クレアチニンクリアランス値と PEPCID の半減期の間には密接な関係があります。重度の腎不全患者、すなわちクレアチニンクリアランスが 10 mL/分未満の患者では、PEPCID の消失半減期が 20 時間を超える可能性があり、中等度および重度の腎不全では用量または投与間隔の調整が必要になる場合があります ( 予防 、 投薬と管理 )。
高齢患者では、PEPCID の薬物動態に臨床的に有意な年齢関連の変化はありません。しかし、腎機能が低下している高齢の患者では、薬物のクリアランスが低下することがあります( 予防 、 高齢者の使用 )。
臨床研究
十二指腸潰瘍
内視鏡検査で確認された十二指腸潰瘍の外来患者を対象とした米国の多施設二重盲検試験で、経口投与された PEPCID がプラセボと比較されました。表 1 に示すように、PEPCID 40 mg hs で治療された患者の 70% が 4 週目までに治癒しました。
週目までに治癒しなかった患者は、研究を継続しました。 8 週目までに、PEPCID で治療された患者の 83% が治癒したのに対し、プラセボで治療された患者の 45% が治癒しました。 PEPCID による潰瘍治癒の発生率は、内視鏡で確認された治癒した潰瘍の割合に基づいて、各時点でプラセボよりも有意に高かった。
この研究では、プラセボを投与された患者よりもPEPCIDを投与された患者の方が、日中および夜間の痛みが軽減するまでの時間が有意に短かった。 PEPCID を投与された患者は、プラセボを投与された患者よりも制酸剤の摂取量が少なかった.
十二指腸潰瘍の長期維持療法
PEPCID 40mg、20mg pohs は、内視鏡検査で治癒が確認された十二指腸潰瘍の患者を対象とした 2 つの二重盲検多施設研究において、維持療法としてプラセボ hs と比較されました。米国の研究では、プラセボで治療された患者で観察された 12 か月以内の潰瘍発生率は、PEPCID で治療された患者の 2.4 倍でした。 PEPCID で治療された 89 人の患者では、プラセボを投与された 89 人の患者で観察された潰瘍発生率が 56.6% であるのに対し、累積で観察された潰瘍発生率は 23.4% でした (p
胃潰瘍
内視鏡検査で活動性の良性胃潰瘍が確認された患者を対象とした米国および国際的な多施設共同二重盲検試験で、経口投与された PEPCID 20mg、40mg hs がプラセボと比較されました。 PEPCID 群とプラセボ群の間。表 2 に示すように、PEPCID 20 mg による潰瘍治癒の発生率 (ドロップアウトは未治癒としてカウント) は、米国の研究では 6 および 8 週、国際研究では 4、6 および 8 週でプラセボよりも統計的に有意に優れていました。内視鏡検査で確認された、治癒した潰瘍の数。
プラセボを投与された患者よりもPEPCID 20mgを投与された患者の方が、日中および夜間の痛みの完全な緩和にかかる時間が統計的に有意に短かった。ただし、どちらの研究でも、研究終了時 (8 週目) までに痛みが軽減された患者の割合に統計的に有意な差はありませんでした。
胃食道逆流症(GERD)
経口投与された PEPCID は、逆流性食道炎の症状があり、食道のびらんや潰瘍の内視鏡的証拠がない患者を登録した米国の研究で、プラセボと比較されました。 PEPCID 20 mg 1 日 2 回投与は、40 mg hs およびプラセボよりも統計的に有意に優れており、症状の中等度または優れた改善と定義された、良好な症状の結果をもたらしました (表 3)。
治療の 2 週間までに、プラセボと比較して PEPCID 20 mg を 1 日 2 回服用した患者の割合が高くなり、症状の改善が観察されました (p ≤ 0.01)。
症状の改善と、内視鏡検査で確認されたびらんと潰瘍の治癒について、さらに 2 つの試験が行われました。治癒は、内視鏡検査で見えるすべてのびらんまたは潰瘍の完全な解消と定義されました。 PEPCID 40 mg pobid とプラセボおよび PEPCID 20 mg pobid を比較した米国の研究では、6 週目と 12 週目で PEPCID 40 mg 1 日 2 回の治癒率が有意に高いことが示されました (表 4)。
プラセボと比較して、PEPCID を投与された患者は、日中および夜間の胸やけがより早く緩和され、より多くの患者で夜間の胸やけが完全に緩和されました。これらの違いは統計的に有意でした。
国際研究では、PEPCID 40 mg pobid をラニチジン 150 mg pobid と比較すると、12 週目に PEPCID 40 mg bid で統計的に有意に高い治癒率が観察されました (表 5)。しかし、症状の緩和に関しては、治療間に有意差はありませんでした。
病的な過剰分泌状態(例、ゾリンジャー・エリソン症候群、多発性内分泌腺腫)
多発性内分泌腺腫の有無にかかわらず、ゾリンジャー・エリソン症候群などの病的な過剰分泌状態の患者の研究では、PEPCID は胃酸分泌を有意に抑制し、関連する症状を制御しました。 20 から 160 mg を 6 時間ごとに経口投与すると、基礎酸分泌が 10 mEq/hr 未満に維持されました。最初の用量は個々の患者のニーズに合わせて滴定され、一部の患者では時間の経過とともにその後の調整が必要になりました。 PEPCID 40mg は、これらの高用量レベルで 8 人の患者で長期間 (12 か月以上) 耐容性が良好であり、この薬物が原因であると考えられる女性化乳房、プロラクチンレベルの上昇、またはインポテンツの報告例はありませんでした。
小児患者における臨床薬理学
薬物動態
表 6 は、0.5 mg/kg のファモチジン IV を投与された小児患者 (1 歳未満; N=27) における臨床試験および発表された研究、および少数の小児患者 (1 ~ 15 歳) の発表された研究からの薬物動態データを示しています。 ) ファモチジンを静脈内投与。曲線下面積 (AUC) は、1 ~ 15 歳の小児患者の 0.5 mg/kg IV の用量に正規化され、成人の外挿 40 mg 静脈内用量と比較されます (20 mg IV 成人で得られた結果に基づく外挿)用量)。
0 ~ 3 か月齢の小児患者では、それ以上の年齢の小児患者と比較して、血漿クリアランスが減少し、排泄半減期が延長されます。年齢 > 3 か月~15 歳の小児患者の薬物動態パラメータは、成人で得られたパラメータに匹敵します。
人の小児患者 (11 ~ 15 歳) のバイオアベイラビリティ研究では、経口バイオアベイラビリティの平均値が 0.5 であるのに対し、成人の値は 0.42 ~ 0.49 であることが示されました。 0.5 mg/kg の経口投与により、1 歳未満の小児患者 (N=5) および 11 ~ 15 歳の小児患者で、645 ± 249 ng-hr/mL および 580 ± 60 ng-hr/mL の AUC が達成されました。 40 mg を経口投与した成人の 482 ± 181 ng-hr/mL と比較して、それぞれ。
薬力学
ファモチジンの薬力学は、シグモイド Emax モデルを使用して 2 ~ 13 歳の 5 人の小児患者で評価されました。これらのデータは、ファモチジンの血清濃度と胃酸抑制との間の関係が、成人のある研究で観察されたものと類似していることを示唆している(表7)。
発表された 5 つの研究 (表 8) では、ファモチジンが胃の pH に及ぼす影響と、小児患者の胃酸抑制の持続時間が調べられました。各研究のデザインは異なりますが、経時的な酸抑制データは次のように要約されています。
ファモチジン IV 0.5 mg/kg の胃内 pH および胃酸抑制に対する効果の持続時間は、ある研究で、生後 1 か月未満の小児患者の方が年長の小児患者よりも長いことが示されました。胃酸抑制のこのより長い期間は、生後 3 か月未満の小児患者におけるクリアランスの減少と一致しています (表 6 を参照)。
患者情報
情報が提供されていません。を参照してください。 予防 セクション。
