消化管の治療: Nexium 20mg, 40mg Esomeprazole 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
ネキシウムとは何ですか?
ネキシウムは、胃食道逆流症 (GERD) の症状や、ゾリンジャー・エリソン症候群などの胃酸過多の症状を治療するために使用される処方薬です。ネキシウムは、単独で使用することも、他の薬と併用することもできます。
ネキシウム 20mg はプロトンポンプ阻害剤です。
ネキシウム 20mg が生後 1 か月未満の静脈内投与および 1 歳未満の経口投与で安全かつ有効であるかどうかは不明です。
ネキシウム 40mg の副作用は何ですか?
ネキシウムは、次のような重大な副作用を引き起こす可能性があります。
- 激しい胃痛、
- 水様または血様の下痢、
- 発作(けいれん)、
- 排尿がほとんどまたはまったくない、
- 尿中の血、
- 腫れ、
- 急激な体重増加、
- めまい、
- 速いまたは不規則な心拍数、
- 振戦またはけいれんする筋肉の動き、
- ぎくしゃくした感じ、
- 筋肉のけいれん、
- 手足の筋肉のけいれん、
- 咳や窒息感、
- 関節痛など
- 太陽の下で悪化する頬や腕の皮膚発疹
上記の症状がある場合は、すぐに医療機関を受診してください。
ネキシウム 40mg の最も一般的な副作用は次のとおりです。
- 頭痛、
- 眠気、
- 軽度の下痢
- 吐き気、
- 胃痛、
- ガス、
- 便秘、および
- 口渇
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、ネキシウムの考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
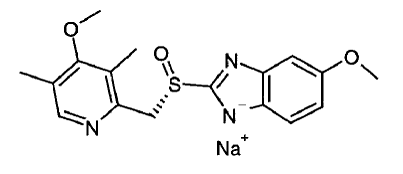
注射用 NEXIUM® IV (エソメプラゾール ナトリウム) の有効成分は、(S)-5-メトキシ-2[[(4-メトキシ-3,5-ジメチル-2-ピリジニル)-メチル]スルフィニル]-1H-ベンズイミダゾールです。ナトリウム、胃酸分泌を阻害するプロトンポンプ阻害剤。エソメプラゾールはオメプラゾールの S 異性体であり、S 異性体と R 異性体の混合物です。その実験式は C17H18N3O3SNa で、分子量は 367.4 g/mol (ナトリウム塩) および 345.4 g/mol (親化合物) です。
エソメプラゾール ナトリウムは、水に非常に溶けやすく、エタノールに溶けやすい (95%)。構造式は次のとおりです。
注射用 NEXIUM 20mg IV は、無菌の凍結乾燥した白色からオフホワイトの多孔質ケークまたは粉末として 5 mL バイアルに入っています。乳酸リンゲル注射、USP または 5% ブドウ糖注射、USP。注射用ネキシウム IV には、エソメプラゾール 20 mg または 40 mg に相当するエソメプラゾール ナトリウム 21.3 mg または 42.5 mg、エデト酸二ナトリウム 1.5 mg、および pH 調整用の水酸化ナトリウム適量が含まれています。注射用ネキシウム IV の再構成溶液の pH は、再構成量に依存し、pH 範囲は 9 ~ 11 です。水溶液中のエソメプラゾール ナトリウムの安定性は、強く pH に依存します。分解速度は、pH の低下とともに増加します。
適応症
びらん性食道炎(EE)による胃食道逆流症(GERD)の治療
NEXIUM IV は、経口 NEXIUM 40mg が不可能または適切でない場合の経口療法の代替として、成人および生後 1 か月から 17 歳までの小児患者の EE を伴う GERD の短期治療に適応されます。
成人における内視鏡治療後の胃潰瘍または十二指腸潰瘍の再出血のリスク低減
NEXIUM 40mg IV は、成人の急性出血性胃潰瘍または十二指腸潰瘍に対する内視鏡治療後の胃潰瘍または十二指腸潰瘍の再出血のリスク低減を目的としています。
投薬と管理
EE を伴う GERD の投与量
成人患者
成人の推奨用量は、20 mg または 40 mg のネキシウム 40 mg を 1 日 1 回、静脈内注射 (少なくとも 3 分間以上) または静脈内注入 (10 分から 30 分間) により 10 日間まで [参照] 投薬と管理 ]。
小児患者
小児患者の推奨用量は、以下の表 1 に示すように、年齢と体重に基づいています。 10~30分かけて1日1回、最大10日間点滴静注する[ 投薬と管理 ]。
治療の完了
- ネキシウム 20mg IV を 10 日以上投与した場合の安全性と有効性は実証されていません。
- 経口療法が可能または適切である場合は、NEXIUM 40mg IV による静脈内療法を中止し、経口 NEXIUM 20mg 療法を継続してください。
成人における内視鏡治療後の胃潰瘍または十二指腸潰瘍の再出血のリスク低減のための投与量
成人の推奨用量は、ネキシウム IV 80 mg を 30 分かけて静脈内注入し、続いて 8 mg/時の持続注入を 72 時間の合計治療時間で行うことです (つまり、最初の 30 分間の負荷量と 71.5 時間の持続投与を含みます)。注入)[参照 投薬と管理 ]。
静脈内療法は、出血性胃潰瘍または十二指腸潰瘍の急性初期管理のみを目的としており、完全な治療を構成するものではありません。治療の完全なコースの静脈内療法に続いて経口酸抑制療法を管理します。
肝障害に対する用量調節
EEを伴うGERD
重度の肝障害(Child-Pugh クラス C)の患者の場合、最大投与量は 1 日 1 回 20 mg です。 特定の集団での使用 ]。
成人における内視鏡治療後の胃潰瘍または十二指腸潰瘍の再出血のリスク低減
軽度から中等度の肝障害 (Child-Pugh クラス A および B) の患者には、80 mg を 30 分かけて静脈内注入し、続いて 6 mg/時を 71.5 時間持続注入しました。
重度の肝障害 (Child-Pugh クラス C) の患者には、80 mg を 30 分かけて静脈内注入し、続いて 4 mg/時を 71.5 時間持続注入 [参照 特定の集団での使用 ]。
EE を使用した GERD の準備および投与手順
NEXIUM 40mg IV を他の薬剤と同時に同じ静脈内部位および/またはチューブから投与しないでください。
経口制酸剤は、ネキシウム 20mg IV による治療中に使用することができます
成人患者では少なくとも 3 分間の静脈内注射
成人および小児患者における10分から30分にわたる静脈内注入
保管所
最終的な(希釈された)ネキシウム IV 溶液は、30°C(86°F)までの室温で保存し、以下の表 2 に記載されている指定期間内に投与してください。
成人の胃潰瘍または十二指腸潰瘍の再出血のリスクを軽減するための準備と投与の指示
NEXIUM 40mg IV を他の薬剤と同時に同じ静脈内部位および/またはチューブから投与しないでください。
ネキシウム IV による治療中に経口制酸薬を使用することがある
ローディング用量(80mg)
持続注入
保管所
- 最終的な(希釈された)ネキシウム IV 溶液は室温で 30°C(86°F)まで保存し、12 時間以内に投与してください。
供給方法
剤形と強度
注射用: 再構成用の単回用量バイアルに、白からオフホワイトの凍結乾燥粉末として 40 mg のエソメプラゾール。
保管と取り扱い
NEXIUM 20mg IV は、40mg のエソメプラゾールを含む再構成用の白色からオフホワイトの凍結乾燥粉末として単回投与バイアルで提供されます。
ネキシウム 40mg IV .次のように使用できます。
保管所
25°C (77°F) で保管してください。 15° から 30°C (59° から 86°F) まで許容されるエクスカーション。 [見る USP制御の室温 .] 光から守る。使用時までカートンで保管してください。
再構成および投与後、未使用のエソメプラゾール溶液を廃棄します [参照 投薬と管理 ]。
製造元: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. 改訂: 2022 年 3 月
副作用
次の重篤な有害反応は、以下およびラベルの他の場所で説明されています。
- 急性尿細管間質性腎炎 [参照 警告と注意事項 ]
- クロストリジウム・ディフィシル関連下痢[参照 警告と注意事項 ]
- 骨折 [参照 警告と注意事項 ]
- 重度の皮膚有害反応 [参照 警告と注意事項 ]
- 皮膚および全身性エリテマトーデス [参照 警告と注意事項 ]
- 低マグネシウム血症とミネラル代謝 [参照 警告と注意事項 ]
- 胃底ポリープ [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
症候性GERDおよびEE
大人
ネキシウム IV の安全性は、健康な被験者 (n=204) と胃潰瘍または十二指腸潰瘍の出血患者 (n=375) を含む 4 つの異なる集団で実施された臨床試験の結果に基づいています。以下のデータは、実薬対照試験における 359 人の患者における NEXIUM 20mg IV への曝露を反映しています: EE の病歴を伴うまたは伴わない症候性 GERD (n=199) および EE 患者 (n=160)。人口は 18 歳から 77 歳でした。 45%が男性、52%が白人、17%が黒人、3%がアジア人、28%がその他の人種です。ほとんどの患者は、点滴または注射のいずれかで 20 または 40 mg の用量を受け取りました。患者の少なくとも 1% で発生する有害反応を以下の表 3 に示します。
NEXIUM 20mg IV 20 および 40mg を注射または注入として静脈内投与すると、経口エソメプラゾールと同様の安全性プロファイルが得られることがわかりました。
小児科
生後 1 か月から 17 歳までの小児患者を対象に、NEXIUM IV を 1 日 1 回反復静脈内投与した場合の薬物動態を評価する無作為化非盲検多国間試験が実施されました [ 臨床薬理学 ]。安全性の結果は、エソメプラゾールの既知の安全性プロファイルと一致しており、予期しない安全性シグナルは確認されませんでした。
成人における胃潰瘍または十二指腸潰瘍の再出血のリスク低減
以下の表 4 に記載されているデータは、プラセボ対照試験で内視鏡的に確認された胃潰瘍または十二指腸潰瘍の出血を呈した 375 人の患者における NEXIUM 20mg IV への曝露を反映しています。人口は 18 歳から 98 歳でした。男性 68%、白人 87%、黒人 1%、アジア人 7%、その他の人種 4%。内視鏡的止血後、患者はプラセボまたは 80 mg のネキシウム IV を 30 分間にわたって静脈内注入され、続いて 8 mg/時の持続注入が合計 72 時間の治療期間にわたって行われました。最初の 72 時間後、すべての患者は 27 日間経口 PPI を受けました。
上記の注射部位反応を除いて、注射または注入として投与されたネキシウム 20mg IV による静脈内治療は、経口エソメプラゾールと同様の安全性プロファイルを有することが判明しました。
市販後の経験
エソメプラゾールの承認後の使用中に、次の副作用が確認されています。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
血液およびリンパ系の障害: 無顆粒球症、汎血球減少症;
目の病気: ぼやけた視界;
胃腸障害: 膵炎;口内炎;顕微鏡的大腸炎;胃底腺ポリープ;
肝胆道疾患: 肝不全、黄疸の有無にかかわらず肝炎;
免疫系障害: アナフィラキシー反応/ショック;全身性エリテマトーデス;
感染症と蔓延: 消化管カンジダ症;
代謝および栄養障害: 低マグネシウム血症(低カルシウム血症および/または低カリウム血症につながる可能性があります)[参照 警告と注意事項 ]、低ナトリウム血症;
筋骨格および結合組織障害: 筋力低下、筋肉痛、骨折;
神経系障害: 肝性脳症、味覚障害;
精神障害: 攻撃性、動揺、うつ病、幻覚;
腎および尿路疾患: 間質性腎炎;
生殖器系および乳房疾患: 女性化乳房;
呼吸器、胸部および縦隔の障害: 気管支痙攣;
皮膚および皮下組織の疾患: 脱毛症、多形紅斑、多汗症、光線過敏症、スティーブンス・ジョンソン症候群、中毒性表皮壊死融解症(TEN、致死的なものもある)、好酸球増多と全身症状を伴う薬物反応(DRESS)、急性汎発性発疹性膿疱症(AGEP)、皮膚エリテマトーデス。
オメプラゾールに関連する有害反応は、NEXIUM IV でも発生することが予想されます。完全な安全性情報については、経口オメプラゾールの完全な処方情報を参照してください。
薬物相互作用
表 5 および 6 には、エソメプラゾールと併用して投与した場合に臨床的に重要な薬物相互作用および診断薬との相互作用を伴う薬物と、それらを予防または管理するための指示が含まれています。
PPI との相互作用に関する詳細な情報を得るには、併用薬のラベルを参照してください。
警告
の一部として含まれています 予防 セクション。
予防
胃悪性腫瘍の存在
成人では、ネキシウム IV による治療に対する症候性反応は、胃の悪性腫瘍の存在を排除するものではありません。 PPIによる治療を完了した後、最適な反応が得られないか、初期に症状が再発した成人患者では、追加のフォローアップと診断テストを検討してください。高齢の患者では、内視鏡検査も検討してください。
急性尿細管間質性腎炎
急性尿細管間質性腎炎 (TIN) は、PPI を服用している患者で観察されており、PPI 治療中の任意の時点で発生する可能性があります。患者は、症候性過敏症反応から腎機能低下の非特異的症状(例、倦怠感、吐き気、食欲不振)まで、さまざまな徴候や症状を示すことがあります。報告された症例シリーズでは、一部の患者は生検で診断され、腎外症状(例、発熱、発疹、関節痛)がない状態で診断されました。 NEXIUM 20mg IV を中止し、急性 TIN が疑われる患者を評価する [参照 禁忌 ]。
クロストリジウム・ディフィシル関連下痢症
発表された観察研究は、ネキシウム 20mg IV のような PPI 療法が、特に入院患者において、クロストリジウム・ディフィシル関連下痢のリスク増加と関連している可能性があることを示唆しています。この診断は、下痢が改善しない場合に考慮する必要があります [参照 有害反応 ]。
患者は、治療する状態に適した最低用量と最短期間の PPI 療法を使用する必要があります。
骨折
いくつかの公開された観察研究は、プロトンポンプ阻害剤 (PPI) 療法が骨粗鬆症に関連した股関節、手首、または脊椎の骨折のリスク増加と関連している可能性があることを示唆しています。骨折のリスクは、高用量(1 日複数回の投与と定義)および長期の PPI 療法(1 年以上)を受けた患者で増加しました。患者は、治療する状態に適した最低用量と最短期間の PPI 療法を使用する必要があります。骨粗鬆症関連の骨折のリスクがある患者は、確立された治療ガイドラインに従って管理する必要があります[参照 投薬と管理 、 有害反応 ]。
重度の皮膚有害反応
PPI の使用に関連して、スティーブンス・ジョンソン症候群 (SJS) や中毒性表皮壊死融解症 (TEN)、好酸球増加症や全身症状を伴う薬物反応 (DRESS)、急性汎発性発疹性膿疱症 (AGEP) などの重度の皮膚副作用が報告されています。 [見る 有害反応 ]。重度の皮膚有害反応の最初の兆候または症状、または過敏症の他の兆候が見られた場合は、ネキシウム IV の投与を中止し、さらなる評価を検討してください。
皮膚および全身性エリテマトーデス
エソメプラゾールを含む PPI を服用している患者では、皮膚エリテマトーデス (CLE) および全身性エリテマトーデス (SLE) が報告されています。これらの事象は、既存の自己免疫疾患の新たな発症と悪化の両方として発生しています。 PPI 誘発性エリテマトーデスの症例の大部分は CLE でした。
PPI で治療された患者で報告された CLE の最も一般的な形態は亜急性 CLE (SCLE) であり、乳児から高齢者までの範囲の患者で継続的な薬物療法の後、数週間から数年以内に発生しました。一般に、組織学的所見は臓器の関与なしに観察されました。
全身性エリテマトーデス (SLE) は、PPI を投与されている患者では CLE ほど一般的ではありません。 PPI 関連の SLE は通常、非薬物誘発性 SLE よりも軽度です。 SLE の発症は、通常、主に若年成人から高齢者までの範囲の患者で、治療を開始してから数日から数年以内に発生しました。発疹を呈した患者の大部分。しかし、関節痛と血球減少症も報告されました。
医学的に指示されているよりも長い PPI の投与は避けてください。ネキシウム 20mg IV を投与されている患者に CLE または SLE と一致する徴候または症状が認められた場合は、薬剤の投与を中止し、評価のために適切な専門医に患者を紹介してください。ほとんどの患者は、4 ~ 12 週間で PPI のみを中止すると改善します。血清学的検査(例、ANA)は陽性である可能性があり、血清学的検査結果の上昇は、臨床症状よりも解消に時間がかかる場合があります。
クロピドグレルとの相互作用
NEXIUM IV とクロピドグレルの併用は避けてください。クロピドグレルはプロドラッグです。クロピドグレルによる血小板凝集の阻害は、完全に活性代謝物によるものです。クロピドグレルの活性代謝物への代謝は、CYP2C19 活性を阻害するエソメプラゾールなどの併用薬との併用によって損なわれる可能性があります。クロピドグレルと 40 mg のエソメプラゾールを併用すると、クロピドグレルの薬理活性が低下します。 NEXIUM IV を使用する場合は、代替の抗血小板療法を検討してください [ 薬物相互作用 ]。
低マグネシウム血症とミネラル代謝
症候性および無症候性の低マグネシウム血症は、ほとんどの場合、1 年間の治療後に、少なくとも 3 か月間 PPI で治療された患者でまれに報告されています。重篤な有害事象には、テタニー、不整脈、および発作が含まれます。低マグネシウム血症は、低カルシウム血症および/または低カリウム血症につながる可能性があり、リスクのある患者の潜在的な低カルシウム血症を悪化させる可能性があります。ほとんどの患者で、低マグネシウム血症の治療にはマグネシウムの補充と PPI の中止が必要でした。
長期の治療が予想される患者、またはジゴキシンなどの薬剤または低マグネシウム血症を引き起こす可能性のある薬剤(利尿薬など)と一緒に PPI を服用している患者の場合、医療専門家は、PPI 治療の開始前および定期的にマグネシウム濃度をモニタリングすることを検討してもよい [参照 有害反応 ]。
低カルシウム血症のリスクがある患者(副甲状腺機能低下症など)では、ネキシウム IV の開始前、および治療中は定期的にマグネシウムとカルシウムのレベルをモニタリングすることを検討してください。必要に応じて、マグネシウムやカルシウムを補給してください。低カルシウム血症が治療に抵抗性である場合は、PPI の中止を検討してください。
セントジョーンズワートまたはリファンピンとの相互作用
CYP2C19 または CYP3A4 を誘導する薬剤 (セントジョーンズワートまたはリファンピンなど) は、エソメプラゾール濃度を大幅に低下させることができます [参照 薬物相互作用 ]。ネキシウム 40mg IV とセントジョーンズワートまたはリファンピンの併用は避けてください。
神経内分泌腫瘍の診断調査との相互作用
血清クロモグラニン A (CgA) レベルは、薬物による胃酸の減少に続いて増加します。増加した CgA レベルは、神経内分泌腫瘍の診断調査で偽陽性の結果を引き起こす可能性があります。医療提供者は、CgA レベルを評価する少なくとも 14 日前にエソメプラゾール治療を一時的に中止し、最初の CgA レベルが高い場合はテストを繰り返すことを検討する必要があります。一連の試験を実施する場合(例:モニタリング用)、試験間の参照範囲が異なる可能性があるため、同じ商用試験所を試験に使用する必要があります [参照 薬物相互作用 ]。
メトトレキサートとの相互作用
文献によると、PPI とメトトレキサートの併用 (主に高用量。メトトレキサート処方情報を参照) は、メトトレキサートおよび/またはその代謝産物の血清レベルを上昇および延長させ、メトトレキサート毒性を引き起こす可能性があることを示唆しています。高用量のメトトレキサート投与では、一部の患者では PPI の一時的な中止が考慮される場合があります [ 薬物相互作用 ]。
胃底ポリープ
PPI の使用は、特に 1 年以上の長期使用に伴って増加する胃底腺ポリープのリスク増加と関連しています。胃底腺ポリープを発症したほとんどの PPI ユーザーは無症候性であり、内視鏡検査で偶発的に胃底腺ポリープが特定されました。治療中の状態に適した最短期間の PPI 療法を使用してください。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
エソメプラゾールの発がん性は、オメプラゾール研究を使用して評価されました。ラットにおける 24 か月の 2 つの経口発がん性試験では、1.7、3.4、13.8、44.0、および 140.8 mg/kg/日のオメプラゾール (体表面に表されるヒトの用量 40 mg/日の約 0.4 から 34 倍)面積ベース) 雄と雌の両方のラットで用量依存的に胃 ECL 細胞カルチノイドを産生した。この影響の発生率は、オメプラゾールの血中濃度が高い雌ラットで著しく高かった。胃カルチノイドは、未治療のラットではめったに発生しません。さらに、ECL 細胞の過形成は、両方の性別のすべての治療グループに存在しました。これらの研究の 1 つでは、メスのラットにオメプラゾール 13.8 mg/kg/日 (体表面積ベースでヒトの用量 40 mg/日の約 3.4 倍) を 1 年間投与し、その後さらに 1 年間、薬物を投与せずに追跡しました。 .これらのラットにはカルチノイドは見られませんでした。治療に関連した ECL 細胞過形成の発生率の増加が 1 年の終わりに観察されました (治療群 94% 対 対照群 10%)。 2 年目までに、治療ラットと対照ラットの差はかなり小さくなりました (46% 対 26%) が、それでも治療群ではより多くの過形成が見られました。胃腺癌が 1 匹のラット (2%) に見られた。 2 年間投与された雄または雌のラットに同様の腫瘍は見られませんでした。この系統のラットでは、歴史的に同様の腫瘍は記録されていませんが、1 つの腫瘍のみに関する発見は解釈が困難です。オメプラゾールの 78 週間経口マウス発がん性試験では、腫瘍発生の増加は示されませんでしたが、この試験は決定的なものではありませんでした。
エソメプラゾールは、Ames 突然変異試験、in vivo ラット骨髄細胞染色体異常試験、および in vivo マウス小核試験で陰性でした。しかし、エソメプラゾールは、in vitro ヒトリンパ球染色体異常試験で陽性でした。オメプラゾールは、in vitro ヒトリンパ球染色体異常試験、in vivo マウス骨髄細胞染色体異常試験、in vivo マウス小核試験で陽性であった。
エソメプラゾールの受胎能および生殖能力に対する潜在的な影響は、オメプラゾール研究を使用して評価されました。オメプラゾールは、ラットに 138 mg/kg/日までの経口用量 (体表面積ベースでヒトの用量 40 mg/日の約 34 倍) で、親動物の生殖能力に影響を与えないことがわかった。
特定の集団での使用
妊娠
リスクの概要
妊娠中の女性を対象としたエソメプラゾールの十分に管理された研究はありません。エソメプラゾールは、オメプラゾールの s-異性体です。利用可能な疫学的データは、妊娠初期のオメプラゾール使用による主要な先天性奇形またはその他の妊娠の有害転帰のリスク増加を実証していません。ラットとウサギの生殖研究では、オメプラゾールの用量依存性胚致死率は、ヒトの経口用量 40 mg の約 3.4 ~ 34 倍でした (体重 60 kg の人の体表面積に基づく)。
催奇形性は、ラットおよびウサギにエソメプラゾール マグネシウムを経口投与した動物生殖試験で観察されず、ヒトの経口投与量 40 mg の約 68 倍および 42 倍の用量で投与されました (60 kg の人の体表面積に基づく)。 .骨形態の変化は、妊娠中および授乳期のほとんどを通じて、ヒトの経口投与量 40 mg の約 34 倍以上の投与量で投与されたラットの子孫で観察されました。母体への投与が妊娠期間のみに限定された場合、どの年齢の子の骨端の形態にも影響はありませんでした ( データ )。
示された母集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2% ~ 4% および 15% ~ 20% です。
データ
ヒューマンデータ
エソメプラゾールは、オメプラゾールの S 異性体です。 4 つの疫学研究では、妊娠中にオメプラゾールを使用した女性から生まれた乳児の先天異常の頻度と、H2 受容体拮抗薬または他の対照にさらされた女性の乳児の異常の頻度を比較しました。
1995 年から 99 年までの妊娠の約 99% をカバーする、Swedish Medical Birth Registry からの集団ベースのレトロスペクティブ コホート疫学研究では、955 人の乳児 (824 人が最初の学期中に暴露され、そのうち 39 人が最初の学期を超えて暴露され、131 人がその後に暴露された) について報告された。妊娠中にオメプラゾールを使用した母親。子宮内でオメプラゾールに曝露され、奇形、低出生体重、低アプガースコア、または入院した乳児の数は、この集団で観察された数と同様でした.心室中隔欠損症で生まれた乳児の数と死産児の数は、オメプラゾールに曝露された乳児では、この集団で予想される数よりもわずかに高かった.

1996 年から 2009 年までのデンマークのすべての出生を対象とした人口ベースのレトロスペクティブ コホート研究では、母親が妊娠の最初の三半期にオメプラゾールを使用した 1,800 の出生と、母親がプロトン ポンプ阻害剤を使用しなかった 837,317 の出生が報告されました。妊娠初期にオメプラゾールに曝露された母親から生まれた乳児の先天性欠損症の全体的な割合は、妊娠初期にプロトンポンプ阻害剤に曝露されていない母親から生まれた乳児で2.9%および2.6%でした.
レトロスペクティブ コホート研究では、妊娠第 1 期に H2 遮断薬またはオメプラゾールのいずれかに暴露された 689 人の妊婦 (オメプラゾールに暴露された 134 人) と、妊娠第 1 期にいずれにも暴露されていない 1,572 人の妊婦が報告されました。 H2ブロッカーであるオメプラゾールに妊娠初期に曝露した、または曝露しなかった母親から生まれた子孫の全体的な奇形率は、それぞれ3.6%、5.5%、および4.1%でした。
小規模な前向き観察コホート研究では、妊娠中にオメプラゾールに暴露された 113 人の女性が追跡されました (妊娠初期の暴露では 89%)。主要な先天性奇形の報告された割合は、オメプラゾール群で 4%、非催奇形物質に暴露された対照群で 2%、および疾患を組み合わせた対照群で 2.8% でした。自然流産と選択的流産、早産、出産時の在胎週数、平均出生時体重の割合は、グループ間で同様でした。
いくつかの研究では、全身麻酔下で帝王切開の前投薬として 200 人以上の妊婦にオメプラゾールの経口または静脈内単回投与を行った場合、乳児に対する明らかな短期的な悪影響は報告されていません。
動物データ
オメプラゾール
138 mg/kg/日までの経口投与量(体表面積ベースでヒトの経口投与量 40 mg の約 34 倍)でオメプラゾールを使用し、ウサギで 69.1 mg/kg/日までの投与量でオメプラゾールを用いて実施された生殖試験(体表面積ベースで 40 mg のヒトの経口投与量の約 34 倍) は、器官形成中にオメプラゾールの催奇形性の可能性に関する証拠を開示していませんでした。ウサギでは、6.9 から 69.1 mg/kg/日の用量範囲のオメプラゾール (体表面積ベースでヒトの経口用量 40 mg の約 3.4 から 34 倍) を器官形成中に投与すると、胚致死率が用量依存的に増加した。胎児吸収、および妊娠の混乱。ラットでは、オメプラゾールを 13.8 ~ 138.0 mg/kg/日(体表面に 40 mg を経口投与した場合の約 3.4 ~ 34 倍)のオメプラゾールを親に投与した子孫に、用量依存的な胚/胎児毒性および出生後の発生毒性が観察された。面積ベース)、授乳期間を通じて交配前に投与されます。
エソメプラゾール
エソメプラゾール マグネシウムをラットに 280 mg/kg/日まで経口投与した場合(体表面積ベースでヒトの経口投与量 40 mg の約 68 倍)または器官形成中に投与される最大 86 mg/kg/日 (体表面積ベースでヒト用量の約 41 倍) までの経口用量。
骨の発達を評価するためのエンドポイントを追加したラットの出生前および出生後の発生毒性試験は、エソメプラゾール マグネシウムを 14 ~ 280 mg/kg/日の経口用量で実施しました (人体に対するヒトの経口用量 40 mg の約 3.4 ~ 68 倍)。表面積ベース)。新生児/生後早期 (出生から離乳) の生存率は、138 mg/kg/日以上の用量で減少しました (体表面積ベースでヒトの経口用量 40 mg の約 34 倍)。体重と体重増加は減少し、離乳直後の時間枠における神経行動または一般的な発達の遅延は、69 mg/kg/日以上の用量で明らかでした (体に 40 mg の経口ヒト用量の約 17 倍)。表面積ベース)。さらに、大腿骨の長さ、皮質骨の幅および厚さの減少、脛骨成長板の厚さの減少、および軽度から軽度の骨髄低細胞性が、14 mg/kg/日以上の用量で認められました (経口ヒトの約 3.4 倍)。体表面積ベースで40mgの用量)。 138 mg/kg/日以上の用量のエソメプラゾール マグネシウムを経口投与したラットの子孫で、大腿骨の骨端異形成が観察されました (体表面積ベースでヒトの経口用量 40 mg の約 34 倍)。
エソメプラゾール マグネシウムを 14 ~ 280 mg/kg/日 (ヒトの経口用量 40 mg の約 3.4 ~ 68 倍) の経口用量で投与した場合、妊娠中および授乳中のラットの出生前および出生後の毒性試験で、母体の骨への影響が観察されました。体表面積ベース)。ラットに妊娠 7 日から生後 21 日の離乳まで投与した場合、138 mg/kg/日以上の投与量で母体の大腿骨重量が最大 14% (プラセボ治療と比較して) 統計的に有意に減少したことが観察されました。 (体表面積ベースでヒトの経口投与量40mgの約34倍)。
エソメプラゾール ストロンチウムを用いたラットの出生前および出生後の発育研究 (エソメプラゾール マグネシウムの研究と比較して等モル用量を使用) では、上記のように、母動物と仔動物で同様の結果が得られました。
生後 2 日目から成体期までの子犬の骨の発達を評価するためのさらなる時点でのラットにおける追跡発生毒性研究が、280 mg/kg/日の経口用量のエソメプラゾール マグネシウムで実施されました (ヒトの経口用量 40 mg の約 68 倍)。エソメプラゾールの投与は、妊娠7日目または妊娠16日目から分娩までであった。母体への投与が妊娠期間のみに限定された場合、どの年齢の子孫でも骨端線の形態に影響はありませんでした。
授乳
リスクの概要
エソメプラゾールはオメプラゾールの S 異性体であり、限られたデータから、オメプラゾールが母乳中に存在する可能性があることが示唆されています。母乳で育てられた乳児または乳生産に対するエソメプラゾールの影響に関する臨床データはありません。母乳育児の発達上および健康上の利点は、ネキシウム 20mg に対する母親の臨床的必要性、およびネキシウムまたは母体の基礎疾患による母乳育児への潜在的な悪影響と併せて考慮する必要があります。
小児用
ネキシウム 20mg IV の安全性と有効性は、NEXIUM 40mg の経口投与が不可能または適切でない場合の経口療法の代替として、EE を伴う GERD の短期治療において生後 1 か月から 17 歳までの小児患者で確立されています。
この年齢層におけるネキシウム 40mg IV の使用は、成人の有効性を小児に外挿し、小児科と成人の曝露のマッチングに基づいて用量を選択したことに基づいており、以下の証拠によって裏付けられています。小児患者における注射用ネキシウム 20mg IV、b) 成人および小児患者の IV PK データを比較した母集団 PK モデルからの予測、c) 成人 IV および小児経口データから得られた曝露と薬力学的結果との関係、および d) PK の結果成人における NEXIUM 40mg IV の承認を裏付ける適切で十分に管理された研究 [参照 有害反応 、 臨床薬理学 、 臨床研究 ]。
NEXIUM IV の安全性と有効性は、EE による GERD の治療、または治療的内視鏡検査後の胃潰瘍または十二指腸潰瘍の再出血のリスク軽減について、生後 1 か月未満の患者では確立されていません。
幼獣データ
幼若ラットの毒性研究では、エソメプラゾールは、マグネシウム塩とストロンチウム塩の両方とともに、体表面積に基づいて、人間の 1 日用量 40 mg の約 34 ~ 68 倍の経口用量で投与されました。死亡率の増加は高用量で見られ、エソメプラゾールのすべての用量で、体重、体重増加、大腿骨重量および大腿骨長の減少、ならびに全体的な成長の減少が見られた[参照 非臨床毒性学 ]。
高齢者の使用
出血性胃潰瘍または十二指腸潰瘍患者の臨床試験では、NEXIUM IV に無作為に割り付けられた 375 人の患者の 52% が 65 歳以上でした。高齢者と若年者の間で安全性と有効性の全体的な違いは観察されず、NEXIUM 40mg IV と経口エソメプラゾールの他の報告された臨床経験では、高齢者と若年者の反応の違いは確認されていませんが、一部の高齢者の感受性が高いとは言えません。除外する。
肝障害
EEを伴うGERD
エソメプラゾールへの曝露は、肝機能が正常な患者と比較して、重度の肝障害 (Child-Pugh クラス C) の患者では大幅に増加しましたが、軽度から中等度の肝障害 (Child-Pugh クラス A および B) の患者では増加しませんでした [ 臨床薬理学 ]。
成人患者の場合、軽度から中等度の肝障害には用量調節は必要ありません。重度の肝障害のある患者の場合、推奨される最大投与量は 1 日 1 回 20 mg です。 投薬と管理 ]。
内視鏡治療後の胃潰瘍または十二指腸潰瘍の再出血のリスク低減
肝障害のある患者に持続静脈内投与として投与された NEXIUM 20mg の薬物動態データは入手できません。エソメプラゾールがエナンチオマーである静脈内オメプラゾールへの曝露は、正常な肝機能を持つ被験者と比較して、あらゆる程度の肝障害を持つ患者で増加しました[ 臨床薬理学 ]。
成人患者の場合、肝機能障害の程度にかかわらず、ネキシウム IV 80 mg の初回負荷量を調整する必要はありません。軽度から中等度の肝障害 (Child-Pugh クラス A および B) の患者では、持続注入の速度を 6 mg/時間に減らし、重度の肝障害 (Child-Pugh クラス C) の患者では 4 mg/時間に減らします [ 投薬と管理 ]。
過剰摂取
ネキシウム 40mg の意図的な過剰摂取(1 日 240mg を超える用量の限られた経験)に関連して説明されている症状は一時的なものです。ヒトにおけるオメプラゾールの過剰摂取の報告も関連する可能性があります。用量は 2,400 mg (通常の推奨臨床用量の 120 倍) までの範囲でした。症状はさまざまでしたが、混乱、眠気、かすみ目、頻脈、吐き気、発汗、紅潮、頭痛、口渇、および推奨用量で見られるものと同様のその他の有害反応が含まれていました.完全な安全性情報については、経口オメプラゾールの完全な処方情報を参照してください。エソメプラゾールに対する特異的な解毒剤は知られていません。エソメプラゾールは広くタンパク質に結合しているため、透析によって除去されるとは考えられません。過剰摂取の場合、治療は対症療法および支持療法でなければなりません。
過剰暴露が発生した場合は、毒物管理センター (1-800-222-1222) に電話して、中毒または過剰摂取の管理に関する最新情報を入手してください。
禁忌
- NEXIUM 20mg IV は、代用ベンズイミダゾールまたは製剤のいずれかの成分に対して既知の過敏症のある患者には禁忌です。過敏症反応には、アナフィラキシー、アナフィラキシーショック、血管性浮腫、気管支痙攣、急性尿細管間質性腎炎、蕁麻疹などがあります。 警告と注意事項 、 有害反応 ]。
- ネキシウム 20mg IV を含むプロトンポンプ阻害薬 (PPI) は、リルピビリン含有製品を受けている患者には禁忌です [ 薬物相互作用 ]。
臨床薬理学
作用機序
エソメプラゾールは、胃壁細胞の分泌面で H+/K+ ATPase 酵素系を特異的に阻害することによって胃酸分泌を抑制する、抗分泌性化合物である置換ベンズイミダゾールのクラスに属します。エソメプラゾールは、壁細胞の酸性コンパートメントでプロトン化および変換され、活性阻害剤であるアキラルなスルフェンアミドを形成します。この酵素系は胃粘膜内の酸 (プロトン) ポンプと見なされているため、エソメプラゾールは、酸産生の最終段階をブロックするという点で、胃酸ポンプ阻害剤として特徴付けられています。この効果は用量に関連しており、刺激に関係なく、基礎酸分泌と刺激酸分泌の両方を阻害します。
薬力学
抗分泌活動
健康な被験者の 24 時間胃内 pH に対するエソメプラゾールの効果は、表 7 に示すように、20 mg および 40 mg の NEXIUM 20 mg IV を 1 日 1 回 30 分間にわたって 5 日間静脈内注入する 2 つの研究で評価されました。
80 mg の NEXIUM.IV を 30 分間かけて静脈内注入し、続いて 8 mg/時を 23.5 時間持続注入した後の 24 時間の胃内 pH に対するエソメプラゾールの効果が、2 つの研究で評価されました。
ピロリ菌陰性の健康な白人被験者 (n=24) では、胃内 pH が > 6 および > 7 であった 24 時間以上 (95% CI) は、52.3% (40.3, 64.4) および 4.8% (1.8, 7.8)、それぞれ。
H. pylori 陽性 (n=8) および H. pylori 陰性 (n=11) の健康な中国人被験者では、胃内 pH が > 6 および > 7 のときの 24 時間にわたる時間の割合 (95% CI) は 53% でした ( 45.6, 60.3) と 15.1% (9.5, 20.7)。胃内 pH > 6 [59% vs. 47%] および pH > 7 [17% vs. 11%] の時間の割合は、H. pylori 陰性の被験者と比較して、H. pylori 陽性の被験者の方が大きい傾向がありました。
血清ガストリン効果
血清ガストリン濃度に対するエソメプラゾールの効果は、最大 8 週間の経口エソメプラゾールの臨床試験で約 2,700 人の患者と、最大 12 か月間治療を受けた 1,300 人以上の患者で評価されました。平均空腹時ガストリンレベルは用量依存的に増加しました。血清ガストリン濃度の増加は、治療後 2 ~ 3 か月以内にプラトーに達し、治療中止後 4 週間以内にベースライン レベルに戻りました。
ガストリンの増加は、腸クロム親和性細胞の過形成と血清クロモグラニン A (CgA) レベルの増加を引き起こします。上昇した CgA レベルは、神経内分泌腫瘍の診断調査で偽陽性の結果を引き起こす可能性があります [参照 警告と注意事項 ]。
腸クロム親和性 (ECL) 細胞効果
ECL 細胞に対するエソメプラゾールの静脈内投与の効果に関する利用可能なデータはありません。
ヒト胃生検標本は、長期臨床試験でオメプラゾールを経口投与された 3,000 人以上の患者 (子供と大人の両方) から得られました。これらの研究における ECL 細胞過形成の発生率は、時間とともに増加しました。しかし、これらの患者では、ECL 細胞カルチノイド、異形成、または腫瘍形成の症例は発見されていません。 非臨床毒性学 ]。
経口エソメプラゾール(10 mg、20 mg、または 40 mg/日)で最大 12 か月間治療された 1,000 人以上の患者において、ECL 細胞過形成の有病率は、時間と用量とともに増加しました。胃粘膜に ECL 細胞カルチノイド、異形成、または新形成を発症した患者はいなかった。
内分泌への影響
エソメプラゾールは、20 mg または 40 mg を 4 週間経口投与した場合、甲状腺機能に影響を与えませんでした。内分泌系に対するエソメプラゾールの他の影響は、オメプラゾールの研究で評価されました。オメプラゾール 30 mg または 40 mg/日を 2 ~ 4 週間経口投与しても、炭水化物代謝、副甲状腺ホルモン、コルチゾール、エストラジオール、テストステロン、プロラクチン、コレシストキニン、またはセクレチンの循環レベルに影響はありませんでした。
薬物動態
吸収
ネキシウム IV 20 mg および 40 mg を 1 日 1 回 30 分かけて 5 日間点滴静注した後の健常者におけるエソメプラゾールの薬物動態を表 8 に示します。
24 人の健康な被験者にネキシウム 40mg IV を 30 分間にわたって 80mg の負荷用量として静脈内投与した後、8mg/時を 23.5 時間 (合計 24 時間) 持続注入した後、エソメプラゾールの薬物動態パラメータ [幾何平均値(95% CI)] は次のとおりでした: AUCt 111.1 micromol*h/L (100.5、122.7 micromol*h/L)、Cmax 15.0 micromol/L (13.5、16.6 micromol/L)、および定常血漿濃度 (Css) 3.9マイクロモル/L(3.5、4.5マイクロモル/L)。健康な白人被験者の別の研究では、同じ治療レジメンが投与されました。
エソメプラゾールは CYP2C19 の時間依存的阻害剤であり、自己阻害と非線形薬物動態をもたらします。全身曝露は、エソメプラゾールの複数回経口投与後、用量に比例して増加します。最初の投与と比較して、1 日 1 回の投与後の定常状態での全身暴露 (Cmax および AUC0-24h) は、20 mg 投与量の最初の投与後と比較して、それぞれ 43% および 90% 増加し、95% 増加しました。 40 mg の用量では、それぞれ 159% です。
分布
エソメプラゾールは 97% が血漿タンパク質に結合しています。血漿タンパク質結合は、2 ~ 20 micromol/L の濃度範囲で一定です。健常者の定常状態での見かけの分布体積は約 16 L です。
排除
代謝
エソメプラゾールは、シトクロム P450 (CYP) 酵素系によって肝臓で広範囲に代謝されます。エソメプラゾールの代謝物には、抗分泌活性がありません。エソメプラゾールの代謝の大部分は、ヒドロキシおよびデスメチル代謝産物を形成する CYP2C19 イソ酵素に依存しています。残りの量は、スルホン代謝産物を形成する CYP3A4 に依存します。
排泄
エソメプラゾールは、主に尿中に代謝物として排泄されますが、糞便中にも排泄されます。親薬物の 1% 未満が尿中に排泄されます。エソメプラゾールは血漿から完全に除去され、1 日 1 回の投与で蓄積はありません。ネキシウム IV の静脈内投与後のエソメプラゾールの血漿消失半減期は、約 1.1 ~ 1.4 時間であり、用量の増加とともに延長されます。
血漿クリアランス (CL) は、NEXIUM 40mg IV を 30 分間かけて 80 mg を静脈内注入し、続いて 8 mg/h を 23.5 時間持続注入した場合、約 5.9 ~ 7.2 L/h です。
特定の集団
高齢患者
エソメプラゾールの AUC 値と Cmax 値は、定常状態の若い被験者と比較して、高齢者の方がわずかに高かった (それぞれ 25% と 18%)。この曝露の増加は、臨床的に関連しているとは考えられていません。
小児患者
エソメプラゾールの薬物動態は、ネキシウム 20 mg の無作為化、非盲検、多国間、反復投与試験で、出生から 17 歳までの 50 人の小児患者 (うち 44 人の小児患者は生後 1 か月から 17 歳まで) で評価されました。 1 日 1 回 3 分間の静脈内注射として 40mg IV を投与。エソメプラゾールの血漿 AUC 値は、成人と比較して、6 ~ 11 歳および 12 ~ 17 歳の小児患者でそれぞれ 183% および 60% 高かった。
その後の薬物動態分析では、以下の投薬レジメンが 1 日 1 回 20 mg のネキシウム IV を投与された成人患者で観察されたものに匹敵する定常状態の血漿曝露 (AUC0-24) を達成すると予測されました。 1 歳から 17 歳までの体重が 55 kg 未満の小児患者には 10 mg を 1 日 1 回、1 歳から 17 歳までの体重が 55 kg 以上の小児患者には 20 mg を 1 日 1 回。注入時間を 3 分から 10 分または 30 分に延長すると、40 mg および 20 mg のネキシウム IV 用量で成人患者に観察された値に匹敵する定常状態の Cmax 値が得られると予測されました [ 特定の集団での使用 ]。
男性と女性の患者
エソメプラゾールの AUC および Cmax 値は、経口投与した場合、定常状態で男性よりも女性でわずかに高かった (13%)。エソメプラゾールの静脈内投与についても同様の違いが見られました。この曝露の増加は、臨床的に関連しているとは考えられていません。
腎障害のある患者
エソメプラゾールの 1% 未満が変化せずに尿中に排泄されるため、腎臓障害のある患者におけるエソメプラゾールの薬物動態は、健康な被験者と比較して変化するとは予想されません。
肝障害のある患者
軽度(Child-Pugh クラス A)、中等度(Child-Pugh クラス B)、および重度(Child-Pugh クラス C)の肝障害を持つ患者 4 人に 40 mg を 1 日 1 回経口投与した後に得られたエソメプラゾールの定常状態の薬物動態は、肝機能が正常な 36 人の男性および女性の GERD 患者で得られたものと比較した。軽度および中等度の肝機能障害の患者では、AUC は正常な肝機能の患者で期待できる範囲内でした。重度の肝障害のある患者では、AUC は正常な肝機能の患者よりも 2 ~ 3 倍高かった。 [見る 特定の集団での使用 ]。
肝障害のある患者に持続静脈内投与されたエソメプラゾールの薬物動態データはありません。軽度(Child-Pugh クラス A; n=5)、中等度(Child-Pugh クラス B; n=4)および重度 (Child-Pugh クラス C; n=3) の肝障害が、24 人の男性および女性の健康な被験者で得られたものと比較されました。軽度および中等度の肝障害を持つ患者では、オメプラゾールのクリアランスと定常状態の血漿濃度は、健康な被験者よりもそれぞれ約 35% 低く、50% 高かった。重度の肝障害のある患者では、オメプラゾールのクリアランスは健常者の 50% であり、定常状態の血漿濃度は健常者の 2 倍でした [参照 特定の集団での使用 ]。
薬物相互作用研究
他の薬剤に対するエソメプラゾール/オメプラゾールの効果
in vitro および in vivo の研究では、エソメプラゾールが CYP 1A2、2A6、2C9、2D6、2E1、および 3A4 を阻害する可能性は低いことが示されています。
抗レトロウイルス薬
リルピビリン、アタザナビル、ネルフィナビルなどの一部の抗レトロウイルス薬では、オメプラゾールと一緒に投与すると血清濃度の低下が報告されている[参照 薬物相互作用 ]。
リルピビリン
リルピビリン(毎日 150 mg)とオメプラゾール(毎日 20 mg)を複数回投与した後、リルピビリンでは AUC が 40%、Cmax が 40%、Cmin が 33% 減少した [参照 禁忌 ]。
ネルフィナビル
ネルフィナビル (1250 mg、1 日 2 回) とオメプラゾール (1 日 40 mg) の複数回投与後、AUC は 36% と 92% 減少し、Cmax は 37% と 89% 減少し、Cmin はネルフィナビルと M8 でそれぞれ 39% と 75% 減少しました。 .
アタザナビル
アタザナビル (毎日 400 mg) とオメプラゾール (毎日 40 mg、アタザナビルの 2 時間前) の複数回投与後、AUC は 94%、Cmax は 96%、Cmin は 95% 減少しました。
サキナビル
サキナビル/リトナビル (1000/100 mg) を 15 日間、1 日 2 回、11 日から 15 日目にオメプラゾール 40 mg を 1 日 2 回同時投与した後、AUC は 82%、Cmax は 75%、Cmin は 106% 増加しました。この相互作用の背後にあるメカニズムは完全には解明されていません。
クロピドグレル
クロスオーバー研究では、健康な被験者にクロピドグレル (負荷用量 300 mg、その後 28 日間の維持用量として 1 日あたり 75 mg) を単独で投与し、エソメプラゾール (クロピドグレルと同時に 1 日 1 回 40 mg を経口投与) を 29 日間投与しました。クロピドグレルとエソメプラゾールを一緒に投与した場合、クロピドグレルの活性代謝物への曝露は、この期間にわたって35%から40%減少しました。薬力学的パラメーターも測定され、血小板凝集の阻害の変化がクロピドグレル活性代謝物への曝露の変化に関連していることが実証された[参照 警告と注意事項 、 薬物相互作用 ]。
ミコフェノール酸モフェチル
オメプラゾール 20 mg を 1 日 2 回 4 日間投与し、オメプラゾールの最後の投与の約 1 時間後に 1000 mg の MMF を 1 回投与したクロスオーバー試験では、12 人の健康な被験者に Cmax が 52% 減少し、23% が減少しました。 MPA の AUC [参照 薬物相互作用 ]。
シロスタゾール
オメプラゾールは CYP2C19 の阻害剤として作用します。クロスオーバー試験で 20 人の健康な被験者に 1 週間、毎日 40 mg の用量で投与されたオメプラゾールは、シロスタゾールの Cmax と AUC をそれぞれ 18% と 26% 増加させました。シロスタゾールの 4 ~ 7 倍の活性を持つ活性代謝物の 1 つである 3,4-ジヒドロシロスタゾールの Cmax と AUC は、それぞれ 29% と 69% 増加しました。シロスタゾールとオメプラゾールの同時投与は、シロスタゾールと上記の活性代謝物の濃度を増加させると予想される[ 薬物相互作用 ]。
ジアゼパム
エソメプラゾール 30 mg と CYP2C19 基質であるジアゼパムの同時投与により、ジアゼパムのクリアランスが 45% 減少しました。ジアゼパムの血漿レベルの上昇は、投与後 12 時間以降に観察されました。しかし、当時、ジアゼパムの血漿中濃度は治療間隔を下回っていたため、この相互作用が臨床的に関連する可能性は低い.
ジゴキシン
健康な被験者にオメプラゾール 20 mg を 1 日 1 回投与し、ジゴキシンを併用投与すると、ジゴキシンのバイオアベイラビリティが 10% 増加しました (被験者 2 人で 30%) [参照 薬物相互作用 ]。
その他の薬
エソメプラゾールといずれかのナプロキセン (非選択的 NSAID) の同時投与では、これらの NSAID の薬物動態プロファイルに臨床的に関連する変化は確認されませんでした。
エソメプラゾール/オメプラゾールに対する他の薬剤の効果
セントジョーンズワート
12 人の健康な男性被験者を対象としたクロスオーバー研究では、セントジョーンズワート (300 mg を 1 日 3 回、14 日間) は、CYP2C19 代謝不良者のオメプラゾールの全身暴露を有意に減少させました (Cmax および AUC は 37.5% および 37.9% 減少しました)。 %) および高代謝者 (Cmax および AUC はそれぞれ 49.6% および 43.9% 減少) [参照 薬物相互作用 ]。
ボリコナゾール
オメプラゾールとボリコナゾール (CYP2C19 と CYP3A4 の複合阻害剤) の同時投与により、オメプラゾール曝露が 2 倍以上になりました。健康な被験者にボリコナゾール (400 mg を 12 時間ごとに 1 日、その後 200 mg を 1 日 1 回、6 日間) をオメプラゾール (40 mg を 1 日 1 回、7 日間) とともに投与した場合、オメプラゾールの定常状態の Cmax および AUC0-24有意に増加: ボリコナゾールなしでオメプラゾールを投与した場合と比較して、それぞれ平均 2 倍 (90% CI: 1.8、2.6) および 4 倍 (90% CI: 3.3、4.4) 薬物相互作用 ]。
その他の薬
エソメプラゾールと経口避妊薬、ジアゼパム、フェニトイン、キニジン、ナプロキセン(非選択的 NSAID)との同時投与は、エソメプラゾールの薬物動態プロファイルを変化させないようでした。
微生物学
消化管微生物生態への影響
プロトンポンプ阻害剤を含む何らかの手段による胃酸の減少は、胃腸管に通常存在する細菌の胃内数を増加させます.プロトンポンプ阻害剤による治療は、サルモネラ菌やカンピロバクターなどの胃腸感染症のリスクをわずかに増加させる可能性があり、入院患者ではクロストリジウム・ディフィシルも発生する可能性があります.
ファーマコゲノミクス
多型酵素であるCYP2C19は、エソメプラゾールの代謝に関与しています。 CYP2C19*1 対立遺伝子は完全に機能しますが、CYP2C19*2 および *3 対立遺伝子は機能しません。酵素機能がない、または酵素機能の低下に関連する他の対立遺伝子があります。 2 つの完全に機能する対立遺伝子を持つ患者は高代謝型であり、2 つの機能喪失型対立遺伝子を持つ患者は低代謝型です。エソメプラゾールへの全身暴露は、患者の代謝状態によって異なります: 低代謝者 > 中間代謝者 > 高代謝者.白人の約 3%、アジア人の 15 ~ 20% が CYP2C19 の代謝不良者です。
エソメプラゾールの全身暴露は、CYP2C19 の高代謝者 (EM; n=17) と比較して、CYP2C19 中間代謝者 (IM; n=6) でわずかに高かった (約 17%)。 7 EM と 11 IM を含む中国人の健康な被験者の研究では、これらの遺伝子型全体で同様の薬物動態の違いが認められました。これらの研究から得られる代謝不良者 (PM) の薬物動態に関する情報は非常に限られています。
NEXIUM 40mg IV 40mg を 1 日 1 回投与した後の定常状態では、残りの集団 (EM) の AUC に対する代謝不良者の AUC の比率は約 1.5 です。この曝露の変化は、臨床的に意味があるとは見なされません。
動物毒物学および/または薬理学
生殖研究
ラットでは最大 280 mg/kg/日(体表面積ベースでヒトの経口投与量 40 mg の約 68 倍)の経口投与量でラットを使用し、経口投与量は最大 86 mg/kg/日でウサギを使用して生殖試験を実施しました。 (体表面積ベースでヒトの経口投与量 40 mg の約 42 倍) であり、エソメプラゾールによる受胎能障害または胎児への害の証拠は明らかにされていません [参照 特定の集団での使用 ]。
幼若動物研究
14 日間の回復期を伴う 28 日間の毒性試験が、エソメプラゾール マグネシウムを 70 ~ 280 mg/kg/日 (体表に 40 mg のヒトの 1 日経口投与量の約 17 ~ 68 倍) の用量で幼若ラットで実施されました。面積ベース)。幼若ラットに生後 7 日から生後 35 日までエソメプラゾールマグネシウムを投与した場合、280 mg/kg/日の高用量で死亡数の増加が観察されました。 1 日 (体表面積ベースでヒトの 1 日経口投与量 40 mg の約 34 倍)、治療に関連した体重の減少 (約 14%) と体重増加、大腿骨の重量と大腿骨の長さの減少、および全体的な影響成長。エソメプラゾールの等モル用量で、別のエソメプラゾール塩であるエソメプラゾールストロンチウムを用いたこの研究でも、上記の同等の所見が観察された。
臨床研究
GERDの酸抑制
びらん性食道炎の有無にかかわらず GERD の症状を有する 206 人の患者における胃酸抑制に対する静脈内または経口投与後のエソメプラゾールの薬力学的効果を比較するために、4 つの多施設非盲検 2 期間クロスオーバー研究が実施されました。患者は無作為に 20 mg または 40 mg の NEXIUM 40 mg IV または経口エソメプラゾールを 1 日 1 回 10 日間 (期間 1) 投与され、その後、期間 2 で別の製剤に 10 日間切り替えられ、期間 1 からのそれぞれの用量に一致しました。 NEXIUM 40mg IV 20mg および 40mg は、2 つの研究では 3 分間の注射として、他の 2 つの研究では 15 分間の点滴として投与されました。
患者集団は 18 歳から 72 歳までの範囲でした。 54% が女性でした。白人 53%、黒人 24%、アジア人 5%、その他の人種 17%。基礎酸排出量(BAO)および最大酸排出量(MAO)は、期間1、11日目の投与後22~24時間で測定されました。期間 2、3 日目。 BAO および MAO は、6.0 mcg/kg のペンタガストリンの皮下注射の前後 (それぞれ) の胃内容物の 1 時間連続収集から推定されました。
これらの研究では、1 日 1 回投与の 10 日間後、NEXIUM IV 20 mg および 40 mg は、これらの GERD 患者の BAO および MAO を抑制する能力において、エソメプラゾールの対応する経口投与量と同様でした (以下の表 9 を参照)。
静脈内投与と経口投与を切り替えても、酸抑制に大きな変化はありませんでした。
出血性胃潰瘍または十二指腸潰瘍
無作為化、二重盲検、プラセボ対照臨床試験が、内視鏡検査で確認された胃潰瘍または十二指腸潰瘍出血を呈した 764 人の患者で実施されました。人口は 18 歳から 98 歳でした。 68% が男性、87% が白人、1% が黒人、7% がアジア人、4% がその他の人種でした。内視鏡的止血後、患者はプラセボまたは NEXIUM IV 80 mg の 30 分間にわたる静脈内注入に無作為に割り付けられ、続いて 8 mg/時の持続注入が合計 72 時間行われました。最初の 72 時間後、すべての患者は 27 日間経口 PPI を受けました。無作為化から 3 日以内の再出血の発生率は、プラセボ群の 10.3% と比較して、NEXIUM 20mg IV 治療群で 5.9% でした (治療差 -4.4%; 95% 信頼区間: -8.3%, -0.6%; p=0.03 )。この治療の違いは、すべての患者が経口 PPI を受けていた 7 日目と 30 日目に観察されたものと同様でした。
香港で実施された無作為化二重盲検プラセボ対照単施設試験でも、ラセミ体オメプラゾールを投与された出血性胃潰瘍または十二指腸潰瘍患者の 72 時間以内の再出血のリスクがプラセボと比較して減少したことが示されました。 S-鏡像異性体エソメプラゾール。
患者情報
有害反応
以下に一致する徴候または症状を経験した場合は、医療提供者に報告するよう患者に助言します。
- 過敏反応 [参照 禁忌 ]
- 急性尿細管間質性腎炎 [参照 警告と注意事項 ]
- クロストリジウム・ディフィシル関連下痢[参照 警告と注意事項 ]
- 骨折 [参照 警告と注意事項 ]
- 重度の皮膚有害反応 [参照 警告と注意事項 ]。
- 皮膚および全身性エリテマトーデス [参照 警告と注意事項 ]
- 低マグネシウム血症とミネラル代謝 [参照 警告と注意事項 ]
薬物相互作用
以下のいずれかの治療を開始する前に、医療提供者に報告するよう患者に助言してください。
- リルピビリン含有製品 [参照 禁忌 ]
- クロピドグレル [参照 警告と注意事項 ]
- セントジョンズワートまたはリファンピン [参照 警告と注意事項 ]
- 高用量メトトレキサート [参照 警告と注意事項 ]
管理
- NEXIUM 40mg IV を服用している間は、制酸剤を使用できることを患者に伝えてください。
