Micardis 20mg, 40mg, 80mg Telmisartan 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
ミカルディス 40mg とは何ですか? どのように使用されますか?
ミカルディスは、高血圧の症状を治療し、脳卒中や心臓発作などの心血管疾患のリスクを軽減するために使用される処方薬です。ミカルディス 20mg は、単独で使用することも、他の薬と併用することもできます。
ミカルディス 80mg は、ARB と呼ばれる薬物のクラスに属します。
ミカルディスが 18 歳未満の子供に安全で有効であるかどうかはわかっていません。
ミカルディスの副作用の可能性は何ですか?
ミカルディス 80mg は、次のような重大な副作用を引き起こす可能性があります。
- 立ちくらみ、
- 腫れ、
- 急激な体重増加、
- 吐き気、
- 弱点、
- ピリピリ感、
- 胸痛、
- 不規則な心拍、および
- 動きの喪失
上記の症状がある場合は、すぐに医療機関を受診してください。
ミカルディスの最も一般的な副作用は次のとおりです。
- 鼻づまり、
- 副鼻腔の痛み、
- 背中の痛みと
- 下痢
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、ミカルディスの考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
胎児毒性
- 妊娠が判明したら、速やかにミカルディス 40mg を中止してください。 警告と注意事項 と 特定の集団での使用 ]。
- レニン-アンギオテンシン系に直接作用する薬は、発育中の胎児に損傷や死を引き起こす可能性があります[参照 警告と注意事項 と 特定の集団での使用 ]。
説明
ミカルディス 40mg は、非ペプチド性アンギオテンシン II 受容体(AT1 型)拮抗薬です。
テルミサルタンは化学的に 4'-[(1,4'-ジメチル-2'-プロピル [2,6'-ビ-1H-ベンズイミダゾール]-1'-イル)メチル]-[1,1'-ビフェニル]-2-カルボン酸。実験式は C33H30N4O2、分子量は 514.63、構造式は次のとおりです。
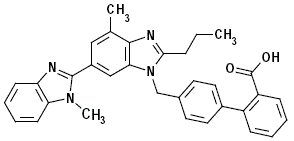
テルミサルタンは白色からわずかに黄色がかった固体です。水にほとんど溶けず、pH 3 ~ 9 の範囲で、強酸にやや溶けにくく(塩酸に溶けない場合を除く)、強塩基に溶けます。
MICARDIS 20mg は、20mg、40mg、または 80mg のテルミサルタンを含む経口投与用の錠剤として入手できます。錠剤には、次の不活性成分が含まれています: 水酸化ナトリウム、メグルミン、ポビドン、ソルビトール、およびステアリン酸マグネシウム。 MICARDIS 錠は吸湿性があり、湿気から保護する必要があります。
適応症
MICARDIS HCT (テルミサルタンとヒドロクロロチアジド) は、血圧を下げるための高血圧の治療に適応されます。血圧を下げると、主に脳卒中や心筋梗塞などの致命的および非致命的な心血管イベントのリスクが低下します。これらの利点は、この薬が主に属するクラスを含む、さまざまな薬理学的クラスの降圧薬の対照試験で見られました。 MICARDIS HCT によるリスク低減を示す対照試験はありません。
高血圧の管理は、必要に応じて、脂質管理、糖尿病管理、抗血栓療法、禁煙、運動、およびナトリウム摂取制限を含む包括的な心血管リスク管理の一部であるべきです。多くの患者は、血圧目標を達成するために複数の薬を必要とします。目標と管理に関する具体的なアドバイスについては、国立高血圧教育プログラムの高血圧の予防、検出、評価、および治療に関する合同全国委員会 (JNC) のガイドラインなど、公開されているガイドラインを参照してください。
さまざまな薬理学的クラスから、作用機序の異なる多数の降圧薬が無作為対照試験で示され、心血管疾患の罹患率と死亡率を低下させることが示されています。これらの利点の大部分を担っているのは薬です。最大かつ最も一貫した心血管転帰の利点は、脳卒中のリスクの低下ですが、心筋梗塞と心血管死亡率の低下も定期的に見られています.
収縮期圧または拡張期圧の上昇は心血管リスクの増加を引き起こし、mmHg あたりの絶対リスク増加は血圧が高いほど大きくなるため、重度の高血圧をわずかに低下させるだけでもかなりの利益が得られます。血圧低下による相対リスク低下は、絶対リスクが異なる集団全体で類似しているため、高血圧とは無関係にリスクが高い患者 (たとえば、糖尿病や高脂血症の患者) では絶対的利益が大きくなり、そのような患者は、より積極的な治療により、より低い血圧の目標を達成することができます。
一部の降圧薬は、黒人患者では(単剤療法として)血圧への影響が小さく、多くの降圧薬には追加の承認された適応症と効果があります(例、狭心症、心不全、または糖尿病性腎疾患)。これらの考慮事項は、治療法の選択の指針となる場合があります[参照 臨床研究 ]。
MICARDIS 40mg HCT は、高血圧治療の初期治療には適応されません [参照 投薬と管理 ]。
MICARDIS HCT は、単独で使用することも、他の降圧薬と組み合わせて使用することもできます。
投薬と管理
投与情報
血圧が十分にコントロールされていない患者には、テルミサルタン 80 mg を MICARDIS 40 mg HCT で 80 mg/12.5 mg を 1 日 1 回投与して開始します。必要に応じて、2 ~ 4 週間後に 160 mg/25 mg まで増量できます。
血圧が 1 日 1 回 25 mg のヒドロクロロチアジドで適切にコントロールされていない患者、またはコントロールされているが、このレジメンで低カリウム血症を経験している患者には、1 日 1 回の MICARDIS HCT 80 mg/12.5 mg で開始します。必要に応じて、2 ~ 4 週間後に 160 mg/25 mg まで増量できます。
個々の成分(テルミサルタンとヒドロクロロチアジド)で用量調整された患者は、代わりに対応する用量の MICARDIS 20mg HCT を投与される場合があります。
MICARDIS 20mg HCT は、他の降圧薬と併用して投与することができます。
肝障害に対する用量調整
40 mg/12.5 mg の組み合わせを使用して、綿密な医学的監督の下で、胆道閉塞性障害または肝不全の患者を開始します。 MICARDIS 40mg HCT 錠剤は、重度の肝障害のある患者には推奨されません [参照 特定の集団での使用 と 臨床薬理学 ]。
重要な管理手順
MICARDIS HCT 錠は、投与直前まで水ぶくれから取り出さないでください。
供給方法
剤形と強度
- 40 mg/12.5 mg、ベーリンガーインゲルハイムのロゴと H4 のマークが付いた赤と白の錠剤
- 80mg/12.5mg、ベーリンガーインゲルハイムのロゴとH8が記された赤と白の錠剤
- 80mg/25mg、ベーリンガーインゲルハイムのロゴとH9のマークが付いた黄色と白色の錠剤
保管と取り扱い
MICARDIS 20mg HCT は、テルミサルタンとヒドロクロロチアジドを含む、両凸 2 層の楕円形のコーティングされていない錠剤として、3 つの強度で利用できます。
- 40mg/12.5mg錠: ベーリンガーインゲルハイムの企業シンボルとH4でマークされた赤と白(赤い斑点が含まれる場合があります)。 3 x 10 カードとして 30 錠のカートンに個別にブリスター シール ( NDC 0597-0043-37)
- 80mg/12.5mg錠: ベーリンガーインゲルハイムの企業シンボルとH8でマークされた赤と白(赤い斑点が含まれる場合があります)。 3 x 10 カードとして 30 錠のカートンに個別にブリスター シール ( NDC 0597-0044-37)
- 80mg/25mg錠: 黄色と白 (黄色の斑点を含む場合があります) には、Boehringer Ingelheim の企業シンボルと H9 がマークされています。 3 x 10 カードとして 30 錠のカートンに個別にブリスター シール ( NDC 0597-0042-37)
保管所
25°C (77°F) で保管してください。 15°C ~ 30°C (59°F ~ 86°F) まで許容されるエクスカーション [USP 制御室温を参照]。錠剤は、投与直前までブリスターから取り出さないでください。
販売元: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 USA.改訂: 2018 年 10 月
副作用
次の有害反応は、ラベルの他の場所で説明されています。
- 低血圧 [参照 警告と注意事項 ]
- 腎障害 [参照 警告と注意事項 ]
- 電解質と代謝障害 [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用の発生率を別の医薬品の臨床試験で観察された発生率と直接比較することはできず、実際に観察された発生率を反映していない可能性があります。
MICARDIS HCT は 1,700 人以上の患者で安全性が評価されており、そのうち 716 人は 6 か月以上、420 人は 1 年以上高血圧治療を受けています。有害反応は、テルミサルタンおよび/またはヒドロクロロチアジドで以前に報告されたものに限定されています。
テルミサルタン/ヒドロクロロチアジドで治療された患者で2%以上の発生率で発生し、プラセボで治療された患者よりも高い率で発生する有害反応を表1に示します[ 臨床研究 ]。
テルミサルタン/ヒドロクロロチアジドで観察されたその他の有害反応は、痛み (背中と腹部を含む)、消化不良、紅斑、嘔吐、気管支炎、咽頭炎でした。
有害反応は、男性と女性、年配の患者と若い患者、黒人と非黒人の患者でほぼ同じ割合で発生しました。
テルミサルタン
テルミサルタンで報告されたその他の有害事象を以下に示します。
自律神経系: インポテンツ、発汗の増加、潮紅
全身: アレルギー、発熱、足の痛み、胸の痛み
心臓血管: 動悸、狭心症、心電図異常、高血圧、末梢浮腫
中枢神経系: 不眠症、傾眠、片頭痛、感覚異常、不随意筋収縮、感覚鈍麻
胃腸: 鼓腸、便秘、胃炎、口渇、痔、胃食道逆流、歯痛
肝胆道: 肝酵素または血清ビリルビンの上昇
代謝: 痛風、高コレステロール血症、糖尿病
筋骨格: 関節炎、関節痛、足のけいれん、筋肉痛
精神的: 不安、抑うつ、緊張
抵抗メカニズム: 感染症、膿瘍、中耳炎
呼吸器: 喘息、鼻炎、呼吸困難、鼻出血
肌: 皮膚炎、湿疹、かゆみ
尿: 頻尿、膀胱炎
血管: 脳血管障害
特別な感覚: 異常視力、結膜炎、耳鳴り、耳痛
ヒドロクロロチアジド
ヒドロクロロチアジドで報告されたその他の有害事象を以下に示します。
全身: 弱点
消化器: 膵炎、黄疸(肝内胆汁うっ滞性黄疸)、唾液腺炎、けいれん、胃の刺激
血液学: 再生不良性貧血、無顆粒球症、白血球減少症、溶血性貧血、血小板減少症
過敏症: 紫斑、光線過敏症、蕁麻疹、壊死性血管炎(血管炎および皮膚血管炎)、発熱、肺炎および肺水腫を含む呼吸困難、アナフィラキシー反応
代謝: 高血糖、糖尿
筋骨格: 筋けいれん
神経系/精神医学: 落ち着きのなさ
腎臓: 間質性腎炎
肌: スティーブンス・ジョンソン症候群を含む多形紅斑、中毒性表皮壊死融解症を含む剥脱性皮膚炎
特別な感覚: 一過性のかすみ目、黄視症
臨床検査所見
クレアチニン、血中尿素窒素 (BUN)
対照試験でミカルディス80mg HCT錠で治療された本態性高血圧患者のBUN(≧11.2mg/dL)と血清クレアチニン(≧0.5mg/dL)の増加が、それぞれ2.8%と1.4%で観察されました。 BUNまたはクレアチニンの増加のために、ミカルディス80mg HCT錠による治療を中止した患者はいなかった[参照 警告と注意事項 ]。
市販後の経験
MICARDIS HCTの承認後の使用中に、次の副作用が確認されました。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
血液およびリンパ系の障害: 好酸球増加症
心疾患: 心房細動、うっ血性心不全、心筋梗塞、頻脈、徐脈
耳と迷路の障害: めまい
一般的な障害および投与部位の状態: 無力症、浮腫
肝胆道: 肝機能異常・肝障害
免疫系障害: アナフィラキシー反応
感染症と蔓延: 尿路感染
調査: CPKの増加
代謝および栄養障害: 低血糖(糖尿病患者)
筋骨格および結合組織障害: 腱痛(腱鞘炎、腱鞘炎を含む)、横紋筋融解症
神経系障害: 失神、頭痛
腎および尿路疾患: 腎不全、急性腎不全を含む腎障害
生殖器系および乳房疾患: 勃起不全
呼吸器、胸部および縦隔の障害: 咳
皮膚および皮下組織の疾患: 薬疹(主に皮疹、発疹、蕁麻疹として報告される有毒な皮膚の発疹)、血管性浮腫(致命的な結果を伴う)
血管障害: 起立性低血圧
薬物相互作用
血清カリウムを増加させる薬剤
テルミサルタンと血清カリウム値を上昇させる他の薬剤との同時投与は、高カリウム血症を引き起こす可能性があります。そのような患者では血清カリウムをモニターしてください。
リチウム
テルミサルタンを含むサイアザイド利尿薬またはアンギオテンシン II 受容体拮抗薬の併用により、血清リチウム濃度およびリチウム毒性の増加が報告されています。 MICARDIS 80mg HCT とリチウムを投与されている患者のリチウム濃度を監視します。
選択的シクロオキシゲナスE-2阻害剤を含む非ステロイド性抗炎症剤
テルミサルタン
選択的シクロオキシゲナーゼ-2阻害剤(COX-2阻害剤)を含む非ステロイド系抗炎症剤:高齢者、体液量が枯渇している患者(利尿薬療法を受けている患者を含む)、または腎機能が低下している患者では、以下を含むNSAIDの同時投与テルミサルタンを含むARBを含む選択的COX-2阻害剤は、急性腎不全の可能性を含む腎機能の悪化を引き起こす可能性があります。これらの影響は通常可逆的です。 ARB の降圧効果は、NSAID によって弱まる可能性があります。したがって、MICARDIS 40mg HCT と NSAID を投与されている患者では、腎機能と血圧を定期的に監視してください。
ヒドロクロロチアジド
選択的COX2阻害剤を含む非ステロイド性抗炎症剤の投与は、利尿薬の利尿作用、ナトリウム利尿作用、および降圧作用を低下させることができます。したがって、ミカルディス HCT と選択的 COX2 阻害剤を含む非ステロイド性抗炎症剤を併用する場合は、利尿剤の望ましい効果が得られるかどうかを注意深く観察してください。
レニン-アンギオテン-アルドステロン系の二重遮断と腎機能の変化
アンジオテンシン遮断薬、ACE 阻害薬、またはアリスキレンによるレニン-アンギオテンシン-アルドステロン系 (RAS) の二重遮断は、低血圧、高カリウム血症、および腎障害のリスク増加と関連しています。 ONTARGET 試験では、アテローム性動脈硬化症または末端臓器損傷を伴う糖尿病の 55 歳以上の患者 25,620 人が登録され、テルミサルタン (ARB) のみ、ラミプリル (ACE 阻害剤) のみ、またはその組み合わせに無作為に割り付けられ、中央値 56 か月間追跡されました。 . ARB と ACE 阻害剤の併用療法を受けた患者は、ARB 単剤療法または ACE 阻害剤の単剤療法と比較して、追加の利益 (心血管死、心筋梗塞、脳卒中、または心不全による入院のリスクがさらに低下することはありません) は得られませんでしたが、単剤療法群と比較した腎機能障害(例、急性腎不全)の発生率。
RAS阻害剤との併用は原則として避けてください。 MICARDIS 40mg HCT および RAS に影響を与える他の薬剤を使用している患者の血圧、腎機能、および電解質を注意深く監視します。
糖尿病患者にアリスキレンと MICARDIS HCT を併用しないでください。腎機能障害のある患者(GFR
ジゴキシン
テルミサルタンをジゴキシンと同時投与すると、ジゴキシンのピーク血漿濃度 (49%) およびトラフ濃度 (20%) の中央値の増加が観察されました。 MICARDIS 40mg HCT とジゴキシンを併用している患者のジゴキシンレベルを監視します。
糖尿病治療薬(経口剤・インスリン)
ヒドロクロロチアジドと併用する場合は、抗糖尿病薬の用量調整が必要になる場合があります。
コレスチラミンおよびコレスチポール樹脂
ヒドロクロロチアジドの吸収は、陰イオン交換樹脂の存在下で損なわれます。ヒドロクロロチアジドが樹脂投与の少なくとも4時間前または4~6時間後に投与されるように、ヒドロクロロチアジドと樹脂の投与量をずらす。
警告
の一部として含まれています "予防" セクション
予防
胎児毒性
テルミサルタン
妊娠第 2 期および第 3 期にレニン-アンギオテンシン系に作用する薬剤を使用すると、胎児の腎機能が低下し、胎児および新生児の罹患率と死亡率が増加します。結果として生じる羊水過少症は、胎児の肺形成不全および骨格の変形に関連している可能性があります。潜在的な新生児の副作用には、頭蓋形成不全、無尿症、低血圧、腎不全、および死亡が含まれます。妊娠が判明した場合は、できるだけ早く MICARDIS HCT を中止してください。
ヒドロクロロチアジド
サイアザイドは胎盤関門を通過し、臍帯血に現れます。有害反応には、胎児または新生児の黄疸および血小板減少症[参照 特定の集団での使用 ]。
体液量または塩分が枯渇した患者における低血圧
体液量または塩分が枯渇している患者(例えば、高用量の利尿薬で治療されている患者)など、活性化されたレニン-アンギオテンシン系を有する患者では、MICARDIS HCT による治療の開始後に症候性低血圧が発生する可能性があります。 MICARDIS 80mg HCTの投与前に、正しい量または減塩。
腎機能障害
急性腎不全を含む腎機能の変化は、レニンアンギオテンシン系を阻害する薬剤や利尿薬によって引き起こされる可能性があります。腎機能がレニン-アンギオテンシン系の活動に部分的に依存している可能性がある患者(例、腎動脈狭窄、慢性腎臓病、重度のうっ血性心不全、または体液量減少の患者)は、乏尿、進行性高窒素血症を発症するリスクが特に高い可能性があります。 、または MICARDIS HCT での急性腎不全。これらの患者の腎機能を定期的に監視します。 MICARDIS HCT で臨床的に重大な腎機能の低下がみられる患者では、治療の差し控えまたは中止を検討してください。
電解質と代謝障害
レニン-アンジオテンシン系を阻害するテルミサルタンを含む薬物は、特に腎不全、糖尿病、または他のアンギオテンシン受容体遮断薬または ACE 阻害薬との併用、および血清カリウム値を上昇させる他の薬物の併用を伴う患者において、高カリウム血症を引き起こす可能性がある [参照 薬物相互作用 ]。
ヒドロクロロチアジドは、低カリウム血症および低ナトリウム血症を引き起こす可能性があります。サイアザイドは、マグネシウムの尿中排泄を増加させることが示されています。これにより、低マグネシウム血症が生じることがあります。低マグネシウム血症は、カリウムが補充されていても治療が困難な低カリウム血症を引き起こす可能性があります.血清電解質を定期的に監視します。
テルミサルタン/ヒドロクロロチアジドの併用療法を使用した対照試験では、40 mg/12.5 mg、80 mg/12.5 mg、または 80 mg/25 mg を投与された患者で、1.4 mEq/L 以上のカリウムの減少が見られず、高カリウム血症を経験した患者もいませんでした。
ヒドロクロロチアジドは尿中カルシウム排泄を減少させ、血清カルシウムの上昇を引き起こす可能性があります。
ヒドロクロロチアジドは、耐糖能を変化させ、コレステロールとトリグリセリドの血清レベルを上昇させる可能性があります。
サイアザイド療法を受けている特定の患者では、高尿酸血症が発生したり、明らかな痛風が誘発されたりすることがあります。テルミサルタンは尿酸を減少させるため、テルミサルタンとヒドロクロロチアジドを併用すると、利尿剤による高尿酸血症が軽減されます。
過敏反応
ヒドロクロロチアジド
ヒドロクロロチアジドに対する過敏反応は、アレルギーや気管支喘息の既往歴がある患者にもない患者にも起こる可能性があるが、そのような病歴のある患者ではより起こりやすい[ 禁忌 ]。
急性近視と続発性閉塞隅角緑内障
スルホンアミドであるヒドロクロロチアジドは、特異体質の反応を引き起こし、急性の一過性近視および急性閉塞隅角緑内障を引き起こす可能性があります。症状には、視力低下または眼痛の急性発症が含まれ、通常、投薬開始から数時間から数週間以内に発生します。急性閉塞隅角緑内障を治療しないと、永久的な視力喪失につながる可能性があります。一次治療は、ヒドロクロロチアジドをできるだけ早く中止することです。眼圧が制御されないままの場合は、迅速な内科的または外科的治療を考慮する必要があります。急性閉塞隅角緑内障を発症する危険因子には、スルホンアミドまたはペニシリンアレルギーの病歴が含まれる場合があります。
全身性エリテマトーデス
サイアザイド利尿薬は、全身性エリテマトーデスの増悪または活性化を引き起こすことが報告されています。
交感神経切除後の患者
ヒドロクロロチアジドの降圧効果は、交感神経切除後の患者で増強される可能性があります。
患者相談情報
患者に、FDA 承認の患者ラベル ( 患者情報 )。
妊娠
妊娠可能な年齢の女性患者には、妊娠中のミカルディス 40mg HCT への曝露の影響について助言してください。妊娠を計画している女性と治療の選択肢について話し合います。できるだけ早く医師に妊娠を報告するように患者に伝えます [ 警告と注意事項 と 特定の集団での使用 ]。
授乳
授乳中の女性には、MICARDIS HCT による治療中は授乳しないようにアドバイスしてください [参照 特定の集団での使用 ]。
症候性低血圧および失神
特に治療の最初の数日間は、立ちくらみが発生する可能性があることを患者にアドバイスし、それを医療提供者に報告してください。不十分な水分摂取、過度の発汗、下痢、または嘔吐は、血圧の過度の低下につながる可能性があり、同様の結果として立ちくらみや失神の可能性があることを患者に知らせてください。失神が発生した場合は、医療提供者に連絡するように患者に助言します [参照 警告と注意事項 ]。
カリウムサプリメント
処方している医療提供者に相談せずに、カリウムのサプリメントやカリウムを含む塩代替物を使用しないように患者に助言する[参照 警告と注意事項 と 薬物相互作用 ]。
急性近視と続発性閉塞隅角緑内障
急性近視または続発性閉塞隅角緑内障の症状が現れた場合は、MICARDIS 80mg HCT の使用を中止し、直ちに医師の診察を受けるよう患者に助言してください。 警告と注意事項 ]。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
テルミサルタンとヒドロクロロチアジド
テルミサルタンとヒドロクロロチアジドの組み合わせによる発がん性、変異原性、生殖能力に関する研究は行われていません。
テルミサルタン
テルミサルタンをマウスとラットに最長 2 年間混餌投与したところ、発がん性の証拠はありませんでした。マウス (1000 mg/kg/日) およびラット (100 mg/kg/日) に投与される最高用量は、mg/m2 に基づいて、それぞれヒトの最大推奨用量 (MRHD) の約 59 倍および 13 倍です。テルミサルタン。これらの同じ用量は、テルミサルタンの MRHD (80 mg/日) を投与されたヒトの全身暴露の 100 倍以上および 25 倍以上のテルミサルタンへの平均全身暴露を提供することが示されています。
遺伝毒性アッセイでは、遺伝子レベルでも染色体レベルでも、テルミサルタン関連の影響は明らかになりませんでした。これらのアッセイには、サルモネラ菌および大腸菌 (Ames) を用いた細菌変異原性試験、チャイニーズハムスター V79 細胞を用いた遺伝子突然変異試験、ヒトリンパ球を用いた細胞遺伝学的試験、およびマウス小核試験が含まれていました。
テルミサルタンの MRHD である mg/m2 ベースで約 13 倍の 100 mg/kg/日 (投与された最高用量) で、雄および雌ラットの生殖能力に対する薬物関連の影響は認められませんでした。ラットにおけるこの用量は、MRHD でのヒトにおける平均全身曝露 (80 mg/日) の少なくとも 50 倍の平均全身曝露 (妊娠 6 日に決定されたテルミサルタン AUC) をもたらした。
ヒドロクロロチアジド
国家毒性プログラム (NTP) の後援の下で実施されたマウスとラットの 2 年間の給餌試験では、メスのマウス (最大約 600 mg/kg/日の用量) またはオスのマウスにおけるヒドロクロロチアジドの発がん性の可能性の証拠は明らかにされませんでした。および雌ラット(約 100 mg/kg/日までの用量で)。しかし、NTP は、雄マウスにおける肝発がん性のあいまいな証拠を発見しました。
ヒドロクロロチアジドは、Salmonella typhimurium 株 TA 98、TA 100、TA 1535、TA 1537、および TA 1538 の Ames 変異原性試験およびチャイニーズハムスター卵巣 (CHO) 染色体異常試験において、in vitro で遺伝毒性を示さなかった。マウス胚細胞染色体、チャイニーズハムスター骨髄染色体、およびショウジョウバエの性連鎖劣性致死形質遺伝子。 in vitro CHO 姉妹染色分体交換 (染色体異常誘発性) アッセイ、マウスリンパ腫細胞 (変異原性) アッセイ、および Aspergillus nidulans 非分離アッセイで陽性の検査結果が得られました。
ヒドロクロロチアジドは、雌雄のマウスとラットの受胎能に悪影響を及ぼさなかった.研究では、これらの種は交配前と妊娠中に餌を介してそれぞれ最大100mg/kgと4mg/kgの用量に暴露された.
特定の集団での使用
妊娠
リスクの概要
MICARDIS HCT は、妊婦に投与すると胎児に害を及ぼす可能性があります。妊娠第 2 期および第 3 期にレニン-アンギオテンシン系に作用する薬剤を使用すると、胎児の腎機能が低下し、胎児および新生児の罹患率と死亡率が増加します( 臨床上の考慮事項 )。妊娠初期に降圧薬の使用にさらされた後の胎児の異常を調べるほとんどの疫学研究では、レニン-アンギオテンシン系に影響を与える薬物を他の降圧薬と区別していません。テルミサルタンを用いたラットとウサギの研究では、母体に毒性のある用量でのみ胎児毒性が示されました (以下を参照)。 データ )。妊娠が判明した場合は、できるだけ早く MICARDIS HCT を中止してください。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2% ~ 4% および 15% ~ 20% です。
臨床上の考慮事項
病気に関連する母体および/または胚/胎児のリスク
妊娠中の高血圧は、子癇前症、妊娠糖尿病、早産、分娩合併症(帝王切開の必要性、分娩後出血など)のリスクを高めます。高血圧は、胎児の子宮内発育制限および子宮内死亡のリスクを高めます。高血圧症の妊婦は注意深く監視し、それに応じて管理する必要があります。
胎児/新生児の副作用
テルミサルタン
妊娠第 2 期および第 3 期に RAS に作用する薬剤を使用すると、羊水過少症、無尿および腎不全につながる胎児の腎機能の低下、胎児の肺形成不全、頭蓋骨形成不全を含む骨格の変形、低血圧、および死亡を引き起こす可能性があります。 .特定の患者のレニン-アンギオテンシン系に影響を与える薬物による治療に代わる適切な方法がないという異常なケースでは、母親に胎児への潜在的なリスクについて知らせてください。
妊娠中に MICARDIS HCT を服用している患者では、一連の超音波検査を実施して羊膜内環境を評価します。妊娠週に基づいて、胎児検査が適切な場合があります。羊水過少症が観察された場合は、母親の命を救うと考えられる場合を除き、ミカルディス HCT を中止してください。ただし、患者と医師は、胎児が不可逆的な損傷を受けるまで羊水過少症が現れない可能性があることに注意する必要があります。
低血圧、乏尿、および高カリウム血症のために、子宮内でミカルディス 20mg HCT に曝露した歴史を持つ乳児を注意深く観察してください。乏尿または低血圧が発生した場合は、血圧と腎灌流をサポートします。低血圧を逆転させ、腎機能を置き換える手段として、交換輸血または透析が必要になる場合があります。 特定の集団での使用 ]。
ヒドロクロロチアジド
チアジドは胎盤を通過し、妊娠中のチアジドの使用は、胎児または新生児の黄疸、血小板減少症、および成人で発生した可能性のある他の有害反応のリスクと関連しています.
データ
動物データ
ミカルディス 40mg HCT
テルミサルタン/ヒドロクロロチアジドを 3.2/1.0、15/4.7、50/15.6、および 0/15.6 mg/kg/日の用量でラットに発生毒性試験を実施しました。 2 つの高用量の組み合わせは、いずれかの薬物単独よりも母動物に対してより毒性があるように見えましたが (体重増加の有意な減少)、発生中の胚に対する毒性の増加は見られませんでした。
テルミサルタン
テルミサルタンを妊娠ラットに最大 50 mg/kg/日の経口用量で、妊娠ウサギに最大 45 mg/kg/日の経口用量で投与した場合、催奇形性の影響は観察されませんでした。ウサギでは、45 mg/kg/日で母体毒性 (体重増加と摂餌量の減少) に関連する胚の致死率が観察されました (mg/m2 に基づく最大推奨用量 [MRHD] 80 mg の約 12 倍)。ラットでは、妊娠後期および授乳期に投与された母体毒性(体重増加および摂餌量の減少)のテルミサルタン用量 15 mg/kg/日(mg/m2 ベースで MRHD の約 1.9 倍)が有害作用を引き起こすことが観察されました。新生児では、生存率の低下、低出生体重、成熟の遅れ、体重増加の減少などがあります。ラットおよびウサギにおける発生毒性の無影響用量、それぞれ 5 および 15 mg/kg/日は、mg/m2 ベースで、テルミサルタンの MRHD (80 mg/日) のそれぞれ約 0.64 および 3.7 倍)。
ヒドロクロロチアジド
ヒドロクロロチアジドを妊娠中のマウスとラットに主要な器官形成のそれぞれの時期にそれぞれ 3000 と 1000 mg/kg/日 (MRHD の約 600 と 400 倍) の用量で投与した研究では、胎児への害の証拠は提供されませんでした。 .
サイアザイドは胎盤を通過することができ、臍帯静脈で到達した濃度は母体血漿の濃度に近づきます。ヒドロクロロチアジドは、他の利尿薬と同様に、胎盤の低灌流を引き起こす可能性があります。羊水に蓄積し、臍帯静脈血漿の最大 19 倍の濃度が報告されています。妊娠中のチアジドの使用は、胎児または新生児の黄疸または血小板減少症のリスクと関連しています。これらの薬剤は、EPH (浮腫、タンパク尿、高血圧) 妊娠中毒症 (子癇前症) の進行を予防したり変更したりしないため、妊婦の高血圧の治療には使用しないでください。妊娠中の他の適応症(心臓病など)でのヒドロクロロチアジドの使用は避けるべきです。
授乳
リスクの概要
母乳中の MICARDIS 20mg HCT またはテルミサルタンの存在、母乳育児への影響、または乳生産への影響に関する情報はありません。発表された限られた研究では、ヒドロクロロチアジドが母乳に存在すると報告されています。しかし、母乳で育てられた乳児に対するヒドロクロロチアジドの影響、または乳生産に対するヒドロクロロチアジドの影響を決定するには、情報が不十分です。テルミサルタンは、授乳中のラットのミルクに含まれています。 (見る データ )。低血圧、高カリウム血症、腎機能障害など、母乳で育てられた乳児に重大な有害反応が起こる可能性があるため、授乳中の女性には MICARDIS HCT による治療中は母乳で育てないようにアドバイスしてください。
データ
テルミサルタンは、授乳中のラットの乳中に、投与後 4 ~ 8 時間の血漿中に見られる濃度の 1.5 ~ 2 倍の濃度で存在していました。
小児用
小児患者における MICARDIS HCT の安全性と有効性は確立されていません。
MICARDIS HCTへの子宮内曝露歴のある新生児
乏尿または低血圧が発生した場合は、血圧と腎灌流をサポートします。交換輸血または透析は、低血圧の逆転および/または障害のある腎機能の代替手段として必要になる場合があります。
高齢者の使用
対照臨床試験 (n=1017) では、テルミサルタン/ヒドロクロロチアジドで治療された患者の約 20% が 65 歳以上で、5% が 75 歳以上でした。これらの患者では、若い患者と比較して、テルミサルタン/ヒドロクロロチアジドの有効性と安全性に全体的な違いは観察されませんでした。他の報告された臨床経験では、高齢患者と若年患者の反応の違いは確認されていませんが、一部の高齢者の感度が高いことは除外できません.一般に、高齢患者の用量選択は慎重に行う必要があり、通常は用量範囲の下限から開始します。これは、肝機能、腎機能、心機能の低下、および付随する疾患または他の薬物療法の頻度が高いことを反映しています。
肝障害のある患者での使用
胆道閉塞性疾患または肝機能不全の患者は、40 mg/12.5 mg の組み合わせを使用して、綿密な医学的監督の下で治療を開始する必要があります。
テルミサルタン
テルミサルタンの大部分は胆汁排泄によって除去されるため、胆道閉塞性障害または肝不全の患者は、クリアランスの低下と血中濃度の上昇が予想されます。
ヒドロクロロチアジド
体液と電解質のバランスがわずかに変化すると、肝機能障害または進行性肝疾患の患者で肝性昏睡を引き起こす可能性があります。
腎障害のある患者への使用
重度の腎機能障害 (CrCl ≤30 mL/min) を有する患者における MICARDIS 40mg HCT の安全性と有効性は確立されていません。重度の腎障害のある患者には、MICARDIS 80mg HCT 錠は推奨されません。軽度 (CrCl 60 ~ 90 mL/min) または中等度 (CrCl 30 ~ 60 mL/min) の腎障害のある患者では、用量調整は必要ありません。
過剰摂取
テルミサルタン
ヒトにおけるテルミサルタンの過剰摂取に関しては、限られたデータしか入手できません。テルミサルタンの過剰摂取の最も可能性の高い症状は、低血圧、めまい、頻脈です。徐脈は、副交感神経 (迷走神経) の刺激によって発生する可能性があります。症候性低血圧が発生した場合は、支持療法を開始する必要があります。テルミサルタンは血液透析では除去されません。
ヒドロクロロチアジド
ヒドロクロロチアジドの過剰摂取の患者に見られる最も一般的な徴候と症状は、電解質枯渇 (低カリウム血症、低塩素血症、低ナトリウム血症) と過度の利尿による脱水によるものです。ジギタリスも投与されている場合、低カリウム血症が不整脈を悪化させる可能性があります。ヒドロクロロチアジドが血液透析によって除去される程度は確立されていません。ヒドロクロロチアジドの経口 LD は、マウスとラットの両方で 10 g/kg を超えています。
禁忌
MICARDIS HCT は禁忌です:
- この製品のいずれかの成分に対して過敏症の患者 [参照 警告と注意事項 ]。
- 無尿症患者。
- 糖尿病患者におけるアリスキレンとの併用 薬物相互作用 ]。
臨床薬理学
作用機序
ミカルディス 40mg HCT
MICARDIS 20mg HCT は、降圧特性を持つ 2 つの薬剤の組み合わせです。サイアザイド系利尿薬であるヒドロクロロチアジドと、アンギオテンシン II 受容体遮断薬 (ARB) であるテルミサルタンです。
テルミサルタン
アンギオテンシン II は、アンギオテンシン変換酵素 (ACE、キニナーゼ II) によって触媒される反応で、アンギオテンシン I から形成されます。アンジオテンシン II は、レニン-アンジオテンシン系の主要な昇圧剤であり、血管収縮、合成の刺激、アルドステロンの放出、心臓の刺激、ナトリウムの腎再吸収などの効果があります。テルミサルタンは、血管平滑筋や副腎などの多くの組織でアンギオテンシン II の AT1 受容体への結合を選択的に遮断することにより、アンギオテンシン II の血管収縮作用とアルドステロン分泌作用を遮断します。したがって、その作用は、アンギオテンシン II 合成の経路とは無関係です。
多くの組織で見られる AT2 受容体もありますが、AT2 が心臓血管の恒常性と関連していることは知られていません。テルミサルタンは、AT2 受容体よりも AT1 受容体に対してはるかに高い親和性 (>3,000 倍) を持っています。
テルミサルタンは ACE (キニナーゼ II) を阻害せず、心血管調節に重要であることが知られている他のホルモン受容体やイオン チャネルに結合したり、ブロックしたりしません。
アンギオテンシン II 受容体の遮断は、レニン分泌に対するアンギオテンシン II の負の調節フィードバックを阻害しますが、結果として生じる血漿レニン活性の増加とアンギオテンシン II 循環レベルは、血圧に対するテルミサルタンの影響を克服しません。
ヒドロクロロチアジド
ヒドロクロロチアジドはチアジド系利尿薬です。サイアザイドは腎尿細管の電解質再吸収メカニズムに影響を与え、ナトリウム塩と塩化物の排泄をほぼ同量増加させます。間接的に、ヒドロクロロチアジドの利尿作用は血漿量を減少させ、その結果、血漿レニン活性が増加し、アルドステロン分泌が増加し、尿中カリウム損失が増加し、血清カリウムが減少します。レニン-アルドステロン結合はアンギオテンシン II によって媒介されるため、ARB の同時投与は、これらの利尿薬に関連するカリウム損失を逆転させる傾向があります。チアジドの降圧効果のメカニズムは完全には理解されていません。
薬力学
テルミサルタン
正常なボランティアでは、テルミサルタン 80 mg の用量は、アンギオテンシン II の静脈内注入に対する昇圧反応をピーク血漿濃度で約 90% 抑制し、約 40% の抑制が 24 時間持続しました。
アンギオテンシン II の血漿濃度と血漿レニン活性は、テルミサルタンを健康な被験者に単回投与し、高血圧患者に反復投与した後、用量依存的に増加しました。健康な被験者への最大 80 mg のテルミサルタンの 1 日 1 回投与は、血漿アルドステロン濃度に影響を与えませんでした。高血圧患者を対象とした複数回投与試験では、電解質(血清カリウムまたはナトリウム)または代謝機能(コレステロール、トリグリセリド、HDL、LDL、グルコース、または尿酸の血清レベルを含む)に臨床的に有意な変化はありませんでした.
テルミサルタンの降圧効果は、軽度から中等度の高血圧症 (拡張期血圧 95 ~ 114 mmHg) の合計 1,773 人の患者を含む 6 つのプラセボ対照臨床試験で研究されており、そのうち 1,031 人がテルミサルタンで治療されました。テルミサルタンを 1 日 1 回投与した後、プラセボを差し引いた後のベースラインからの血圧低下の大きさは、20 mg で約 (SBP/DBP) 6-8/6 mmHg、40 mg で 9-13/6-8 mmHg、および 12 -13/7-8 mmHg で 80 mg。より多くの用量 (最大 160 mg) では、血圧がさらに低下するようには見えませんでした。
降圧作用は 3 時間以内に発現し、最大で約 4 週間低下します。 20、40、および 80 mg の用量で、テルミサルタンの 1 日 1 回投与による降圧効果は、24 時間の投与間隔全体にわたって維持されました。
テルミサルタン 80 mg またはテルミサルタン 80 mg とヒドロクロロチアジド 12.5 mg の併用で 8 週間治療された腎機能が正常な 30 人の高血圧患者では、腎血流、糸球体濾過率、濾過分画、腎血管抵抗、またはクレアチニンクリアランス。
ヒドロクロロチアジド
ヒドロクロロチアジドの経口投与後、利尿は 2 時間以内に始まり、約 4 時間でピークに達し、約 6 ~ 12 時間続きます。
薬物相互作用
ヒドロクロロチアジド
アルコール、バルビツレート、または麻薬
起立性低血圧の増強が起こることがある。
骨格筋弛緩剤
クラーレ誘導体などの筋弛緩剤に対する反応性が高まる可能性があります。
コルチコステロイド、ACTH
強化された電解質枯渇、特に低カリウム血症。
昇圧アミン(例,ノルエピネフリン)
プレッサーアミンに対する反応が低下している可能性がありますが、使用を妨げるほどではありません。
薬物動態
テルミサルタン
吸収:
経口投与後、テルミサルタンのピーク濃度 (Cmax) は、投与後 0.5 ~ 1 時間で到達します。食事はテルミサルタンのバイオアベイラビリティをわずかに低下させ、血漿中濃度-時間曲線 (AUC) の下の面積が 40 mg で約 6%、160 mg 投与で約 20% 減少します。 MICARDIS 20mg HCT は食事の有無にかかわらず投与できます。テルミサルタンの絶対的な生物学的利用能は用量依存的です。 40 および 160 mg でのバイオアベイラビリティは、それぞれ 42% および 58% でした。 MICARDIS 20 mg を経口投与したテルミサルタンの薬物動態は、20 ~ 160 mg の用量範囲にわたって非線形であり、用量の増加に伴う血漿濃度 (Cmax および AUC) の増加は比例を超えています。テルミサルタンは、約 24 時間の最終排出半減期を持つ双指数減衰速度を示します。 1 日 1 回の投与によるテルミサルタンのトラフ血漿濃度は、ピーク血漿濃度の約 10% から 25% です。テルミサルタンの血漿中蓄積指数は、1 日 1 回の反復投与で 1.5 ~ 2.0 です。
分布:
テルミサルタンは、主にアルブミンとα1-酸性糖タンパク質である血漿タンパク質 (>99.5%) に高度に結合します。血漿タンパク質結合は、推奨用量で達成される濃度範囲にわたって一定です。テルミサルタンの分布量は約 500 リットルで、追加の組織結合を示しています。
代謝:
テルミサルタンは抱合によって代謝され、薬理学的に不活性なアシルグルクロニドを形成します。親化合物のグルクロニドは、ヒトの血漿と尿で確認されている唯一の代謝物です。単回投与後、グルクロニドは、測定された血漿中の放射能の約 11% に相当します。シトクロム P450 アイソザイムは、テルミサルタンの代謝には関与していません。
除去:
14C 標識テルミサルタンの静脈内または経口投与後、投与量のほとんど (>97%) は、胆汁排泄を介して変化せずに糞便中に排出されました。尿中には微量しか検出されませんでした (それぞれ総放射能の 0.91% と 0.49%)。
テルミサルタンの総血漿クリアランスは 800 mL/分を超えています。終末半減期と総クリアランスは、用量とは無関係のようです。
ヒドロクロロチアジド
ヒドロクロロチアジドは代謝されませんが、腎臓によって急速に排泄されます。血漿レベルを少なくとも 24 時間追跡した場合、血漿半減期は 5.6 時間から 14.8 時間の間で変動することが観察されています。経口投与量の少なくとも 61% が 24 時間以内に変化せずに排出されます。
ヒドロクロロチアジドは胎盤を通過しますが、血液脳関門は通過せず、母乳に排泄されます。
特定の集団
テルミサルタン
腎不全
テルミサルタンは、血液濾過によって血液から除去されません [参照 警告と注意事項 、 と 特定の集団での使用 ]。
肝不全
肝不全の患者では、テルミサルタンの血漿濃度が上昇し、絶対バイオアベイラビリティが 100% に近づきます [ 特定の集団での使用 ]。
性別
テルミサルタンの血漿中濃度は、一般に男性よりも女性の方が 2 ~ 3 倍高い。しかし、臨床試験では、女性の血圧反応や起立性低血圧の発生率に有意な増加は認められませんでした。投与量の調整は必要ありません。
高齢患者
テルミサルタンの薬物動態は、高齢者と 65 歳未満の若者の間で違いはありません。
薬物相互作用研究
テルミサルタン
ラミプリル
健康な被験者にテルミサルタン 80 mg を 1 日 1 回とラミプリル 10 mg を 1 日 1 回併用投与すると、ラミプリルの定常状態の Cmax と AUC がそれぞれ 2.3 倍と 2.1 倍、ラミプリラトの Cmax と AUC がそれぞれ 2.4 倍と 1.5 倍に増加する.対照的に、テルミサルタンの Cmax と AUC は、それぞれ 31% と 16% 減少します。テルミサルタンとラミプリルを併用投与すると、併用薬の相加的な薬力学的効果の可能性があり、テルミサルタンの存在下でラミプリルとラミプリラトへの曝露が増加するため、反応が大きくなる可能性があります。
その他の薬
テルミサルタンの同時投与は、アセトアミノフェン、アムロジピン、グリブリド、シンバスタチン、ヒドロクロロチアジド、ワルファリン、またはイブプロフェンと臨床的に有意な相互作用をもたらしませんでした。テルミサルタンはシトクロム P450 システムによって代謝されず、CYP2C19 の一部の阻害を除いて、シトクロム P450 酵素に対して in vitro での影響はありませんでした。テルミサルタンは、シトクロム P450 酵素を阻害する薬剤と相互作用するとは考えられていません。また、CYP2C19 によって代謝される薬物の代謝を阻害する可能性を除いて、シトクロム P450 酵素によって代謝される薬物と相互作用することも期待されていません。
臨床研究
テルミサルタンとヒドロクロロチアジド
2,500 人を超える高血圧患者を対象とした対照臨床試験では、1,017 人の患者がテルミサルタン (20 mg から 160 mg) と併用のヒドロクロロチアジド (6.25 mg から 25 mg) に曝露されました。これらの試験には、テルミサルタン (20 mg、40 mg、80 mg、160 mg、またはプラセボ) とヒドロクロロチアジド (6.25 mg、12.5 mg、25 mg、およびプラセボ) の組み合わせによる 1 つの要因試験 (試験 1) が含まれていました。要因試験では、493 人 (60%) の男性を含む 818 人の患者が無作為化されました。 596 (73%) が非黒人、222 (27%) が黒人。 143 人 (18%) が 65 歳以上 (年齢の中央値は 53 歳)。全集団のベースラインでの平均仰臥位血圧は 154/101 mmHg でした。
テルミサルタンとヒドロクロロチアジドの組み合わせは、9-13 と比較して、40 mg/12.5 mg と 80 mg/25 mg の間の用量で、トラフ 16-21/9-11 mmHg での収縮期および拡張期血圧の相加的なプラセボ調整減少をもたらしました。テルミサルタン 40 mg から 80 mg の単剤療法では /7-8 mmHg、ヒドロクロロチアジド 12.5 mg の単剤療法では 4/4 mmHg。降圧効果は、年齢や性別に依存しませんでした。プラセボ対照試験では、テルミサルタンとヒドロクロロチアジドの組み合わせで治療された患者の心拍数に本質的な変化はありませんでした.
高血圧患者を対象とした 6 か月以上の他の 4 つの研究では、無作為化されたテルミサルタン単剤療法の用量で適切に管理されていないか、テルミサルタンの漸増を完了した後に適切な血圧反応が得られなかった患者に対して、ヒドロクロロチアジドの追加が許可されました。実薬対照研究では、テルミサルタン単剤療法で十分な反応を達成または維持できなかった患者のテルミサルタンの滴定用量に 12.5 mg のヒドロクロロチアジドを追加すると、収縮期血圧と拡張期血圧がさらに低下しました。
患者情報
ミカルディス® HCT (my-CAR-dis HCT) (テルミス アルタンおよびヒドロクロロチアジド) 錠剤
MICARDIS HCT 錠の服用を開始する前、および補充を受けるたびに、この患者情報をお読みください。新しい情報があるかもしれません。この情報は、あなたの病状や治療について医師に相談する代わりにはなりません。
MICARDIS 20mg HCT 錠について知っておくべき最も重要な情報は何ですか?
MICARDIS HCT は、胎児に危害または死亡を引き起こす可能性があります。妊娠を計画している場合は、血圧を下げる他の方法について医師に相談してください。 MICARDIS 20mg HCTを服用中に妊娠した場合は、すぐに医師に相談してください.
ミカルディスHCTとは?
MICARDIS 40mg HCT は、高血圧(高血圧症)の治療に使用される処方薬です。
MICARDIS 40mg HCTには以下が含まれます:
- アンギオテンシン受容体遮断薬(ARB)のテルミサルタン
- ヒドロクロロチアジド、水の丸薬または利尿薬
医師は、高血圧を治療するために MICARDIS 80mg HCT と一緒に服用する他の薬を処方する場合があります。
MICARDIS 40mg HCT が小児に安全で有効であるかどうかは不明です。
次の場合は、ミカルディス 20mg HCT 錠を服用しないでください。
- 尿量が少ない、または尿が出ない
- 有効成分(テルミサルタンまたはヒドロクロロチアジド)またはこのリーフレットの最後に記載されているその他の成分にアレルギー(過敏)である
MICARDIS 40mg HCT錠を使用する前に医師に何を伝えるべきですか?
MICARDIS 20mg HCT 錠を服用する前に、次の場合は医師に相談してください。
- 妊娠している、または妊娠を計画している。見る 「MICARDIS 20mg HCT 錠について知っておくべき最も重要な情報は何ですか?」
- 授乳中または授乳を計画している。 MICARDIS 80mg HCT は母乳に移行し、赤ちゃんに害を及ぼす可能性があります。 MICARDIS HCT を服用するか、母乳で育てるかは、あなたと主治医が決定する必要があります。両方を行うべきではありません。 MICARDIS HCT 錠を服用する場合は、赤ちゃんに与える最善の方法について医師に相談してください。
- 血液中の体塩(電解質)レベルが異常であると言われました
- 肝臓に問題がある
- 喘息または喘息の病歴がある
- 狼瘡がある
- 糖尿病を持っている
- 腎臓に問題がある
- 他の病状がある
服用しているすべての薬について医師に伝えてください。 処方薬および非処方薬、ビタミン、ハーブサプリメントを含みます。また、アルコールを飲む場合は医師に相談してください。
MICARDIS 20mg HCT は他の薬の作用に影響を与える可能性があり、他の薬は MICARDIS 20mg HCT の作用に影響を与える可能性があります。特に次の場合は医師に相談してください。
- アリスキレン
- ジゴキシン(ラノキシン®)
- リチウム(Lithobid®、炭酸リチウム、クエン酸リチウム)
- 高血圧や心臓の問題を治療するために使用される他の薬
- 水の丸薬(利尿剤)
- アスピリンまたはその他の非ステロイド性抗炎症薬(NSAID)
- カリウムサプリメントまたはカリウムを含む塩代用品
- インスリンを含む糖尿病の治療に使用される薬
- 麻薬性鎮痛薬
- 睡眠薬
- ステロイド薬または副腎皮質刺激ホルモン(ACTH)
- バルビツレート
- 特定のコレステロール低下薬(コレスチラミンおよびコレスチポール樹脂など、コレステロール低下に使用される樹脂)
上記の薬のいずれかを服用しているかどうかわからない場合は、医師に相談してください。
服用している薬を知る。それらのリストを保管し、新しい薬を入手するときに医師または薬剤師に見せてください.
MICARDIS HCT 錠はどのように服用すればよいですか?
- MICARDIS 40mg HCT 錠は、医師の指示どおりに服用してください。
- MICARDIS HCT の服用量と服用時期については、担当医が説明します。
- 医師の指示がない限り、用量を変更しないでください。
- ミカルディス HCT を 1 日 1 回服用してください。
- MICARDIS 20mg HCT 錠は食事の有無にかかわらず服用してください。
- MICARDIS HCT の服用量が多すぎる場合は、医師に連絡するか、すぐに最寄りの病院の緊急治療室に行ってください。
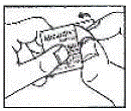
- 読む 「ブリスターの開け方」 MICARDIS 20mg HCTを使用する前に、このリーフレットの最後に記載されています。指示を理解できない場合は、医師に相談してください。
MICARDIS 80mg HCT 錠の副作用の可能性は何ですか?
MICARDIS 20mg HCT 錠は、次のような重大な副作用を引き起こす可能性があります。
- 胎児への傷害または死亡。 見る 「MICARDIS HCT 錠について知っておくべき最も重要な情報は何ですか?」
- 低血圧(低血圧イオン) また、次の場合に発生する可能性が最も高くなります。
- 水の丸薬(利尿薬)を飲む
- 減塩食をしている
- 透析治療を受ける
- 心臓に問題がある
- 嘔吐や下痢で病気になる
- 十分な水分を飲まない
- たくさん汗をかく
- 腎臓の問題 , すでに腎臓病を患っている場合は悪化する可能性があります。腎臓検査の結果に変化が生じる可能性があり、MICARDIS 40mg HCT 錠剤の用量を減らす必要があるかもしれません。次の場合は医師に連絡してください。
- 足、足首、または手の腫れ
- 原因不明の体重増加
- 肝臓の問題 , これは、すでに肝臓に問題があり、ミカルディス 40mg HCT を服用している人では悪化する可能性があります。
- 目の問題。 MICARDIS HCT に含まれる薬剤の 1 つは、視力低下につながる可能性のある眼の問題を引き起こす可能性があります。 MICARDISを開始してから数時間から数週間以内に眼の問題の症状が発生する可能性があります
HCT。次の症状がある場合は、すぐに医師に相談してください。
- 視力低下
- 眼の痛み
- アレルギー反応 。 次のような症状が現れた場合は、すぐに医師に相談してください。
- 顔、舌、喉の腫れ
- 呼吸困難
- 狼瘡の悪化。 MICARDIS 20mg HCTを服用中に狼瘡が悪化したり活動的になったりした場合は、医師に相談してください.
- 血液中の体塩(電解質)レベルの変化と体液の問題。 医師は血液検査を行うことがあります。次の場合は、すぐに医師に連絡してください。
- 口渇
- 渇き
- 疲れ
- 眠気
- 落ち着きのなさ
- 錯乱
- 発作
- 速いハートビート
- 弱点
- 筋肉痛またはけいれん
- 尿量が非常に少ない
- 吐き気または嘔吐
めまいや失神を感じた場合は、横になってすぐに医師に連絡してください。
上記の症状のいずれかが現れた場合は、すぐに医師に連絡してください。
MICARDIS 80mg HCT 錠剤の最も一般的な副作用は次のとおりです。
- 副鼻腔の痛み/うっ血および喉の痛みを含む上気道感染症
- めまい
- 疲労感
- 風邪のような症状
- 背中の痛み
- 下痢
- 吐き気
これらは、ミカルディス 20mg HCT 錠剤で起こりうる副作用のすべてではありません。気になる副作用や治らない副作用がある場合は、医師に相談してください。副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
MICARDIS 80mg HCT錠の保管方法は?
- MICARDIS HCT 錠剤は、室温 68°F ~ 77°F (20°C ~ 25°C) で保管してください。
- ミカルディス 40mg HCT 錠は、服用直前までブリスターから取り出さないでください。
MICARDIS 80mg HCT 錠およびすべての医薬品は、子供の手の届かないところに保管してください。
MICARDIS 40mg HCT 錠に関する一般情報:
医薬品は、患者情報リーフレットに記載されている以外の目的で処方されることがあります。 MICARDIS HCT 錠は、処方されていない状態には使用しないでください。他の人があなたと同じ状態であっても、ミカルディス 20mg HCT 錠を与えないでください。それらに害を及ぼす可能性があります。
この患者情報リーフレットには、MICARDIS HCT 錠剤に関する最も重要な情報がまとめられています。さらに詳しい情報が必要な場合は、医師に相談してください。医療専門家向けに書かれた MICARDIS 20mg HCT 錠剤に関する情報については、薬剤師または医師にお尋ねください。
現在の処方情報については、以下のコードをスキャンするか、Boehringer Ingelheim Pharmaceuticals, Inc. (1-800-542-6257 または (TTY) 1-800-459-9906) までお電話ください。
MICARDIS 20mg HCT 錠の成分は何ですか?
有効成分:テルミサルタンとヒドロクロロチアジド
不活性成分:水酸化ナトリウム、メグルミン、ポビドン、ソルビトール、ステアリン酸マグネシウム、乳糖一水和物、微結晶性セルロース、トウモロコシデンプン、デンプングリコール酸ナトリウム
40 mg/12.5 mg および 80 mg/12.5 mg の錠剤には次の成分も含まれています。
80 mg/25 mg の錠剤には次の成分も含まれています: 黄色酸化鉄。
高血圧(高血圧症)とは?
血圧は、心臓が鼓動するときと心臓が休むときの血管にかかる力です。力が強すぎると高血圧になります。血圧を下げる薬は、脳卒中や心臓発作を起こす可能性を低下させます。
血圧が高いと、心臓が全身に血液を送り出すのが難しくなり、血管に損傷を与えます。 MICARDIS 80mg HCT 錠剤は、血管を弛緩させて血圧を下げるのに役立ちます。
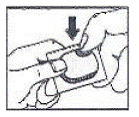
ブリスターの開け方:
この患者情報は、米国食品医薬品局によって承認されています。
