Cordarone 100mg, 50mg Amiodarone 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
コルダロン 100mg とは何ですか? どのように使用されますか?
Cordarone 100mg IV は、不整脈 (心室性不整脈) の症状を治療するために使用される処方薬です。
- Cordarone IV は、単独で使用することも、他の薬と併用することもできます。
- Cordarone 50mg IV は、抗不整脈、III と呼ばれるクラスの薬に属します。
コルダロン 100mg の副作用の可能性は何ですか?
Cordarone 100mg は、次のような重大な副作用を引き起こす可能性があります。
- 呼吸困難、
- 失神、
- 速いまたは不規則な心拍、
- 胸痛、
- 喘鳴、および
- 呼吸困難
上記の症状がある場合は、すぐに医療機関を受診してください。
Cordarone 100mg IV の最も一般的な副作用は次のとおりです。
- 低血圧(低血圧)、
- 心拍数が遅く、
- 心停止、
- 吐き気、
- 熱、
- うっ血性心不全、
- 異常な心拍リズム、
- 心原性ショック、および
- 肝機能検査異常
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Cordarone の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
肺、肝臓および心臓毒性
CORDARONE 100mg は、その使用がかなりの毒性を伴うため、生命を脅かす不整脈のある患者にのみ使用することを意図しています [適応症と使用法を参照]。
CORDARONE は肺毒性 (過敏性肺炎または間質性/肺胞性肺炎) を引き起こす可能性があり、一部の患者シリーズでは 17% という高い率で臨床的に明らかな疾患を引き起こしています。肺毒性は、約 10% の確率で致命的です。 CORDARONE 100mg 治療が開始されたら、ベースラインの胸部 X 線および拡散能力を含む肺機能検査を取得します。病歴、身体検査、および胸部 X 線を 3 ~ 6 か月ごとに繰り返します [警告と注意事項を参照]。
CORDARONE は、致命的な肝毒性を引き起こす可能性があります。ベースラインおよび定期的な肝トランスアミナーゼを取得し、増加が通常の 3 倍を超えた場合、またはベースラインが上昇した患者で 2 倍になった場合は、投与を中止または減量します。患者が臨床的な肝障害の徴候や症状を経験した場合は、CORDARONE の使用を中止してください [警告と注意事項を参照]。
CORDARONE は不整脈を悪化させる可能性があります。 CORDARONE 50mg は、継続的な心電図と心臓蘇生が可能な臨床環境で開始してください [警告と注意事項を参照]。
説明
CORDARONE (アミオダロン HCl) は抗不整脈薬で、200 mg のアミオダロン塩酸塩を含むピンク色のスコア付き錠剤として経口投与できます。存在する不活性成分は、コロイド状二酸化ケイ素、ラクトース、ステアリン酸マグネシウム、ポビドン、デンプン、および FD&C Red 40 です。CORDARONE はベンゾフラン誘導体です。 5-ジヨードフェニルケトン塩酸塩。
構造式は次のとおりです。
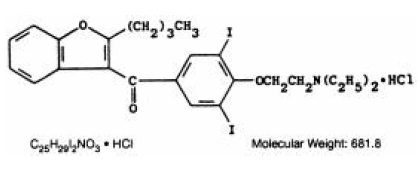
アミオダロン HCl は白色からクリーム色の結晶性粉末です。水に溶けにくく、アルコールに溶けやすく、クロロホルムに溶けやすい。重量で 37.3% のヨウ素が含まれています。
適応症
CORDARONE は、他の利用可能な抗不整脈薬の適切な用量に反応しなかった成人、または代替薬剤が許容できない場合の、生命を脅かす再発性心室細動および生命を脅かす再発性血行動態的に不安定な頻脈の治療に適応されます。
投薬と管理
投与量は、不整脈の重症度と反応に基づいて個別化する必要があります。最低有効量を使用してください。ベースラインの胸部 X 線、肺機能検査、甲状腺機能検査、肝アミノトランスフェラーゼを取得します。治療開始前に低カリウム血症、低マグネシウム血症、低カルシウム血症を是正する
推奨用量
最初の治療効果が現れるまで (通常 1 ~ 3 週間)、800 ~ 1600 mg/日の負荷用量で治療を開始します。不整脈が適切にコントロールされたら、または副作用が顕著になった場合は、CORDARONE 50mg の用量を 1 か月間 600 ~ 800mg/日に減らし、その後、通常は 400mg/日の維持用量に減らします。
管理
コーダロンは一貫して食事と一緒に服用してください [参照] 臨床薬理学 ]。 CORDARONE の食事との分割用量での投与は、1 日総用量が 1000 mg 以上の場合、または胃腸不耐症が発生した場合に推奨されます。
供給方法
剤形と強度
200 mg 錠剤: 丸みを帯びた凸面のピンク色の錠剤で、片面に「C」が盛り上がって「200」とマークされ、裏面には「WYETH」と「4188」とマークされたスコアが付けられています。
保管と取り扱い
CORDARONE®(アミオダロン塩酸塩)錠 次のように、60 錠のボトルで入手できます。
200mg 、 NDC 0008-4188-04、丸みを帯びた凸面のピンク色の錠剤で、片面に「C」が盛り上がって「200」とマークされ、裏面には「WYETH」と「4188」とマークされたスコアが付けられています。
密閉して保管してください。
制御された室温、20°~25°C (68°~77°F) で保管してください。
光から保護します。
遮光性の密閉容器に分注してください。
Sanofi Winthrop Industrie, 1, rue de la Vierge, 33440 Ambares, France によって製造されています。販売元: Wyeth Pharmaceuticals Inc., Pfizer Inc. の子会社, Philadelphia, PA 19101. 改訂: 2018 年 10 月
副作用
次の重篤な副作用については、処方情報の他のセクションで詳しく説明しています。
- 肺毒性 [参照 警告と注意事項 ]
- 肝障害 [参照 警告と注意事項 ]
- 不整脈の悪化 [参照 警告と注意事項 ]
- 視覚障害および失明 [参照 警告と注意事項 ]
- 甲状腺の異常[参照 警告と注意事項 ]
- 徐脈 [参照 警告と注意事項 ]
- 末梢神経障害 [参照 警告と注意事項 ]
- 光過敏症および皮膚の変色 [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
通常の維持量(400mg/日)以上で、CORDARONE 100mg は全患者の約 4 分の 3 に副作用を引き起こし、7 ~ 18% で中止に至ります。
オープンな米国の研究で治療された約 5,000 人の患者の調査と CORDARONE による治療の公表された報告では、最も頻繁に CORDARONE の中止を必要とする副作用には、肺浸潤または線維症、発作性心室頻拍、うっ血性心不全、および肝酵素の上昇が含まれていました。中止の原因となるその他の症状には、視覚障害、光線過敏症、皮膚の青変色、甲状腺機能亢進症、甲状腺機能低下症などがあります。
以下の副作用率は、2 日から 1,515 日間 (平均 441.3 日) 治療を受けた 241 人の患者のレトロスペクティブ研究に基づいています。
甲状腺
共通: 甲状腺機能低下症、甲状腺機能亢進症。
心臓血管
共通: うっ血性心不全、心不整脈、SA 結節機能不全。
胃腸
非常に一般的: 吐き気、嘔吐。
よくある症状:便秘、食欲不振、腹痛。
皮膚科
共通: 日光皮膚炎/光線過敏症。
神経学的
よくある症状:倦怠感と疲労、振戦/異常な不随意運動、協調運動の欠如、異常な歩行/運動失調、めまい、感覚異常、性欲減退、不眠症、頭痛、睡眠障害。
眼科
一般的: 視覚障害。
肝臓
一般的:肝機能検査の異常、非特異的な肝障害。
呼吸器
一般的:肺の炎症または線維症。
他の
よくある症状:紅潮、味覚・嗅覚異常、浮腫、唾液分泌異常、凝固異常。
珍しい: 青い皮膚の変色、発疹、自然発生的な斑状出血、脱毛症、低血圧、および心臓の伝導異常。
市販後の経験
CORDARONEの承認後の使用中に、次の副作用が確認されました。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
血液学 溶血性貧血、再生不良性貧血、汎血球減少症、好中球減少症、血小板減少症、無顆粒球症、肉芽腫。
免疫 :アナフィラキシー/アナフィラキシー反応(ショックを含む)、血管性浮腫。
神経学的 : 偽脳腫瘍、無動症や運動緩慢などのパーキンソン病の症状 (治療の中止により回復する場合もある)、脱髄性多発神経障害。
精神的 幻覚、錯乱状態、見当識障害、せん妄。
心臓 :低血圧(時に致命的)、洞停止。
呼吸器 : 好酸球性肺炎、術後の急性呼吸窮迫症候群、気管支痙攣、閉塞性細気管支炎組織化肺炎、肺胞出血、胸水、胸膜炎。
胃腸 :膵炎、急性膵炎。
肝臓 :肝炎、胆汁うっ滞性肝炎、肝硬変。
皮膚および皮下組織の疾患 蕁麻疹、中毒性表皮壊死融解症 (致命的な場合もある)、多形紅斑、スティーブンス・ジョンソン症候群、剥脱性皮膚炎、水疱性皮膚炎、好酸球増加症および全身症状を伴う薬物発疹 (DRESS)、湿疹、かゆみ、皮膚がん、狼瘡様症候群。
筋骨格 : ミオパチー、筋力低下、横紋筋融解症。
腎臓 :腎障害、腎不全、急性腎不全。
生殖 :精巣上体炎、インポテンス。
ボディ全体 :発熱、口渇。
内分泌と代謝 :甲状腺結節・甲状腺がん、抗利尿ホルモン不適合分泌症候群(SIADH)。
血管 :血管炎。
薬物相互作用
アミオダロンは半減期が長いため、アミオダロンの中止後も薬物相互作用が数週間から数か月持続すると予想されます。
アミオダロンとの薬物相互作用は、以下の表 1 に記載されています。
警告
の一部として含まれています 予防 セクション。
予防
悪影響の持続
アミオダロンの半減期 (15 ~ 142 日) とその活性代謝物であるデエチルアミオダロン (14 ~ 75 日) の長い半減期のため、アミオダロンの中止後も副作用や薬物相互作用が数週間持続する可能性があります。 臨床薬理学 ]。
肺毒性
CORDARONE は、肺毒性と一致する機能的、X 線、ガリウムスキャン、および病理学的データを伴う、咳および進行性の呼吸困難の臨床症候群を引き起こす可能性があります。 CORDARONE に続発する肺毒性は、それぞれ過敏性肺炎(好酸球性肺炎を含む)または間質性/肺胞性肺炎に代表される間接的または直接的な毒性のいずれかから生じる可能性があります。肺毒性の発生率は 17% と高く、約 10% の症例で致死的であると報告されています。 CORDARONE 50mg の治療を開始するときは、ベースラインの胸部 X 線検査と拡散能を含む肺機能検査を行います。病歴、身体診察、および胸部 X 線を 3 ~ 6 か月ごとに、または症状が発生した場合に繰り返します。患者が肺毒性の徴候または症状を経験した場合は、代替の抗不整脈療法を検討してください。プレドニゾン 40 ~ 60 mg/日を数週間にわたって漸減することは、肺毒性の治療に役立つ可能性があります。
成人呼吸窮迫症候群(ARDS)
心臓手術または非心臓手術を受けた CORDARONE 療法を受けている患者では、術後に ARDS の発生が報告されています。患者は通常、強力な呼吸療法によく反応しますが、まれに致命的な結果になることもあります。
肝障害
肝酵素レベルの無症候性上昇が頻繁に見られますが、CORDARONE 100mg は生命を脅かす肝障害を引き起こす可能性があります。組織学は、アルコール性肝炎または肝硬変の組織学に似ています。ベースラインおよび定期的な肝トランスアミナーゼを取得します。トランスアミナーゼが通常の 3 倍を超えた場合、またはベースラインが上昇した患者で 2 倍になった場合は、CORDARONE 100mg の投与を中止または減量し、追跡検査を受け、適切に治療してください。
不整脈の悪化
CORDARONE 100mg は、患者の約 2 ~ 5% で現在の不整脈を悪化させるか、新しい心室細動、絶え間ない心室頻拍、カーディオバージョンに対する抵抗の増加、および QTc 延長に関連する多形性心室頻拍 (Torsade de Pointes [TdP]) を引き起こす可能性があります。
CORDARONE による治療を開始する前に、低カリウム血症、低マグネシウム血症、および低カルシウム血症を是正してください。これらの障害は、QTc 延長の程度を誇張し、TdP の可能性を高める可能性があるためです。重度または長期の下痢を経験している患者、または利尿薬、下剤、全身性コルチコステロイド、アムホテリシン B などの電解質レベルに影響を与える薬を服用している患者では、電解質と酸塩基のバランスに特に注意してください。
視覚障害および失明
視神経症と視神経炎
視神経障害および視神経炎の症例は、通常、視覚障害および時には永続的な失明をもたらしますが、アミオダロンで治療された患者で報告されており、治療中のいつでも発生する可能性があります.視力の変化や周辺視力の低下などの視覚障害の症状が現れた場合は、コルダロン100mgの投与を中止し、速やかに眼科を受診してください。コルダロンの投与中は、眼底検査や細隙灯検査などの定期的な眼科検査が推奨されます。 有害反応 ]。
角膜微小沈着物
CORDARONE で治療された成人の大半に、角膜微小沈着が見られます。それらは通常、細隙灯検査によってのみ識別できますが、患者の 10% ほどで視覚的なハローやかすみ目などの症状を引き起こします。角膜の微小沈着は、投与量の減少または治療の終了により元に戻ります。無症候性の微小沈着物だけでは、用量を減らしたり治療を中止したりする理由にはなりません [参照 有害反応 ]。
甲状腺の異常
CORDARONE 50mg は、チロキシン (T4) からトリヨードサイロニン (T3) への末梢変換を阻害し、臨床的に甲状腺機能が正常な患者において、チロキシン レベルの上昇、T3 レベルの低下、不活性逆 T3 (rT3) レベルの上昇を引き起こす可能性があります。 CORDARONE 50mg は、甲状腺機能低下症 (患者の最大 10% で報告) または甲状腺機能亢進症 (患者の約 2% で発生) のいずれかを引き起こす可能性があります。特に高齢患者、甲状腺結節、甲状腺腫、またはその他の甲状腺機能障害の既往歴のある患者では、治療前および治療後も定期的に甲状腺機能を監視してください。
甲状腺機能亢進症は、不整脈のブレークスルーを誘発する可能性があります。不整脈の新たな兆候が現れた場合は、甲状腺機能亢進症の可能性を考慮する必要があります。甲状腺機能亢進症の症状を治療するには、抗甲状腺薬、β-アドレナリン遮断薬、一時的なコルチコステロイド療法が必要になる場合があります。アミオダロン誘発性甲状腺中毒症では、かなりの量の既成甲状腺ホルモンが腺に蓄えられているため、抗甲状腺薬の作用が遅れる可能性があります。放射性ヨウ素療法は、アミオダロン誘発性甲状腺機能亢進症に関連する放射性ヨウ素の摂取量が少ないため、禁忌です。 CORDARONE による甲状腺機能亢進症の後に、一時的な甲状腺機能低下症が続くことがあります。
甲状腺機能低下症は、先行するアミオダロン誘発性甲状腺機能亢進症の初期または解消に続くものである可能性があります。アミオダロン療法に関連して、重度の甲状腺機能低下症および粘液浮腫性昏睡、時には致命的であることが報告されています。一部の臨床的に甲状腺機能低下症のアミオダロン治療を受けている患者では、遊離チロキシン指数値が正常である場合があります。 CORDARONE および甲状腺ホルモン補充の用量を減らすか中止することにより、甲状腺機能低下症を管理します。
徐脈
CORDARONE は、患者の 2 ~ 4% で、症候性徐脈または洞停止を引き起こし、逃避巣の抑制を引き起こします。リスクは、電解質障害または併用抗不整脈薬または負のクロノトロープの使用によって増加します[参照 薬物相互作用 ]。徐脈では、レートコントロールのためにペースメーカーが必要になる場合があります。
アミオダロンを服用している患者で、レディパスビル/ソホスブビルまたはソホスブビルとシメプレビルの併用療法が開始された場合、市販後に症候性徐脈の症例が報告されています。徐脈は通常、数時間から数日以内に発生しますが、場合によっては、抗ウイルス治療の開始後 2 週間以内に現れます。抗ウイルス治療の中止後、徐脈は一般に解消した。この効果のメカニズムは不明です。抗ウイルス治療を開始する際に、アミオダロンを服用している、または最近中止した患者の心拍数を監視する[参照 薬物相互作用 ]。
植込み型心臓デバイス
除細動器またはペースメーカーが埋め込まれている患者では、抗不整脈薬を慢性的に投与すると、ペーシングまたは除細動閾値に影響を与える可能性があります。したがって、アミオダロン治療の開始時および治療中は、ペーシングと除細動の閾値を評価する必要があります。
胎児毒性
CORDARONE を妊婦に投与すると、胎児に害を及ぼす可能性があります。胎児への曝露は、新生児の心臓、甲状腺、神経発達、神経、および成長への影響の可能性を高める可能性があります[参照 特定の集団での使用 ]。
末梢神経障害
CORDARONE の慢性投与は、CORDARONE を中止しても解消されない末梢神経障害を引き起こす可能性があります。
光過敏症と皮膚の変色
CORDARONE は患者の約 10% で光感作を誘発します。日焼け止めクリームまたは防護服である程度の保護が得られる場合があります。長期間の治療中に、露出した皮膚が青灰色に変色することがあります。色白の患者や日光に過度にさらされる患者では、リスクが高まる可能性があります。投薬を中止すると、変色がいくらか回復することがあります。
手術
揮発性麻酔薬
CORDARONE 100mg 療法を受けている患者は、ハロゲン化吸入麻酔薬の心筋抑制および伝導効果に対してより敏感である可能性があります。
患者相談情報
患者に、FDA 承認の患者ラベル ( 投薬ガイド )。
妊娠中の女性には、胎児への潜在的なリスクについてアドバイスしてください。妊娠の可能性がある女性には、処方者に妊娠またはその疑いがあることを知らせるように助言する [参照 特定の集団での使用 ]。
CORDARONE による治療中は、授乳は推奨されないことを女性に助言する [参照 特定の集団での使用 ]。
患者には、グレープフルーツ ジュースとセント ジョンズ ワートを避けるようにアドバイスしてください。
肺毒性、不整脈の悪化、徐脈、視覚障害、または甲状腺機能低下症および甲状腺機能亢進症の徴候や症状を経験した場合は、医師の診察を受けるよう患者に助言してください。
この商品のラベルは更新されている可能性があります。完全な処方情報については、www.pfizer.com をご覧ください。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
アミオダロン HCl は、ラットにおける甲状腺腫瘍 (濾胞腺腫および/または癌腫) の発生率の統計的に有意な用量依存的増加と関連していました。甲状腺腫瘍の発生率は、試験した最低用量、すなわち 5 mg/kg/日 (ヒトの最大推奨維持用量*の約 0.08 倍) で対照群よりも高かった。
CORDARONE による変異原性試験 (Ames、小核、および溶原性試験) は陰性でした。
アミオダロン塩酸塩を雌雄ラットに交配の 9 週間前から投与した研究では、1 日 90 mg/kg の用量で受胎能の低下が観察されました (ヒトの最大推奨維持用量の約 1.4 倍*)。
※体重60kgで600mg(体表面積で比較)
特定の集団での使用
妊娠
リスクの概要
市販後報告および公表された症例シリーズから入手可能なデータは、妊婦におけるアミオダロンの使用が、新生児甲状腺機能低下症および甲状腺機能亢進症、新生児徐脈、神経発達異常、早産および胎児発育制限を含む胎児への悪影響のリスクを高める可能性があることを示しています。アミオダロンとその代謝物であるデスエチルアミオダロン (DEA) は、胎盤を通過します。妊娠中に心室性不整脈を含む潜在的な不整脈を治療しないと、母親と胎児にリスクが生じます( 臨床上の考慮事項 )。動物研究では、器官形成期のウサギ、ラット、およびマウスへのアミオダロンの投与は、ヒトの最大推奨維持用量よりも少ない用量で胚胎児毒性をもたらした( データ )。妊娠中の女性には、胎児への潜在的なリスクについてアドバイスしてください。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天異常および流産の推定バックグラウンド リスクは、それぞれ 2% ~ 4% および 15% ~ 20% です。
臨床上の考慮事項
病気に関連する母体および/または胚/胎児のリスク
心室頻拍の発生率は増加し、妊娠中により症状が現れることがあります。心室性不整脈は、基礎に心筋症、先天性心疾患、心臓弁膜症、または僧帽弁逸脱症がある妊婦に最もよく発生します。ほとんどの頻脈エピソードは異所性ビートによって開始されるため、異所性活動の傾向が高まるため、妊娠中に不整脈エピソードの発生が増加する可能性があります。妊娠中には、妊娠中に固有の分布量の増加と薬物代謝の増加により、治療レベルを維持することが困難になる可能性があるため、ブレークスルー不整脈も発生する可能性があります。
胎児/新生児の有害反応
アミオダロンとその代謝物は胎盤を通過することが示されています。妊娠中の母親のアミオダロン使用に関連する胎児への悪影響には、新生児徐脈、QT延長、および周期的な心室性期外収縮、出生前または新生児で検出され、数日間の暴露後でも報告された新生児甲状腺機能低下症(甲状腺腫を伴うまたは伴わない)、新生児の高サイロキシン血症、甲状腺機能とは独立した神経発達異常、発話の遅れ、書き言葉や算数の困難、運動発達の遅れ、運動失調、頭の同期性揺動を伴うジャーク眼振、胎児の発育制限、早産など。甲状腺障害や不整脈の徴候や症状がないか、新生児を監視します。
労働と配達
不整脈のリスクは、陣痛および分娩中に増加する可能性があります。 CORDARONE で治療された患者は、分娩中も継続的に監視する必要があります [参照 警告と注意事項 ]。
データ
動物データ
器官形成期の妊娠中のラットとウサギでは、塩酸アミオダロンを 25 mg/kg/日 (それぞれ、ヒトの最大推奨維持量*の約 0.4 倍と 0.9 倍) 投与しても、胎児に悪影響はありませんでした。ウサギでは、75 mg/kg/日 (人間の最大推奨維持用量*の約 2.7 倍) で 90% 以上の動物が流産しました。ラットでは、50 mg/kg/日以上の用量で精巣がわずかに移動し、一部の頭蓋骨と指骨の不完全な骨化の発生率が増加しました。 100 mg/kg/日以上で、胎児の体重が減少しました。 200 mg/kg/日で、胎児吸収の発生率が増加しました。 (ラットにおけるこれらの用量は、ヒトの最大推奨維持用量の約 0.8、1.6、および 3.2 倍です*)。胎児の成長と生存に対する悪影響も、5 mg/kg/日の用量でマウスの 2 つの系統のうちの 1 つに認められました (ヒトの最大推奨維持量*の約0.04倍。
※体重60kgで600mg(体表面積で比較)
授乳
リスクの概要
アミオダロンとその主要な代謝産物の 1 つである DEA は、母親の体重で調整したアミオダロンの投与量の 3.5% から 45% の間で母乳中に存在します。母乳で育てられた乳児に甲状腺機能低下症と徐脈の症例がありますが、これらの影響が母乳中のアミオダロン曝露によるものかどうかは不明です. CORDARONE による治療中は、授乳は推奨されません。 警告と注意事項 ]。
生殖能力のある雌と雄
不妊
動物の生殖能力に関する研究に基づくと、CORDARONE は女性および男性の生殖能力を低下させる可能性があります。この効果が可逆的かどうかは不明です。 [見る 非臨床毒性学 ]。
小児用
小児患者における CORDARONE の安全性と有効性は確立されていません。
高齢者の使用
65 歳以上の正常な被験者は、若い被験者よりも低いクリアランスと増加した薬物半減期を示します [参照 臨床薬理学 ]。一般に、高齢患者の用量選択は慎重に行う必要があり、通常は用量範囲の下限から開始します。これは、肝臓、腎臓、または心機能の低下、および付随する疾患または他の薬物療法の頻度が高いことを反映しています。
過剰摂取
CORDARONE 50mg の過剰摂取により、致死的なケースもありました。
患者の心調律と血圧を監視し、徐脈が続く場合は、β-アドレナリン作動薬またはペースメーカーを使用することがあります。正の強心剤および昇圧剤で組織灌流が不十分な低血圧を治療します。コルダロン 50mg もその代謝物も透析できません。
禁忌
- 心原性ショック。
- 洞不全症候群、第 2 度または第 3 度の房室ブロック、ペースメーカーが機能しない失神につながる徐脈。
- -ヨウ素を含む薬物またはその成分に対する既知の過敏症。
臨床薬理学
作用機序
アミオダロンはクラス III の抗不整脈薬と見なされますが、4 つのヴォーン ウィリアムズ クラスすべての電気生理学的特性を備えています。クラス I の薬と同様に、アミオダロンは急速なペーシング周波数でナトリウム チャネルを遮断し、クラス II の薬と同様に、アミオダロンは非競合的な抗交感神経作用を発揮します。長期投与によるその主な効果の 1 つは、クラス III の効果である心臓の活動電位を長くすることです。結節組織におけるアミオダロンの負の変時効果は、クラス IV 薬の効果と同様です。アミオダロンは、ナトリウム チャネルの遮断に加えて、心筋のカリウム チャネルを遮断し、伝導の遅延と不応性の延長に寄与します。反交感神経作用とカルシウムおよびカリウム チャネルのブロックは、洞結節に対する負の向変作用、および房室 (AV) 結節における伝導の遅延と不応の延長の原因となります。その血管拡張作用は、心臓の作業負荷を減らし、その結果、心筋の酸素消費量を減らすことができます。
CORDARONE は、dV/dt (活動電位の最大上昇速度) の低下を最小限に抑えながら、すべての心臓線維の活動電位の持続時間を延長します。不応期はすべての心臓組織で延長されます。 CORDARONE は、静止膜電位に影響を与えることなく心臓の不応期を延長します。これらの電気生理学的効果は、15 ~ 20% の洞レートの減少、約 10% の PR および QT 間隔の増加、U 波の発生、および T 波の輪郭の変化に反映されます。 CORDARONE は顕著な洞性徐脈または洞停止および心ブロックを引き起こす可能性がありますが、これらの変化は CORDARONE 50mg の薬理学的作用の証拠であるため、CORDARONE 50mg の中止を必要としません。 警告と注意事項 ]。
血行動態
動物実験およびヒトへの静脈内投与後、CORDARONE 100mg は血管平滑筋を弛緩させ、末梢血管抵抗 (後負荷) を減少させ、心係数をわずかに増加させます。しかし、CORDARONE 100mg の経口投与後、LVEF が低下している患者でも、左室駆出率 (LVEF) に有意な変化は見られません。人への急性静脈内投与後、CORDARONE 100mg は軽度の負の変力作用を有する可能性があります。
薬力学
血漿中濃度と有効性の間に十分に確立された関係はありませんが、1 mg/L をはるかに下回る濃度では効果がないことが多く、2.5 mg/L を超えるレベルは一般に必要ではないようです。血漿濃度の測定値を使用して、レベルが異常に低く、用量を増やすことで恩恵を受ける可能性のある患者、または異常に高く、副作用を最小限に抑えることを期待して用量を減らす可能性のある患者を特定できます。
異常なリズムへの影響は、負荷量を使用した場合でも 2 ~ 3 日以内には見られず、通常は 1 ~ 3 週間かかります。効果がさらに長期間持続する可能性があります。負荷投与レジメンを使用すると、効果が現れるまでの時間が短いという証拠があります。
排出速度が遅いことと一致して、CORDARONE 50mg を中止した後も抗不整脈効果が数週間から数か月持続しますが、再発の時期は変動し、予測できません。一般に、不整脈の再発後に薬物が再開されると、おそらく組織貯蔵が完全に枯渇していないため、最初の反応と比較して比較的急速に制御が確立されます。
薬物動態
吸収
ヒトへの経口投与後、CORDARONE はゆっくりとさまざまに吸収されます。 CORDARONE のバイオアベイラビリティは約 50% です。 1 回の投与から 3 ~ 7 時間後に最大血漿濃度に達します。 100 ~ 600 mg/日の長期投与による血漿濃度は、ほぼ用量に比例し、100 mg/日ごとに平均 0.5 mg/L 増加します。ただし、これらの手段にはかなりの個人差が含まれます。
食物はコルダロンの吸収率と吸収の程度を高めます。 CORDARONE のバイオアベイラビリティーに対する食事の影響は、高脂肪の食事を摂取し、一晩絶食した直後に 600 mg を 1 回服用した 30 人の健康な被験者で研究されています。アミオダロンの血漿濃度-時間曲線下面積 (AUC) およびピーク血漿濃度 (Cmax) は、食物の存在下で、それぞれ 2.3 (範囲 1.7 ~ 3.6) および 3.8 (範囲 2.7 ~ 4.4) 倍増加しました。食物はまた、アミオダロンの吸収率を高め、最高血漿濃度 (Tmax) までの時間を 37% 減少させました。アミオダロンの主要代謝物である DEA の平均 AUC および平均 Cmax は、それぞれ 55% (範囲 58 ~ 101%) および 32% (範囲 4 ~ 84%) 増加しましたが、食物。
分布
CORDARONE は高度にタンパク質と結合しています (約 96%)。 CORDARONE は、さまざまな部位、特に脂肪組織や、肝臓、肺、脾臓などの灌流の多い臓器に広範囲に蓄積するため、平均約 60 L/kg の非常に大きな分布容積を持ちます。
CORDARONE 50mg の主要な代謝物の 1 つである DEA は、ヒトで確認されています。ほぼすべての組織にさらに多く蓄積します。ヒトにおける DEA の活性に関するデータは入手できませんが、動物では、一般にアミオダロン自体と同様の重要な電気生理学的および抗不整脈効果があります。経口アミオダロンの抗不整脈作用に対する DEA の正確な役割と寄与は定かではありません。ヒトにおけるCORDARONE 100mgの経口投与後の最大心室クラスIII効果の発現は、アミオダロンの蓄積よりも経時的なDEAの蓄積とより密接に相関しています。
排除
12 人の健康な被験者に単回投与した後、CORDARONE は、アミオダロンで 58 日 (範囲 15 から 142 日)、アクティブな被験者で 36 日 (範囲 14 から 75 日) の平均見かけの血漿最終消失半減期を持つマルチコンパートメントの薬物動態を示しました。代謝産物 (DEA)。 CORDARONE 100mg の慢性的な経口療法を中止した患者では、2.5 日から 10 日後に血漿レベルが最初に 50% 低下し、二相性の排泄が起こることが示されています。はるかに遅い最終血漿排出段階では、親化合物の半減期は 26 ~ 107 日で、平均は約 53 日で、ほとんどの患者は 40 ~ 55 日の範囲です。したがって、負荷投与期間がない場合、定常状態の血漿濃度は、一定の経口投与で 130 日から 535 日の間に、平均 265 日で到達します。代謝産物の場合、平均血漿消失半減期は約 61 日でした。これらのデータはおそらく、十分に灌流された組織からの薬物の初期排出 (2.5 ~ 10 日の半減期) を反映しており、その後、脂肪などの灌流の不十分な組織コンパートメントからの非常にゆっくりとした排出を表す終末段階が続きます。
排除の両方の段階におけるかなりの被験者間変動、およびどのコンパートメントが薬物効果にとって重要であるかについての不確実性は、正確な維持用量が部分的に決定されるため、負荷用量で不整脈制御が達成されると、個々の反応に注意を払う必要があります。排除率による。 CORDARONE の維持用量を個別化する [参照 投薬と管理 ]。
代謝
アミオダロンは、シトクロム P450 (CYP) 酵素群、特に CYP3A および CYP2C8 によって DEA に代謝されます。 CYP3A イソ酵素は、肝臓と腸の両方に存在します。 In vitro では、アミオダロンと DEA は CYP2C9、CYP2C19、CYP2D6、CYP3A、CYP2A6、CYP2B6、CYP2C8 を阻害する可能性を示します。アミオダロンと DEA は、P 糖タンパク質や有機陽イオン輸送体 (OCT2) などの輸送体を阻害する可能性もあります。
排泄
アミオダロンは、主に肝代謝と胆汁排泄によって排出され、尿中へのアミオダロンまたは DEA の排泄はごくわずかです。アミオダロンも DEA も透析できません。
特定の集団
年齢の影響
65 歳以上の正常な被験者は、若い被験者 (約 150 mL/hr/kg) よりも低いクリアランス (約 100 mL/hr/kg) と、約 20 日から 47 日への t½ の増加を示します。
腎障害
腎機能障害は、アミオダロンまたは DEA の薬物動態に影響を与えません。
肝障害
肝硬変患者へのアミオダロンの静脈内単回投与後、有意に低い Cmax と DEA の平均濃度値が見られますが、アミオダロンの平均レベルは変化しません。
心臓病
重度の左心室機能不全の患者では、アミオダロンの薬物動態は大幅に変化しませんが、DEA の最終排出 t½ は延長されます。
経口アミオダロンによる慢性治療中の腎臓、肝臓、または心臓の異常を伴う患者に対する用量調整は定義されていませんが、高齢患者および重度の左心室機能障害のある患者については、綿密な臨床モニタリングが賢明です。
薬物相互作用
アミオダロンに対する他の薬剤の影響
グレープフルーツ ジュース: 健康なボランティアに与えられたグレープフルーツ ジュースは、アミオダロンの AUC を 50% 増加させ、Cmax を 84% 増加させ、DEA を定量化できない濃度まで減少させました。
シメチジンは CYP3A を阻害し、血清アミオダロン濃度を上昇させることができます。
コレスチラミンは、アミオダロンの腸肝循環を減少させ、それによってその除去を増加させます。これにより、アミオダロンの血清レベルと半減期が減少します。
薬剤に対するアミオダロンの効果
CYP3A 基質
アミオダロンをキニジンと同時に服用すると、キニジンの血清濃度が 2 日後に 33% 上昇します。アミオダロンをプロカインアミドと併用して 7 日未満摂取すると、プロカインアミドと n-アセチル プロカインアミドの血漿濃度がそれぞれ 55% と 33% 増加します。
非鎮静抗ヒスタミン剤であるロラタジンは、主に CYP3A によって代謝され、その代謝はアミオダロンによって阻害される可能性があります。
リドカインの代謝は、アミオダロンによって阻害されます。
シクロホスファミドは、CYP3A を含む CYP450 によって活性代謝物に代謝されるプロドラッグです。シクロホスファミドの代謝は、アミオダロンによって阻害される可能性があります。
不活性チエノピリジン プロドラッグであるクロピドグレルは、肝臓で CYP3A によって活性代謝物に代謝されます。クロピドグレルとアミオダロンの間の潜在的な相互作用が血小板凝集の無効な阻害をもたらすことが報告されています。
マクロライド/ケトライド系抗生物質
アミオダロンは、マクロライド/ケトライド系抗生物質 (アジスロマイシンを除く) および全身性アゾール系抗真菌薬の代謝を阻害する可能性があります。
P糖タンパク質基質
アミオダロンをジゴキシンと同時に服用すると、1 日後に血清ジゴキシン濃度が 70% 増加します。
ダビガトランエテキシレートは、経口アミオダロンと同時に服用すると、ダビガトランの血清濃度が上昇する可能性があります。
デキストロメトルファンは、CYP2D6 と CYP3A の両方の基質です。アミオダロンは CYP2D6 を阻害します。慢性的 (> 2 週間) の経口アミオダロン投与は、デキストロメトルファンの代謝を損ない、血清濃度の上昇につながる可能性があります。
患者情報
コルダロン® (KOR-DU-RON) (アミオダロン) 錠
CORDARONE 50mg について知っておくべき最も重要な情報は何ですか?
CORDARONE は、死に至る重大な副作用を引き起こす可能性があります。
- 肺の問題
- 肝臓の問題
- 心拍の問題の悪化
CORDARONE による治療中に次のような症状が現れた場合は、すぐに医療提供者に連絡するか、医師の診察を受けてください。
- 呼吸困難、喘鳴、息切れ、咳、胸痛、吐血、または発熱
- 吐き気や嘔吐、尿の色が茶色または濃い、いつもよりだるい、肌や白目が黄色くなる(黄疸)、右上腹部の痛み
- 心臓のドキドキ、ビートをスキップする、速くまたはゆっくりと鼓動する、ふらつきを感じる、または失神した場合
- かすみ目、ハローが見える、または目が光に敏感になるなど、視力の問題。 CORDARONE による治療前および治療中は、定期的に目の検査を受ける必要があります。
CORDARONE は、病状を注意深く監視できるように、病院で開始する必要があります。
CORDARONE は、心室性不整脈と呼ばれる生命を脅かす心拍の問題と診断された人で、他の治療法が効かなかった場合、またはそれらに耐えられない場合にのみ使用してください。
CORDARONE 50mg は、他の深刻な副作用を引き起こす可能性があります。 「CORDARONE 100mg で考えられる副作用は何ですか?」を参照してください。治療中に深刻な副作用が発生した場合は、CORDARONE を中止するか、用量を変更するか、治療を受ける必要があります。コルダロンの服用を中止する前に、かかりつけの医療提供者に相談してください。
CORDARONE は治療中止後も数ヶ月間体内に留まるため、CORDARONE の中止後も副作用が残る可能性があります。
CORDARONE 100mg による治療前および治療中に、定期的な検査、血液検査、胸部 X 線検査を受けて、重大な副作用がないかどうかを確認する必要があります。 CORDARONE による治療を開始する前に、肺機能検査も行う必要があります。
コルダロンとは?
CORDARONE は、心室性不整脈と呼ばれる生命を脅かす心拍の問題と診断された人々を治療するために使用される処方薬です。 CORDARONE が子供に安全で有効であるかどうかはわかっていません。
CORDARONE 100mgを服用してはいけない人は?
次の場合は CORDARONE 100mg を服用しないでください。
- 心原性ショックと呼ばれる深刻な心臓の問題を抱えている
- 心拍数の低下の有無にかかわらず、心臓ブロックと呼ばれる特定の種類の心臓の状態がある
- めまいや立ちくらみを伴う心拍数の低下があり、ペースメーカーが埋め込まれていない
- コルダロンのアミオダロン、ヨウ素、またはその他の成分にアレルギーのある方。 CORDARONE の成分の完全なリストについては、この投薬ガイドの最後を参照してください。
CORDARONE 100mg を服用する前に、次の場合を含め、すべての病状について医療提供者に伝えてください。
- 肺または呼吸に問題がある
- 肝臓に問題がある
- 甲状腺の問題がある、またはあった
- 心拍数が遅い、または血圧に問題がある
- 下痢をしている、または長期間下痢をしている
- 血液中のカリウム、マグネシウム、またはカルシウムのレベルが低いと言われました
- ペースメーカーまたは除細動器が埋め込まれている
- 全身麻酔での手術を予定している場合
- 妊娠している、または妊娠する予定がある。 CORDARONE は胎児に害を及ぼす可能性があります。 CORDARONE による治療中に妊娠した場合は、すぐに医療提供者に伝えてください。 CORDARONE 100mg は、治療中止後も数ヶ月体内に留まることができます。
- 授乳中または授乳を計画している。 CORDARONE 100mg は母乳に移行し、赤ちゃんに害を及ぼす可能性があります。コルダロンを服用している間は、授乳しないでください。 CORDARONE は治療中止後も数ヶ月体内に留まることができます。この時期に赤ちゃんに食事を与える最善の方法について、かかりつけの医療提供者に相談してください。
処方薬や市販薬、ビタミン、ハーブサプリメントなど、服用しているすべての薬について医療提供者に伝えてください。 CORDARONE 50mg と特定の他の薬は互いに影響し合い、深刻な副作用を引き起こす可能性があります。 CORDARONE と相互作用する薬のリストについては、薬剤師にお尋ねください。
コルダロンはどのように服用すればよいですか?
- 退院後は、コルダロンを医師の指示どおりに服用してください。
- CORDARONE の摂取量と摂取時期については、かかりつけの医療提供者が説明します。
- 心臓のリズムが制御されている場合、または特定の副作用がある場合、医療提供者は必要に応じて CORDARONE 50mg の投与量を変更することがあります。 CORDARONE 50mg の投与量が変更されているときは、担当の医療提供者が注意深く監視する必要があります。
- コルダロンは食事の有無にかかわらず、毎回同じように服用してください。
- CORDARONE 100mg を過剰に服用した場合は、すぐに医療提供者に連絡するか、最寄りの病院の緊急治療室に行ってください。飲み忘れた場合は、通常の時間に次の量を待ってから服用してください。同時に 2 回分を服用しないでください。次の定期的な予定の線量を続けてください。
コルダロンを服用している間、何を避けるべきですか?
- CORDARONE による治療中は、グレープフルーツ ジュースを飲むことは避けてください。 CORDARONE 50mg と一緒にグレープフルーツ ジュースを飲むと、血液中の CORDARONE の量が増加し、副作用を引き起こす可能性があります。
- CORDARONE 100mg は、肌を日光に敏感にする可能性があります。ひどい日焼けをすることがあります。日光に当たる必要がある場合は、日焼け止めを使用し、肌を覆う帽子と衣服を着用して、肌を保護してください。日焼けした場合は、医療機関に相談してください。投薬ガイドセクションの「皮膚の問題」を参照してください 「コルダロンの副作用は?」 下。
CORDARONE の副作用にはどのようなものがありますか?
コラダロンは、次のような重大な副作用を引き起こす可能性があります。
- 見る 「CORDARONE について知っておくべき最も重要な情報は何ですか?」
- 神経の問題。 CORDARONE 100mg は神経障害を引き起こす可能性があります。手、足、または足の「ピンと針」またはしびれ感、筋力低下、制御不能な動き、調整不良、または歩行障害などの神経障害の症状が現れた場合は、医療提供者に連絡してください。
- 皮膚の問題。 CORDARONE を使用すると、肌が日光に過敏になったり、青みがかった灰色になったりすることがあります。色白の人や日光によく当たる人は、これらの皮膚の問題のリスクが高くなる可能性があります.コルダロンを中止すると、青みがかった灰色の肌の色の一部が正常に戻る場合があります。
- 甲状腺の問題。 CORDARONE は、甲状腺機能の低下 (甲状腺機能低下症) を引き起こす可能性があり、時には重度になる可能性があります。
- CORDARONE による治療中に甲状腺機能の低下が生じた場合、医療提供者は CORDARONE による治療を中止するか、用量を減らす必要があり、場合によっては甲状腺ホルモンを補充する薬を処方する必要があります。
- 甲状腺機能が亢進すると、甲状腺ホルモンが過剰に分泌されます。コルダロンを服用している間でも、心拍が異常になることがあります。かかりつけの医療提供者は、甲状腺機能亢進症を治療するために特定の薬を処方する場合があります。 CORDARONE による治療中に異常な心拍が発生した場合は、医療提供者に連絡してください。これは、甲状腺機能亢進症の可能性があります。
- CORDARONE による治療を開始する前と治療中に、医療提供者は甲状腺機能をチェックするための検査を行う必要があります。
- CORDARONE による治療中に次のような甲状腺の問題の症状が現れた場合は、医療提供者に連絡してください。
- 弱点
- 体重減少または体重増加
- 暑さや寒さに弱い
- 薄毛
- 発汗
- 月経周期の変化
- 首の腫れ(甲状腺腫)
- 緊張感
- 過敏性
- 落ち着きのなさ
- 集中力の低下
- 気分の落ち込み(高齢者)
- 身震い
CORDARONE の最も一般的な副作用は次のとおりです。
- 肺の問題
- ハートビートの問題
- 心の問題
- 肝臓の問題
CORDARONE 50mg は、男性と女性の生殖能力に影響を与える可能性があります。効果が可逆的かどうかは不明です。不妊症について懸念がある場合は、医療提供者に相談してください。
これらは CORDARONE の考えられるすべての副作用ではありません。詳細については、医療提供者または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
コルダロンの保管方法は?
- CORDARONE 100mg を 20°~25°C (68°~77°F) の室温で保管してください。
- コルダロンは密閉容器に保管し、コルダロン 50mg は遮光して保管してください。
CORDARONE 50mg とすべての薬は子供の手の届かないところに保管してください。
CORDARONE の安全で効果的な使用に関する一般情報
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。コルダロンが処方されていない状態には使用しないでください。他の人があなたと同じ症状であっても、コルダロンを与えないでください。それらに害を及ぼす可能性があります。医療専門家向けに書かれた CORDARONE に関する情報については、薬剤師または医療提供者にお尋ねください。
コルダロン100mgの成分は?
有効成分: アミオダロン塩酸塩
不活性成分: コロイド状二酸化ケイ素、乳糖、ステアリン酸マグネシウム、ポビドン、デンプン、および FD&C Red 40。
この医薬品ガイドは、米国食品医薬品局によって承認されています。
