心臓病 治療: Coumadin 1mg, 2mg, 5mg Warfarin 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
クマディンとは何ですか?
クマジンは、血栓を治療し、体内で血栓が形成される可能性を下げるために使用される処方薬です。血栓が脚や肺に形成されると、脳卒中、心臓発作、またはその他の深刻な状態を引き起こす可能性があります。
クマジンの副作用は何ですか?
クマジンは、次のような重大な副作用を引き起こす可能性があります。
- 皮膚組織の死(皮膚壊死または壊疽)。 これは、Coumadin を開始した直後に発生する可能性があります。これは、血栓が形成され、体の一部への血流が妨げられるために発生します。体のどこかに痛み、色、または温度の変化がある場合は、すぐに医療提供者に連絡してください。死亡または患部の喪失 (切断) を防ぐために、すぐに医療処置が必要になる場合があります。
- 腎臓の問題。クマジンを服用している人では、腎臓の損傷が起こる可能性があります。尿に血が混じっている場合は、すぐに医療提供者に連絡してください。すでに腎臓に問題がある場合、医療提供者は、クマディンによる治療中に出血をチェックするために、より頻繁に検査を行うことがあります。
- 「紫色のつま先症候群」。 つま先に痛みがあり、色が紫色または暗色に見える場合は、すぐに医療提供者に連絡してください.
これらは、クマジンの副作用のすべてではありません。詳細については、医療提供者または薬剤師にお尋ねください。副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
出血リスク
- COUMADIN は大出血または致命的な出血を引き起こす可能性があります [ 警告と注意事項 ]。
- 治療を受けたすべての患者の INR を定期的にモニタリングする [参照 投薬と管理 ]。
- 薬物、食事の変更、およびその他の要因は、COUMADIN 5mg 療法で達成される INR レベルに影響を与えます [参照 薬物相互作用 ]。
- 出血のリスクを最小限に抑え、出血の徴候と症状を報告するための予防措置について患者に指示する[参照 患者情報 ]。
説明
クマディン(ワルファリンナトリウム)錠および注射用クマディン(ワルファリンナトリウム)には、ビタミンK⌈依存性凝固因子を阻害することにより作用する抗凝固剤であるワルファリンナトリウムが含まれています。ワルファリン ナトリウムの化学名は 3-(α-アセトニルベンジル)-4-ヒドロキシクマリン ナトリウム塩であり、R-および S-エナンチオマーのラセミ混合物です。結晶性ワルファリンナトリウムは、イソプロパノールクラスレートです。その実験式は C19H15NaO4 であり、その構造式は次のように表されます。
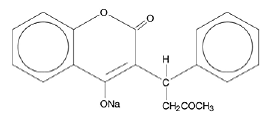
結晶性ワルファリン ナトリウムは、白色で無臭の結晶性粉末で、光によって変色します。水に非常に溶けやすく、アルコールに溶けやすく、クロロホルムとエーテルに非常に溶けにくい。
経口用の COUMADIN 錠には、以下も含まれます。
COUMADIN 1mg の静脈内注射用注射剤は、滅菌凍結乾燥粉末として供給され、2.7 mL 滅菌注射用水で再構成すると、以下が含まれます。
適応症
COUMADIN® は以下の適応があります。
- 静脈血栓症とその進展、肺塞栓症(PE)の予防と治療。
- 心房細動 (AF) および/または心臓弁置換術に伴う血栓塞栓性合併症の予防と治療。
- 死亡、再発性心筋梗塞 (MI)、および心筋梗塞後の脳卒中や全身塞栓などの血栓塞栓イベントのリスクの低減。
使用制限
COUMADIN 2mg は確立された血栓に直接影響を与えず、虚血組織の損傷を元に戻すこともありません。しかし、血栓が発生すると、抗凝固療法の目標は、形成された血栓のさらなる拡大を防ぎ、深刻で致命的な後遺症を引き起こす可能性のある二次的な血栓塞栓合併症を防ぐことです.
投薬と管理
個別投与
COUMADIN 2mg の用量と投与は、薬物に対する患者の INR 反応に従って、患者ごとに個別化する必要があります。患者の INR と治療中の状態に基づいて用量を調整します。示された状態に対する抗凝固療法の期間と強度については、エビデンスに基づく最新の臨床診療ガイドラインを参照してください。
個々の適応症の推奨目標 INR 範囲と期間
4.0 を超える INR は、ほとんどの患者に追加の治療上の利点を提供しないようであり、出血のリスクが高くなります。
静脈血栓塞栓症(深部静脈血栓症 [DVT] および PE を含む)
ワルファリンの投与量を調整して、すべての治療期間で目標 INR 2.5 (INR 範囲、2.0 ~ 3.0) を維持します。
治療期間は、以下の適応症に基づいています。
- 一過性(可逆的)危険因子に続発する DVT または PE の患者には、ワルファリンによる 3 か月間の治療が推奨されます。
- 誘発されていない DVT または PE の患者には、少なくとも 3 か月間はワルファリンによる治療が推奨されます。治療の 3 ヶ月後、個々 の患者の長期治療のリスクと利益の比率を評価します。
- 誘発されない DVT または PE のエピソードが 2 回ある患者には、ワルファリンによる長期治療が推奨されます。長期の抗凝固療法を受けている患者については、個々の患者でそのような治療を継続するリスクベネフィット比を定期的に再評価してください。
心房細動
非弁性心房細動の患者では、ワルファリンで抗凝固療法を行い、INR 2.5 (範囲、2.0 ~ 3.0) を目標にします。
- 持続性または発作性であり、脳卒中のリスクが高い非弁膜性心房細動の患者(すなわち、以下の特徴のいずれかを有する:以前の虚血性脳卒中、一過性脳虚血発作、または全身塞栓症、または以下の危険因子のうちの 2 つを有する:年齢が高い) 75 歳以上、中等度または重度の左心室収縮機能障害および/または心不全、高血圧の既往歴、糖尿病など)、ワルファリンによる長期の抗凝固療法が推奨されます。
- 持続性または発作性であり、虚血性脳卒中のリスクが中程度の非弁膜性心房細動患者 (すなわち、次の危険因子の 1 つを有する: 75 歳以上の年齢、中等度または重度の左心室収縮機能障害および/または心不全) 、高血圧または糖尿病の既往がある場合)、ワルファリンによる長期の抗凝固療法が推奨されます。
- AF および僧帽弁狭窄症の患者には、ワルファリンによる長期の抗凝固療法が推奨されます。
- AF および人工心臓弁を有する患者には、ワルファリンによる長期の抗凝固療法が推奨されます。弁のタイプと位置、および患者の要因に応じて、目標 INR が増加し、アスピリンが追加される場合があります。
機械および生体人工心臓弁
- 大動脈位置にバイリーフレット機械弁または Medtronic Hall (ミネソタ州ミネアポリス) の傾斜ディスク弁を有し、洞調律であり、左心房拡大のない患者には、目標 INR 2.5 (範囲、2.0-3.0) までのワルファリンによる治療がおすすめ。
- 僧帽弁位置に傾斜ディスク弁および二葉機械弁を有する患者には、目標 INR 3.0 (範囲、2.5 ~ 3.5) までのワルファリンによる治療が推奨されます。
- ケージ付きボール弁またはケージ付きディスク弁の患者には、目標 INR 3.0 (範囲、2.5 ~ 3.5) までのワルファリンによる治療が推奨されます。
- 生体弁が僧帽弁位置にある患者には、弁挿入後の最初の 3 か月間、目標 INR 2.5 (範囲、2.0 ~ 3.0) までのワルファリンによる治療が推奨されます。血栓塞栓症の追加の危険因子が存在する場合 (AF、以前の血栓塞栓症、左心室機能障害)、2.5 の目標 INR (範囲、2.0-3.0) が推奨されます。
心筋梗塞後
- 心筋梗塞の高リスク患者(例えば、大きな前方心筋梗塞患者、重大な心不全患者、経胸壁心エコー検査で心内血栓が認められる患者、心房細動患者、血栓塞栓症の既往歴のある患者)には、併用療法中程度の強度 (INR、2.0 ~ 3.0) のワルファリンと低用量のアスピリン (≤100 mg/日) を MI 後少なくとも 3 か月間使用することが推奨されます。
再発性全身塞栓症およびその他の適応症
ワルファリンによる経口抗凝固療法は、心房細動を伴う弁膜症患者、僧帽弁狭窄症の患者、および原因不明の全身性塞栓症の再発患者を対象とした臨床試験では十分に評価されていません。ただし、これらの患者には中程度の用量レジメン (INR 2.0 ~ 3.0) を使用できます。
初期および維持投与
COUMADIN 2mg の適切な初回投与量は、患者によって大きく異なります。ワルファリンの用量変動の原因となるすべての要因がわかっているわけではなく、初期用量は次の影響を受けます。
- 年齢、人種、体重、性別、併用薬、合併症などの臨床的要因
- 遺伝的要因 (CYP2C9 および VKORC1 遺伝子型) [参照 臨床薬理学 ]。
上記の要因を考慮して、予想される維持用量に基づいて初回用量を選択します。患者固有の臨床要因を考慮して、この用量を変更してください。高齢者および/または衰弱した患者、およびアジア人患者では、より低い初回および維持用量を検討する[参照 特定の集団での使用 と 臨床薬理学 ]。ローディングドーズの日常的な使用は、出血やその他の合併症を増加させる可能性があり、血栓形成に対するより迅速な保護を提供しないため、推奨されません.
患者ごとに治療期間を個別化します。一般に、血栓症および塞栓症の危険がなくなるまで、抗凝固療法を継続する必要があります。 個々の適応症の推奨目標 INR 範囲と期間 ]。
遺伝子型を考慮しない推奨投与量
患者の CYP2C9 および VKORC1 遺伝子型が不明な場合、通常、クマジン 1mg の初回投与量は 1 日 1 回 2 ~ 5mg です。 INR 応答を綿密に監視し、治療対象の適応症を考慮して、各患者の投薬ニーズを判断します。典型的な維持用量は、1 日 1 回 2 ~ 10 mg です。
遺伝子型を考慮した推奨投与量
表 1 は、CYP2C9 および VKORC1 遺伝子バリアントの異なる組み合わせを持つ患者のサブグループで観察された 3 つの予想維持 COUMADIN 用量の範囲を示しています [ 臨床薬理学 ]。患者の CYP2C9 および/または VKORC1 の遺伝子型がわかっている場合は、初期用量を選択する際にこれらの範囲を考慮してください。 CYP2C9 *1/*3、*2/*2、*2/*3、および *3/*3 の患者は、所定の投与計画で最大の INR 効果を達成するために、これらの CYP バリアントを持たない患者。
最適な抗凝固療法を達成するためのモニタリング
COUMADIN の治療範囲 (インデックス) は狭く、その作用は他の薬剤や食事中のビタミン K などの要因の影響を受ける可能性があります。したがって、COUMADIN 治療中は抗凝固作用を注意深く監視する必要があります。 INR の結果が治療範囲で安定するまで、初期用量の投与後、INR を毎日決定します。安定化後、定期的な INR を実行して治療範囲内で投与を維持します。 INR を実施する頻度は、臨床状況に基づく必要がありますが、一般的に許容される INR 決定の間隔は 1 ~ 4 週間です。他のワルファリン製品を COUMADIN と交換するとき、および他の薬を開始、中止、または不規則に服用するときはいつでも、追加の INR テストを実行してください。一般的な併用薬であるヘパリンは INR を上昇させる [参照 他の抗凝固薬からの変換 と 薬物相互作用 ]。
全血凝固および出血時間の測定は、クマジン 5mg 治療のモニタリングに有効な手段ではありません。
腎障害
腎不全患者には用量調整は必要ありません。腎機能が低下している患者では、INR をより頻繁にモニタリングして、INR を治療範囲内に維持する [参照 警告と注意事項 と 特定の集団での使用 ]。
飲み忘れ
COUMADIN の抗凝固効果は 24 時間以上持続します。患者が意図した時刻に COUMADIN の服用を逃した場合、患者は同じ日にできるだけ早く服用する必要があります。患者は、逃した用量を補うために、翌日に用量を 2 倍にするべきではありません。
静脈内投与経路
クマジン1mgの静脈内投与量は、経口投与量と同じです。再構成後、注射用 COUMADIN を 1 ~ 2 分かけて末梢静脈にゆっくりとボーラス注射します。
注射用 COUMADIN 2mg は、筋肉内投与には推奨されません。
注射用滅菌水 2.7 mL でバイアルを再構成します。得られた収量は、1 mL あたり 2 mg の溶液 2.5 mL (合計 5 mg) です。非経口医薬品は、溶液と容器が許す限り、投与前に粒子状物質と変色がないか目視検査する必要があります。粒子状物質や変色が認められる場合は使用しないでください。
溶解後、注射用 COUMADIN は室温で 4 時間安定です。抗菌防腐剤は含まれていないため、調製した溶液の無菌性を保証するように注意する必要があります。バイアルは使い捨てです。未使用の溶液は廃棄してください。
歯科および手術中の治療
一部の歯科または外科的処置では、COUMADIN療法の中断または投与量の変更が必要になる場合があります. COUMADIN 2mgを短期間でも中止する場合は、ベネフィットとリスクを考慮してください。歯科または外科手術の直前に INR を決定します。これらの処置の前、最中、または直後に抗凝固療法を受けなければならない低侵襲処置を受けている患者では、INRを治療範囲の下限に維持するようにCOUMADINの投与量を調整することで、抗凝固療法を安全に継続できる可能性があります。
他の抗凝固薬からの変換
ヘパリン
COUMADIN 2mg の完全な抗凝固効果は数日間達成されないため、初期の迅速な抗凝固にはヘパリンが好まれます。 COUMADIN による初期治療中、ヘパリン抗凝固療法による干渉の臨床的意義は最小限です。 COUMADIN への変換は、ヘパリン療法と同時に開始するか、3 ~ 6 日遅れる場合があります。確実な治療的抗凝固作用を得るために、全量のヘパリン療法を継続し、COUMADIN 療法とヘパリンを 4 ~ 5 日間重ね合わせ、COUMADIN 2mg が INR によって決定される望ましい治療反応をもたらすまで、その時点でヘパリンを中止することができます。
ヘパリンは INR に影響を与える可能性があるため、ヘパリンと COUMADIN 1mg の両方を投与されている患者は、少なくとも INR を監視する必要があります。
- ヘパリンの最後の静脈内ボーラス投与から 5 時間後、または
- ヘパリンの持続静脈内注入の中止から 4 時間後、または
- 最後のヘパリン皮下注射から 24 時間後。
COUMADIN 1mg は、ヘパリンがなくても、活性化部分トロンボプラスチン時間 (aPTT) テストを増加させる可能性があります。 INR が望ましい範囲内にある aPTT の重度の上昇 (>50 秒) は、術後出血のリスクが高いことを示すものとして特定されています。
その他の抗凝固剤
COUMADIN への変換に関する指示については、他の抗凝固剤のラベルを参照してください。
供給方法
剤形と強度
錠剤
COUMADIN シングルスコア錠
注射用
注射用: 5 mg、単回投与バイアル中の凍結乾燥粉末。
保管と取り扱い
錠剤
COUMADIN 錠剤は、片面に 1、2、2-1/2、3、4、5、6、7-1/2、または 10 の数字が重ねて刻印され、「COUMADIN」と刻印され、反対面にはシングルスコアが付けられています。プレーン。 COUMADIN は、次のような効力と色のボトルと病院単位用量のブリスター パッケージで入手できます。
光と湿気から保護してください。制御された室温 (59°-86°F、15°-30°C) で保管してください。 USP で定義されているように、密閉された耐光性容器に分注してください。
病院の単位用量ブリスターパッケージは、中身が使用されるまでカートンに保管してください。
注入
クマディン 注射バイアルの場合、2.7 mL の滅菌注射用水で再構成した後、5 mg のワルファリンが得られます (最大収量は 2 mg/mL 溶液の 2.5 mL です)。バイアルの正味内容は、凍結乾燥粉末 5.4 mg です。
5mgバイアル(6本入り箱) - NDC 0590-0324-35
光から保護します。バイアルは使用するまで箱に入れて保管してください。制御された室温 (59°-86°F、15°- 30°C) で保管してください。
再構成後、制御された室温 (59°-86°F、15°-30°C) で保管し、4 時間以内に使用してください。
冷蔵しないでください。未使用の溶液は廃棄してください。
特殊な取り扱い
潜在的に危険な薬物の適切な取り扱いと廃棄の手順を検討する必要があります。
このテーマに関するガイドラインが公開されました [ 参考文献を参照 ]。
妊娠中の薬局および臨床関係者は、粉砕または破損した錠剤への曝露を避ける必要があります [参照 特定の集団での使用 ]。
参考文献
OSHA 有害薬物。 OSHA。 http://www.osha.gov/SLTC/hazardousdrugs/index.html。
販売元: Bristol-Myers Squibb Company, Princeton, New Jersey 08543 USA.改訂: 2017 年 6 月
副作用
COUMADIN 2mg に対する次の重篤な副作用については、ラベルの他のセクションで詳しく説明しています。
- 出血[参照 ボックス警告 、 警告と注意事項 と 過剰摂取 ]
- 組織壊死 [参照 警告と注意事項 ]
- カルシフィラキシー [参照 警告と注意事項 ]
- 急性腎障害 [参照 警告と注意事項 ]
- 全身性アテローム塞栓症およびコレステロール微小塞栓症 [参照 警告と注意事項 ]
- HIT および HITTS 患者における四肢の虚血、壊死、および壊疽 [参照 警告と注意事項 ]
- リスクが高いその他の臨床環境 [参照 警告と注意事項 ]
COUMADIN 1mg のその他の副作用には、次のようなものがあります。
- 免疫系障害:過敏症・アレルギー反応(蕁麻疹、アナフィラキシー反応を含む)
- 血管障害:血管炎
- 肝胆道障害:肝炎、肝酵素の上昇。胆汁うっ滞性肝炎は、クマジンとチクロピジンの同時投与に関連しています。
- 胃腸障害:吐き気、嘔吐、下痢、味覚異常、腹痛、鼓腸、膨満感
- 皮膚障害:発疹、皮膚炎(水疱性皮疹を含む)、そう痒症、脱毛症
- 呼吸器障害:気管または気管気管支の石灰化
- 一般障害:悪寒
薬物相互作用
薬物は、薬力学的または薬物動態メカニズムを通じて COUMADIN 5mg と相互作用する可能性があります。 COUMADIN 2mg との薬物相互作用の薬力学的メカニズムは、相乗作用 (止血障害、凝固因子合成の低下)、競合的拮抗作用 (ビタミン K)、およびビタミン K 代謝の生理学的制御ループの変化 (遺伝的耐性) です。 COUMADIN との薬物相互作用の薬物動態メカニズムは、主に酵素誘導、酵素阻害、および血漿タンパク質結合の減少です。一部の薬物は、複数のメカニズムによって相互作用する可能性があることに注意することが重要です。植物薬を含む他の薬を開始または中止するとき、または短期間の使用を目的とした薬(例、抗生物質、抗真菌薬、コルチコステロイド)を含む他の薬の投与量を変更するときは、より頻繁に INR モニタリングを実施する必要があります。 ボックス警告 ]。
COUMADIN との相互作用または出血に関連する有害反応に関する詳細情報を入手するには、同時に使用されるすべての薬物のラベルを参照してください。
CYP450 相互作用
ワルファリンの代謝に関与する CYP450 アイソザイムには、CYP2C9、2C19、2C8、2C18、1A2、および 3A4 が含まれます。より強力なワルファリンの S-エナンチオマーは CYP2C9 によって代謝され、R-エナンチオマーは CYP1A2 および 3A4 によって代謝されます。
- CYP2C9、1A2、および/または 3A4 の阻害剤は、ワルファリンへの曝露を増やすことによって、ワルファリンの効果を高める (INR を高める) 可能性があります。
- CYP2C9、1A2、および/または 3A4 の誘導物質は、ワルファリンへの曝露を減らすことにより、ワルファリンの効果を減少させる (INR を減少させる) 可能性があります。
CYP2C9、1A2、および 3A4 の阻害剤および誘導剤の例を以下の表 2 に示します。ただし、このリストは包括的なものと見なすべきではありません。 CYP450 相互作用の可能性に関する詳細情報を得るには、同時に使用されるすべての薬物のラベルを参照してください。併用薬の開始、中止、または用量変更の際には、CYP450 の阻害および誘導の可能性を考慮する必要があります。併用薬が CYP2C9、1A2、および/または 3A4 阻害剤または誘導剤である場合は、INR を注意深く監視します。
出血リスクを高める薬
出血のリスクを高めることが知られている薬剤の例を表 3 に示します。これらの薬剤をワルファリンと併用すると出血のリスクが高まるため、ワルファリンを併用している患者を注意深く監視してください。
抗生物質と抗真菌剤
ワルファリンと抗生物質または抗真菌薬を服用している患者の INR の変化が報告されていますが、臨床薬物動態研究では、ワルファリンの血漿濃度に対するこれらの薬剤の一貫した効果は示されていません。
ワルファリンを服用している患者の抗生物質または抗真菌薬を開始または停止するときは、INR を注意深く監視してください。
植物(ハーブ)製品と食品
植物薬を開始または停止するときは、より頻繁に INR モニタリングを実行する必要があります。
植物と COUMADIN 2mg の間の代謝および/または薬理学的相互作用の可能性を評価する、十分に管理された適切な研究はほとんどありません。植物性医薬品の製造標準化が行われていないため、有効成分の量が異なる場合があります。これは、抗凝固に対する潜在的な相互作用と効果を評価する能力をさらに混乱させる可能性があります。
一部の植物は、単独で摂取すると出血イベントを引き起こす可能性があり (例えば、ニンニクやイチョウ葉)、抗凝固、抗血小板、および/または線維素溶解特性を有する可能性があります。これらの効果は、クマジンの抗凝固効果に相加的であると予想されます。逆に、いくつかの植物は、クマジンの効果を減少させる可能性があります(例:コエンザイムQ10、オトギリソウ、高麗人参)。一部の植物や食品は、CYP450 相互作用を介して COUMADIN 2mg と相互作用する可能性があります (例: エキナセア、グレープフルーツ ジュース、イチョウ、ゴールデンシール、セントジョーンズワート)。
食品中のビタミン K の量は、クマディンによる治療に影響を与える可能性があります。 COUMADIN 1mg を服用している患者には、一定量のビタミン K を維持しながら、通常のバランスの取れた食事をとるようにアドバイスしてください。
警告
の一部として含まれています "予防" セクション
予防
出血
COUMADIN は大出血または致命的な出血を引き起こす可能性があります。出血は、最初の 1 か月以内に発生する可能性が高くなります。出血の危険因子には、高強度の抗凝固療法 (INR > 4.0)、65歳以上の年齢、変動性の高いINRの既往、消化管出血の既往、高血圧、脳血管疾患、貧血、悪性腫瘍、外傷、腎障害、特定の遺伝的要因が含まれます。要因 [参照 臨床薬理学 ]、特定の併用薬 [参照 薬物相互作用 ]、およびワルファリン療法の長期。
治療を受けたすべての患者の INR を定期的にモニタリングします。出血のリスクが高い人は、より頻繁な INR モニタリング、望ましい INR への慎重な用量調整、および臨床状態に適した最短の治療期間から恩恵を受ける可能性があります。ただし、INR を治療範囲内に維持しても、出血のリスクがなくなるわけではありません。
薬物、食事の変更、およびその他の要因は、COUMADIN 1mg 療法で達成される INR レベルに影響を与えます。植物薬を含む他の薬を開始または中止するとき、または他の薬の投与量を変更するときは、より頻繁に INR モニタリングを実行します。 薬物相互作用 ]。
出血のリスクを最小限に抑え、出血の徴候と症状を報告するための予防措置について患者に指示する[参照 患者情報 ]。
組織壊死
皮膚やその他の組織の壊死および/または壊疽はまれですが、深刻なリスクです (
壊死が基礎疾患によって引き起こされているかどうかを判断するには、慎重な臨床評価が必要です。さまざまな治療法が試みられてきましたが、一様に効果があると考えられている壊死の治療法はありません。壊死が発生した場合は、COUMADIN 5mg の治療を中止してください。抗凝固療法の継続が必要な場合は、代替薬を検討してください。
カルシフィラキシー
致死的かつ重篤なカルシフィラキシーまたはカルシウム尿毒症性動脈障害が、末期腎疾患の有無にかかわらず患者で報告されています。これらの患者でカルシフィラキシーが診断された場合は、クマジン 5mg を中止し、必要に応じてカルシフィラキシーを治療してください。代替の抗凝固療法を検討してください。
急性腎障害
糸球体の完全性が変化した患者または腎疾患の既往がある患者では、おそらく過度の抗凝固療法および血尿のエピソードに関連して、COUMADIN 2mg で急性腎障害が発生する可能性がある [参照 特定の集団での使用 ]。腎機能が低下している患者では、抗凝固療法をより頻繁にモニタリングすることをお勧めします。
全身性アテローム塞栓症およびコレステロール微小塞栓症
COUMADIN による抗凝固療法は、アテローム性プラーク塞栓の放出を促進する可能性があります。全身性アテローム塞栓症とコレステロール微小塞栓症は、塞栓部位に応じてさまざまな徴候と症状を示します。最も一般的に関与する内臓は腎臓であり、膵臓、脾臓、肝臓がそれに続きます。壊死や死亡に至るケースもある。足への微小塞栓から生じる明確な症候群は、「紫色のつま先症候群」として知られています。このような現象が観察された場合は、クマディン治療を中止してください。抗凝固療法の継続が必要な場合は、代替薬を検討してください。
HITおよびHITTS患者における四肢の虚血、壊死および壊疽
ヘパリン誘発性血小板減少症(HIT)および血栓症症候群を伴うヘパリン誘発性血小板減少症(HITTS)の患者の初期治療として COUMADIN を使用しないでください。ヘパリン治療を中止し、ワルファリン治療を開始または継続した HIT および HITTS 患者で、四肢の虚血、壊死、および壊疽の症例が発生しています。一部の患者では、後遺症として患部の切断および/または死亡が含まれています。 COUMADIN による治療は、血小板数が正常化した後に考慮することができます。
人工心臓弁を持つ妊婦への使用
COUMADIN を妊婦に投与すると、胎児に害を及ぼす可能性があります。 COUMADINは妊娠中は禁忌ですが、COUMADIN 1mgを使用する潜在的な利点は、血栓塞栓症のリスクが高い機械的心臓弁を持つ妊婦のリスクを上回る可能性があります.これらの個々の状況では、COUMADIN 2mg の開始または継続の決定は、個々の患者の医学的状況に関連する特定のリスクと利点、および最新の医療ガイドラインを考慮して、患者と一緒に検討する必要があります。妊娠中の COUMADIN への暴露は、主要な先天性奇形 (ワルファリン胚症および胎児毒性)、致命的な胎児出血、および自然流産および胎児死亡のリスク増加の認識されたパターンを引き起こします。妊娠中にこの薬を使用する場合、または患者がこの薬を服用中に妊娠した場合、患者は胎児への潜在的な危険性について知らされるべきです[ 特定の集団での使用 ]。
リスクが高いその他の臨床環境
以下の臨床環境では、クマジン療法のリスクが高まる可能性があります。
- 中等度から重度の肝障害
- 感染症または腸内細菌叢の障害(例、スプルー、抗生物質療法)
- 留置カテーテルの使用
- 重度から中等度の高血圧
- プロテイン C を介した抗凝固反応の欠乏: COUMADIN は、天然に存在する抗凝固剤であるプロテイン C およびプロテイン S の合成を低下させます。プロテイン C またはその補因子であるプロテイン S の遺伝的または後天的な欠乏は、ワルファリン投与後の組織壊死と関連しています。 COUMADIN 2mg による治療開始時にヘパリンによる抗凝固療法を 5 ~ 7 日間併用することで、これらの患者の組織壊死の発生を最小限に抑えることができます。
- 眼科手術: 白内障手術では、COUMADIN の使用は、鋭利な針および局所麻酔ブロックの軽度の合併症の有意な増加と関連していましたが、潜在的に視力を脅かす手術出血性合併症とは関連していませんでした。 COUMADIN 5mgの中止または減量は深刻な血栓塞栓性合併症につながる可能性があるため、水晶体手術などの比較的低侵襲で複雑な眼科手術の前にCOUMADINを中止する決定は、利点と比較検討した抗凝固療法のリスクに基づいて行う必要があります.
- 真性赤血球増加症
- 血管炎
- 糖尿病
INR に影響を与える内因性要因
次の要因が INR 反応の増加に関与している可能性があります: 下痢、肝障害、栄養不良、脂肪便、またはビタミン K 欠乏。
次の要因が INR 応答の低下の原因である可能性があります: ビタミン K 摂取量の増加または遺伝的なワルファリン耐性.
患者相談情報
患者に、FDA 承認の患者ラベル ( 投薬ガイド )。
患者への指示
患者に次のことをアドバイスします。
- 処方された投与スケジュールを厳守してください [参照 投薬と管理 ]。
- 処方されたクマジン 1mg を飲み忘れた場合は、その日のうちにできるだけ早く服用してください。ただし、飲み忘れを補うために翌日にクマジン 5mg を 2 回服用しないでください。 投薬と管理 ]。
- プロトロンビン時間検査を受け、医師または診療所を定期的に訪問して治療を監視します[ 投薬と管理 ] .
- COUMADIN による治療が中止された場合、COUMADIN 5mg の抗凝固効果が約 2 ~ 5 日間持続する可能性があることに注意してください。 臨床薬理学 ]。
- 外傷の原因となる可能性のある活動やスポーツは避けてください。 特定の集団での使用 ]。また、頻繁に転倒する場合は、合併症のリスクが高まる可能性があるため、医師に伝えてください。
- ビタミン K の一貫した摂取を維持するために、通常のバランスの取れた食事をとってください。葉物野菜を大量に食べるなど、食生活を大幅に変更することは避けてください。 薬物相互作用 ]。
- 医師に連絡して、重度の下痢、感染症、発熱などの深刻な病気を報告してください [参照 警告と注意事項 と 有害反応 ]。
- COUMADINを服用していることを示す身分証明書を携帯してください。
出血のリスク
患者にアドバイスする
- 異常な出血や症状が発生した場合は、直ちに医師に連絡してください。出血の兆候と症状には、痛み、腫れまたは不快感、切り傷からの長期出血、月経出血または膣出血の増加、鼻血、ブラッシングによる歯茎の出血、異常な出血またはあざ、赤または暗褐色の尿、赤またはタール黒色の便、頭痛、めまい、または衰弱[参照 ボックス警告 と 警告と注意事項 ]。
併用薬および植物薬(ハーブ)
患者に次のことをアドバイスします。
- 医師の助言がない限り、サリチル酸塩(例えば、アスピリンや局所鎮痛薬)、その他の市販薬、および植物(ハーブ)製品を含む他の薬を服用または中止しないでください[ 薬物相互作用 ]。
妊娠と授乳
患者に次のことをアドバイスします。
- 主治医に連絡する
- 妊娠していると思われる場合は直ちに[参照 特定の集団での使用 ]、
- 妊娠計画について話し合う [参照 特定の集団での使用 ]、
- 母乳育児を検討している場合 [参照 特定の集団での使用 ]。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
ワルファリンによる発がん性、変異原性、生殖能力に関する研究は行われていません。
特定の集団での使用
妊娠
リスクの概要
COUMADIN 1mg は、血栓塞栓症のリスクが高く、機械的心臓弁を持つ妊婦を除き、妊娠中の女性には禁忌であり、その場合、COUMADIN 5mg の利点がリスクを上回る可能性がある [参照 警告と注意事項 ]。 COUMADIN 1mg は胎児に害を及ぼす可能性があります。妊娠初期にワルファリンに曝露すると、曝露した子孫の約 5% に先天性奇形のパターンが生じました。これらのデータは十分に管理された研究で収集されたものではないため、この重大な先天性欠損症の発生率は、対照群または米国の一般集団における推定発生率と比較するための適切な根拠ではなく、実際に観察された発生率を反映していない可能性があります。 COUMADIN を妊娠中の女性に処方する場合は、COUMADIN の利点とリスク、および胎児へのリスクの可能性を考慮してください。
妊娠中の有害な結果は、母親の健康状態や薬の使用に関係なく発生します。示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2% ~ 4% および 15% ~ 20% です。
臨床上の考慮事項
胎児/新生児の有害反応
ヒトでは、ワルファリンは胎盤を通過し、胎児血漿中の濃度は母体の値に近づきます。妊娠初期にワルファリンに曝露すると、曝露した子孫の約 5% に先天性奇形のパターンが生じました。ワルファリン胚症は、点状の骨端を伴うまたは伴わない鼻形成不全(点状軟骨異形成)および成長遅延(低出生体重を含む)を特徴とする。脳梁の無形成を特徴とする背側正中異形成、ダンディ・ウォーカー奇形、正中小脳萎縮、視神経萎縮を特徴とする腹側正中異形成など、中枢神経系および眼の異常も報告されています。精神遅滞、失明、統合失調症、小頭症、水頭症、およびその他の有害な妊娠転帰が、妊娠の第 2 および第 3 トリメスターにおけるワルファリン曝露後に報告されています [参照 禁忌 ]。
授乳
リスクの概要
限定的に発表された研究によると、ワルファリンで治療された母親の母乳にはワルファリンは存在しませんでした。母乳育児中の乳児の出血を含む深刻な副作用の可能性があるため、母乳育児の発達上および健康上の利点と、母親の COUMADIN の臨床的必要性、および COUMADIN 2mg または母体の基礎疾患による母乳育児中の乳児への潜在的な悪影響を考慮してください。授乳中の女性に COUMADIN 5mg を処方する前に。
臨床上の考慮事項
授乳中の乳児のあざや出血を監視します。
データ
ヒューマンデータ
15 人の授乳中の母親の公開データに基づくと、ワルファリンは母乳から検出されませんでした。満期産の新生児 15 人のうち、乳児 6 人のプロトロンビン時間が予想範囲内であることが記録されていました。他の 9 人の乳児のプロトロンビン時間は得られませんでした。未熟児への影響は評価されていません。
生殖能力のある雌と雄
妊娠検査
COUMADIN は胎児に害を及ぼす可能性がある [参照 特定の集団での使用 ]。
COUMADIN 療法を開始する前に、生殖能力のある女性の妊娠状態を確認してください。
避妊
女性
生殖能力のある女性には、治療中および COUMADIN の最終投与後少なくとも 1 か月は効果的な避妊法を使用するようにアドバイスしてください。
小児用
COUMADIN を使用した適切で十分に管理された研究は、どの小児集団でも実施されておらず、小児患者における最適な投与量、安全性、有効性は不明です。小児における COUMADIN の使用は、成人のデータと推奨に基づいており、観察研究と患者登録から入手可能な限られた小児データに基づいています。 COUMADIN 1mg を投与された小児患者は、外傷につながる可能性のある活動やスポーツを避ける必要があります。
乳児および小児における止血システムの発達は、血栓症および抗凝固剤に対する反応の生理機能の変化をもたらします。小児集団におけるワルファリンの投与量は、患者の年齢によって異なり、一般的に乳児が最も高く、青年期は、目標 INR を維持するためのキログラムあたりのミリグラムの必要量が最も少なくなります。年齢、併用薬、食事、および既存の病状によってワルファリンの必要量が変化するため、小児患者では目標 INR 範囲を達成および維持することが困難な場合があり、より頻繁な INR 測定が推奨されます。
出血率は、小児観察研究および患者登録において、患者集団および臨床ケアセンターによって異なりました。
乳児用調合乳を含むビタミン K を含む栄養を摂取している乳児および小児は、ワルファリン療法に耐性がある可能性がありますが、母乳で育てられた乳児はワルファリン療法に敏感である可能性があります。
高齢者の使用
対照臨床試験でワルファリンナトリウムを投与され、分析可能なデータが得られた患者の総数のうち、1885 人の患者 (24.4%) が 65 歳以上で、185 人の患者 (2.4%) が 75 歳以上でした。これらの患者と若い患者の間で有効性または安全性に全体的な違いは観察されませんでしたが、一部の高齢者の感度が高いことは除外できません。
60 歳以上の患者は、ワルファリンの抗凝固効果に対して予想以上の INR 反応を示すようです [ 臨床薬理学 ]。 COUMADIN は、監視されていない老化のある患者には禁忌です。いかなる状況においても、また出血の危険性が高い身体的状態においても、年配の患者に COUMADIN を投与する際には注意してください。高齢患者では COUMADIN の開始用量と維持用量を減らすことを検討する [参照 投薬と管理 ]。
腎障害
腎クリアランスは、ワルファリンに対する抗凝固反応の小さな決定因子であると考えられています。腎障害のある患者には用量調節は必要ありません。ワルファリンを服用している腎障害のある患者に、より頻繁に INR を監視するように指示する [ 警告と注意事項 ]。
肝障害
肝障害は、凝固因子の合成障害およびワルファリンの代謝低下を通じて、ワルファリンへの反応を増強する可能性があります。これらの患者に COUMADIN を使用する場合は注意してください。
過剰摂取
徴候と症状
出血(例,便または尿中の血液の出現,血尿,過度の月経出血,下血,点状出血,表在性外傷による過度のあざまたは持続的な出血,説明のつかないヘモグロビンの低下)は,過剰な抗凝固作用の徴候である。
処理
過剰な抗凝固療法の治療は、INR のレベル、出血の有無、および臨床状況に基づいています。 COUMADIN 2mg 抗凝固療法の逆転は、COUMADIN 1mg 治療を中止し、必要に応じて経口または非経口ビタミン K1 を投与することによって得ることができます。
ビタミン K1 の使用は、その後の COUMADIN 療法に対する反応を低下させ、長期にわたる INR が急速に逆転した後、患者は治療前の血栓状態に戻る可能性があります。 COUMADIN 2mg の投与を再開すると、ビタミン K の効果が逆転し、慎重な投与量の調整によって治療上の INR を再び得ることができます。迅速な再抗凝固療法が必要な場合、初期治療にはヘパリンが望ましい場合があります。
COUMADIN 2mg の効果を無効にする必要がある場合は、プロトロンビン複合体濃縮物 (PCC)、新鮮凍結血漿、または活性化された第 VII 因子治療を考慮することができます。肝炎やその他のウイルス性疾患のリスクは、血液製剤の使用に関連しています。 PCC および活性化された第 VII 因子も、血栓症のリスクの増加と関連しています。したがって、これらの製剤は、クマジン 2 mg の過剰摂取に起因する例外的または生命を脅かす出血エピソードにのみ使用する必要があります。
禁忌
COUMADIN 1mg は以下に禁忌です:
- 妊娠
COUMADIN 2mg は、血栓塞栓症のリスクが高い人工心臓弁を持つ妊婦を除き、妊娠中の女性には禁忌です [ 警告と注意事項 と 特定の集団での使用 ]。 COUMADIN 2mg を妊婦に投与すると、胎児に害を及ぼす可能性があります。妊娠中の COUMADIN への暴露は、主要な先天性奇形 (ワルファリン胚症および胎児毒性)、致命的な胎児出血、および自然流産および胎児死亡のリスク増加の認識されたパターンを引き起こします。 COUMADIN を妊娠中に使用する場合、または患者がこの薬の服用中に妊娠した場合、患者は胎児への潜在的な危険性について知らされるべきである [参照 特定の集団での使用 ]。
COUMADIN は、以下の患者には禁忌です。
- 出血傾向または血液疾患
- 最近または予定されている中枢神経系または眼の手術、または外傷性手術で大きな開口部が生じた[参照 警告と注意事項 ]
- 以下に関連する出血傾向:
- 消化管、泌尿生殖器、気道の活動性潰瘍または明らかな出血
- 中枢神経系出血
- 脳動脈瘤、大動脈解離
- 心膜炎および心嚢液貯留
- 細菌性心内膜炎
- 切迫流産、子癇、子癇前症
- 高レベルの不遵守の可能性に関連する状態にある監視されていない患者
- 制御不能な出血の可能性がある脊髄穿刺およびその他の診断または治療処置
- ワルファリンまたは本製品のその他の成分に対する過敏症(アナフィラキシーなど)[参照 有害反応 ]
- 主な局所麻酔または腰椎ブロック麻酔
- 悪性高血圧
臨床薬理学
作用機序
ワルファリンは、因子 II、VII、IX、および X、および抗凝固タンパク質 C および S を含むビタミン K 依存性凝固因子の合成を阻害することによって作用します。依存凝固因子。ビタミン K は、生物活性に不可欠なタンパク質の γ-カルボキシグルタミン酸残基の生合成を促進します。ワルファリンは、ビタミン K エポキシド レダクターゼ (VKORC1) 酵素複合体の C1 サブユニットを阻害することにより、凝固因子の合成を妨害し、それによってビタミン K1 エポキシドの再生を減少させると考えられています。 ファーマコゲノミクス ]。
薬力学
抗凝固効果は通常、ワルファリン投与後 24 時間以内に現れます。ただし、抗凝固効果のピークは 72 ~ 96 時間遅れる場合があります。ラセミ体ワルファリンの単回投与の作用持続時間は2~5日です。 COUMADIN 1mg の効果は、毎日の維持用量の効果が重なるにつれて、より顕著になる可能性があります。これは、影響を受けるビタミン K 依存性凝固因子および抗凝固タンパク質の半減期と一致しています: 第 II 因子 - 60 時間、VII - 4 ~ 6 時間、IX - 24 時間、X - 48 ~ 72 時間、およびプロテイン C および S はそれぞれ約8時間と30時間。
薬物動態
COUMADIN は、ワルファリンの R-鏡像異性体と S-鏡像異性体のラセミ混合物です。 S-エナンチオマーは、ヒトにおいて R-エナンチオマーよりも 2 ~ 5 倍の抗凝固活性を示しますが、一般にクリアランスはより迅速です。
吸収
ワルファリンは、経口投与後、基本的に完全に吸収され、通常最初の 4 時間以内に最高濃度に達します。
分布
ワルファリンは、約 0.14 L/kg の比較的小さな見かけの分布容積に分布します。水溶液を急速に静脈内または経口投与した後、6~12時間続く分布期が見られます。薬剤の約 99% は血漿タンパク質に結合します。
代謝
ワルファリンの除去は、ほぼ完全に代謝によって行われます。ワルファリンは、肝シトクロム P-450 (CYP450) ミクロソーム酵素によって立体選択的に代謝され、不活性なヒドロキシル化代謝物 (主な経路) になり、レダクターゼによって還元された代謝物 (ワルファリン アルコール) に最小限の抗凝固活性で代謝されます。ワルファリンの同定された代謝物には、デヒドロワルファリン、2 つのジアステレオ異性体アルコール、および 4'-、6-、7-、8-、および 10-ヒドロキシワルファリンが含まれます。ワルファリンの代謝に関与する CYP450 アイソザイムには、CYP2C9、2C19、2C8、2C18、1A2、および 3A4 が含まれます。多形酵素である CYP2C9 は、ワルファリンの in vivo 抗凝固活性を調節するヒト肝臓 CYP450 の主要な形態である可能性があります。 CYP2C9 対立遺伝子のバリアントが 1 つ以上ある患者では、S-ワルファリンのクリアランスが低下している [参照 ファーマコゲノミクス ]。
排泄
ワルファリンの単回投与後の半減期は約 1 週間です。しかし、有効な半減期は 20 時間から 60 時間の範囲で、平均して約 40 時間です。通常、R-ワルファリンのクリアランスは S-ワルファリンの半分です。したがって、分布量が類似しているため、ルワルファリンの半減期は S-ワルファリンの半減期よりも長くなります。 R ワルファリンの半減期は 37 時間から 89 時間、S ワルファリンの半減期は 21 時間から 43 時間です。放射性標識された薬物を使用した研究では、経口投与された用量の最大 92% が尿中に回収されることが実証されています。ワルファリンがそのまま尿中に排泄されることはほとんどありません。尿中排泄は代謝産物の形で行われます。
高齢患者
60 歳以上の患者は、ワルファリンの抗凝固効果に対して予想以上の INR 反応を示すようです。この年齢層におけるワルファリンの抗凝固効果に対する感受性の増加の原因は不明ですが、薬物動態学的要因と薬力学的要因の組み合わせによる可能性があります。限られた情報では、S-ワルファリンのクリアランスに差がないことが示唆されています。ただし、若年者と比較して、高齢者では R-ワルファリンのクリアランスがわずかに減少する可能性があります。したがって、患者の年齢が上がるにつれて、通常、治療レベルの抗凝固作用を得るために必要なワルファリンの用量は少なくなります[ 投薬と管理 ]。
アジアの患者
アジアの患者は、ワルファリンの開始用量と維持用量を減らす必要がある場合があります。さまざまな適応症のためにワルファリンで安定した 151 人の中国人外来患者を対象とした非対照研究では、2 ~ 2.5 の INR を達成するために 3.3 ± 1.4 mg の 1 日平均ワルファリン必要量が報告されました。患者の年齢は、これらの患者のワルファリン必要量の最も重要な決定要因であり、年齢が上がるにつれてワルファリン必要量が次第に低くなりました。
ファーマコゲノミクス
CYP2C9 および VKORC1 多型
ワルファリンの S-エナンチオマーは、主に多型酵素である CYP2C9 によって 7-ヒドロキシワルファリンに代謝されます。バリアント対立遺伝子 CYP2C9*2 および CYP2C9*3 は、in vitro での CYP2C9 酵素による S-ワルファリンの 7-ヒドロキシル化を減少させます。白人におけるこれらの対立遺伝子の頻度は、CYP2C9*2 と CYP2C9*3 でそれぞれ約 11% と 7% です。
酵素活性の低下に関連するその他の CYP2C9 対立遺伝子は、アフリカ系集団の *5、*6、および *11 対立遺伝子や、白人の *5、*9、および *11 対立遺伝子など、より低い頻度で発生します。
ワルファリンは、多タンパク質酵素複合体である VKOR を阻害することにより、ビタミン K サイクルにおけるビタミン K エポキシドからのビタミン K の再生を減少させます。 VKORC1 遺伝子の特定の一塩基多型 (.1639G>A など) は、可変のワルファリン用量要件と関連付けられています。
VKORC1 および CYP2C9 遺伝子バリアントは、一般に、ワルファリンの必要用量における既知の変動性の最大の割合を説明しています。
CYP2C9 および VKORC1 の遺伝子型情報が入手できれば、ワルファリンの初回投与量の選択に役立ちます。 投薬と管理 ]。
臨床研究
心房細動
非リウマチ性心房細動患者 3,711 人を対象とした 5 つの前向き無作為対照臨床試験で、ワルファリンは脳卒中を含む全身性血栓塞栓症のリスクを有意に低下させました(表 4 を参照)。リスク低減は、1 つの試験 (CAFA: 45%) を除くすべてで 60% から 86% の範囲でした。これらの試験のうち 2 つの試験で肯定的な結果が発表されたため、早期に中止されました。これらの試験における大出血の発生率は、0.6% から 2.7% の範囲でした (表 4 を参照)。
心房細動と僧帽弁狭窄症の患者を対象とした試験では、クマディンによる抗凝固療法の利点が示唆されている[参照 投薬と管理 ]。
機械および生体人工心臓弁
機械的人工心臓弁を持つ 254 人の患者を対象としたプロスペクティブ、無作為化、非盲検、陽性対照研究では、ジピリダモール/アスピリンで治療された患者と比較して、ワルファリンのみで治療された患者で血栓塞栓症のない期間が有意に長いことがわかりました (p.
機械的人工心臓弁を持つ 258 人の患者における中等度 (INR 2.65) と高強度 (INR 9.0) のワルファリン療法を比較した前向き非盲検臨床研究では、血栓塞栓症が 2 つのグループで同様の頻度で発生しました (100 回あたり 4.0 および 3.7 イベント)。それぞれ患者年)。大出血は、強度の高いグループでより一般的でした。この調査の結果を表 6 に示します。
210 人の患者を対象とした無作為化試験で、組織心臓弁置換術後の 3 か月間の 2 つの強度のワルファリン療法 (INR 2.0 ~ 2.25 対 INR 2.5 ~ 4.0) を比較したところ、血栓塞栓症が 2 つのグループで同様の頻度で発生しました (主要な塞栓イベント2.0% 対 1.9%、軽度の塞栓イベントはそれぞれ 10.8% 対 10.2%)。大出血は、強度の低い INR グループではゼロであったのに対し、強度の高い INR グループでは 4.6% の患者で発生しました。
心筋梗塞
WARIS (The Warfarin Re-Infarction Study) は、2.8 から 4.8 の目標 INR までワルファリンで治療された、梗塞後 2 から 4 週間の 1214 人の患者の二重盲検無作為試験でした。主要評価項目は、総死亡率と再発性梗塞の複合でした。脳血管イベントの副次評価項目が評価されました。患者の平均追跡期間は 37 か月でした。血管死の分析を含む、各エンドポイントの結果を表 7 に示します。
WARIS II (The Warfarin, Aspirin, Re-Infarction Study) は、急性心筋梗塞で入院した 3,630 人の患者を対象とした非盲検無作為化試験で、目標 INR 2.8 ~ 4.2、アスピリン 160 mg/日、またはワルファリンを目標 INR 2.8 ~ 4.2 で治療しました。目標 INR 2.0 ~ 2.5 に加えて、退院前に 1 日あたりアスピリン 75 mg。主要エンドポイントは、死亡、非致死的再梗塞、または血栓塞栓性脳卒中の複合でした。平均観察期間は約4年でした。 WARIS II の結果を表 8 に示します。
ワルファリンを投与された 2 つのグループでは、アスピリンのみを投与されたグループよりも約 4 倍多くの大出血エピソードがありました。アスピリンとワルファリンを併用した患者では、ワルファリンのみを投与された患者よりも大出血エピソードの頻度は高くありませんでしたが、小出血エピソードの発生率は併用療法群で高かった.
患者情報
クマジン® (COU-ma-din) (ワルファリンナトリウム)
COUMADIN 5mg について知っておくべき最も重要な情報は何ですか?
COUMADIN は、重篤な出血を引き起こし、時には死に至ることもあります。これは、クマディンが体内で血栓が形成される可能性を低下させる血液希釈剤であるためです.
- COUMADIN を服用している場合、出血のリスクが高くなる可能性があります。
- 65歳以上である
- 胃または腸の出血の病歴がある
- 血圧が高い(高血圧症)
- 脳卒中または「ミニ脳卒中」(一過性脳虚血発作またはTIA)の病歴がある
- 深刻な心臓病を患っている
- 低血球数または癌を患っている
- 事故や手術などの外傷を負った
- 腎臓に問題がある
- 次のような出血のリスクを高める他の薬を服用してください。
- ヘパリンを含む薬
- 血栓を予防または治療するための他の薬
- 非ステロイド系抗炎症薬(NSAID)
- ワルファリンナトリウムを長期間服用する。クマジンの有効成分はワルファリンナトリウムです。
これらの薬を服用している場合は、医療提供者に伝えてください。あなたの薬が上記のものであるかどうかわからない場合は、医療提供者に尋ねてください.
他の多くの医薬品が COUMADIN 1mg と相互作用し、必要な用量に影響を与えたり、COUMADIN 1mg の副作用を増加させたりする可能性があります。医療提供者に相談する前に、薬を変更または中止したり、新しい薬を開始したりしないでください。
COUMADINを服用している間は、ワルファリンナトリウムを含む他の薬を服用しないでください.
- COUMADIN に対する反応を確認するために、定期的な血液検査を受けてください。 この血液検査はINR検査と呼ばれます。 INR テストでは、血液が凝固する速さを確認します。どの INR 番号があなたに最適かは、担当の医療提供者が決定します。 COUMADIN 2mg の用量は、INR を目標範囲内に保つように調整されます。
- 次のような出血の問題の徴候や症状が見られた場合は、すぐに医療提供者に連絡してください。
- 痛み、腫れ、または不快感
- 頭痛、めまい、または衰弱
- 異常なあざ(原因不明のあざ、または大きくなるあざ)
- 鼻血
- 歯ぐきの出血
- 切り傷からの出血は止まるまでに時間がかかる
- 通常より重い月経出血または膣出血
- ピンクまたは茶色の尿
- 赤または黒の便
- 喀血
- 吐血またはコーヒーかすのようなもの
- 一部の食品や飲料は COUMADIN と相互作用し、治療や投与量に影響を与える可能性があります。
- 通常のバランスの取れた食事をとります。食事を変更する前に、医療提供者に相談してください。葉物や緑の野菜を大量に食べないでください。葉物野菜にはビタミン K が含まれています。特定の植物油にも大量のビタミン K が含まれています。ビタミン K が多すぎると、クマジンの効果が低下する可能性があります。
- COUMADIN を服用していることをすべての医療提供者に常に伝えてください。
- COUMADIN を着用または携帯する情報。
「クマジン 1mg で起こりうる副作用は何ですか?」を参照してください。副作用の詳細については。
クマディンとは?
COUMADIN は、血栓を治療し、体内で血栓が形成される可能性を下げるために使用される処方薬です。血栓が脚や肺に形成されると、脳卒中、心臓発作、またはその他の深刻な状態を引き起こす可能性があります。
クマジンを服用してはいけない人
次の場合は COUMADIN 5mg を服用しないでください。
- 出血の問題が発生するリスクは、治療によって得られる利益よりも高くなります。 COUMADIN があなたに適しているかどうかは、かかりつけの医療提供者が判断します。
- 人工心臓弁を持っていない限り、あなたは妊娠しています。 COUMADIN は、先天性欠損症、流産、または胎児の死亡を引き起こす可能性があります。
- あなたはワルファリンまたはクマディンの他の成分にアレルギーがあります. COUMADIN の成分の完全なリストについては、このリーフレットの最後を参照してください。
クマディンを服用する前に
以下の場合を含め、すべての病状について医療提供者に伝えてください。
- 出血の問題がある
- 頻繁に落ちる
- 肝臓に問題がある
- 腎臓に問題があるか、透析を受けている
- 高血圧がある
- うっ血性心不全と呼ばれる心臓の問題がある
- 糖尿病を持っている
- 手術または歯科処置を受ける予定
- 他の病状がある
- 妊娠している、または妊娠する予定がある。 「クマジン 2mg を服用してはいけない人は?」を参照してください。 COUMADIN による治療を開始する前に、担当の医療提供者が妊娠検査を行います。妊娠する可能性のある女性は、治療中、および COUMADIN の最終投与後少なくとも 1 か月間、効果的な避妊を行う必要があります。
- 授乳中です。 COUMADIN を服用して母乳育児を行うかどうかは、あなたと担当の医療提供者が決定する必要があります。 COUMADIN を服用して授乳している場合は、赤ちゃんにあざや出血がないか確認してください。
COUMADIN を服用していることをすべての医療提供者と歯科医に伝えてください。 COUMADIN 1mg を処方した医療提供者に相談する必要があります。 どれか 手術または歯科処置。 COUMADIN を短期間中止する必要があるか、用量を調整する必要がある場合があります。
あなたが服用しているすべての薬について、医療提供者に伝えてください。 処方薬および市販薬、ビタミン、ハーブサプリメントを含みます。あなたの他の薬のいくつかは、クマジンの働きに影響を与える可能性があります.特定の薬は、出血のリスクを高める可能性があります。見る 「クマディンについて知っておくべき最も重要な情報は何ですか?」
COUMADIN 1mg の服用方法は?
- COUMADIN 1mg を処方どおりに服用してください。 担当の医療提供者は、クマディンに対する反応に応じて、時々用量を調整します。
- あなたの状態を監視するために、定期的に血液検査を受け、医療提供者と一緒に診察を受ける必要があります.
- COUMADIN を飲み忘れた場合は、医療提供者に連絡してください。 その日のうちにできるだけ早く服用してください。 しない 飲み忘れた量を補うために、翌日、クマジン 5mg を 2 回分服用してください。
- 次の場合は、すぐに医療提供者に連絡してください。
- クマディンを取りすぎる
- 下痢、感染症、または熱がある
- 特に頭をぶつけた場合、転んだり怪我をしたりします。あなたの医療提供者はあなたをチェックする必要があるかもしれません。
COUMADIN 5mgを服用している間、何を避けるべきですか?
- 重傷を負う可能性のある活動やスポーツは行わないでください。
COUMADIN の考えられる副作用は何ですか?
COUMADIN は、次のような重大な副作用を引き起こす可能性があります。
- 見る 「クマディンについて知っておくべき最も重要な情報は何ですか?」
- 皮膚組織の死(皮膚壊死または壊疽)。 これは COUMADIN を開始した直後に発生する可能性があります。これは、血栓が形成され、体の一部への血流が妨げられるために発生します。体のどこかに痛み、色、または温度の変化がある場合は、すぐに医療提供者に連絡してください。死亡または患部の喪失 (切断) を防ぐために、すぐに医療処置が必要になる場合があります。
- 腎臓の問題。 COUMADIN を服用している人では、腎障害が起こる可能性があります。尿に血が混じっている場合は、すぐに医療提供者に伝えてください。すでに腎臓に問題がある場合は、医療提供者が COUMADIN 2mg の治療中に出血をチェックするためにより頻繁に検査を行うことがあります。
- 「紫色のつま先症候群」。 つま先に痛みがあり、色が紫色または暗色に見える場合は、すぐに医療提供者に連絡してください.
これらは COUMADIN の副作用のすべてではありません。詳細については、医療提供者または薬剤師にお尋ねください。副作用に関する医学的アドバイスについては、医師に連絡してください。 1..800-FDA-1088 で副作用を FDA に報告できます。
COUMADIN 5mgの保管方法は?
- COUMADIN は 59°F ~ 86°F (15°C ~ 30°C) で保管してください。
- COUMADIN 2mg を密閉容器に保管する
- COUMADIN を光や湿気から遠ざけてください。
- 期限切れまたは未使用の COUMADIN を捨てる正しい方法については、医療提供者または薬剤師の指示に従ってください。
- 妊娠中の女性は、粉砕または破損した COUMADIN 錠剤を取り扱ってはなりません。
COUMADIN 1mg とすべての医薬品は子供の手の届かないところに保管してください。
COUMADIN の安全で効果的な使用に関する一般情報。
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。 COUMADIN 5mg は、処方されていない状態には使用しないでください。他の人があなたと同じ症状を持っている場合でも、クマディン 2mg を与えないでください。それらに害を及ぼす可能性があります。
医療従事者向けに書かれた COUMADIN に関する情報については、医療提供者または薬剤師に尋ねることができます。
COUMADIN 1mg 錠の成分は何ですか?
有効成分: ワルファリンナトリウム
不活性成分 : ラクトース、デンプン、ステアリン酸マグネシウムに加えて、
1mg:D&CレッドNo.6バリウムレーキ
mg: FD&C ブルー No. 2 アルミニウム レーキおよび FD&C レッド No. 40 アルミニウム レーキ
2.5 mg: D&C イエロー No. 10 アルミニウム レーキおよび FD&C ブルー No. 1 アルミニウム レーキ
3mg:FD&Cイエロー6号アルミレーキ、FD&Cブルー2号アルミレーキ、FD&Cレッド40号アルミレーキ
4mg:FD&CブルーNo.1アルミレーキ
5mg:FD&C 黄6号アルミレーキ
mg: FD&C 黄色 6 号アルミニウム レーキおよび FD&C 青色 1 号アルミニウム レーキ
7.5 mg: D&C イエロー No. 10 アルミニウム レーキおよび FD&C イエロー No. 6 アルミニウム レーキ
この医薬品ガイドは、米国食品医薬品局によって承認されています。
