Clarinex 5mg Desloratadine 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
クラリネックス® (デスロラタジン)錠
説明
クラリネックス(デスロラタジン)錠は、抗ヒスタミン剤であるデスロラタジンを5mg含有する、薄い青色の丸いフィルムコーティング錠で、経口投与されます。クラリネックス 5mg 錠には、次の賦形剤も含まれています: 二塩基性リン酸カルシウム二水和物 USP、微結晶性セルロース NF、コーンスターチ NF、タルク USP、カルナバワックス NF、ホワイトワックス NF、ラクトース一水和物からなるコーティング材料、ヒプロメロース、二酸化チタン、ポリエチレングリコール、およびFD&C ブルー #2 アルミレーキ。
クラリネックス経口溶液は、0.5 mg/1 mL のデスロラタジンを含む透明なオレンジ色の液体です。経口溶液には、次の不活性成分が含まれています: プロピレングリコール USP、ソルビトール溶液 USP、クエン酸 (無水) USP、クエン酸ナトリウム二水和物 USP、安息香酸ナトリウム NF、エデト酸二ナトリウム USP、精製水 USP。また、グラニュー糖、バブルガム用の天然および人工香料、FDC イエロー #6 染料も含まれています。
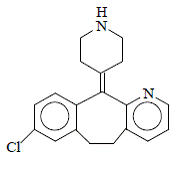
デスロラタジンは白色からオフホワイトの粉末で、水にはわずかに溶けますが、エタノールとプロピレングリコールにはよく溶けます。実験式は C19H19ClN2 で、分子量は 310.8 です。化学名は 8-クロロ-6,11-ジヒドロ-11-(4-ピペリジニリデン)-5H-ベンゾ[5,6]シクロヘプタ[1,2-b]ピリジンで、次の構造を持っています。
適応症
季節性アレルギー性鼻炎
CLALINEX® は、2 歳以上の患者の季節性アレルギー性鼻炎の鼻および鼻以外の症状の軽減に適応されます。
多年性アレルギー性鼻炎
クラリネックスは、生後 6 か月以上の患者の通年性アレルギー性鼻炎の鼻および鼻以外の症状の緩和に適応されます。
慢性特発性蕁麻疹
クラリネックス 5mg は、生後 6 か月以上の慢性特発性蕁麻疹患者のそう痒症の症状緩和、蕁麻疹の数の減少、および蕁麻疹のサイズの軽減を目的としています。
投薬と管理
デスロラタジンの口腔内崩壊錠剤製剤は市場で入手できる可能性がありますが、CLARINEX® RediTabs® 錠剤はもはや販売されていません。
クラリネックス錠5mg、経口液剤、レディタブ錠は、食事に関係なく服用できます。クラリネックス (デスロラタジン) RediTabs 錠を舌の上に置き、飲み込む前に崩壊させます。錠剤の崩壊は急速に起こります。水ありまたは水なしで投与します。ブリスターを開封したらすぐに服用してください。
クラリネックス オーラル ソリューションの年齢に適した用量は、2 mL および 2.5 mL (小さじ 1/2) を供給するように調整された市販の計量スポイトまたはシリンジを使用して投与する必要があります。
12歳以上の成人および青少年
クラリネックス タブレットまたはクラリネックス レディタブ タブレットの推奨用量は、1 日 1 回 5 mg のタブレット 1 錠です。クラリネックス オーラル ソリューションの推奨用量は、1 日 1 回小さじ 2 杯(10 mL 中 5 mg)です。
6~11歳のお子様
クラリネックス オーラル ソリューションの推奨用量は、1 日 1 回小さじ 1 杯(5 mL 中 2.5 mg)です。 CLALINEX RediTabs 錠の推奨用量は、1 日 1 回 2.5 mg の錠剤 1 錠です。
12ヶ月から5歳までのお子様
クラリネックス 5mg 経口溶液の推奨用量は、1 日 1 回小さじ 1/2 杯 (2.5 mL 中 1.25 mg) です。
生後6~11ヶ月のお子様
クラリネックス内用液の推奨用量は、1 日 1 回 2 mL (1 mg) です。
肝障害または腎障害のある成人
肝臓または腎臓に障害のある成人患者では、薬物動態データに基づいて、1 日おきに 5 mg 錠剤 1 錠の開始用量が推奨されます。データが不足しているため、肝臓または腎臓に障害のある子供への推奨投与量を示すことはできません。 臨床薬理学 ]。
供給方法
剤形と強度
クラリネックス錠は、5 mg のデスロラタジンを含む、「C5」とエンボス加工されたライトブルーのフィルムコーティング錠です。クラリネックス内服液は、デスロラタジン 0.5 mg/1 mL を含む透明なオレンジ色の液体です。
保管と取り扱い
クラリネックス5mg錠: 100本入り高密度ポリエチレンペットボトルにエンボス加工を施した水色のフィルムコーティング錠「C5」( NDC 0085-1264-01)。
クラリネックス 5mg 内用液: 16 オンスの琥珀色のガラス瓶に 0.5 mg/1 mL のデスロラタジンを含む透明なオレンジ色の液体 ( NDC 0085-1334-01) と 4 オンスのアンバー ガラス ボトル ( NDC 0085-1334-02)。
保管所
クラリネックス錠: ユニット オブ ユースのパッケージとユニット ドース ホスピタル パックを過度の湿気から保護してください。 25°C (77°F) で保管してください。 15 ~ 30°C (59 ~ 86°F) まで許容されるエクスカーション [参照 USP制御の室温 ]。熱に弱い。 30°C (86°F) 以上での露出は避けてください。
クラリネックス オーラル ソリューション: 25°C (77°F) で保管してください。 15 ~ 30°C (59 ~ 86°F) まで許容されるエクスカーション [参照 USP制御の室温 ]。光から保護します。
製造元: MERCK & CO., INC., Whitehouse Station, NJ 08889, USA の子会社である Merck Sharp & Dohme Corp.。改訂: 2019 年 3 月
副作用
以下の副作用については、ラベルの他のセクションで詳しく説明しています。
- 過敏反応。 [見る 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、臨床現場で観察された率を反映していない可能性があります。
大人と青少年
アレルギー性鼻炎
反復投与プラセボ対照試験では、12 歳以上の 2834 人の患者が 1 日 2.5 mg から 20 mg の用量でクラリネックス錠を投与され、そのうち 1655 人の患者が 1 日あたりの推奨用量 5 mg を投与されました。 1 日 5 mg を投与された患者では、有害事象の発生率は、クラリネックス 5 mg とプラセボで治療された患者の間で同様でした。有害事象のために途中で中止した患者の割合は、クラリネックス 5 mg 群で 2.4%、プラセボ群で 2.6% でした。デスロラタジンを投与された患者のこれらの試験では、重大な有害事象はありませんでした。クラリネックス 5 mg 錠の推奨 1 日用量 (5 mg を 1 日 1 回) を投与された患者の 2% 以上から報告され、プラセボよりもクラリネックス錠でより一般的であったすべての有害事象を表 1 に示します。
臨床検査および心電図異常の頻度と程度は、クラリネックスとプラセボで治療された患者で同様でした。
性別、年齢、または人種によって定義された患者のサブグループの有害事象に差はありませんでした。
慢性特発性蕁麻疹
慢性特発性蕁麻疹の複数回投与のプラセボ対照試験では、12 歳以上の 211 人の患者が CLARINEX 5mg 錠を投与され、205 人がプラセボを投与されました。クラリネックス 5mg 錠を投与された患者の 2% 以上で報告され、プラセボよりもクラリネックス 5mg でより一般的であった有害事象は、次のとおりでした (クラリネックス 5mg とプラセボのそれぞれの発生率): 頭痛 (14%、13%) 、吐き気 (5%、2%)、疲労 (5%、1%)、めまい (4%、3%)、咽頭炎 (3%、2%)、消化不良 (3%、1%)、筋肉痛 (3%) %、1%)。
小児科
つのプラセボ対照臨床試験で、生後 6 か月から 11 歳までの 246 人の小児被験者が 15 日間、クラリネックス経口溶液を投与されました。 6 歳から 11 歳の小児対象は 1 日 1 回 2.5 mg、1 歳から 5 歳の対象は 1 日 1 回 1.25 mg、生後 6 か月から 11 か月の対象は 1 日 1 回 1.0 mg を投与されました。
6 歳から 11 歳の被験者では、2% 以上の被験者から個別の有害事象は報告されませんでした。
2 ~ 5 歳の被験者において、クラリネックス 5mg 経口液剤を投与された被験者の少なくとも 2% でクラリネックスとプラセボについて報告された有害事象は、発熱 (5.5%、5.4%)、尿路感染症 (3.6%) であり、プラセボよりも頻度が高かった。 %、0%) および水痘 (3.6%、0%)。
生後 12 か月から 23 か月の被験者で、CLARINEX 経口液剤を投与された被験者の少なくとも 2% で CLALINEX 5mg 製品とプラセボについて報告された有害事象は、発熱 (16.9%、12.9%)、下痢 ( 15.4%、11.3%)、上気道感染症 (10.8%、9.7%)、咳 (10.8%、6.5%)、食欲増進 (3.1%、1.6%)、情緒不安定 (3.1%、0%)、鼻出血 ( 3.1%、0%)、寄生虫感染 (3.1%、0%)、咽頭炎 (3.1%、0%)、発疹斑状丘疹 (3.1%、0%)。
生後 6 か月から 11 か月の被験者において、CLARINEX 5mg 経口液剤を投与された被験者の少なくとも 2% で、プラセボよりも頻度が高く、CLARINEX 5mg とプラセボについて報告された有害事象は、上気道感染症でした (21.2%、12.9%)。下痢 (19.7%、8.1%)、発熱 (12.1%、1.6%)、神経過敏 (12.1%、11.3%)、咳 (10.6%、9.7%)、傾眠 (9.1%、8.1%)、気管支炎 (6.1%、 0%)、中耳炎 (6.1%、1.6%)、嘔吐 (6.1%、3.2%)、食欲不振 (4.5%、1.6%)、咽頭炎 (4.5%、1.6%)、不眠症 (4.5%、0%)、鼻漏 (4.5%、3.2%)、紅斑 (3.0%、1.6%)、吐き気 (3.0%、0%)。
QTc間隔を含む、心電図パラメータに臨床的に意味のある変化はありませんでした。臨床試験でクラリネックス 5mg 経口液剤を投与された 246 人の小児被験者のうち、有害事象のために治療を中止したのは 1 人だけでした。
市販後の経験
有害事象は不確実な規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることが常に可能であるとは限りません。デスロラタジンの販売中に、以下の自然発生的な有害事象が報告されています。
心疾患: 頻脈、動悸
呼吸器、胸部および縦隔の障害: 呼吸困難
皮膚および皮下組織の障害: 発疹、かゆみ
神経系障害: 精神運動多動、運動障害(ジストニア、チック、錐体外路症状を含む)、発作(既知の発作障害のある患者とない患者で報告されています)
免疫系障害: 過敏反応(蕁麻疹、浮腫、アナフィラキシーなど)
調査: ビリルビンを含む肝臓酵素の上昇
肝胆道障害: 肝炎
代謝および栄養障害: 食欲増進
薬物相互作用
シトクロム P450 3A4 の阻害剤
対照臨床研究では、デスロラタジンとケトコナゾール、エリスロマイシン、またはアジスロマイシンとの同時投与により、デスロラタジンおよび 3 ヒドロキシデスロラタジンの血漿濃度が増加しましたが、デスロラタジンの安全性プロファイルに臨床的に関連する変化はありませんでした。 [見る 臨床薬理学 ]
フルオキセチン
対照臨床研究では、選択的セロトニン再取り込み阻害剤(SSRI)であるフルオキセチンとデスロラタジンの同時投与により、デスロラタジンと 3 ヒドロキシデスロラタジンの血漿濃度が増加しましたが、デスロラタジンの安全性プロファイルに臨床的に関連する変化はありませんでした。 [見る 臨床薬理学 ]
シメチジン
対照臨床研究では、デスロラタジンとヒスタミン H2 受容体拮抗薬であるシメチジンの同時投与により、デスロラタジンと 3 ヒドロキシデスロラタジンの血漿中濃度が上昇しましたが、デスロラタジンの安全性プロファイルに臨床的に関連する変化はありませんでした。 [見る 臨床薬理学 ]
薬物乱用と依存
クラリネックス錠で乱用または依存が発生していることを示す情報はありません。
警告
の一部として含まれています 予防 セクション。
予防
過敏反応
発疹、かゆみ、蕁麻疹、浮腫、呼吸困難、アナフィラキシーなどの過敏反応が、デスロラタジンの投与後に報告されています。このような反応が生じた場合は、CLARINEX 5mg による治療を中止し、別の治療法を検討する必要があります。 [見る 有害反応 ]
患者相談情報
患者に、FDA 承認の患者ラベル ( 患者情報 )。
患者様向け情報
- 患者は指示どおりにクラリネックス 5mg を使用するように指示されるべきです。
- バイオアベイラビリティーに対する食事の影響はないため、患者には、食事に関係なく CLALINEX 5mg 錠、経口液剤、または RediTabs 錠を服用するように指示することができます。
- 投与量を増やしても有効性が高まることが研究で実証されておらず、傾眠が起こる可能性があるため、投与量や投与頻度を増やさないように患者にアドバイスする必要があります。
- フェニルケトン尿薬:CLARINEX RediTabs 錠剤にはフェニルアラニンが含まれています。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん性試験
デスロラタジンの発がん性は、ラットでのロラタジン研究とマウスでのデスロラタジン研究を使用して評価されました。ラットでの 2 年間の研究では、ロラタジンは 25 mg/kg/日までの用量で食事で投与されました (推定デスロラタジンおよびデスロラタジン代謝物曝露は、推奨される 1 日経口用量でのヒトの AUC の約 30 倍でした)。ロラタジン 10 mg/kg/日を投与された雄、およびロラタジン 25 mg/kg/日を投与された雄と雌で、肝細胞腫瘍 (腺腫と癌腫の組み合わせ) の有意に高い発生率が観察されました。ロラタジン 10 mg/kg を投与されたラットにおける推定デスロラタジンおよびデスロラタジン代謝物曝露は、推奨される 1 日経口用量でのヒトの AUC の約 7 倍でした。デスロラタジンの長期使用中のこれらの所見の臨床的意義は不明です。
マウスでの 2 年間の食事研究では、雄と雌にそれぞれ最大 16 mg/kg/日と 32 mg/kg/日のデスロラタジンを投与しても、腫瘍の発生率に有意な増加は見られませんでした。これらの用量でのマウスにおけるデスロラタジンおよびデスロラタジン代謝産物の推定曝露量は、推奨される 1 日経口用量でのヒトにおける AUC のそれぞれ 12 倍および 27 倍でした。
遺伝毒性試験
デスロラタジンを用いた遺伝毒性試験では、復帰突然変異試験 (サルモネラ菌/大腸菌哺乳類ミクロソーム細菌変異原性試験) または染色体異常に関する 2 つの試験 (ヒト末梢血リンパ球染色体染色体異常誘発試験およびマウス骨髄小核試験) において、遺伝毒性の可能性の証拠はありませんでした。 )。
生殖能力の障害
24 mg/kg/日までのデスロラタジン用量では、ラットの雌の生殖能力に影響はありませんでした (デスロラタジンおよびデスロラタジン代謝産物の推定暴露量は、推奨される 1 日経口用量でのヒトの AUC の約 130 倍でした)。メスの受胎率の低下、精子の数と運動性の低下、および組織病理学的な精巣の変化によって示される受胎能のオス特有の低下が、ラットに 12 mg/kg の経口デスロラタジン用量で発生しました (デスロラタジンおよびデスロラタジン代謝物の推定曝露量は、ラットの約 45 倍でした)。推奨される 1 日経口投与量でのヒトの AUC)。デスロラタジンは、3 mg/kg/日の経口用量でラットの生殖能力に影響を与えませんでした (推定デスロラタジンおよびデスロラタジン代謝物暴露は、推奨される 1 日経口用量でのヒトの AUC の約 8 倍でした)。
特定の集団での使用
妊娠
妊娠カテゴリーC
妊娠中の女性を対象とした、十分に管理された研究はありません。動物の繁殖研究は常に人間の反応を予測できるわけではないため、デスロラタジンは明らかに必要な場合にのみ妊娠中に使用する必要があります.
デスロラタジンは、ラットまたはウサギにおいて、推奨される 1 日経口投与量で、ヒトの濃度-時間曲線下面積 (AUC) のそれぞれ約 210 倍および 230 倍で催奇形性がありませんでした。しかし、着床前損失の増加および着床数と胎児数の減少が認められましたが、雌ラットでの別の研究では、推奨される 1 日経口投与量でヒトの AUC の約 120 倍でした。体重の減少と立直り反射の遅さは、推奨される 1 日経口投与量で、ヒトの AUC の約 50 倍以上で子犬に報告されました。デスロラタジンは、推奨される 1 日経口投与量でヒトの AUC の約 7 倍で、子犬の発育に影響を与えませんでした。比較の AUC は、それぞれウサギのデスロラタジン曝露と、ラットのデスロラタジンおよびその代謝物曝露の合計を指します。 [見る 非臨床毒性学 ]
授乳中の母親
デスロラタジンは母乳に移行します。したがって、授乳を中止するかデスロラタジンを中止するかの決定は、授乳中の母親への薬の利点と子供へのリスクの可能性を考慮して行う必要があります。
小児用
小児集団におけるクラリネックス 5mg 経口溶液の推奨用量は、成人および小児被験者におけるクラリネックス 5mg の血漿中濃度のクロススタディ比較に基づいています。クラリネックス オーラル ソリューションの安全性は、3 つのプラセボ対照臨床試験で、生後 6 か月から 11 歳までの 246 人の小児被験者で確立されています。季節性および通年性のアレルギー性鼻炎および慢性特発性蕁麻疹の経過とクラリネックスの効果は、小児集団と成人集団で十分に類似しているため、成人の有効性データから小児患者への外挿が可能になります。これらの年齢層におけるクラリネックス 5mg 経口液剤の有効性は、成人を対象としたクラリネックス 5mg 錠の十分に管理された研究から得られた証拠によって裏付けられています。クラリネックス 5mg 錠剤またはクラリネックス 5mg 経口液剤の安全性と有効性は、生後 6 か月未満の小児患者では証明されていません。 [見る 臨床薬理学 ]
CLALINEX RediTabs 2.5 mg 錠剤は、小児患者では評価されていません。 CLALINEX 5mg RediTabs タブレットと以前に販売された RediTabs タブレットの生物学的同等性は成人で確立されました。記載されている小児科における用量設定研究と併せて、CLARINEX 5mg RediTab の薬物動態データは、6 歳から 11 歳の小児患者における 2.5 mg の用量強度の使用を支持しています。
高齢者の使用
デスロラタジンの臨床研究には、65 歳以上の被験者が若い被験者と異なる反応を示すかどうかを判断するのに十分な数の被験者が含まれていませんでした。他の報告された臨床経験では、年配の患者と若い患者の違いは特定されていません。一般に、高齢患者の用量選択は、肝機能、腎機能、または心機能の低下、および付随する疾患または他の薬物療法の頻度が高いことを反映して、慎重に行う必要があります。 [見る 臨床薬理学 ]
腎障害
腎機能障害のある患者には用量調整が推奨される[参照 投薬と管理 と 臨床薬理学 ]。
肝障害
肝機能障害のある患者には用量調整が推奨される[参照 投薬と管理 と 臨床薬理学 ]。
過剰摂取
過剰摂取の場合は、吸収されていない薬物を除去するための標準的な手段を検討してください。対症療法と支持療法が推奨されます。デスロラタジンと 3-ヒドロキシデスロラタジンは、血液透析では除去されません。
急性過剰摂取に関する情報は、市販後の有害事象報告および CLALINEX 5mg 製品の開発中に実施された臨床試験からの経験に限定されています。用量範囲試験では、10 mg および 20 mg/日の用量で傾眠が報告されました。
別の研究では、クラリネックス 45 mg を 1 日 1 回 10 日間投与された健常な男性および女性のボランティアにおいて、臨床的に関連する有害事象は報告されていません。 臨床薬理学 ]。

致死率は 250 mg/kg 以上の経口用量でラットに発生しました (推定デスロラタジンおよびデスロラタジン代謝物曝露は、推奨される 1 日経口用量でのヒトの AUC の約 120 倍でした)。マウスの経口致死量の中央値は 353 mg/kg でした (デスロラタジンの推定暴露量は、mg/m² ベースでヒトの 1 日経口投与量の約 290 倍でした)。サルでは 250 mg/kg までの経口投与で死亡は発生しませんでした (デスロラタジンの推定暴露量は、mg/m² ベースでヒトの 1 日経口投与量の約 810 倍でした)。
禁忌
CLALINEX 5mg 錠剤、RediTab、および経口液剤は、この薬剤またはその成分のいずれか、またはロラタジンに対して過敏な患者には禁忌です [参照 警告と注意事項 と 有害反応 ]。
臨床薬理学
作用機序
デスロラタジンは、選択的 H1 受容体ヒスタミン拮抗活性を有する長時間作用型の三環系ヒスタミン拮抗薬です。受容体結合データは、2 ~ 3 ng/mL (7 ナノモル) の濃度で、デスロラタジンがヒト ヒスタミン H1 受容体と有意な相互作用を示すことを示しています。デスロラタジンは、in vitro でヒトマスト細胞からのヒスタミン放出を阻害しました。ラットにおける放射性標識組織分布研究およびモルモットにおける放射性リガンド H1 受容体結合研究の結果は、デスロラタジンが血液脳関門を容易に通過しないことを示しました。この所見の臨床的意義は不明です。
薬力学
ホイールアンドフレア
デスロラタジン 5 mg を単回および反復投与した後のヒト ヒスタミン皮膚膨疹の研究では、この薬剤が 1 時間までに抗ヒスタミン効果を示すことが示されました。このアクティビティは 24 時間続く場合があります。 28 日間の治療期間にわたって、デスロラタジン 5 mg 群内でヒスタミン誘発性皮膚膨疹タキフィラキシーの証拠はありませんでした。ヒスタミン膨疹皮膚テストの臨床的関連性は不明です。
QTcへの影響
45 mg の 1 日 1 回の用量が、正常な男性および女性のボランティアに 10 日間与えられました。この研究で得られたすべての心電図は、心臓専門医によって盲検法で手動で読み取られました。クラリネックスで治療を受けた被験者では、プラセボと比較して平均心拍数が 9.2 bpm 増加しました。 QT 間隔は、Bazett 法と Fridericia 法の両方によって心拍数 (QTc) に対して補正されました。 QTc (Bazett) を使用すると、プラセボと比較して、CLARINEX で治療された被験者で平均 8.1 ミリ秒の増加が見られました。 QTc (Fridericia) を使用すると、プラセボと比較して、CLARINEX で治療された被験者で平均 0.4 ミリ秒の増加が見られました。臨床的に関連する有害事象は報告されていません。
薬物動態
吸収
デスロラタジン 5 mg 錠剤を 1 日 1 回、10 日間正常な健康なボランティアに経口投与した後、最大血漿濃度 (Tmax) までの平均時間は、投与後約 3 時間であり、平均定常状態ピーク血漿濃度 (Cmax) および AUC 4 ng/mL および 56.9 ng.hr/mL がそれぞれ観察されました。食べ物もグレープフルーツ ジュースも、デスロラタジンのバイオアベイラビリティ (Cmax と AUC) に影響を与えませんでした。
CLARINEX Oral Solution の薬物動態プロファイルは、30 人の成人ボランティアを対象としたスリーウェイ クロスオーバー試験で評価されました。 5 mg のデスロラタジンを含む 10 mL のクラリネックス経口溶液の単回投与は、5 mg のクラリネックス錠の単回投与と生物学的に同等でした。食物は、クラリネックス 5mg 経口溶液のバイオアベイラビリティ (AUC および Cmax) に影響を与えませんでした。
CLARINEX 5mg RediTabs 錠の薬物動態プロファイルは、24 人の成人ボランティアを対象とした 3 因子クロスオーバー試験で評価されました。 5 mg のデスロラタジンを含む単一の CLARINEX RediTabs タブレットは、デスロラタジンと 3-ヒドロキシデスロラタジンの両方について、単一の 5 mg の CLARINEX RediTabs タブレット (元の製剤) と生物学的に同等でした。食物と水は、CLARINEX RediTabs 錠のバイオアベイラビリティ (AUC と Cmax) に影響を与えませんでした。
分布
デスロラタジンおよび 3-ヒドロキシデスロラタジンは、血漿タンパク質にそれぞれ約 82% ~ 87% および 85% ~ 89% 結合します。デスロラタジンと 3-ヒドロキシデスロラタジンのタンパク質結合は、腎機能障害のある被験者では変化しませんでした。
代謝
デスロラタジン (ロラタジンの主要代謝物) は、活性代謝物である 3-ヒドロキシデスロラタジンに広範囲に代謝され、その後グルクロン酸抱合されます。 3-ヒドロキシデスロラタジンの形成に関与する酵素は特定されていません。臨床試験からのデータは、一般集団の一部が 3 ヒドロキシデスロラタジンを形成する能力が低下しており、デスロラタジンの代謝が不十分であることを示しています。薬物動態研究 (n=3748) では、被験者の約 6% がデスロラタジンの代謝不良者 (3-ヒドロキシデスロラタジンとデスロラタジンの AUC 比が 0.1 未満の被験者、またはデスロラタジンの半減期が 50 時間を超える被験者として定義) でした。 )。これらの薬物動態研究には、2 歳から 5 歳の 977 人の被験者、6 歳から 11 歳の 1575 人の被験者、および 12 歳から 70 歳の 1196 人の被験者を含む 2 歳から 70 歳の被験者が含まれていました。代謝不良者の有病率は、年齢層によって差がありませんでした。代謝不良者の頻度は、白人 (2%、n=1,462) およびヒスパニック系 (2%、n=1,063) と比較して、黒人 (17%、n=988) で高かった。低代謝者におけるデスロラタジンへの曝露の中央値 (AUC) は、低代謝者ではない被験者の約 6 倍でした。デスロラタジンの低代謝者である被験者は、前向きに特定することができず、推奨用量のデスロラタジンを投与した後、より高いレベルのデスロラタジンに曝露されます.代謝状態が特定された複数回投与の臨床安全性研究では、合計 94 人の低代謝者と 123 人の正常な代謝者が登録され、15 ~ 35 日間、クラリネックス経口溶液で治療されました。これらの研究では、低代謝者と正常な代謝者の間で安全性の全体的な違いは観察されませんでした。これらの研究では確認されていませんが、代謝の悪い患者における曝露関連の有害事象のリスクが増加する可能性は否定できません。
排除
デスロラタジンの平均血漿消失半減期は約 27 時間でした。 Cmax および AUC 値は、5 ~ 20 mg の単回経口投与後、用量に比例して増加しました。投与 14 日後の蓄積の程度は、半減期および投与頻度と一致していた。ヒトの物質収支研究では、14C-デスロラタジン投与量の約 87% の回復が記録されており、代謝産物として尿と糞便に均等に分布していました。血漿 3 ヒドロキシデスロラタジンの分析では、デスロラタジンと比較して類似の Tmax 値と半減期値が示されました。
特別な集団
高齢者対象
クラリネックス 5mg 錠を複数回投与した高齢の被験者 (65 歳以上; n=17) では、デスロラタジンの Cmax および AUC の平均値は、若い被験者 (65 歳未満) よりも 20% 大きかった。体重で正規化した場合の経口全身クリアランス (CL/F) は、2 つの年齢グループ間で類似していました。デスロラタジンの平均血漿排出半減期は、65 歳以上の被験者で 33.7 時間でした。 3-ヒドロキシデスロラタジンの薬物動態は、年配の被験者と若い被験者で変化がないように見えました。これらの年齢に関連する違いは臨床的に関連する可能性は低く、高齢者には用量調整は推奨されません.
小児科
歳から 11 歳の被験者では、2.5 mg のデスロラタジンを含む 5 mL のクラリネックス経口溶液を 1 回投与すると、5 mg のクラリネックス錠を 1 回投与した成人と同様のデスロラタジン血漿濃度が得られました。 2 ~ 5 歳の被験者では、1.25 mg のデスロラタジンを含む 2.5 mL のクラリネックス経口液剤を単回投与すると、成人に 5 mg のクラリネックス錠を 1 回投与した場合と同様のデスロラタジン血漿濃度が得られました。しかし、代謝物 (3-ヒドロキシデスロラタジン) の Cmax および AUC は、1.25 を投与された 2 ~ 11 歳の小児で得られた Cmax および AUC と比較して、成人に投与された 5 mg の経口液剤で 1.27 および 1.61 倍高かった。クラリネックス内用液2.5mg。
それぞれ 1.25 mg または 0.625 mg のデスロラタジンを含む CLALINEX 5 mg 経口溶液 2.5 mL または 1.25 mL のいずれかの単回用量を、6 ~ 11 か月齢および 12 ~ 23 か月齢の被験者に投与しました。母集団薬物動態分析の結果は、成人が単回 5-クラリネックス経口溶液の mg 用量。
CLALINEX 5mg RediTabs 2.5mg 錠剤は、小児患者では評価されていません。クラリネックス 5mg RediTabs タブレットと元のクラリネックス 5mg RediTabs タブレットの生物学的同等性は成人で確立されました。記載されている小児科における用量設定研究と併せて、CLARINEX 5mg RediTabs 錠の薬物動態データは、6 歳から 11 歳の小児患者における 2.5 mg の用量強度の使用を支持しています。
腎障害
7.5 mg の単回投与後のデスロラタジンの薬物動態は、軽度 (n=7; クレアチニンクリアランス 51-69 mL/min/1.73 m²)、中等度 (n=6; クレアチニンクリアランス 34-43 mL/min/1.73 m²) の患者で特徴づけられました。 )、および重度 (n=6; クレアチニンクリアランス 5-29 mL/min/1.73 m²) 腎障害または血液透析依存 (n=6) の患者。軽度および中等度の腎機能障害の患者では、腎機能が正常な被験者と比較して、Cmax および AUC の中央値がそれぞれ約 1.2 倍および 1.9 倍増加しました。重度の腎障害または血液透析に依存している患者では、Cmax および AUC 値がそれぞれ約 1.7 倍および 2.5 倍増加しました。 3-ヒドロキシデスロラタジン濃度の最小の変化が観察されました。デスロラタジンと 3-ヒドロキシデスロラタジンは、血液透析ではほとんど除去されませんでした。デスロラタジンと 3-ヒドロキシデスロラタジンの血漿タンパク質結合は、腎障害によって変化しませんでした。腎機能障害のある患者には用量調整が推奨される[参照 投薬と管理 ]。
肝障害
デスロラタジンの薬物動態は、軽度 (n=4)、中等度 (n=4)、および重度 (n=4) の肝機能障害を持つ患者 (Child-Pugh 分類の肝機能による定義) と、正常な肝機能。肝機能障害のある患者は、重症度に関係なく、健常者と比較して AUC が約 2.4 倍増加しました。軽度、中等度、および重度の肝障害を有する患者におけるデスロラタジンの見かけの経口クリアランスは、正常な被験者のそれのそれぞれ 37%、36%、および 28% でした。肝障害のある患者におけるデスロラタジンの平均排出半減期の増加が観察されました。 3-ヒドロキシデスロラタジンの場合、肝障害のある患者の平均 Cmax および AUC 値は、正常な肝機能を持つ被験者と統計的に有意な差はありませんでした。肝機能障害のある患者には用量調整が推奨される[参照 投薬と管理 ]。
性別
クラリネックス 5mg 錠で 14 日間治療を受けた女性被験者は、男性被験者と比較して、デスロラタジンの Cmax 値と AUC 値がそれぞれ 10% と 3% 高かった。 3-ヒドロキシデスロラタジンの Cmax 値と AUC 値も、男性と比較して女性でそれぞれ 45% と 48% 増加しました。ただし、これらの明らかな違いは臨床的に関連する可能性が低いため、投与量の調整は推奨されません.
人種
クラリネックス錠による 14 日間の治療後、デスロラタジンの Cmax 値と AUC 値は、白人と比較して黒人でそれぞれ 18% と 32% 高かった。 3-ヒドロキシデスロラタジンについては、白人と比較して黒人の Cmax および AUC 値が 10% 減少しました。これらの違いは臨床的に関連する可能性が低いため、用量調整は推奨されません。
薬物相互作用
健康な男性 (各研究で n=12) と女性 (各研究で n=12) のボランティアを対象とした 2 つの対照クロスオーバー臨床薬理学研究では、デスロラタジン 7.5 mg (1 日用量の 1.5 倍) を 1 日 1 回、エリスロマイシン 500 mg と 8 時間ごとに同時投与しました。時間またはケトコナゾール 200 mg を 12 時間ごとに 10 日間。 3 つの別々の管理された並行群の臨床薬理学研究では、臨床用量 5 mg のデスロラタジンが、アジスロマイシン 500 mg とその後に 250 mg を 1 日 1 回 4 日間 (n=18)、またはフルオキセチン 20 mg を 1 日 1 回 7 日間併用投与されました。フルオキセチン (n=18) またはシメチジン 600 mg を 12 時間ごとに 14 日間 (n=18) 23 日間の前処理期間の後、定常状態で正常な健康な男性および女性のボランティアに投与しました。デスロラタジンおよび 3-ヒドロキシデスロラタジンの血漿濃度 (Cmax および AUC0-24 時間) の増加が観察されましたが (表 2 を参照)、心電図パラメーター (補正 QT 間隔を含む) によって評価されるように、デスロラタジンの安全性プロファイルに臨床的に関連する変化はありませんでした。臨床検査、バイタルサイン、および有害事象。
動物毒性学および/または薬理学生殖毒性学研究
デスロラタジンは、ラットでは 48 mg/kg/日までの用量で催奇形性を示さなかった (デスロラタジンおよびデスロラタジン代謝産物の推定暴露量は、推奨される 1 日あたりの経口用量でのヒトの AUC の約 210 倍であった)、またはウサギでは 60 mg/kg/日までの用量で催奇形性はなかった。日 (デスロラタジンの推定曝露量は、推奨される 1 日経口用量でのヒトの AUC の約 230 倍でした)。別の研究では、24 mg/kg の雌ラットで着床前損失の増加と着床数および胎児数の減少が認められました (デスロラタジンおよびデスロラタジン代謝産物の推定曝露量は、推奨される毎日の経口摂取量でのヒトの AUC の約 120 倍でした)。用量)。 9 mg/kg/日以上の用量で、子犬で体重の減少と立直り反射の遅延が報告されました (デスロラタジンおよびデスロラタジン代謝産物の推定曝露量は、推奨される 1 日経口用量でのヒトの AUC の約 50 倍以上でした)。デスロラタジンは、3 mg/kg/日の経口用量で子犬の発育に影響を与えませんでした (デスロラタジンおよびデスロラタジン代謝産物の推定曝露量は、推奨される 1 日経口用量でのヒトの AUC の約 7 倍でした)。
臨床研究
季節性アレルギー性鼻炎
クラリネックス錠の臨床効果と安全性は、12~75 歳の季節性アレルギー性鼻炎患者 2,300 人以上で評価されました。米国で実施された 2 ~ 4 週間の 4 つの二重盲検無作為化プラセボ対照臨床試験で、合計 1838 人の患者が 2.5 ~ 20 mg/日のクラリネックスを投与されました。これらの研究の結果は、季節性アレルギー性鼻炎の成人および青年患者の治療におけるCLARINEX 5mgの有効性と安全性を実証しました。用量範囲試験では、CLARINEX 2.5 ~ 20 mg/日が研究されました。 5、7.5、10、および 20 mg/日の用量は、プラセボよりも優れていました。 5.0 mg を超える用量では追加の効果は見られませんでした。同じ研究では、プラセボ (2.3%) と比較して、10 mg/日および 20 mg/日 (それぞれ 5.2% および 7.6%) の用量で傾眠の発生率の増加が観察されました。
季節性アレルギー性鼻炎と喘息を併発している 924 人の患者 (15 歳から 75 歳) を対象とした 2 つの 4 週間の研究では、CLARINEX 5mg 錠 5mg を 1 日 1 回服用することで鼻炎の症状が改善し、肺機能が低下することはありませんでした。これは、軽度から中等度の喘息を伴う季節性アレルギー性鼻炎の成人患者に、クラリネックス 5mg 錠を投与する安全性を裏付けるものです。
クラリネックス錠 5 mg を 1 日 1 回服用すると、季節性アレルギー性鼻炎患者の総症状スコア (鼻と鼻以外の症状の個々のスコアの合計) が大幅に減少しました。表 3 を参照してください。
性別、年齢、または人種によって定義された患者のサブグループ間で、CLARINEX 5mg 錠 5mg の有効性に有意差はありませんでした。
多年性アレルギー性鼻炎
クラリネックス錠 5 mg の臨床効果と安全性は、12 歳から 80 歳までの通年性アレルギー性鼻炎患者 1,300 人以上で評価されました。米国および国際的に実施された 4 週間の 2 つの二重盲検ランダム化プラセボ対照臨床試験では、合計 685 人の患者が 1 日 5 mg の CLALINEX 5mg を投与されました。これらの研究の 1 つでは、1 日 1 回の CLALINEX 5mg 錠 5mg が、通年性アレルギー性鼻炎患者の総症状スコアを大幅に低下させることが示されました (表 4)。
慢性特発性蕁麻疹
クラリネックス 5mg 錠 5mg を 1 日 1 回投与した場合の有効性と安全性は、12 歳から 84 歳までの慢性特発性蕁麻疹患者 416 人を対象に調査され、そのうち 211 人がクラリネックスの投与を受けました。 6 週間にわたる 2 つの二重盲検プラセボ対照無作為化臨床試験で、事前に指定された 1 週間の初回評価時点で、クラリネックス錠はプラセボと比較してそう痒の重症度を大幅に軽減しました(表 5)。副次的評価項目も評価され、クラリネックス 5mg 錠 5mg は治療の最初の 1 週間で、副次的評価項目である「蕁麻疹の数」と「最大の蕁麻疹のサイズ」をプラセボと比較して減少させました。
クラリネックス経口液剤の臨床的安全性は、アレルギー性鼻炎、慢性特発性蕁麻疹の既往歴のある小児被験者、または抗ヒスタミン療法の候補であった被験者を対象とした、15 日間の 3 回の二重盲検プラセボ対照安全性試験で報告されています。最初の研究では、クラリネックス オーラル ソリューション 2.5 mg が 6 歳から 11 歳までの 60 人の小児被験者に投与されました。 2 番目の研究では、2 歳から 5 歳の 55 人の小児被験者に投与された 1.25 mg のクラリネックス経口溶液が評価されました。 3 つ目の研究では、12 ~ 23 か月齢の 65 人の小児被験者に 1.25 mg の CLALINEX 5mg 経口溶液を投与し、6 ~ 11 か月齢の 66 人の小児被験者に 1.0 mg の CLARINEX 経口溶液を投与しました。これらの研究の結果は、生後 6 か月から 11 歳までの小児被験者における CLALINEX 5mg 経口溶液の安全性を実証しました。
患者情報
クラリネックス® (CLA-RI-NEX) (デスロラタジン) 錠剤、RediTabs®、経口液剤
CLALINEX® の服用を開始する前、およびリフィルを入手するたびに、CLARINEX® に付属の患者情報をお読みください。新しい情報があるかもしれません。このリーフレットは、患者さん向けの情報をまとめたものです。医師または薬剤師から追加情報を得ることができます。このリーフレットは、病状や治療について医師に相談する代わりにはなりません。
クラリネックス5mgとは?
クラリネックスは、デスロラタジン(抗ヒスタミン薬)を含む処方薬です。
クラリネックスは、以下の症状をコントロールするために使用されます:
- 2歳以上の季節性アレルギー性鼻炎(くしゃみ、鼻づまり、鼻水、鼻のかゆみ)。
- 生後 6 か月以上の人の通年性アレルギー性鼻炎 (くしゃみ、鼻づまり、鼻水、鼻のかゆみ)。
- 慢性特発性蕁麻疹 (長期のかゆみ) と生後 6 ヶ月以上の人々の蕁麻疹の数とサイズを減らすために.
クラリネックスは、生後 6 か月未満の子供には使用できません。
クラリネックスを服用してはいけない人は?
次の場合は、クラリネックス 5mg を服用しないでください。
- デスロラタジンまたはクラリネックス錠、クラリネックス RediTab®、またはクラリネックス経口液剤のいずれかの成分にアレルギーがある。成分の完全なリストについては、このリーフレットの最後を参照してください。
- ロラタジン(アラバート、クラリチン)にアレルギーがあります。
この薬を服用するかどうかについて質問がある場合は、この薬を服用する前に医師に相談してください。
CLALINEX 5mg を服用する前に医師に何を伝えるべきですか?
クラリネックス 5mg を服用する前に、次の場合は医師に相談してください。
- 肝臓または腎臓に問題がある。
- 他の病状がある。
- 妊娠している、または妊娠する予定がある。クラリネックス 5mg が胎児に害を及ぼすかどうかは不明です。妊娠中または妊娠を計画している場合は、医師に相談してください。
- 授乳中または授乳を計画している。クラリネックス 5mg は母乳に移行する可能性があります。クラリネックスを服用する場合、赤ちゃんに与える最善の方法について医師に相談してください。
服用しているすべての薬について医師に伝えてください。 処方薬および非処方薬、ビタミン、ハーブサプリメントを含みます。クラリネックス 5mg は他の医薬品の作用に影響を与える可能性があり、他の医薬品はクラリネックス 5mg の作用に影響を与える可能性があります。特に次の場合は医師に相談してください。
- ケトコナゾール(ニゾラール)
- エリスロマイシン(Ery-tab、Eryc、PCE)
- アジスロマイシン(ジスロマック、Zmax)
- 抗ヒスタミン剤
- フルオキセチン(プロザック)
- シメチジン(タガメット)
服用している薬を知る。あなたの薬のリストを保管し、新しい薬を手に入れるときに医師と薬剤師に見せてください.
クラリネックスの服用方法は?
- クラリネックス 5mg は、医師の指示どおりに服用してください。
- クラリネックス 5mg の用量を変更したり、規定よりも頻繁に服用したりしないでください。
- クラリネックス 5mg は食事の有無にかかわらず服用できます。
- CLALINEX RediTabs タブレットを舌の上に置き、飲み込む前に溶かしてください。 CLALINEX 5mg RediTab は、水の有無にかかわらず服用できます。ブリスターを開封したら、すぐに CLALINEX 5mg RediTabs タブレットを服用してください。
- クラリネックス内服液は、2mLまたは2.5mLを測れるスポイトまたは経口注射器で服用してください。スポイトまたは注射器がない場合は、薬剤師に相談してください。
- クラリネックスの服用量が多すぎる場合は、すぐに医師に連絡するか、医師の診察を受けてください。
クラリネックス錠の副作用の可能性は?
クラリネックス 5mg は、次のような重大な副作用を引き起こす可能性があります。
- アレルギー反応。次のような症状がある場合は、クラリネックス 5mg の服用を中止し、すぐに医師に連絡するか、緊急の助けを求めてください。
- 発疹
- かゆみ
- 蕁麻疹
- 唇、舌、顔、喉の腫れ
- 息切れまたは呼吸困難
アレルギー性鼻炎の成人および 12 歳以上の小児におけるクラリネックスの最も一般的な副作用は次のとおりです。
- 喉の痛み
- 口渇
- 筋肉痛
- 疲れ
- 眠気
- 生理痛
医師が処方したよりも多くのクラリネックスを服用すると、眠気や疲労感が増す可能性があります.
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、CLARINEX の考えられる副作用のすべてではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
クラリネックス 5mg の保管方法は?
- 店 クラリネックス錠 59°F から 86°F (15°C から 30°C) の間。
- クラリネックス錠 熱に敏感です。 86°F (30°C) 以上で保管しないでください。
- 守る クラリネックス錠5mg 水分から。
- 店 クラリネックス内服液5mg 59°F から 86°F (15°C から 30°C) の間。クラリネックス 5mg 内用液を光から守ります。
保つ クラリネックス錠、レディタブ錠 、 と 内服液 また、すべての薬は子供の手の届かないところにあります。
クラリネックスに関する一般情報
医薬品は、患者情報リーフレットに記載されている以外の目的で処方されることがあります。クラリネックス 5mg は、処方されていない状態には使用しないでください。他の人があなたと同じ状態であっても、クラリネックス 5mg を与えないでください。それらに害を及ぼす可能性があります。
この患者情報リーフレットには、CLARINEX に関する最も重要な情報がまとめられています。さらに詳しい情報が必要な場合は、医師に相談してください。医療専門家向けに書かれた CLALINEX に関する情報については、薬剤師または医師にお尋ねください。
詳細については、 www.CLARINEX.com
クラリネックス5mgの成分は?
有効成分: デスロラタジン
フェニルケトン尿症の患者: CLALINEX RediTabs タブレットには、フェニルアラニンが含まれています。
クラリネックス 5mg 錠の不活性成分: 二塩基性リン酸カルシウム二水和物 USP、微晶質セルロース NF、コーンスターチ NF、タルク USP、カルナウバワックス NF、ホワイトワックス NF、ラクトース一水和物、ヒプロメロース、二酸化チタン、ポリエチレングリコール、および FD&C ブルー #2 アルミニウムレーキからなるコーティング材。
クラリネックス 5mg 経口液剤の不活性成分: プロピレングリコール USP、ソルビトール溶液 USP、クエン酸 (無水) USP、クエン酸ナトリウム二水和物 USP、安息香酸ナトリウム NF、エデト酸二ナトリウム USP、精製水 USP。また、グラニュー糖、バブルガム用の天然および人工香料、FDC イエロー #6 染料も含まれています。
