Mobic 7.5mg, 15mg Meloxicam 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Mobic 15mg とは何ですか? どのように使用されますか?
Mobic 7.5mg は、変形性関節症、関節リウマチ、および中等度から重度の痛みの症状を治療するために使用される処方箋非ステロイド性抗炎症薬です。 Mobic 7.5mg は、単独で使用することも、他の医薬品と併用することもできます。
モビックは非ステロイド性抗炎症薬(NSAID)です。
Mobic が体重 132 ポンド (60 kg) 未満の子供に安全で効果的かどうかはわかっていません。
Mobic 7.5mg の副作用の可能性は何ですか?
- あらゆる種類の皮膚発疹、
- 呼吸困難、
- 腫れ、
- 急激な体重増加、
- 血便またはタール便
- コーヒーかすのような吐血や吐血、
- 吐き気、
- 上腹部の痛み、
- かゆみ、
- 疲労感、
- 風邪のような症状、
- 食欲減少、
- 暗い尿、
- 粘土色の便、
- 目や皮膚の黄変(黄疸)、
- 薄い肌、
- 疲れ、
- 立ちくらみ、
- 手や足の冷え、
- 排尿がほとんどまたはまったくない、および
- 足や足首の腫れ
上記の症状がある場合は、すぐに医療機関を受診してください。
Mobic 15mg の最も一般的な副作用は次のとおりです。
- 胃痛、
- 吐き気、
- 嘔吐、
- 胸焼け、
- 下痢、
- 便秘、
- ガス、
- めまい、および
- 風邪やインフルエンザの症状
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは Mobic の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
重篤な心血管および胃腸イベントのリスク
心血管血栓性イベント
- 非ステロイド性抗炎症薬 (NSAIDs) は、心筋梗塞や脳卒中などの重篤な心血管血栓性イベントのリスクを高め、致命的になる可能性があります。このリスクは、治療の初期に発生する可能性があり、使用期間とともに増加する可能性があります [警告と注意事項を参照]。
- MOBIC 7.5mg は、冠動脈バイパス移植 (CABG) 手術の設定では禁忌です [禁忌および警告と注意事項を参照]。
消化管出血、潰瘍、および穿孔
- NSAID は、胃や腸の出血、潰瘍、穿孔など、致命的な可能性がある重篤な胃腸 (GI) の有害事象のリスクを高めます。これらのイベントは、使用中にいつでも、警告なしに発生する可能性があります。高齢患者および消化性潰瘍疾患および/または消化管出血の既往歴のある患者は、深刻な消化管イベントのリスクが高くなります[警告と注意事項を参照]。
説明
MOBIC (メロキシカム) は、非ステロイド性抗炎症薬 (NSAID) です。パステルイエローの MOBIC 15mg 錠剤には、経口投与用に 7.5mg または 15mg のメロキシカムが含まれています。メロキシカムは、4-ヒドロキシ-2-メチル-N-(5メチル2チアゾリル)-2H-1,2-ベンゾチアジン-3-カルボキサミド-1,1-ジオキシドと化学的に指定されています。分子量は351.4です。その実験式は C14H13N3O4S2 であり、次の構造式を持っています。
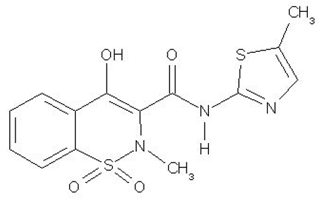
メロキシカムはパステルイエローの固体で、実質的に水に溶けず、強酸や強塩基で高い溶解度が観察されます。メタノールに非常に溶けにくい。メロキシカムは、n-オクタノール/バッファー pH 7.4 中で見かけの分配係数 (log P)app = 0.1 を持っています。メロキシカムの pKa 値は 1.1 と 4.2 です。
MOBIC 15mg は、7.5 mg または 15 mg のメロキシカムを含む経口投与用の錠剤として入手できます。
MOBIC 15mg 錠剤の不活性成分には、コロイド状二酸化ケイ素、クロスポビドン、ラクトース一水和物、ステアリン酸マグネシウム、微結晶性セルロース、ポビドン、およびクエン酸ナトリウム二水和物が含まれます。
適応症
変形性関節症(OA)
MOBIC は、変形性関節症の徴候および症状の緩和に適応されます [参照 臨床研究
関節リウマチ(RA)
MOBIC は、関節リウマチの徴候および症状の緩和に適応されます [参照 臨床研究 ]。
若年性関節リウマチ (JRA) 少関節および多関節コース
MOBIC 7.5 mg は、体重が 60 kg 以上の患者の少関節または多関節の若年性関節リウマチの徴候および症状の緩和に適応します [参照 投薬と管理 と 臨床研究 ]。
投薬と管理
一般的な投与指示
MOBIC の使用を決定する前に、MOBIC およびその他の治療オプションの潜在的な利点とリスクを慎重に検討してください。個々の患者の治療目標に一致する最短の期間で最低の有効用量を使用する [参照 警告と注意事項 ]。
MOBIC による初期治療に対する反応を観察した後、個々の患者のニーズに合わせて用量を調整します。
成人の場合、MOBIC の 1 日最大推奨経口投与量は、製剤に関係なく 15 mg です。血液透析患者では、1 日最大 7.5 mg が推奨されます。 特定の集団での使用 と 臨床薬理学
MOBICは食事のタイミングに関係なく服用できます。
変形性関節症
変形性関節症の徴候と症状を緩和するために、MOBIC の推奨される開始および維持経口用量は、1 日 1 回 7.5 mg です。一部の患者は、1 日 1 回 15 mg に用量を増やすことで、追加の効果が得られる場合があります。
関節リウマチ
関節リウマチの兆候と症状を軽減するために、MOBIC 7.5mg の推奨開始および維持経口用量は、1 日 1 回 7.5mg です。一部の患者は、1 日 1 回 15 mg に用量を増やすことで、追加の効果が得られる場合があります。
若年性関節リウマチ (JRA) 少関節および多関節コース
若年性関節リウマチの治療では、体重が 60 kg 以上の子供の場合、MOBIC 7.5 mg の推奨経口投与量は 1 日 1 回 7.5 mg です。臨床試験で 7.5 mg を超えて用量を増やしても、追加の利点は示されませんでした。
MOBIC タブレットは、体重が 60 kg 未満の子供には使用しないでください。
腎障害
重度の腎障害のある被験者への MOBIC 15mg の使用は推奨されません。
血液透析中の患者では、MOBIC の最大投与量は 1 日あたり 7.5 mg です。 臨床薬理学 ]。
メロキシカムの他の製剤との非互換性
MOBIC 錠は、他の承認された経口メロキシカム製剤と同等の全身曝露を示していません。したがって、総ミリグラム強度が同じであっても、MOBIC 7.5mg 錠剤は経口メロキシカム製品の他の製剤と互換性がありません。 MOBIC 7.5mg 錠剤の同様の用量強度を、経口メロキシカム製品の他の製剤で代用しないでください。
供給方法
剤形と強度
MOBIC(メロキシカム)錠:
- 7.5 mg: メロキシカム 7.5 mg を含むパステル イエロー、円形、両凸、素錠。片面にベーリンガーインゲルハイムのロゴ、もう片面に「M」の文字が印象的。
- 15mg:メロキシカム15mgを含有するパステルイエロー、長方形、両凸、素錠。片面にタブレットコード「15」、もう片面に「M」の文字が印象的。
保管と取り扱い
モビック メロキシカム 7.5 mg を含むパステル イエロー、円形、両凸、コーティングなしの錠剤、またはメロキシカム 15 mg を含むパステル イエロー、長方形、両凸、コーティングなしの錠剤として入手できます。 7.5 mg の錠剤には、片面にベーリンガー インゲルハイムのロゴ、もう片面に「M」の文字が刻印されています。 15 mg 錠剤には、片面に錠剤コード「15」、もう片面に「M」の文字が刻印されています。
MOBIC (メロキシカム) 錠 7.5 mg: NDC 0597-0029-01; 100本のボトル
MOBIC (メロキシカム) 錠 15 mg: NDC 0597-0030-01; 100本のボトル
保管所
20°C から 25°C (68°F から 77°F) で保管してください。 15°C から 30°C (59°F から 86°F) まで許容されるエクスカーション [参照 USP制御の室温 ]。 MOBIC タブレットは乾燥した場所に保管してください。
タイトな容器に錠剤を調剤します。
これとすべての薬を子供の手の届かないところに保管してください。
販売元: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 USA.改訂: 2021 年 4 月
副作用
次の副作用については、ラベルの他のセクションで詳しく説明しています。
- 心血管血栓性イベント [参照 囲み警告 と 警告と注意事項 ]
- 消化管出血、潰瘍、および穿孔 [参照 囲み警告 と 警告と注意事項 ]
- 肝毒性 [参照 警告と注意事項 ]
- 高血圧 [参照 警告と注意事項 ]
- 心不全および浮腫 [参照 警告と注意事項 ]
- 腎毒性および高カリウム血症 [参照 警告と注意事項 ]
- アナフィラキシー反応 [参照 警告と注意事項 ]
- 深刻な皮膚反応 [参照 警告と注意事項 ]
- 好酸球増加症および全身症状(DRESS)を伴う薬物反応 [参照 警告と注意事項 ]
- 胎児毒性 [参照 警告と注意事項 ]
- 血液毒性 [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
大人
変形性関節症と関節リウマチ
MOBIC フェーズ 2/3 臨床試験データベースには、MOBIC 7.5 mg/日で治療された 10,122 人の OA 患者と 1012 人の RA 患者、MOBIC 15 mg/日で治療された 3505 人の OA 患者と 1351 人の RA 患者が含まれています。これらの用量の MOBIC は、661 人の患者に少なくとも 6 か月間、312 人の患者に少なくとも 1 年間投与されました。これらの患者の約 10,500 人が 10 のプラセボおよび/または実薬対照変形性関節症試験で治療され、これらの患者の 2363 人が 10 のプラセボおよび/または実薬対照関節リウマチ試験で治療されました。胃腸(GI)の有害事象は、MOBIC 15mg 試験のすべての治療群で最も頻繁に報告された有害事象でした。
MOBIC 7.5mg の有効性と安全性をプラセボおよび実薬群と比較するために、膝または股関節の変形性関節症患者を対象に 12 週間の多施設二重盲検無作為試験を実施しました。 MOBIC の有効性と安全性をプラセボと比較するために、関節リウマチ患者を対象に 12 週間の多施設二重盲検ランダム化試験が 2 件実施されました。
表 1a は、12 週間のプラセボおよび実薬対照変形性関節症試験で、MOBIC 治療群の 2% 以上で発生した有害事象を示しています。
表 1b は、2 つの 12 週間のプラセボ対照関節リウマチ試験で、MOBIC 7.5mg 治療群の 2% 以上で発生した有害事象を示しています。
実薬対照変形性関節症試験で短期(4~6週間)および長期(6ヶ月)治療を受けた患者の2%以上でMOBIC 15mgで発生した有害事象を表2に示します。
高用量の MOBIC (22.5 mg 以上) は、重篤な消化管イベントのリスク増加と関連しています。したがって、MOBIC 15mg の 1 日量は 15mg を超えてはなりません。
小児科
少関節および多関節コース 若年性関節リウマチ (JRA)
387 人の少関節および多関節コースの JRA 患者が、3 つの臨床試験で 1 日あたり 0.125 ~ 0.375 mg/kg の範囲の用量で MOBIC 15 mg に曝露されました。これらの研究は、2 つの 12 週間の多施設共同二重盲検ランダム化試験 (1 つは 12 週間の非盲検延長試験、もう 1 つは 40 週間の延長試験) と 1 つの 1 年間の非盲検 PK 試験で構成されていました。 MOBIC 15mg を使用したこれらの小児科の研究で観察された有害事象は、成人の臨床試験の経験と本質的に類似していましたが、頻度には違いがありました.特に、次の最も一般的な有害事象である腹痛、嘔吐、下痢、頭痛、および発熱は、成人の試験よりも小児でより一般的でした. MOBIC を投与された 7 例 (
以下は、約 16,200 人の患者を対象とした臨床試験で MOBIC を投与された患者の 2% 未満で発生した副作用のリストです。
全身: アレルギー反応、顔面浮腫、疲労感、発熱、のぼせ、倦怠感、失神、体重減少、体重増加
心血管 : 狭心症、心不全、高血圧、低血圧、心筋梗塞、血管炎
中枢および末梢神経系: 痙攣、感覚異常、振戦、めまい
胃腸 :大腸炎、口渇、十二指腸潰瘍、おくび、食道炎、胃潰瘍、胃炎、胃食道逆流症、消化管出血、吐血、出血性十二指腸潰瘍、出血性胃潰瘍、腸管穿孔、下血、膵炎、十二指腸潰瘍穿孔、胃潰瘍穿孔、口内炎潰瘍性
心拍数とリズム: 不整脈、動悸、頻脈
血液学 : 白血球減少症、紫斑病、血小板減少症
肝臓と胆道系: ALT上昇、AST上昇、ビリルビン血症、GGT上昇、肝炎
代謝と栄養 :脱水
精神的 :異常夢、不安、食欲増進、錯乱、抑うつ、神経過敏、傾眠
呼吸器 : 喘息、気管支痙攣、呼吸困難
皮膚と付属物: 脱毛症、血管性浮腫、水疱性発疹、光線過敏症、かゆみ、発汗増加、蕁麻疹
特別な感覚 : 視力異常、結膜炎、味覚異常、耳鳴り
泌尿器系 : 蛋白尿、BUN上昇、クレアチニン上昇、血尿、腎不全
市販後の経験
MOBICの承認後の使用中に、次の副作用が確認されました。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.自発報告による有害事象をラベリングに含めるかどうかの決定は、通常、次の要因の 1 つまたは複数に基づいて行われます。薬。世界的な市販後の経験または文献で報告されている有害反応には、次のものがあります。無顆粒球症;気分の変化 (気分の高揚など);ショックを含むアナフィラキシー反応;多形紅斑;剥脱性皮膚炎;間質性腎炎;黄疸;肝不全;スティーブンス・ジョンソン症候群;中毒性表皮壊死融解症、不妊症の女性。
薬物相互作用
メロキシカムとの臨床的に重要な薬物相互作用については、表 3 を参照してください。こちらもご覧ください 警告と注意事項 と 臨床薬理学 .
警告
の一部として含まれています 予防 セクション。
予防
心血管血栓性イベント
いくつかの COX-2 選択的および非選択的 NSAID の最大 3 年間の臨床試験では、致命的な可能性がある心筋梗塞 (MI) や脳卒中などの重篤な心血管 (CV) 血栓症のリスクが増加することが示されています。利用可能なデータに基づくと、CV 血栓イベントのリスクがすべての NSAID で同様であることは明らかではありません。 NSAID の使用によってもたらされるベースラインを超える重篤な心血管血栓性イベントの相対的な増加は、既知の心血管疾患または心血管疾患の危険因子がある場合とない場合で同様であるように思われます。しかし、既知の心血管疾患または危険因子を持つ患者は、ベースライン率が高いため、過剰な重篤な心血管血栓イベントの絶対発生率が高くなりました。いくつかの観察研究では、深刻な CV 血栓症のリスクの増加は、治療の最初の数週間で始まったことがわかりました。 CV 血栓リスクの増加は、高用量で最も一貫して観察されています。
NSAID 治療を受けている患者の有害な CV イベントの潜在的なリスクを最小限に抑えるために、可能な限り短い期間で最小の有効用量を使用してください。医師と患者は、以前の心血管症状がなくても、治療過程全体を通して、そのような事象の発生に注意を払う必要があります。重篤な心血管イベントの症状と、発生した場合の対処法について、患者に説明する必要があります。
アスピリンの同時使用が、NSAID の使用に関連する重篤な CV 血栓イベントのリスク増加を軽減するという一貫した証拠はありません。アスピリンとメロキシカムなどの NSAID の同時使用は、重篤な胃腸(GI)イベントのリスクを高めます。 警告と注意事項 ]。
冠動脈バイパス移植(CABG)手術後の状態
CABG 手術後の最初の 10 ~ 14 日間の痛みの治療のための COX-2 選択的 NSAID の 2 つの大規模な対照臨床試験では、心筋梗塞と脳卒中の発生率が増加することがわかりました。 NSAIDs は、CABG の状況では禁忌です [参照 禁忌 ]。
MI後の患者
デンマーク国民登録簿で実施された観察研究では、MI 後の期間に NSAID で治療された患者は、治療の最初の週から、再梗塞、心血管関連死、および全死因死亡のリスクが高いことが示されました。この同じコホートでは、MI 後 1 年間の死亡率は、非 NSAID 曝露患者では 100 人年あたり 12 であるのに対し、NSAID 治療患者では 100 人年あたり 20 でした。絶対死亡率は MI 後 1 年目から幾分低下したが、NSAID 使用者の死亡の相対リスクの増加は、少なくともその後 4 年間の追跡調査で持続した。
最近心筋梗塞を発症した患者では、CV 血栓性イベントの再発のリスクを上回ると予想される場合を除き、MOBIC 15mg の使用を避けてください。 MOBIC 15mg を心筋梗塞を起こしたばかりの患者に使用する場合は、心虚血の徴候がないか患者を監視してください。
消化管出血、潰瘍、および穿孔
メロキシカムを含む NSAID は、食道、胃、小腸、または大腸の炎症、出血、潰瘍、穿孔など、致命的な可能性がある重篤な胃腸 (GI) の有害事象を引き起こす可能性があります。これらの重篤な有害事象は、NSAID で治療されている患者において、警告症状の有無にかかわらず、いつでも発生する可能性があります。 NSAID 療法で重篤な上部消化管の有害事象を発症した患者の 5 人に 1 人のみが症状を示します。 NSAID による上部消化管潰瘍、肉眼的出血、または穿孔は、3 ~ 6 か月間治療を受けた患者の約 1%、1 年間治療を受けた患者の約 2% ~ 4% で発生しました。ただし、短期間の NSAID 治療でもリスクがないわけではありません。
消化管出血、潰瘍、および穿孔の危険因子
消化性潰瘍疾患および/または消化管出血の既往歴があり、NSAID を使用した患者は、これらの危険因子のない患者と比較して、消化管出血を発症するリスクが 10 倍以上高くなりました。 NSAID で治療された患者の消化管出血のリスクを高めるその他の要因には、NSAID 治療の長期化が含まれます。経口コルチコステロイド、アスピリン、抗凝固薬、または選択的セロトニン再取り込み阻害薬(SSRI)の併用。喫煙;アルコールの使用;高齢;および一般的な健康状態が悪い。致命的な消化管イベントに関する市販後の報告のほとんどは、高齢者または衰弱した患者で発生しました。さらに、進行した肝疾患および/または凝固障害のある患者は、消化管出血のリスクが高くなります。
NSAID 治療患者の消化管リスクを最小限に抑えるための戦略
- 可能な限り短い期間で最低の有効量を使用してください。
- 一度に複数の NSAID を投与することは避けてください。
- 利点が出血のリスクの増加を上回ると予想される場合を除き、リスクの高い患者への使用は避けてください。そのような患者、および活動性消化管出血のある患者については、NSAIDs 以外の代替療法を検討してください。
- NSAID 治療中は、消化管潰瘍や出血の徴候や症状に注意してください。
- 重篤な胃腸の有害事象が疑われる場合は、直ちに評価と治療を開始し、重篤な胃腸の有害事象が除外されるまで MOBIC 15mg を中止してください。
- 心臓予防のために低用量アスピリンを併用している状況では、消化管出血の証拠について患者をより綿密に監視する[参照 薬物相互作用 ]。
肝毒性
ALT または AST の上昇 (正常 [ULN] の上限の 3 倍以上) が、臨床試験で NSAID 治療を受けた患者の約 1% で報告されています。さらに、劇症肝炎、肝壊死、肝不全などのまれな、時には致命的な重度の肝障害の症例が報告されています。
ALT または AST の上昇 (ULN の 3 倍未満) は、メロキシカムを含む NSAID で治療された患者の最大 15% で発生する可能性があります。
肝毒性の警戒すべき兆候と症状(吐き気、疲労、無気力、下痢、そう痒症、黄疸、右上腹部圧痛、「インフルエンザ様」症状など)について患者に知らせる。肝疾患に一致する臨床徴候および症状が発現した場合、または全身症状が発生した場合 (例、好酸球増加症、発疹など)、MOBIC を直ちに中止し、患者の臨床評価を実施する [参照 特定の集団での使用 と 臨床薬理学 ]。
高血圧症
MOBIC を含む NSAID は、既存の高血圧の新たな発症または悪化につながる可能性があり、いずれも CV イベントの発生率の増加に寄与する可能性があります。アンギオテンシン変換酵素 (ACE) 阻害薬、サイアザイド利尿薬、またはループ利尿薬を服用している患者は、NSAID を服用すると、これらの治療に対する反応が損なわれる可能性があります [参照 薬物相互作用 ]。
NSAID 治療の開始時および治療中は、血圧 (BP) を監視します。
心不全と浮腫
Coxib と従来の NSAID Trialists’ Collaboration によるランダム化比較試験のメタ分析では、COX-2 選択的治療を受けた患者と非選択的 NSAID 治療を受けた患者では、プラセボ治療を受けた患者と比較して、心不全による入院が約 2 倍増加したことが示されました。心不全患者を対象としたデンマーク国立登録簿の研究では、NSAID の使用により心筋梗塞、心不全による入院、および死亡のリスクが増加しました。
さらに、体液貯留と浮腫は、NSAID で治療された一部の患者で観察されています。メロキシカムの使用は、これらの病状の治療に使用されるいくつかの治療薬(利尿薬、ACE阻害薬、またはアンギオテンシン受容体遮断薬[ARB]など)のCV効果を鈍らせる可能性があります[ 薬物相互作用 ]。
重度の心不全患者への MOBIC 15mg の使用は、心不全の悪化のリスクを上回ると予想される場合を除き、避けてください。重度の心不全患者に MOBIC を使用する場合は、心不全の悪化の徴候がないか患者を監視してください。
腎毒性と高カリウム血症
腎毒性
MOBIC を含む NSAID の長期投与は、腎乳頭壊死、腎機能不全、急性腎不全、およびその他の腎障害を引き起こしています。
腎毒性は、腎プロスタグランジンが腎灌流の維持において代償的役割を果たしている患者にも見られます。これらの患者では、NSAID の投与によりプロスタグランジン生成が用量依存的に減少し、二次的に腎血流が減少し、明らかな腎代償不全が引き起こされる可能性があります。この反応のリスクが最も高い患者は、腎機能障害、脱水、循環血液量減少、心不全、肝機能障害、利尿薬および ACE 阻害薬または ARB を服用している患者、および高齢者です。通常、NSAID 療法を中止すると、治療前の状態に戻ります。
MOBIC の腎臓への影響は、既存の腎疾患を持つ患者の腎機能障害の進行を早める可能性があります。一部の MOBIC 代謝産物は腎臓から排泄されるため、腎機能の悪化の徴候がないか患者を監視してください。
MOBIC を開始する前に、脱水症または血液量減少症の患者の体液量ステータスを修正します。 MOBIC の使用中は、腎障害または肝障害、心不全、脱水症、血液量減少症の患者の腎機能をモニタリングする [参照 薬物相互作用 ]。
進行性腎疾患患者における MOBIC 15mg の使用に関する管理された臨床研究から得られる情報はありません。腎機能が悪化するリスクを上回ると期待される場合を除き、腎疾患が進行した患者への MOBIC 7.5mg の使用は避けてください。進行した腎疾患の患者に MOBIC を使用する場合は、腎機能の悪化の徴候がないか患者を監視する [参照 臨床薬理学 ]。
高カリウム血症
高カリウム血症を含む血清カリウム濃度の上昇は、腎機能障害のない一部の患者でさえ、NSAID の使用で報告されています。腎機能が正常な患者では、これらの影響は低レニン血症-低アルドステロン症状態に起因するとされています。
アナフィラキシー反応
メロキシカムは、メロキシカムに対する既知の過敏症の有無にかかわらず、アスピリン感受性喘息患者のアナフィラキシー反応と関連している[参照 禁忌 と 警告と注意事項 ]。
アナフィラキシー反応が発生した場合は、緊急の助けを求めてください。
アスピリン感受性に関連する喘息の増悪
喘息患者の亜集団は、鼻ポリープを合併した慢性副鼻腔炎を含む可能性があるアスピリン感受性喘息を有する可能性があります。重度の致命的な気管支痙攣;および/またはアスピリンやその他の NSAID に対する不耐性。このようなアスピリン感受性患者では、アスピリンと他の NSAID との交差反応性が報告されているため、MOBIC は、この形態のアスピリン感受性を持つ患者には禁忌です [ 禁忌 ]。 MOBIC 15mg を既存の喘息患者 (アスピリン感受性がない) に使用する場合は、喘息の徴候や症状の変化について患者を監視してください。
深刻な皮膚反応
メロキシカムを含む NSAID は、剥脱性皮膚炎、スティーブンス・ジョンソン症候群 (SJS)、中毒性表皮壊死症 (TEN) などの重篤な皮膚有害反応を引き起こし、致命的な場合があります。これらの重大なイベントは、予告なしに発生する可能性があります。重篤な皮膚反応の兆候と症状について患者に知らせ、皮膚発疹またはその他の過敏症の兆候が最初に現れた場合は MOBIC の使用を中止してください。 MOBIC は、以前に NSAIDs に対して重篤な皮膚反応を示した患者には禁忌です [参照 禁忌 ]。
好酸球増加症および全身症状を伴う薬物反応 (DRESS)
MOBIC などの NSAID を服用している患者では、好酸球増加症および全身症状を伴う薬物反応 (DRESS) が報告されています。これらのイベントのいくつかは、致命的または生命を脅かすものです。 DRESS は通常、発熱、発疹、リンパ節腫脹、および/または顔面の腫れを示しますが、これに限定されません。他の臨床症状には、肝炎、腎炎、血液学的異常、心筋炎、または筋炎が含まれる場合があります。 DRESS の症状は、急性のウイルス感染に似ている場合があります。好酸球増加症がしばしば存在します。この障害は症状がさまざまであるため、ここに記載されていない他の臓器系が関与している可能性があります。発疹が明らかでない場合でも、発熱やリンパ節腫脹などの過敏症の初期症状が存在する可能性があることに注意することが重要です。そのような徴候や症状がある場合は、MOBIC を中止し、直ちに患者を評価してください。
胎児毒性
胎児動脈管の早期閉鎖
妊娠約 30 週以降の妊婦には、MOBIC を含む NSAID の使用を避けてください。 MOBIC を含む NSAID は、ほぼこの妊娠期間で胎児の動脈管の早期閉鎖のリスクを高めます。
羊水過少症/新生児腎障害
MOBIC 15mg を含む NSAID を妊娠約 20 週以降に使用すると、羊水過少症や場合によっては新生児の腎障害につながる胎児の腎機能障害を引き起こす可能性があります。これらの有害な転帰は、平均して数日から数週間の治療後に見られますが、NSAID開始後48時間で羊水過少症が報告されることはめったにありません.羊水過少症は、常にではありませんが、多くの場合、治療を中止すれば元に戻ります。長期にわたる羊水過少症の合併症には、例えば、四肢拘縮および肺成熟の遅延が含まれる場合があります。市販後の新生児腎機能障害の一部の症例では、交換輸血や透析などの侵襲的処置が必要でした。
妊娠 20 週から 30 週の間に NSAID 治療が必要な場合は、MOBIC の使用を最小限の有効量と可能な限り短い期間に制限してください。 MOBIC 15mg の治療が 48 時間を超える場合は、羊水の超音波モニタリングを検討してください。羊水過少症が発生した場合は MOBIC 15mg を中止し、臨床診療に従ってフォローアップする [参照 特定の集団での使用 ]。
血液毒性
NSAID治療を受けた患者に貧血が発生しました。これは、潜在的または総失血、体液貯留、または不完全に記述された赤血球生成への影響が原因である可能性があります。 MOBIC で治療された患者に貧血の徴候や症状がある場合は、ヘモグロビンまたはヘマトクリットを監視してください。
MOBIC 7.5mg を含む NSAID は、出血イベントのリスクを高める可能性があります。凝固障害やワルファリン、他の抗凝固薬、抗血小板薬(アスピリンなど)、セロトニン再取り込み阻害薬(SSRI)、セロトニン・ノルエピネフリン再取り込み阻害薬(SNRI)の併用などの併存疾患は、このリスクを高める可能性があります。これらの患者の出血の徴候を監視します [参照 薬物相互作用 ]。
炎症と発熱のマスキング
MOBIC 15mg の炎症および場合によっては発熱を抑える薬理学的活性は、感染を検出する際の診断的徴候の有用性を低下させる可能性があります。
ラボモニタリング
深刻な消化管出血、肝毒性、および腎障害は、警告の症状や徴候なしに発生する可能性があるため、長期の NSAID 治療を受けている患者を定期的に CBC および化学的プロファイルでモニタリングすることを検討してください。 警告と注意事項 ]。
患者相談情報
患者に、FDA 承認の患者ラベル ( 投薬ガイド 調剤される各処方箋に添付されます。
NSAID による治療を開始する前に、また進行中の治療中に定期的に、患者、家族、またはその介護者に次の情報を知らせてください。
心血管血栓性イベント
胸痛、息切れ、脱力感、ろれつが回らないなどの心血管血栓性イベントの症状に注意し、これらの症状があればすぐに医療提供者に報告するように患者に助言する[参照 警告と注意事項 ]。
消化管出血、潰瘍、および穿孔
心窩部痛、消化不良、下血、吐血などの潰瘍や出血の症状を医療提供者に報告するように患者に助言します。心臓予防のために低用量アスピリンを併用している状況では、消化管出血の徴候と症状のリスクが高いことを患者に知らせる[参照 警告と注意事項 ]。
肝毒性
肝毒性の警戒すべき兆候と症状(吐き気、疲労、無気力、下痢、そう痒症、黄疸、右上腹部圧痛、「インフルエンザ様」症状など)について患者に知らせる。これらが発生した場合は、患者に MOBIC 7.5mg の使用を中止し、直ちに医学的治療を受けるように指示してください [ 警告と注意事項 ]。
心不全と浮腫
息切れ、原因不明の体重増加、または浮腫などのうっ血性心不全の症状に注意し、そのような症状が発生した場合は医療提供者に連絡するよう患者に助言する[参照 警告と注意事項 ]。
アナフィラキシー反応
アナフィラキシー反応の徴候(例、呼吸困難、顔や喉の腫れ)を患者に知らせてください。これらが発生した場合は、直ちに緊急の助けを求めるように患者に指示します[参照 禁忌 と 警告と注意事項 ]。
DRESSを含む深刻な皮膚反応
発疹や発熱が生じた場合は、MOBIC の服用を直ちに中止し、できるだけ早く医療提供者に連絡するように患者にアドバイスします [ 警告と注意事項 ]。
女性の生殖能力
妊娠を希望する生殖能力のある女性には、MOBIC 7.5mg を含む NSAID が排卵の可逆的遅延と関連している可能性があることを助言する [ 特定の集団での使用 ]。
胎児毒性
妊娠中の女性には、胎児の動脈管が早期に閉鎖するリスクがあるため、妊娠 30 週から MOBIC 15mg やその他の NSAID の使用を避けるように伝えてください。妊娠約 20 ~ 30 週の妊婦に MOBIC 15mg による治療が必要な場合は、治療が 48 時間以上続く場合は、羊水過少症のモニタリングが必要になる可能性があることを伝えてください。 警告と注意事項 と 特定の集団での使用 ]。
NSAIDの併用を避ける
MOBIC 15mg と他の NSAIDs またはサリチル酸塩(例、ジフルニサル、サルサレート)との併用は、胃腸毒性のリスクが高く、有効性がほとんどまたはまったく増加しないため、推奨されないことを患者に知らせます。 警告と注意事項 と 薬物相互作用 ]。風邪、発熱、または不眠症の治療のための「市販薬」に NSAID が含まれている可能性があることを患者に警告します。
NSAID と低用量アスピリンの使用
医療提供者に相談するまで、低用量アスピリンをMOBIC 7.5mgと併用しないように患者に伝えます[ 薬物相互作用 ]。
現在の処方情報については、コードをスキャンするか、Boehringer Ingelheim Pharmaceuticals, Inc. (1-800-542-6257) までお電話ください。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん
ラットでは最大 0.8 mg/kg/日、ラットでは最大 8.0 mg/kg/日までメロキシカムを経口投与したラット (104 週) およびマウス (99 週) の長期発がん性試験では、腫瘍発生率の増加はありませんでした。マウス (体表面積 [BSA] 比較に基づく 15 mg/日 MOBIC 7.5 mg の最大推奨ヒト用量 [MRHD] のそれぞれ最大 0.5 倍および 2.6 倍)。
突然変異誘発
メロキシカムは、Ames アッセイで変異原性を示さず、ヒトリンパ球を用いた染色体異常アッセイおよびマウス骨髄での in vivo 小核試験で染色体異常誘発性を示さなかった。
生殖能力の障害
メロキシカムは、雄で最大 9 mg/kg/日、雌で 5 mg/kg/日までの経口用量で、ラットの雄と雌の受精能を損なわなかった (それぞれ最大 5.8 倍と 3.2 倍、 BSA比較)。
特定の集団での使用
妊娠
リスクの概要
MOBIC を含む NSAID の使用は、胎児の動脈管の早期閉鎖および胎児の腎機能障害を引き起こし、羊水過少症や、場合によっては新生児の腎機能障害を引き起こす可能性があります。これらのリスクがあるため、MOBIC の使用量と使用期間は妊娠 20 週から 30 週までに制限し、妊娠 30 週以降の MOBIC の使用は避けてください ( 臨床上の考慮事項 、 データ )。
胎児動脈管の早期閉鎖
MOBIC 15mg を含む NSAID を妊娠約 30 週以降に使用すると、胎児の動脈管が早期に閉鎖するリスクが高まります。
羊水過少症/新生児腎障害
妊娠約 20 週以降の妊娠での NSAID の使用は、羊水過少症につながる胎児の腎機能障害の症例と関連しており、場合によっては新生児の腎機能障害と関連しています。
妊娠第 1 期または第 2 期の女性における NSAID 使用の潜在的な胎児リスクに関する観察研究のデータは決定的ではありません。
動物の繁殖研究では、MOBIC の最大推奨ヒト用量 (MRHD) の 0.65 倍および 6.5 倍に相当する経口用量のメロキシカムを器官形成期に投与したラットおよびウサギで胚胎児死亡が観察されました。 MRHD の 78 倍に相当する経口用量のメロキシカムを胚形成全体にわたって処理したウサギでは、心臓中隔欠損症の発生率の増加が観察されました。出生前および出生後の生殖研究では、MRHD の 0.08 倍のメロキシカムで、難産の発生率の増加、分娩の遅延、および子孫の生存率の低下が見られました。 MRHD の 2.6 倍および 26 倍に相当する経口用量のメロキシカムを器官形成中に投与したラットおよびウサギでは、催奇形性の影響は観察されなかった [参照 データ ]。
動物データに基づいて、プロスタグランジンは子宮内膜の血管透過性、胚盤胞着床、および脱落膜化において重要な役割を果たしていることが示されています。動物実験では、メロキシカムなどのプロスタグランジン合成阻害剤の投与により、着床前および着床後の損失が増加しました。プロスタグランジンは、胎児の腎臓の発達にも重要な役割を果たしていることが示されています。公表された動物研究では、プロスタグランジン合成阻害剤は、臨床的に適切な用量で投与された場合、腎臓の発達を損なうことが報告されています。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。すべての妊娠には、先天性欠損症、喪失、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2% ~ 4% および 15% ~ 20% です。
臨床上の考慮事項
胎児/新生児の有害反応
胎児動脈管の早期閉鎖
MOBIC 7.5mg を含む NSAID は、胎児の動脈管の早期閉鎖を引き起こす可能性があるため、妊娠約 30 週以降の女性への NSAID の使用は避けてください。 データ )。
羊水過少症/新生児腎障害
妊娠約 20 週以降に NSAID が必要な場合は、使用を最小限の有効量と可能な限り短い期間に制限してください。 MOBIC 15mg の治療が 48 時間を超えた場合は、超音波で羊水過少症を監視することを検討してください。羊水過少症が発生した場合は、MOBIC 7.5mg を中止し、臨床診療に従ってフォローアップします ( データ )。
労働または配達
分娩中または分娩中の MOBIC 7.5mg の効果に関する研究はありません。動物実験では、メロキシカムを含む NSAIDs はプロスタグランジン合成を阻害し、分娩を遅らせ、死産の発生率を高めます。
データ
ヒューマンデータ
胎児動脈管の早期閉鎖
出版された文献によると、妊娠約 30 週以降に NSAID を使用すると、胎児の動脈管が早期に閉鎖する可能性があります。
羊水過少症/新生児腎障害
発表された研究および市販後のレポートでは、妊娠約 20 週以降の母親の NSAID 使用が、羊水過少症、場合によっては新生児の腎障害につながる胎児の腎機能障害に関連していると記載されています。これらの有害な転帰は、平均して数日から数週間の治療後に見られますが、NSAID開始後48時間で羊水過少症が報告されることはめったにありません.すべてではありませんが、多くの場合、羊水の減少は一過性であり、薬物の中止により元に戻りました。母体の NSAID 使用および羊水過少症を伴わない新生児の腎機能障害の限られた数の症例報告があり、そのうちのいくつかは不可逆的でした。新生児腎機能障害の一部の症例では、交換輸血や透析などの侵襲的処置による治療が必要でした。
これらの市販後研究およびレポートの方法論的限界には、対照群の欠如が含まれます。薬物曝露の用量、期間、およびタイミングに関する限られた情報。および他の薬の併用。これらの制限により、母体の NSAID 使用による胎児および新生児の有害転帰のリスクの信頼できる推定値を確立することができなくなります。新生児転帰に関する公表された安全性データは主に早産児に関係しているため、母親の使用を通じてNSAIDに曝露された満期産児に対する特定の報告されたリスクの一般化可能性は不明です.
動物データ
メロキシカムは、胎児の器官形成中に妊娠ラットに最大 4 mg/kg/日 (BSA 比較に基づく MOBIC 15 mg の MRHD の 2.6 倍) の経口用量で投与した場合、催奇形性はありませんでした。妊娠中のウサギにメロキシカムを胚形成を通じて投与すると、60 mg/kg/日の経口用量で心臓の中隔欠損症の発生率が増加しました (BSA 比較に基づく MRHD の 78 倍)。無影響レベルは 20 mg/kg/日 (BSA 換算に基づく MRHD の 26 倍) でした。ラットとウサギでは、器官形成を通じて投与された場合、それぞれ 1 mg/kg/日と 5 mg/kg/日の経口メロキシカム用量で胚致死が発生した (BSA 比較に基づく MRHD よりもそれぞれ 0.65 倍と 6.5 倍大きい)。 .
授乳中の妊娠後期に妊娠ラットにメロキシカムを経口投与すると、0.125 mg/kg/日以上のメロキシカム用量で、難産の発生率が増加し、分娩が遅れ、子孫の生存率が低下した (BSA 比較に基づく MRHD の 0.08 倍)。
授乳
リスクの概要
メロキシカムが母乳中に存在するかどうか、母乳で育てられた乳児への影響、または乳生産への影響について利用可能な人間のデータはありません.母乳育児の発達上および健康上の利点は、MOBIC に対する母親の臨床的必要性、および MOBIC 15mg または母体の基礎疾患による母乳育児への潜在的な悪影響と併せて考慮する必要があります。
データ
動物データ
メロキシカムは、授乳中のラットの乳中に、血漿よりも高い濃度で存在していました。
生殖能力のある雌と雄
不妊
女性
作用機序に基づいて、MOBIC を含むプロスタグランジンを介した NSAID の使用は、一部の女性の可逆的不妊症に関連している卵胞の破裂を遅らせるか、または防止する可能性があります。発表された動物研究は、プロスタグランジン合成阻害剤の投与が、排卵に必要なプロスタグランジン媒介卵胞破裂を妨害する可能性があることを示しています. NSAIDs で治療された女性を対象とした小規模な研究でも、可逆的な排卵遅延が示されています。妊娠困難な女性や不妊症の調査を受けている女性では、MOBIC を含む NSAID の中止を検討してください。
小児用
2 歳から 17 歳までの小児 JRA 患者におけるメロキシカムの安全性と有効性は、3 つの臨床試験で評価されています。 投薬と管理 、 有害反応 と 臨床研究 ]。
高齢者の使用
高齢の患者は、若い患者と比較して、NSAID に関連する重篤な心血管、胃腸、および/または腎臓の副作用のリスクが高くなります。高齢患者にとって予想される利益がこれらの潜在的なリスクを上回る場合は、投与範囲の下限から投与を開始し、副作用について患者を監視します[参照 警告と注意事項 ]。
肝障害
軽度から中等度の肝障害のある患者では、用量調整は必要ありません。重度の肝障害を持つ患者は、十分に研究されていません。メロキシカムは肝臓で著しく代謝され、肝毒性が起こる可能性があるため、肝障害のある患者ではメロキシカムを慎重に使用する[参照] 警告と注意事項 と 臨床薬理学 ]。
腎障害
軽度から中等度の腎障害のある患者では、用量調整は必要ありません。重度の腎障害のある患者は研究されていません。重度の腎障害のある被験者への MOBIC 7.5mg の使用は推奨されません。血液透析中の患者では、メロキシカムは 1 日あたり 7.5 mg を超えてはなりません。メロキシカムは透析可能ではありません [参照 投薬と管理 と 臨床薬理学 ]。
過剰摂取
急性 NSAID の過剰摂取に続く症状は通常、無気力、眠気、吐き気、嘔吐、心窩部痛に限定されており、支持療法で一般的に回復可能です。消化管出血が発生しました。高血圧、急性腎不全、呼吸抑制、および昏睡が発生しましたが、まれでした [ 警告と注意事項 ]。
NSAID の過剰摂取後は、対症療法と支持療法で患者を管理します。特定の解毒剤はありません。嘔吐および/または活性炭 (成人で 60 ~ 100 グラム、小児患者では体重 1 kg あたり 1 ~ 2 グラム) および/または摂取後 4 時間以内に見られる症状のある患者または大量の過剰摂取 (推奨用量の 5 ~ 10 倍)。強制利尿、尿のアルカリ化、血液透析、または血液灌流は、タンパク質結合が高いため役に立たない場合があります。
メロキシカムの過剰摂取の経験は限られています。コレスチラミンは、メロキシカムのクリアランスを促進することが知られています。コレスチラミン 4 g を 1 日 3 回経口投与することにより、メロキシカムの除去が促進されることが臨床試験で実証されました。コレスチラミンの投与は、過剰摂取後に役立つ場合があります。
過剰摂取の治療に関する追加情報については、毒物管理センター (1-800-222-1222) に電話してください。
禁忌
MOBIC 15mg は、次の患者には禁忌です。
- -メロキシカムまたは医薬品の成分に対する既知の過敏症(例、アナフィラキシー反応および重篤な皮膚反応)[参照 警告と注意事項 ]
- -アスピリンまたは他のNSAIDを服用した後の喘息、蕁麻疹、またはその他のアレルギー型反応の病歴。そのような患者では、NSAIDsに対する重度の、時には致命的なアナフィラキシー反応が報告されています[ 警告と注意事項 ]
- 冠動脈バイパス移植 (CABG) 手術の状況 [参照 警告と注意事項 ]
臨床薬理学
作用機序
メロキシカムには、鎮痛、抗炎症、解熱作用があります。
MOBIC の作用メカニズムは、他の NSAID と同様に完全には理解されていませんが、シクロオキシゲナーゼ (COX-1 および COX-2) の阻害が関与しています。
メロキシカムは、インビトロでのプロスタグランジン合成の強力な阻害剤です。治療中に到達したメロキシカム濃度は、in vivo 効果を生み出しました。プロスタグランジンは求心性神経を敏感にし、動物モデルで痛みを誘発するブラジキニンの作用を増強します。プロスタグランジンは炎症のメディエーターです。メロキシカムはプロスタグランジン合成の阻害剤であるため、その作用機序は末梢組織におけるプロスタグランジンの減少による可能性があります。
薬物動態
吸収
メロキシカム カプセルの絶対バイオアベイラビリティは、30 mg の IV ボーラス注射と比較して、30 mg の単回経口投与後の 89% でした。単回静脈内投与後、用量に比例した薬物動態が 5 mg から 60 mg の範囲で示されました。複数回の経口投与後、メロキシカム カプセルの薬物動態は、7.5 mg から 15 mg の範囲で用量に比例しました。 7.5 mg のメロキシカム錠剤を絶食条件下で服用した後、平均 C は 4 ~ 5 時間以内に達成され、長期にわたる薬物吸収が示されました。反復投与により、5 日目までに定常状態の濃度に達しました。2 回目のメロキシカム濃度のピークは、投与後約 12 ~ 14 時間で発生し、胆汁のリサイクルが示唆されます。
7.5 mg/5 mL および 15 mg/10 mL のメロキシカム経口懸濁液用量は、それぞれメロキシカム 7.5 mg および 15 mg カプセルと生物学的に同等であることがわかっています。メロキシカム カプセルは、MOBIC 7.5mg 錠剤と生物学的に同等であることが示されています。
食事と制酸効果
高脂肪の朝食 (75 g の脂肪) に続くメロキシカム カプセルの投与は、平均ピーク薬物レベル (すなわち、Cmax) が約 22% 増加し、吸収の程度 (AUC) は変化しませんでした。最大濃度までの時間 (Tmax) は、5 ~ 6 時間で達成されました。対照的に、メロキシカム懸濁液の AUC 値も Cmax 値も、同様の高脂肪食後に影響を受けませんでしたが、平均 Tmax 値は約 7 時間に増加しました。制酸剤の同時投与による薬物動態学的相互作用は検出されませんでした。これらの結果に基づき、MOBIC 15mg は、食事のタイミングや制酸剤の併用に関係なく投与できます。
分布
メロキシカムの平均分布量 (Vss) は約 10 L です。メロキシカムは、治療用量範囲内でヒト血漿タンパク質 (主にアルブミン) に約 99.4% 結合します。タンパク質結合の割合は、臨床的に関連する濃度範囲では薬物濃度とは無関係ですが、腎疾患患者では約 99% まで減少します。経口投与後のメロキシカムのヒト赤血球への浸透は 10% 未満です。放射性標識された用量の後、血漿中に検出された放射能の 90% 以上が未変化のメロキシカムとして存在していました。
滑液中のメロキシカム濃度は、1 回の経口投与後、血漿中の濃度の 40% から 50% の範囲です。血漿と比較して滑液のアルブミン含有量が低いため、滑液の遊離画分は血漿の 2.5 倍です。この貫通の重要性は不明です。
排除
代謝
メロキシカムは、肝臓で広範囲に代謝されます。メロキシカム代謝物には、中間代謝物である 5'-ヒドロキシメチル メロキシカムの酸化によって形成される P-450 媒介代謝からの 5'-カルボキシ メロキシカム (用量の 60%) が含まれますが、これもより少ない程度で排泄されます (用量の 9%)。 )。 In vitro 研究では、CYP2C9 (シトクロム P450 代謝酵素) がこの代謝経路で重要な役割を果たしていることが示されていますが、CYP3A4 アイソザイムの寄与はわずかです。患者のペルオキシダーゼ活性は、それぞれ投与量の 16% と 4% を占める他の 2 つの代謝産物の原因である可能性があります。 4 つの代謝物すべてが in vivo 薬理学的活性を持つことは知られていません。
排泄
メロキシカムの排泄は、主に代謝産物の形で行われ、尿と糞で同程度に発生します。未変化の親化合物の微量のみが尿 (0.2%) および糞便 (1.6%) に排泄されます。尿中排泄の程度は、7.5 mg をラベルなしで複数回投与した場合に確認されました。投与量の 0.5%、6%、および 13% がメロキシカムの形で尿中に検出され、5'-ヒドロキシメチルおよび 5'-ヒドロキシメチルは尿中に検出されました。 -カルボキシ代謝物、それぞれ。薬剤のかなりの胆汁および/または経腸分泌があります。これは、メロキシカムの単回 IV 投与に続くコレスチラミンの経口投与がメロキシカムの AUC を 50% 減少させたときに実証されました。
平均排泄半減期 (t1/2) は 15 時間から 20 時間の範囲です。消失半減期は用量レベル全体で一定であり、治療用量範囲内の線形代謝を示しています。血漿クリアランスは、7 ~ 9 mL/min の範囲です。
特定の集団
小児科
単回 (0.25 mg/kg) の投与後および定常状態 (0.375 mg/kg/日) に達した後、若い患者 (2 ~ 6 歳) では、年長の患者と比較して曝露が約 30% 低いという一般的な傾向がありました。患者(7〜16歳)。年配の患者は、0.25 mg/kg の用量に正規化された AUC 値を使用した場合、成人患者と同様 (単回投与) またはわずかに減少 (定常状態) のメロキシカム曝露を有していた [参照 投薬と管理 ]。メロキシカムの平均 (SD) 排出半減期は、2 歳から 6 歳の患者で 15.2 時間 (10.1)、7 歳から 16 歳の患者で 13.0 時間 (3.0) でした。
母集団の薬物動態の体重を利用した共変量分析では、年齢ではなく、メロキシカムの見かけの経口血漿クリアランスの違いに対する単一の予測共変量でした。体重で正規化された見かけの経口クリアランス値は、小児患者におけるメロキシカム曝露の適切な予測因子でした。
歳未満の小児患者における MOBIC の薬物動態は調査されていません。
高齢者
高齢の男性 (65 歳以上) は、若い男性と同様のメロキシカム血漿濃度と定常状態の薬物動態を示しました。体重の正規化後、年配の女性 (65 歳以上) は、若い女性 (55 歳以下) と比較して、AUCss が 47% 高く、Cmax,ss が 32% 高かった。高齢女性の総濃度が増加したにもかかわらず、有害事象プロファイルは両方の高齢患者集団で同等でした。高齢の男性患者と比較して、高齢の女性患者ではより少ない遊離画分が見られました。
セックス
若い女性は、若い男性と比較してわずかに低い血漿濃度を示しました。 MOBIC 7.5 mg の単回投与後の平均排出半減期は、男性グループの 23.4 時間と比較して、女性グループの 19.5 時間でした。定常状態では、データは類似していました (17.9 時間対 21.4 時間)。性別によるこの薬物動態の違いは、臨床的にはほとんど重要ではないようです。薬物動態には直線性があり、男女間で Cmax または Tmax に顕著な差はありませんでした。
肝障害
メロキシカム 15 mg の単回投与後、健康なボランティアと比較して、軽度 (Child-Pugh クラス I) または中等度 (Child-Pugh クラス II) の肝障害を持つ患者の血漿濃度に顕著な差はありませんでした。メロキシカムのタンパク質結合は、肝機能障害の影響を受けませんでした。軽度から中等度の肝障害のある患者では、用量調整は必要ありません。重度の肝障害 (Child-Pugh クラス III) の患者は十分に研究されていない [参照 警告と注意事項 と 特定の集団での使用 ]。
腎障害
メロキシカムの薬物動態は、軽度および中等度の腎障害のある被験者で調査されています。メロキシカムの総薬物血漿濃度は減少し、メロキシカムの総クリアランスは腎障害の程度とともに増加しましたが、遊離AUC値はすべてのグループで類似していました.腎機能障害のある被験者のメロキシカムクリアランスが高いのは、肝臓の代謝とその後の排泄に利用できる未結合のメロキシカムの割合が増加したためである可能性があります。軽度から中等度の腎障害のある患者では、用量調整は必要ありません。重度の腎障害のある患者は十分に研究されていません。重度の腎障害のある被験者への MOBIC の使用は推奨されません [参照 投薬と管理 、 警告と注意事項 と 特定の集団での使用 ]。
血液透析
メロキシカムの単回投与後、遊離 Cmax 血漿濃度は、健康なボランティア (0.3% 遊離画分) と比較して、慢性血液透析を受けている腎不全患者 (遊離画分 1%) の方が高かった。血液透析は、血漿中の総薬物濃度を低下させませんでした。したがって、血液透析後に追加投与する必要はありません。メロキシカムは透析可能ではありません [参照 投薬と管理 と 特定の集団での使用 ]。
薬物相互作用研究
アスピリン
NSAID をアスピリンと一緒に投与すると、NSAID のタンパク質結合は減少しましたが、遊離 NSAID のクリアランスは変化しませんでした。 MOBIC 15mg を健康なボランティアにアスピリン (1000 mg を 1 日 3 回) と一緒に投与すると、メロキシカムの AUC (10%) と C (24%) が増加する傾向がありました。この相互作用の臨床的意義は不明です。 NSAID とアスピリンとの臨床的に重要な薬物相互作用については、表 3 を参照してください。 薬物相互作用 ]。
コレスチラミン
コレスチラミンによる 4 日間の前処理により、メロキシカムのクリアランスが 50% 大幅に増加しました。これにより、t1/2 が 19.2 時間から 12.5 時間に短縮され、AUC が 35% 減少しました。これは、消化管におけるメロキシカムの再循環経路の存在を示唆しています。この相互作用の臨床的関連性は確立されていません。
シメチジン
シメチジン 200 mg を 1 日 4 回同時に投与しても、メロキシカム 30 mg の単回投与の薬物動態は変化しませんでした。
ジゴキシン
メロキシカム 15 mg を 1 日 1 回 7 日間投与しても、β-アセチルジゴキシンを臨床用量で 7 日間投与した後、ジゴキシンの血漿濃度プロファイルは変化しませんでした。 In vitro 試験では、ジゴキシンとメロキシカムの間にタンパク質結合薬物相互作用は見られませんでした。
リチウム
健康な被験者で実施された研究では、リチウムのみを投与された被験者と比較して、毎日メロキシカム 15 mg QD を使用して 804 ~ 1072 mg の範囲のリチウムを 1 日 2 回投与された被験者では、投与前の平均リチウム濃度と AUC が 21% 増加しました [ 薬物相互作用 ]。
メトトレキサート
13 人の関節リウマチ (RA) 患者を対象とした研究では、週 1 回服用したメトトレキサートの薬物動態に対するメロキシカムの複数回投与の効果が評価されました。メロキシカムは、メトトレキサートの単回投与の薬物動態に有意な影響を与えませんでした。インビトロで、メトトレキサートはメロキシカムをそのヒト血清結合部位から置換しなかった[参照 薬物相互作用 ]。
ワルファリン
ワルファリンの抗凝固効果に対するメロキシカムの効果は、1.2 から 1.8 の間の INR (国際正規化比) を生成するワルファリンの毎日の用量を受け取っている健康な被験者のグループで研究されました。これらの被験者では、メロキシカムはワルファリンの薬物動態およびプロトロンビン時間によって決定されるワルファリンの平均抗凝固効果を変化させませんでした。しかし、1 人の被験者は INR が 1.5 から 2.1 に増加しました。 MOBIC 15mg をワルファリンと一緒に投与する場合は注意が必要です。なぜなら、ワルファリンを服用している患者は、新しい薬が導入されたときに INR の変化と出血性合併症のリスクの増加を経験する可能性があるからです。 薬物相互作用 ]。
臨床研究
変形性関節症と関節リウマチ
膝と股関節の変形性関節症の徴候と症状の治療のための MOBIC 15mg の使用は、12 週間の二重盲検対照試験で評価されました。 MOBIC (毎日 3.75 mg、7.5 mg、および 15 mg) をプラセボと比較しました。 4 つの主要評価項目は、治験責任医師による総合評価、患者の総合評価、患者の疼痛評価、および合計 WOMAC スコア (疼痛、機能、こわばりに関する自記式アンケート) でした。 MOBIC 7.5 mg を毎日、MOBIC 15 mg を毎日服用している患者は、プラセボと比較して、これらの各エンドポイントで有意な改善を示しました。
変形性関節症の徴候と症状の管理のための MOBIC の使用は、4 週間から 6 か月の期間にわたる、米国以外の 6 つの二重盲検の実薬対照試験で評価されました。これらの試験では、7.5 mg/日および 15 mg/日の用量での MOBIC の有効性は、ピロキシカム 20 mg/日およびジクロフェナク SR 100 mg/日に匹敵し、米国の試験で見られた有効性と一致していました。
関節リウマチの兆候と症状を治療するための MOBIC 7.5mg の使用は、12 週間の二重盲検対照多国籍試験で評価されました。 MOBIC (毎日 7.5 mg、15 mg、および 22.5 mg) をプラセボと比較しました。この研究の主要評価項目は、ACR20 応答率であり、RA 応答の臨床、検査、および機能測定の複合測定値です。 MOBIC 7.5 mg および 15 mg を毎日投与された患者は、プラセボと比較して主要評価項目で有意な改善を示しました。 15 mg の用量と比較して、22.5 mg の用量では増加する利点は観察されませんでした。
若年性関節リウマチ (JRA) 少関節および多関節コース
2 歳以上の若年性関節リウマチの徴候および症状の治療のための MOBIC 7.5mg の使用は、2 つの 12 週間の二重盲検並行群実薬対照試験で評価されました。 .
両方の研究には、ナプロキセンと 2 回のメロキシカムの 3 つのアームが含まれていました。両方の研究で、メロキシカムの投与は 0.125 mg/kg/日 (最大 7.5 mg) または 0.25 mg/kg/日 (最大 15 mg) で開始され、ナプロキセンの投与は 10 mg/kg/日で開始されました。 1 つの研究では 12 週間の投与期間を通じてこれらの用量を使用しましたが、もう 1 つの研究では 4 週間後に 0.25 mg/kg/日および 0.375 mg/kg/日 (最大 22.5 mg) のメロキシカムおよび 15 mg/kg の用量に漸増しました。 /ナプロキセンの一日。
有効性分析では、ACR Pediatric 30 レスポンダーの定義、親と治験責任医師の評価、アクティブな関節と可動範囲が制限された関節の数、および赤血球沈降速度の複合体を使用しました。レスポンダーの割合は、両方の研究で 3 つのグループすべてで類似しており、メロキシカムの投与グループ間で違いは観察されませんでした。
患者情報
非ステロイド性抗炎症薬(NSAID)の投薬ガイド
非ステロイド性抗炎症薬 (NSAIDs) と呼ばれる薬について知っておくべき最も重要な情報は何ですか?
NSAID は、次のような重大な副作用を引き起こす可能性があります。
- 死に至る可能性のある心臓発作や脳卒中のリスクが高まります。 このリスクは治療の初期に発生する可能性があり、次のように増加する可能性があります。
- NSAIDsの増量に伴い
- NSAIDの長期使用
「冠動脈バイパス移植(CABG)」と呼ばれる心臓手術の直前または直後に NSAID を服用しないでください。
最近心臓発作を起こした後は、医療提供者が指示しない限り、NSAID の服用を避けてください。最近の心臓発作の後にNSAIDを服用すると、別の心臓発作のリスクが高くなる可能性があります.
- 食道(口から胃につながる管)、胃、腸の出血、潰瘍、裂傷(穿孔)のリスクの増加:
- 使用中いつでも
- 警告症状なし
- 死に至る可能性があるもの
潰瘍または出血のリスクは、次の場合に増加します。
- 胃潰瘍、またはNSAIDの使用による胃または腸の出血の過去の病歴
- 「コルチコステロイド」、「抗凝固薬」、「SSRI」、または「SNRI」と呼ばれる薬を服用し、NSAIDの用量を増やす
- NSAIDの長期使用
- 喫煙
- アルコールを飲む
- 高齢
- 病弱
- 進行した肝疾患
- 出血の問題
NSAID は次の場合にのみ使用してください。
- 規定どおり
- あなたの治療のために可能な限り低い用量で
- 必要最小限の時間で
NSAIDとは何ですか?
NSAID は、さまざまな種類の関節炎、月経痛、およびその他の種類の短期的な痛みなどの病状による痛みや発赤、腫れ、および熱 (炎症) を治療するために使用されます。
NSAIDsを服用してはいけない人は?
NSAID を服用しないでください。
- 喘息発作、蕁麻疹、またはアスピリンやその他の NSAID によるその他のアレルギー反応を起こしたことがある場合。
- 心臓バイパス手術の直前または直後。
NSAID を服用する前に、次の場合を含め、すべての病状について医療提供者に伝えてください。
- 肝臓または腎臓に問題がある
- 高血圧がある
- 喘息がある
- 妊娠している、または妊娠する予定がある。妊娠約 20 週以降に NSAID を服用すると、胎児に害を及ぼす可能性があります。妊娠 20 ~ 30 週の間に NSAID を 2 日以上服用する必要がある場合、医療提供者は赤ちゃんの周りの子宮内の液体の量を監視する必要がある場合があります。 妊娠約 30 週以降は NSAID を服用しないでください。
- 授乳中または授乳を計画している。
処方薬や市販薬、ビタミン、ハーブのサプリメントなど、服用しているすべての薬について医療提供者に伝えてください。 NSAIDs と他のいくつかの薬は相互に作用し、深刻な副作用を引き起こす可能性があります。 最初に医療提供者に相談せずに、新しい薬の服用を開始しないでください。
NSAIDsの考えられる副作用は何ですか?
NSAID は、次のような重大な副作用を引き起こす可能性があります。
「非ステロイド性抗炎症薬 (NSAID) と呼ばれる薬について知っておくべき最も重要な情報は何ですか?」を参照してください。
- 新しいまたは悪化した高血圧
- 心不全
- 肝不全を含む肝臓の問題
- 腎不全を含む腎臓の問題
- 低赤血球(貧血)
- 生命を脅かす皮膚反応
- 生命を脅かすアレルギー反応
NSAID のその他の副作用には、胃痛、便秘、下痢、 ガス、胸やけ、吐き気、嘔吐、めまい。
次のいずれかの症状が現れた場合は、すぐに緊急援助を受けてください。
- 息切れまたは呼吸困難
- 胸痛
- 体の一部または側面の脱力
- ろれつが回らない
- 顔や喉の腫れ
次のいずれかの症状が現れた場合は、NSAID の使用を中止し、すぐに医療提供者に連絡してください。
- 吐き気
- いつもより疲れている、または弱っている
- 下痢
- かゆみ
- 肌や目が黄色く見える
- 消化不良または胃痛
- 風邪のような症状
- 血を吐く
- 便に血が混じっている、またはタールのように黒くてねばねばしている
- 異常な体重増加
- 発熱を伴う皮膚発疹または水ぶくれ
- 腕、脚、手、足のむくみ
NSAID の服用量が多すぎる場合は、すぐに医療提供者に連絡するか、医師の診察を受けてください。
これらは、NSAIDs の考えられるすべての副作用ではありません。詳細については、NSAID について医療提供者または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
NSAID に関するその他の情報:
- アスピリンは NSAID ですが、心臓発作の可能性を高めることはありません。アスピリンは、脳、胃、腸で出血を引き起こす可能性があります。アスピリンは、胃や腸に潰瘍を引き起こすこともあります。
- 一部の NSAID は、処方箋なしで低用量で販売されています (店頭)。市販の NSAID を 10 日以上使用する前に、医療提供者に相談してください。
NSAID の安全で効果的な使用に関する一般情報
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。処方されていない状態に NSAID を使用しないでください。他の人があなたと同じ症状を持っていても、NSAID を他の人に与えないでください。それらに害を及ぼす可能性があります。
NSAID についてさらに詳しい情報が必要な場合は、医療提供者に相談してください。医療専門家向けに書かれた NSAID に関する情報については、薬剤師または医療提供者に尋ねることができます。
この医薬品ガイドは、米国食品医薬品局によって承認されています。
