Neoral 25mg, 100mg Cyclosporine 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
ネオーラル 25mg とは何ですか? どのように使用されますか?
ネオーラル 25mg は、移植後の臓器拒絶反応を予防し、関節リウマチおよび乾癬の症状を治療するための予防薬として使用される処方薬です。ネオーラルは、単独で使用することも、他の薬と併用することもできます。
Neoral は、DMARDs、Immunomodulators と呼ばれる薬物のクラスに属します。免疫抑制剤;カルシニューリン阻害剤。
ネオーラル 25mg が子供に安全で効果的かどうかは不明です。
ネオーラルの考えられる副作用は何ですか?
Neoral は、次のような重大な副作用を引き起こす可能性があります。
- 蕁麻疹、
- 呼吸困難、
- 顔、唇、舌、喉の腫れ、
- 発話、思考、視覚、または筋肉の動きの問題、
- 発作、
- 激しい頭痛、
- ぼやけた視界、
- 首や耳がドキドキする
- 薄い肌、
- あざができやすい、
- 不正出血、
- 吐き気、
- 弱点、
- ピリピリ感、
- 胸痛、
- 不規則な心拍、
- 動きの喪失、
- 排尿がほとんどまたはまったくない、
- 足や足首のむくみ、
- 疲労感、
- 呼吸困難、
- 食欲減少、
- 胃の痛み(右上)、
- 皮膚や目の黄変、
- 熱、
- 寒気、
- インフルエンザの症状、
- 口内炎、
- 皮膚のただれ、
- 喉の痛み、そして
- 咳
上記の症状がある場合は、すぐに医療機関を受診してください。
ネオーラルの最も一般的な副作用は次のとおりです。
- 震えや震え、
- にきび、
- 顔または体毛の成長の増加、
- 血圧の上昇、
- 吐き気、
- 下痢、および
- 歯茎の腫れや痛み
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、ネオーラルの考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
適応疾患に対する全身免疫抑制療法の管理に経験のある医師のみが Neoral® を処方する必要があります。固形臓器移植で使用される用量では、免疫抑制療法および臓器移植レシピエントの管理に経験のある医師のみが Neoral® を処方する必要があります。薬を服用している患者は、適切な検査室と支援医療資源を備え、スタッフが配置された施設で管理する必要があります。維持療法を担当する医師は、患者の経過観察に必要な完全な情報を持っている必要があります。全身性免疫抑制剤である Neoral® は、感染に対する感受性および新形成の発症を増加させる可能性があります。腎臓、肝臓、および心臓移植患者では、Neoral® を他の免疫抑制剤と一緒に投与することがあります。移植患者の免疫抑制の程度が高まると、感染に対する感受性が高まり、リンパ腫やその他の新生物が発生する可能性があります。
Neoral® Soft Gelatin Capsules (シクロスポリン カプセル、USP) MODIFIED および Neoral® Oral Solution (シクロスポリン経口溶液、USP) MODIFIED は、Sandimmune® Soft Gelatin Capsules (シクロスポリン カプセル、USP) および Sandimmune® Oral Solution (シクロスポリン経口) と比較して、バイオアベイラビリティが向上しています。ソリューション、USP)。 Neoral® と Sandimmune® は生物学的に同等ではなく、医師の監督なしに互換的に使用することはできません。特定のトラフ濃度では、シクロスポリンへの曝露は、Sandimmune® よりも Neoral® の方が大きくなります。非常に高用量の Sandimmune® を投与されている患者が Neoral® に変更された場合は、特に注意が必要です。シクロスポリンの血中濃度は、高濃度による毒性を避けるために、Neoral® を服用している移植患者および関節リウマチ患者で監視する必要があります。低濃度による臓器拒絶の可能性を最小限に抑えるために、移植患者では用量調整を行う必要があります。公開された文献の血中濃度と現在のアッセイを使用して得られた血中濃度との比較は、採用されているアッセイ方法の詳細な知識を使用して行う必要があります。
乾癬患者の場合(上記の囲み警告も参照)
以前にPUVAで治療された乾癬患者は、メトトレキサートまたはその他の免疫抑制剤、UVB、コールタール、または放射線療法で治療を受けた場合、Neoral®を服用すると皮膚悪性腫瘍を発症するリスクが高くなります.
Neoral® の有効成分であるシクロスポリンは、推奨される用量では、全身性高血圧および腎毒性を引き起こす可能性があります。リスクは、シクロスポリン療法の用量と期間が長くなるにつれて増加します。腎臓の構造的損傷を含む腎機能障害は、シクロスポリンの潜在的な結果であるため、治療中は腎機能を監視する必要があります。
説明
Neoral® は、水性環境で即座にマイクロエマルジョンを形成するシクロスポリンの経口製剤です。
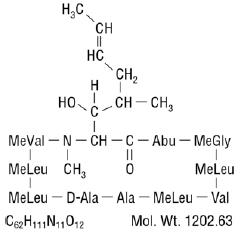
Neoral® の有効成分であるシクロスポリンは、11 個のアミノ酸からなる環状ポリペプチド免疫抑制剤です。これは、真菌種 Beauveria nivea によって代謝産物として生成されます。
化学的に、シクロスポリンは [R-[R*,R*-(E)]]-環状-(L-アラニル-D-アラニル-N-メチル-L-ロイシルN-メチル-L-ロイシル-N-メチル-L-バリル-3-ヒドロキシ-N,4-ジメチル-L-2-アミノ-6-オクテノイル-L-α-アミノブチリル-N-メチルグリシル-N-メチル-L-ロイシル-L-バリル-N-メチル-L-ロイシル)。
Neoral® Soft Gelatin Capsules (シクロスポリン カプセル、USP) MODIFIED は、25 mg および 100 mg の強度で入手できます。
各 25 mg カプセルには以下が含まれます。
シクロスポリン………………………………25 mg アルコール、USP 脱水.................................................11.9% v/v (9.5% 重量/体積)
各 100 mg カプセルには以下が含まれます。
シクロスポリン………………………………100 mg アルコール、USP 脱水物………………………………………………………………………………11.9 % v/v (9.5% 重量/体積)
不活性成分: コーン油-モノ-ジ-トリグリセリド、ポリオキシル40硬化ヒマシ油NF、DL-αトコフェロールUSP、ゼラチンNF、グリセロール、黒酸化鉄、プロピレングリコールUSP、二酸化チタンUSP、カルミン、その他の成分。
Neoral® Oral Solution (シクロスポリン経口溶液、USP) MODIFIED は、50 mL ボトルで入手できます。
各 mL には以下が含まれます。
シクロスポリン…………………………100 mg/mL アルコール、USP 脱水…… ...........11.9% v/v (9.5% wt/vol.)
不活性成分: コーン油-モノ-ジ-トリグリセリド、ポリオキシル40硬化ヒマシ油NF、DL-αトコフェロールUSP、プロピレングリコールUSP。
シクロスポリン (シクロスポリン A とも呼ばれます) の化学構造は次のとおりです。
適応症
腎臓、肝臓、心臓の移植
Neoral 25mg は、腎臓、肝臓、および心臓の同種異系移植における臓器拒絶反応の予防に適応されます。 Neoral 100mg は、アザチオプリンおよびコルチコステロイドと組み合わせて使用されています。
関節リウマチ
ネオーラルは、疾患がメトトレキサートに十分に反応しない重度の活動性関節リウマチ患者の治療に適応されます。ネオーラルは、メトトレキサート単独では十分に反応しない関節リウマチ患者にメトトレキサートと組み合わせて使用できます。
乾癬
ネオーラルは、少なくとも 1 つの全身療法(PUVA、レチノイド、またはメトトレキサートなど)または他の全身療法が禁忌であるか、または許容できない患者。
リバウンドはめったに発生しませんが、ほとんどの患者は、治療の中止時に他の治療法と同様にネオーラル 100mg で再発を経験します。
投薬と管理
Neoral 25mg Soft Gelatin Capsules (シクロスポリン カプセル、USP) MODIFIED および Neoral Oral Solution (シクロスポリン経口液剤、USP) MODIFIE D
Neoral は、Sandimmune と比較してバイオアベイラビリティが向上しています。 Neoral 25mg と Sandimmune は生物学的に同等ではなく、医師の監督なしに互換的に使用することはできません。
Neoral 100mg の 1 日量は、常に 2 回に分けて投与する必要があります (BID)。ネオーラルは、時間帯や食事との関係に関して一貫したスケジュールで投与することをお勧めします。グレープフルーツとグレープフルーツ ジュースは代謝に影響を与え、シクロスポリンの血中濃度を上昇させるため、避ける必要があります。
特定の集団
腎臓、肝臓、および心臓移植における腎障害
シクロスポリンの腎排泄は最小限であり、その薬物動態は、定期的な血液透析治療を受けている末期腎疾患の患者で有意に変化しているようには見えません。 臨床薬理学 )。しかし、腎毒性の可能性があるため (参照 警告 )、腎機能の注意深いモニタリングが推奨されます。シクロスポリンの投与量は、必要に応じて減らす必要があります ( 警告 と 予防 )。
関節リウマチおよび乾癬における腎障害
腎機能障害のある患者には、シクロスポリンを投与しないでください( 禁忌 、 警告 と 予防 )。
肝障害
重度の肝疾患患者では、シクロスポリンのクリアランスが大幅に低下する可能性があります( 臨床薬理学 )。重度の肝機能障害のある患者では、血中濃度を推奨される目標範囲内に維持するために用量の減量が必要になる場合があります (以下を参照)。 警告 と 予防 )。
新たに移植された患者
Neoral 25mg の最初の経口投与量は、移植の 4 ~ 12 時間前または術後に投与できます。ネオーラル 25mg の初回投与量は、移植された臓器および免疫抑制プロトコルに含まれる他の免疫抑制剤によって異なります。新たに移植された患者では、Neoral の初回経口投与量は、Sandimmune の初回経口投与量と同じです。推奨される初期投与量は、米国の移植センターにおけるサンディミューンの使用に関する 1994 年の調査結果から入手できます。平均±標準偏差の初回投与量は、腎移植患者(75 施設)で 9 ± 3 mg/kg/日、肝移植患者(30 施設)で 8 ± 4 mg/kg/日、および 7 ± 3 mg/kg/日であった。心臓移植患者向け(24センター)。 1 日総投与量を 2 つの等しい 1 日投与量に分割しました。続いて、事前定義されたシクロスポリンの血中濃度を達成するために、ネオーラル用量が調整されます。 移植患者の血中濃度モニタリング 、 下)。シクロスポリンのトラフ血中濃度を使用する場合、ネオーラル 100mg の目標範囲はサンディミューンと同じです。サンディミューンと同じネオーラル 100mg のトラフ濃度目標範囲を使用すると、ネオーラルが投与されたときのシクロスポリン曝露が大きくなります (以下を参照)。 薬物動態、吸収 )。投与量は、拒絶反応と忍容性の臨床評価に基づいて滴定する必要があります。維持療法としては、低用量のネオーラル 100mg で十分な場合があります。
副腎コルチコステロイドによる補助療法が最初に推奨されます。プレドニゾンのさまざまな漸減投与スケジュールは、同様の結果を達成するようです。患者の体重に基づく代表的な投与スケジュールは、最初の 4 日間は 2.0 mg/kg/日から開始し、1 週間までに 1.0 mg/kg/日、2 週間までに 0.6 mg/kg/日、0.3 mg/kg/日まで漸減します。 1ヶ月までに0.15mg/kg/日、2ヶ月以降は維持量として。ステロイドの投与量は、患者の状態と移植片の機能に応じて、個別にさらに漸減する場合があります。プレドニゾンの投与量は、臨床状況に応じて調整する必要があります。
移植患者におけるサンディミューンからネオーラル 25mg への変換
サンディミューンからネオーラルへの切り替えを検討している移植患者では、以前にサンディミューンで使用されていたのと同じ 1 日量からネオーラルを開始する必要があります (1:1 の用量換算)。その後、変換前のシクロスポリン血中トラフ濃度を達成するために、ネオラル用量を調整する必要があります。サンディミューンと同じネオーラル 100mg のトラフ濃度目標範囲を使用すると、ネオーラルが投与されたときのシクロスポリン曝露が大きくなります (以下を参照)。 薬物動態、吸収 )。サンディミューンの吸収不良が疑われる患者には、異なる投与戦略が必要です( サンディミューンの吸収が悪い移植患者、 下)。一部の患者では、血中トラフ濃度の増加がより顕著であり、臨床的に重要な場合があります。
血中トラフ濃度が変換前の値に達するまでは、ネオーラルへの変換後、シクロスポリン血中トラフ濃度を 4 ~ 7 日ごとにモニタリングすることを強くお勧めします。 .さらに、血清クレアチニンや血圧などの臨床安全パラメータは、変換後の最初の 2 か月間、2 週間ごとに監視する必要があります。血中トラフ濃度が望ましい範囲外にある場合、および/または臨床安全パラメータが悪化した場合は、Neeral 100mg の投与量をそれに応じて調整する必要があります。
サンディミューンの吸収が悪い移植患者
サンディミューンの経口投与量に対してシクロスポリンの血中トラフ濃度が予想よりも低い患者は、サンディミューンからのシクロスポリンの吸収が不十分または一貫していない可能性があります。ネオーラルに切り替えた後、患者はシクロスポリン濃度が高くなる傾向があります。 ネオーラルへの変換後のシクロスポリンのバイオアベイラビリティの増加により、シクロスポリンの血中トラフ濃度が目標範囲を超える可能性があります。 10 mg/kg/日を超える用量で患者をネオーラル 100 mg に変更する場合は、特に注意が必要です。 Neoral の用量は、シクロスポリンのトラフ濃度、忍容性、および臨床反応に基づいて個別に滴定する必要があります。この集団では、濃度が望ましい範囲内で安定するまで、シクロスポリンの血中トラフ濃度をより頻繁に、少なくとも週に 2 回 (初回投与量が 10 mg/kg/日を超える場合は毎日) 測定する必要があります。
関節リウマチ
Neoral の初回投与量は 2.5 mg/kg/日で、分割 (BID) 経口投与として 1 日 2 回服用します。サリチル酸塩、NSAID、および経口コルチコステロイドは継続してもよい( 警告 と 予防 、 薬物相互作用 )。作用の発現は一般に 4 ~ 8 週間の間に起こります。十分な臨床効果が見られず、忍容性が良好な場合 (血清クレアチニンがベースラインから 30% 未満であることを含む)、8 週間後に 0.5 ~ 0.75 mg/kg/日、12 週間後に再び最大 4 mg まで用量を増やすことができます。 /kg/日。 16 週間の治療で効果が見られない場合は、ネオーラル 25mg の治療を中止する必要があります。
有害事象、例えば、血清クレアチニンの高血圧上昇(患者の治療前レベルの 30% を上回る)または臨床的に重大な臨床検査値の異常( 警告 と 予防 )。
減量が異常の制御に効果的でない場合、または有害事象または異常が重度の場合は、ネオーラル 25mg を中止する必要があります。 Neoral 25mg をメトトレキサートの推奨用量と組み合わせる場合は、同じ初期用量と用量範囲を使用する必要があります。ほとんどの患者は、最大 15 mg/週のメトトレキサート用量と組み合わせた場合、3 mg/kg/日以下のネオーラル 25 mg 用量で治療できます (以下を参照)。 臨床薬理学 、 臨床試験 )。
長期治療データは限られています。関節リウマチ疾患活動性の再発は、一般にシクロスポリンを中止してから 4 週間以内に明らかになります。
乾癬
ネオーラル 100mg の初回投与量は 2.5mg/kg/日です。ネオーラルは、分割 (1.25 mg/kg BID) 経口用量として、1 日 2 回服用する必要があります。患者は、有害事象が発生しない限り、少なくとも 4 週間はその用量を維持する必要があります。その時までに患者に有意な臨床的改善が見られない場合は、患者の投与量を 2 週間間隔で増量する必要があります。患者の反応に基づいて、約 0.5 mg/kg/日の用量増加を最大 4.0 mg/kg/日に行う必要があります。
有害事象、例えば、高血圧、血清クレアチニンの上昇 (患者の治療前のレベルより 25% 以上高い)、または臨床的に重大な検査値の異常を制御するために、いつでも 25% から 50% の用量減量を行う必要があります。減量が異常の制御に有効でない場合、または有害事象または異常が重度の場合は、ネオラル 25mg を中止する必要があります ( 乾癬患者の特別なモニタリング )。
患者は一般に、乾癬の臨床症状が 2 週間でいくらか改善します。病気の十分な制御と安定化には、12 ~ 16 週間かかる場合があります。ネオーラル 25mg を用いた用量調節臨床試験の結果は、乾癬の 75% 以上 (PASI に基づく) の改善が、8 週間後に患者の 51% で、16 週間後に患者の 79% で達成されたことを示しています。 4 mg/kg/日または患者の最大耐用量で 6 週間後に満足のいく反応が得られない場合は、治療を中止する必要があります。患者が適切にコントロールされ、安定しているように見えたら、ネオラル 25mg の投与量を減らし、適切な反応を維持する最低用量で患者を治療する必要があります (これは必ずしも患者の完全なクリアランスではありません)。臨床試験では、推奨用量範囲の下限でのシクロスポリン用量は、患者の60%で満足のいく反応を維持するのに効果的でした. 2.5 mg/kg/日未満の用量でも同様に効果的です。
シクロスポリンによる治療を中止すると、約 6 週間 (患者の 50%) から 16 週間 (患者の 75%) で再発が起こります。大多数の患者では、シクロスポリンによる治療の中止後にリバウンドは発生しません。慢性尋常性乾癬がより重度の乾癬に変化した 13 例が報告されています。膿疱性乾癬が 9 例、紅皮症性乾癬が 4 例であった。乾癬患者におけるネオーラルの長期経験は限られており、1年以上の長期にわたる継続的な治療は推奨されていません.この生涯にわたる疾患の患者の長期管理では、他の治療法との代替を考慮する必要があります。
Neoral 25mg Oral Solution (シクロスポリン経口液剤、USP) 変更 - 投与に関する推奨事項
Neoral 25mg Oral Solution (シクロスポリン経口溶液、USP) MODIFIED をよりおいしくするには、室温のオレンジまたはリンゴ ジュースで希釈する必要があります。患者は、希釈剤を頻繁に切り替えることを避ける必要があります。グレープフルーツ ジュースはシクロスポリンの代謝に影響を与えるため、避ける必要があります。ネオーラル液と牛乳の組み合わせは口に合わない場合があります。ネオーラル 100mg 経口溶液として投与した場合のシクロスポリンのバイオアベイラビリティに対する牛乳の影響は評価されていません。
保護カバーを取り外した後、付属の投薬シリンジを使用して容器から変更されたネオーラル 25mg 経口溶液 (シクロスポリン経口溶液、USP) の規定量を取り、溶液をオレンジまたはリンゴジュースのグラスに移します。よくかき混ぜて一気に飲む。飲む前に希釈した経口溶液を放置しないでください。ガラス容器(プラスチック製ではありません)を使用してください。より多くの希釈剤でガラスをすすぎ、全用量が確実に消費されるようにします。使用後は、注射器の外側を清潔なタオルで乾かし、保護カバーを元に戻してください。投与シリンジを水または他の洗浄剤で洗い流さないでください。注射器の洗浄が必要な場合は、使用を再開する前に完全に乾かしてください。
移植患者の血中濃度モニタリング
移植センターは、シクロスポリンの血中濃度モニタリングが患者管理に不可欠な要素であることを発見しました。血中濃度分析で重要なのは、使用するアッセイの種類、移植臓器、投与するその他の免疫抑制剤です。一定の関係は確立されていませんが、血中濃度モニタリングは、拒絶反応と毒性の臨床評価、用量調整、コンプライアンスの評価に役立つ可能性があります。
シクロスポリンの血中濃度を測定するために、さまざまなアッセイが使用されてきました。非特異的アッセイを使用した古い研究では、特異的アッセイの約 2 倍の濃度がしばしば引用されていました。したがって、公開された文献の濃度と現在のアッセイを使用した個々の患者の濃度との比較は、採用されているアッセイ方法の詳細な知識を使用して行う必要があります。現在のアッセイ結果も互換性がなく、承認されたラベルに従って使用する必要があります。さまざまなアッセイ方法に関する議論は、Annals of Clinical Biochemistry 1994 に含まれています。 31: 420-446.いくつかのアッセイとアッセイマトリックスが利用可能ですが、親化合物固有のアッセイが臨床事象と最もよく相関するというコンセンサスがあります。これらのうち、HPLC が標準参照ですが、モノクローナル抗体 RIA とモノクローナル抗体 FPIA は、感度、再現性、および利便性を提供します。ほとんどの臨床医は、トラフのシクロスポリン濃度に基づいてモニタリングを行っています。 Applied Pharmacokinetics, Principles of Therapeutic Drug Monitoring (1992) には、シクロスポリンの薬物動態と薬物モニタリング技術に関する幅広い議論が含まれています。血中濃度モニタリングは、腎機能モニタリングや組織生検に代わるものではありません。
供給方法
Neoral® ソフト ゼラチン カプセル (シクロスポリン カプセル、USP) 変更
25mg
楕円形、青灰色に赤で刻印、「25 mg」を超える「Neoral」。
30個の単位用量ブリスターのパッケージ( NDC 0078-0246-15)。
100mg
長方形、青灰色、赤で刻印され、「NEORAL」は「100 mg」を超えています。
30個の単位用量ブリスターのパッケージ( NDC 0078-0248-15)。
保管および分配
元の単位用量容器内で、室温が 68°F ~ 77°F (20°C ~ 25°C) に制御されています。
Neoral® Oral Solution (Cyclosporine Oral Solution、USP) MODIFIED
100 mg/mL ( NDC 0078-0274-22)。
保管および分配
68°F~77°F (20°~25°C) に制御された室温の元の容器。冷蔵庫に保管しないでください。中身は開封後、2ヶ月以内に使い切る必要があります。 68°F (20°C) 未満の温度では、溶液がゲル化することがあります。軽い凝集または軽い沈殿物の形成も発生する可能性があります。製品の性能や付属のシリンジを使用した投与に影響はありません。これらの変化を元に戻すには、室温 77°F (25°C) まで温めます。
Neoral® ソフト ゼラチン カプセル (シクロスポリン カプセル、USP) 変更
Neoral® Oral Solution (シクロスポリン経口液剤、USP) MODIFIED
配布元: Novartis Pharmaceuticals Corporation, East Hanover, New Jersey 07936. 2021 年 6 月改訂.
副作用
腎臓、肝臓、心臓の移植
シクロスポリン療法の主な副作用は、腎機能障害、振戦、多毛症、高血圧、および歯茎の過形成です。
高血圧症
通常は軽度から中等度の高血圧症が、腎移植後の患者の約 50% とほとんどの心臓移植患者に発生する可能性があります。
糸球体毛細血管血栓症
糸球体毛細血管血栓症は、シクロスポリンで治療された患者で発見されており、移植片不全に進行する可能性があります。病理学的変化は、溶血性尿毒症症候群で見られるものと似ており、腎微小血管系の血栓症、糸球体毛細血管および輸入細動脈を閉塞する血小板フィブリン血栓、微小血管障害性溶血性貧血、血小板減少症、および腎機能の低下が含まれていました。移植後に他の免疫抑制剤を使用した場合にも、同様の所見が観察されています。
低マグネシウム血症
低マグネシウム血症は、シクロスポリン治療中にけいれんを示す一部の患者で報告されていますが、すべての患者では報告されていません。正常な被験者におけるマグネシウム枯渇研究は、低マグネシウム血症が神経障害に関連していることを示唆していますが、高血圧、高用量のメチルプレドニゾロン、低コレステロール血症、およびシクロスポリンの高血漿濃度に関連する腎毒性を含む複数の要因が、シクロスポリン毒性の神経学的症状に関連しているようです.
薬物相互作用
シクロスポリンの薬物動態および/または安全性に対する薬物およびその他の薬剤の影響
以下に挙げる個々の薬剤はすべて、シクロスポリンと相互作用することが十分に実証されています。さらに、特に脱水状態でのシクロスポリンとの NSAID の併用は、腎機能障害を増強する可能性があります。腎機能を損なうことが知られている他の薬を使用する場合は注意が必要です (以下を参照)。 警告 、 腎毒性 )。
腎機能障害を増強する可能性のある薬剤
シクロスポリンとの相加的または相乗的な腎障害を示す可能性のある薬物を併用している間は、腎機能(特に血清クレアチニン)を注意深く監視する必要があります。腎機能の重大な障害が発生した場合は、併用薬の投与量を減らすか、別の治療法を検討する必要があります。
シクロスポリンは、CYP 3A アイソザイム、特に CYP3A4 によって広範囲に代謝され、多剤排出トランスポーター P 糖タンパク質の基質です。シクロスポリンの血漿濃度または全血濃度を増加または減少させるさまざまな薬剤が知られています。オルリスタットなどのシクロスポリンの吸収を低下させる化合物は避けるべきです。シクロスポリン濃度を著しく変化させる薬剤を併用する場合は、所望のシクロスポリン濃度を達成するための適切なネオーラル 100mg の用量調整が不可欠です (B を参照)。 血中濃度モニタリング )。
1. シクロスポリン濃度を上げる薬
HIVプロテアーゼ阻害剤
HIV プロテアーゼ阻害剤 (例えば、インジナビル、ネルフィナビル、リトナビル、およびサキナビル) はシトクロム P-450 3A を阻害することが知られており、シクロスポリンの濃度を上昇させる可能性がありますが、相互作用に関する正式な研究はありません。これらの薬剤を併用する場合は注意が必要です。
グレープフルーツジュース
グレープフルーツとグレープフルーツ ジュースは代謝に影響を与え、シクロスポリンの血中濃度を上昇させるため、避けるべきです。
2. シクロスポリン濃度を下げる薬/栄養補助食品
ボセンタン
健康な被験者に 7 日間、ボセンタン (忍容性に基づいて 12 時間ごとに 250 ~ 1000 mg) とシクロスポリン (12 時間ごとに 300 mg を 2 日間、その後 Cmax が 200 ~ 250 ng/mL になるように投与) を同時投与すると、シクロスポリンを単独で投与した場合と比較して、シクロスポリンの平均用量正規化 AUC、Cmax、およびトラフ濃度は、それぞれ約 50%、30%、および 60% でした ( 薬物動態および/または他の薬物または薬剤の安全性に対するシクロスポリンの影響 )。シクロスポリンとボセンタンの併用は避けるべきです。
ボセプレビル
健康な被験者にボセプレビル(800 mg を 1 日 3 回、7 日間)とシクロスポリン(100 mg を単回投与)を併用投与すると、シクロスポリン投与時と比較して、シクロスポリンの平均 AUC と Cmax がそれぞれ約 2.7 倍と 2 倍増加しました。一人で与えられました。
テラプレビル
健康な被験者にテラプレビル (8 時間ごとに 750 mg、11 日間) をシクロスポリン (8 日目に 10 mg) と同時投与すると、シクロスポリンの平均用量正規化 AUC および Cmax がそれぞれ約 4.5 倍および 1.3 倍増加しました。シクロスポリン (100 mg 単回投与) を単独で投与した場合と比較して。
セントジョーンズワート
シクロスポリンとハーブ栄養補助食品セントジョンズワートとの間の深刻な薬物相互作用の報告があります.この相互作用により、シクロスポリンの血中濃度が著しく低下し、治療レベル以下、移植臓器の拒絶反応、および移植片の損失が生じることが報告されています。
リファブチン
リファブチンは、シトクロム P-450 システムによって代謝される他の薬物の代謝を増加させることが知られています。リファブチンとシクロスポリンの相互作用は研究されていません。この2つの薬を併用する場合は注意が必要です。
薬物動態および/または他の薬物または薬剤の安全性に対するシクロスポリンの影響
シクロスポリンは、CYP3A4 および複数の薬物排出トランスポーター (例えば、P 糖タンパク質) の阻害剤であり、CYP3A4、P 糖タンパク質または有機陰イオン輸送タンパク質の基質であるコメケーションの血漿濃度を増加させる可能性があります。
シクロスポリンは、ジゴキシン、コルヒチン、プレドニゾロン、HMG-CoA レダクターゼ阻害剤(スタチン)、およびアリスキレン、ボセンタン、ダビガトラン、レパグリニド、NSAID、シロリムス、エトポシド、およびその他の薬物のクリアランスを低下させる可能性があります。
詳細および具体的な推奨事項については、他の薬剤の完全な処方情報を参照してください。シクロスポリンと他の薬剤または薬剤との併用に関する決定は、利益とリスクを慎重に評価した後、医療従事者が行う必要があります。
ジゴキシン
ジゴキシンを服用している数人の患者で、シクロスポリンを開始してから数日以内に重度のジギタリス毒性が見られました.ジゴキシンをシクロスポリンと同時に使用する場合は、血清ジゴキシン濃度をモニターする必要があります。
コルヒチン
シクロスポリンがミオパチーやニューロパシーなどのコルヒチンの毒性効果を増強する可能性についての報告があり、特に腎機能障害のある患者においてそうである.シクロスポリンとコルヒチンを同時に投与すると、コルヒチンの血漿濃度が大幅に増加します。コルヒチンをシクロスポリンと同時に使用する場合は、コルヒチンの投与量を減らすことが推奨されます。
HMG-CoAレダクターゼ阻害剤(スタチン)
ロバスタチン、シンバスタチン、アトルバスタチン、プラバスタチン、まれにフルバスタチンとのシクロスポリンの併用投与により、筋肉痛や筋力低下、筋炎、横紋筋融解症などの筋毒性の文献および市販後の事例が報告されています。シクロスポリンと同時に投与する場合、これらのスタチンの投与量は、ラベルの推奨に従って減らす必要があります。スタチン療法は、ミオパシーの徴候や症状がある患者、または横紋筋融解症に続発する腎不全を含む重度の腎障害の素因となる危険因子を持つ患者では、一時的に差し控えるか中止する必要があります。
レパグリニド
シクロスポリンは、レパグリニドの血漿濃度を上昇させ、それによって低血糖のリスクを高める可能性があります。 12 時間間隔で 100 mg シクロスポリン カプセルを 2 回経口投与し、シクロスポリン初回投与の 13 時間後に 0.25 mg レパグリニド錠剤 (0.5 mg 錠剤の半分) を 1 回経口投与した 12 人の健康な男性被験者において、レパグリニドの平均 Cmaxおよび AUC は、それぞれ 1.8 倍 (範囲: 0.6 ~ 3.7 倍) および 2.4 倍 (範囲 1.2 ~ 5.3 倍) 増加しました。シクロスポリンとレパグリニドを併用している患者には、血糖値を注意深く監視することをお勧めします。
アンブリセンタン
アンブリセンタン (1 日 5 mg) とシクロスポリン (最初は 100 ~ 150 mg を 1 日 2 回、その後 Cmax 150 ~ 200 ng/mL を達成するように投与) を健康な被験者に 8 日間同時投与すると、アンブリセンタンの AUC と Cmax が平均で約 2 ~アンブリセンタン単独と比較して、それぞれ倍と1.5倍。アンブリセンタンをシクロスポリンと同時投与する場合、アンブリセンタンの用量は、推奨される 1 日最大用量まで漸増すべきではありません。
アントラサイクリン系抗生物質
高用量のシクロスポリン(例,16mg/kg/日の静脈内投与開始時)は,癌患者におけるアントラサイクリン系抗生物質(例,ドキソルビシン,ミトキサントロン,ダウノルビシン)への曝露を増加させる可能性がある。
アリスキレン
シクロスポリンは、P糖タンパク質およびCYP3A4の基質であるアリスキレンの薬物動態を変化させます。シクロスポリン (200 mg) の単回投与と減量アリスキレン (75 mg) を同時に投与された 14 人の健康な被験者では、アリスキレンの平均 Cmax は約 2.5 倍 (90% CI: 1.96 から 3.17) 増加し、平均 AUC はこれらの被験者がアリスキレンを単独で投与された場合と比較して、約 4.3 倍 (90% CI: 3.52 ~ 5.21)。アリスキレンとシクロスポリンの併用投与は、アリスキレン排出半減期の中央値 (26 時間対 43 ~ 45 時間) および T (0.5 時間対 1.5 ~ 2.0 時間) を延長しました。シクロスポリンの平均 AUC および Cmax は、報告された文献値と同等でした。これらの被験者にシクロスポリンとアリスキレンを併用投与すると、主に頭痛、のぼせ、吐き気、嘔吐、傾眠などの有害事象の数や強度が増加しました。シクロスポリンとアリスキレンの併用は推奨されません。
ボセンタン
健康な被験者では、ボセンタンとシクロスポリンの同時投与により、正規化された用量が時間依存的に平均増加しました。
ボセンタントラフ濃度 (すなわち、1 日目に約 21 倍、8 日目 (定常状態) には約 2 倍) は、ボセンタンを 1 日目に単回投与した場合と比較して ( シクロスポリンの薬物動態および/または安全性に対する薬物およびその他の薬剤の影響 )。シクロスポリンとボセンタンの併用は避けるべきです。
ダビガトラン
ダビガトラン濃度に対するシクロスポリンの効果は、正式に研究されていませんでした。ダビガトランとシクロスポリンを同時に投与すると、シクロスポリンの P-gp 阻害活性により、血漿ダビガトラン濃度が上昇する可能性があります。シクロスポリンとダビガトランの併用は避けるべきです。
カリウム保持性利尿薬
高カリウム血症が発生する可能性があるため、シクロスポリンはカリウム保持性利尿薬と併用しないでください。シクロスポリンをカリウム保持薬(例、アンギオテンシン変換酵素阻害薬、アンギオテンシン II 受容体拮抗薬)、カリウム含有薬、およびカリウムが豊富な食事の患者と併用する場合にも注意が必要です。このような状況では、カリウム レベルを管理することをお勧めします。
非ステロイド性抗炎症薬 (NSAID) の相互作用
シクロスポリンを関節リウマチ患者に NSAID と併用する場合は、臨床状態と血清クレアチニンを綿密に監視する必要があります。 警告 )。
99mTc-ジエチレントリアミン五酢酸 (DTPA) および (p-アミノ馬尿酸) PAH クリアランスによって決定されるように、シクロスポリンとナプロキセンおよびスリンダクの両方との間で薬力学的相互作用が起こることが報告されており、併用は腎機能の相加的低下と関連している。ジクロフェナクの併用投与はシクロスポリンの血中濃度に影響を与えませんが、ジクロフェナクの血中濃度がほぼ 2 倍になり、腎機能の可逆的低下が時折報告されています。したがって、ジクロフェナクの用量は治療範囲の下限にある必要があります。
メトトレキサートの相互作用
予備データは、メトトレキサートとシクロスポリンが関節リウマチ患者 (N = 20) に同時投与された場合、メトトレキサート濃度 (AUC) が約 30% 増加し、その代謝産物である 7-ヒドロキシ メトトレキサートの濃度 (AUC) が約 80% 減少したことを示しています。 %。この相互作用の臨床的意義は不明です。シクロスポリン濃度は変化していないようです (N = 6)。
シロリムス
血清クレアチニンの上昇は、フル用量シクロスポリンと組み合わせてシロリムスを使用した研究で観察されました.この効果は、シクロスポリンの用量を減らすことでしばしば元に戻ります。シクロスポリンの同時同時投与は、シロリムスの血中濃度を有意に上昇させます。シロリムス濃度の上昇を最小限に抑えるために、シロリムスはシクロスポリン投与の 4 時間後に投与することをお勧めします。
ニフェジピン
シクロスポリンと同時にニフェジピンを投与すると、歯肉過形成が頻繁に起こることが報告されています。シクロスポリンの副作用として歯肉過形成が発生した患者では、ニフェジピンの併用は避けるべきである。
メチルプレドニゾロン
高用量のメチルプレドニゾロンをシクロスポリンと同時に投与した場合の痙攣が報告されています。
その他の免疫抑制薬および薬剤
他の免疫抑制剤または放射線療法 (PUVA および UVB を含む) を受けている乾癬患者は、過剰な免疫抑制の可能性があるため、シクロスポリンを同時に投与すべきではありません。
生ワクチンの有効性に対するシクロスポリンの影響
シクロスポリンによる治療中は、ワクチン接種の効果が低下することがあります。生ワクチンの使用は避けるべきです。
シクロスポリン薬物相互作用の詳細については、Novartis Medical Affairs Department (1-888-NOW-NOVA [1-888-669-6682]) までお問い合わせください。
警告
(こちらもご覧ください 囲み警告 )
すべての患者
ネオーラル 25mg の有効成分であるシクロスポリンは、腎毒性および肝毒性を引き起こす可能性があります。シクロスポリンの投与量が増えると、リスクが高まります。腎臓の構造的損傷を含む腎機能障害は、ネオーラル 100mg の潜在的な結果であるため、治療中は腎機能を監視する必要があります。 シクロスポリンを腎毒性薬と一緒に使用する場合は注意が必要です (見る 予防 )。
ネオーラルを投与されている患者は、血清クレアチニンを頻繁にモニタリングする必要があります( スペシャルモニタリング 下 投薬と管理 )。高齢の患者さんは、年齢とともに腎機能の低下もみられるため、特に注意してモニタリングする必要があります。患者が適切に監視されておらず、用量が適切に調整されていない場合、シクロスポリン療法は、構造的な腎損傷および持続的な腎機能障害の発生と関連している可能性があります。
血清クレアチニンと BUN の増加は、Neoral 治療中に発生する可能性があり、糸球体濾過率の低下を反映しています。いつでも腎機能障害がある場合は、綿密なモニタリングが必要であり、頻繁な用量調整が必要になる場合があります。血清クレアチニン上昇の頻度と重症度は、シクロスポリン療法の用量と期間とともに増加します。これらの上昇は、減量または中止しなければ、より顕著になる可能性があります。
Neoral 100mg は Sandimmune と生物学的に同等ではないため、1:1 の比率 (mg/kg/日) を使用して Neoral から Sandimmune に変換すると、シクロスポリンの血中濃度が低下する可能性があります。 Neoral から Sandimmune への変更は、過少投与の可能性を避けるためにモニタリングを強化して行う必要があります。
腎臓、肝臓、心臓の移植
腎毒性
ネオーラルの有効成分であるシクロスポリンは、高用量で使用すると腎毒性および肝毒性を引き起こす可能性があります。シクロスポリン治療中に血清クレアチニンおよび BUN レベルが上昇することは珍しくありません。腎移植患者におけるこれらの上昇は、必ずしも拒絶反応を示すものではなく、投与量の調整を開始する前に、各患者を十分に評価する必要があります。
サンディミューンの経口溶液の歴史的経験に基づくと、シクロスポリンに関連する腎毒性は、腎移植の 25%、心臓移植の 38%、および肝移植の 37% で認められました。軽度の腎毒性は一般に、腎移植後 2 ~ 3 か月で認められ、手術前の BUN およびクレアチニンの上昇がそれぞれ 35 ~ 45 mg/dL および 2.0 ~ 2.5 mg/dL の範囲で低下することから成り立っていました。これらの上昇は、多くの場合、シクロスポリンの減量に反応しました。
より明白な腎毒性が移植後早期に見られ、急速に上昇する BUN とクレアチニンによって特徴付けられました。これらのイベントは腎拒絶反応のエピソードに似ているため、それらを区別するように注意する必要があります。この形態の腎毒性は、通常、シクロスポリンの減量に反応します。
腎移植片拒絶反応と薬物毒性を確実に区別する特定の診断基準は見つかっていませんが、多くのパラメーターがいずれかと有意に関連しています。ただし、最大 20% の患者で腎毒性と拒絶反応が同時に起こる可能性があることに注意してください。
シクロスポリン関連腎症の形態は、腎機能の連続的な悪化と腎臓の形態学的変化によって特徴付けられます。シクロスポリンを投与された移植レシピエントの 5% から 15% は、シクロスポリン療法の減少または中止にもかかわらず、血清クレアチニン上昇の減少を示さない。これらの患者の腎生検では、尿細管の空胞化、尿細管の微小石灰化、尿細管周囲の毛細血管のうっ血、動脈障害、および尿細管の萎縮を伴う間質性線維症の縞模様のうちの 1 つまたはいくつかが示されます。これらの形態学的変化はいずれも完全に特異的ではありませんが、シクロスポリン関連の構造的腎毒性の診断には、これらの所見の証拠が必要です。
シクロスポリン関連腎症の発症を考慮すると、何人かの著者が間質性線維症の出現とシクロスポリンのより高い累積用量または持続的に高い循環トラフ濃度との関連を報告していることは注目に値します。これは、投与量が最も高くなる傾向にある移植後最初の 6 ヶ月間に特に当てはまり、腎臓レシピエントでは臓器がシクロスポリンの毒性作用に対して最も脆弱であると思われる時期です。これらの患者の間質性線維症の発症に寄与するその他の要因には、灌流時間の延長、温虚血時間、急性毒性のエピソード、および急性および慢性拒絶反応があります。間質性線維症の可逆性とその腎機能との相関関係はまだ決定されていません。シクロスポリンの中止または減量後に、動脈障害の可逆性が報告されています。
いつでも腎機能障害がある場合は、綿密なモニタリングが必要であり、頻繁な用量調整が必要になる場合があります。
重度の絶え間ない拒絶反応の場合、パルスステロイドとモノクローナル抗体によるレスキュー療法が拒絶反応のエピソードを元に戻すことができない場合、ネオーラルの投与量を過剰な血中濃度まで増やすよりも、代わりの免疫抑制療法に切り替えることが望ましい場合があります。
腎機能の相加的または相乗的な障害の可能性があるため、ネオーラルを腎機能を損なう可能性のある他の薬剤と併用投与する場合は注意が必要です。 予防 、 薬物相互作用 )。
血栓性微小血管症
時折、患者は血小板減少症および微小血管障害性溶血性貧血の症候群を発症し、移植片の失敗を引き起こす可能性があります。血管障害は、拒絶反応がなくても発生する可能性があり、インジウム 111 標識血小板研究によって示されるように、移植片内での激しい血小板消費を伴います。この症候群の病因も管理も明らかではありません。シクロスポリンの減量または中止、および 1) ストレプトキナーゼとヘパリンの投与、または 2) プラズマフェレーシスの後に回復が見られますが、これはインジウム 111 標識血小板スキャンによる早期発見に依存しているようです ( 有害反応 )。
高カリウム血症
重大な高カリウム血症 (高塩素血症性代謝性アシドーシスを伴うこともある) および高尿酸血症が、個々の患者で時折見られます。
肝毒性
シクロスポリンで治療された患者では、胆汁うっ滞、黄疸、肝炎、および肝不全を含む肝毒性および肝障害の症例が報告されています。ほとんどの報告には、重大な併存疾患、基礎疾患、および感染性合併症や肝毒性の可能性がある薬物療法を含むその他の交絡因子を持つ患者が含まれていました。場合によっては、主に移植患者で、致命的な転帰が報告されています( 有害反応 、 市販後の経験、腎臓、肝臓、心臓移植 )。
通常、肝酵素とビリルビンの上昇によって現れる肝毒性は、臨床試験でシクロスポリンで治療された患者で報告されました。腎移植で 4%、心臓移植で 7%、肝移植で 4% です。これは通常、高用量のシクロスポリンが使用された最初の 1 か月の治療中に認められました。ケミストリーの上昇は通常、投与量の減少とともに減少しました。
悪性腫瘍
他の免疫抑制剤を投与されている患者と同様に、シクロスポリンを投与されている患者は、リンパ腫やその他の悪性腫瘍、特に皮膚の悪性腫瘍を発症するリスクが高くなります。シクロスポリンを服用している患者は、過剰な紫外線への曝露を避けるように警告する必要があります。リスクの増加は、特定の薬剤の使用ではなく、免疫抑制の強度と期間に関連しているようです。免疫系が過剰に抑制されると感染症や悪性腫瘍のリスクが高まるため、複数の免疫抑制剤を含む治療法は慎重に使用する必要があります。一部の悪性腫瘍は致命的となる場合があります。シクロスポリンを投与されている移植患者は、致命的な結果を伴う重篤な感染症のリスクが高くなります。
重篤な感染症
Neoral 100mg を含む免疫抑制剤を投与されている患者は、日和見感染を含む細菌、ウイルス、真菌、および原虫感染を発症するリスクが高くなります。これらの感染症は、致命的な結果を含む深刻な結果につながる可能性があります( 囲み警告 、 と 有害反応 )。
ポリオーマウイルス感染症
Neoral 100mg を含む免疫抑制剤を投与されている患者は、ポリオーマ ウイルス感染症を含む日和見感染症のリスクが高くなります。移植患者のポリオーマ ウイルス感染症は、深刻な、場合によっては致命的な結果をもたらす可能性があります。これらには、JC ウイルス関連の進行性多巣性白質脳症 (PML)、および特に BK ウイルス感染によるポリオーマウイルス関連腎症 (PVAN) の症例が含まれ、これらはシクロスポリンを投与されている患者で観察されています。 PVAN は、腎機能の低下や腎移植片の喪失などの深刻な転帰と関連しています (参照 有害反応 、 市販後の経験、腎臓、肝臓、心臓移植 )。患者モニタリングは、PVAN のリスクがある患者を検出するのに役立つ場合があります。
ネオーラルで治療された患者でPMLの症例が報告されています。時に致命的な PML は、片麻痺、無関心、錯乱、認知機能障害、および運動失調を一般的に示します。 PML の危険因子には、免疫抑制療法による治療と免疫機能の障害が含まれます。免疫抑制患者では、医師は神経学的症状を報告している患者の鑑別診断で PML を考慮する必要があり、神経科医との相談は臨床的に適応と見なされるべきです。
PML または PVAN を発症した移植患者の総免疫抑制を軽減することを考慮する必要があります。ただし、免疫抑制の低下は、移植片を危険にさらす可能性があります。
神経毒性
特に高用量のメチルプレドニゾロンと組み合わせて、シクロスポリンを投与されている成人および小児患者における痙攣の報告があります。
後発性可逆性脳症症候群(PRES)を含む脳症は、市販後の報告と文献の両方に記載されています。症状には、意識障害、痙攣、視覚障害(失明を含む)、運動機能の喪失、運動障害、および精神障害が含まれます。多くの場合、白質の変化は、画像技術と病理標本を使用して検出されています。高血圧、低マグネシウム血症、低コレステロール血症、高用量コルチコステロイド、高シクロスポリン血中濃度、および移植片対宿主病などの素因は、報告された症例のすべてではありませんが多くで指摘されています。ほとんどの場合、変化はシクロスポリンの中止により元に戻り、場合によっては減量後に改善が認められました。肝移植を受けた患者は、腎移植を受けた患者よりも脳症になりやすいようです。シクロスポリン誘発性神経毒性の別のまれな症状は、他の適応症よりも移植患者でより頻繁に発生し、乳頭浮腫を含む視神経乳頭浮腫であり、良性頭蓋内圧亢進症に続発する視覚障害の可能性があります。
シクロスポリンを腎毒性薬と一緒に使用する場合は注意が必要です( 予防 )。
関節リウマチ
シクロスポリン腎症は、19ヶ月の平均治療期間の後、60人中6人(10%)の関節リウマチ患者の腎生検で検出されました。これらの 6 人の患者のうち 1 人の患者だけが 4 mg/kg/日以下の用量で治療されました。血清クレアチニンは、シクロスポリンの中止後、1 人を除くすべての患者で改善しました。 「最大クレアチニン増加」は、シクロスポリン腎症を予測する要因のようです。
他の免疫抑制剤と同様に、シクロスポリンによる悪性リンパ腫の発生が増加する可能性があります。シクロスポリンによるリスクが、関節リウマチ患者またはこの適応症の細胞傷害性治療を受けている関節リウマチ患者のリスクよりも大きいかどうかは明らかではありません。リンパ腫の 5 例が検出されました。4 例は、関節リウマチのためにシクロスポリンで治療された約 2,300 人の患者の調査で、もう 1 例は臨床試験で報告されました。この調査では、他の腫瘍 (12 の皮膚癌、24 の多様な種類の固形腫瘍、および 1 の多発性骨髄腫) も報告されましたが、疫学的分析では、悪性リンパ腫以外のシクロスポリンとの関係は支持されませんでした。
患者は、悪性腫瘍の発生についてNeoral 25mg治療の前および治療中に徹底的に評価する必要があります.さらに、ネオーラル 25mg 療法を他の免疫抑制剤と一緒に使用すると、悪性腫瘍のリスクを高めることが知られている過剰な免疫抑制を誘発する可能性があります。
乾癬
(こちらもご覧ください 乾癬に関する囲み警告 )
シクロスポリンは潜在的に深刻な副作用を伴う強力な免疫抑制剤であるため、乾癬患者の治療前にネオーラル 100mg を使用するリスクと利点を考慮する必要があります。ネオーラルの有効成分であるシクロスポリンは、腎毒性および高血圧を引き起こす可能性があります( 予防 )およびリスクは、投与量と治療期間の増加とともに増加します。異常な腎機能、制御されていない高血圧、または悪性腫瘍のある患者など、リスクが高い可能性がある患者は、ネオーラルを受けるべきではありません。
腎機能障害はネオーラルの潜在的な結果であるため、治療中は腎機能を監視する必要があります。
Neoral 100mg を投与されている患者は、血清クレアチニンを頻繁にモニタリングする必要があります ( スペシャルモニタリング 下 投薬と管理 )。高齢の患者さんは、年齢とともに腎機能の低下もみられるため、特に注意してモニタリングする必要があります。患者が適切に監視されておらず、用量が適切に調整されていない場合、シクロスポリン療法は構造的な腎臓の損傷と持続的な腎機能障害を引き起こす可能性があります.
血清クレアチニンと BUN の増加は、Neoral 25mg 治療中に発生する可能性があり、糸球体濾過率の低下を反映しています。
シクロスポリン 1.2 ~ 7.6 mg/kg/日で平均 23 か月間治療された 86 人の乾癬患者の腎生検では、患者の 18/86 (21%) でシクロスポリン腎症の証拠が示されました。病状は、腎尿細管萎縮および間質性線維症からなっていた。これらの患者のうち 13 人の繰り返し生検で、さまざまな投与量のシクロスポリンを平均 2 年間維持したところ、シクロスポリン誘発性腎症の患者数は 26/86 (30%) に上昇しました。大部分の患者 (19/26) は 5.0 mg/kg/日以上の用量でした (推奨される最高用量は 4 mg/kg/日です)。患者はまた、シクロスポリンを 15 か月以上 (18/26) 服用しており、および/または血清クレアチニンが 1 か月以上 (21/26) 臨床的に有意に増加していました。シクロスポリン療法を中止した患者 11 人中 7 人で、クレアチニン値が正常範囲に戻りました。
シクロスポリン治療を受けた乾癬患者では、皮膚およびリンパ増殖性悪性腫瘍の発症リスクが高くなります。悪性腫瘍の相対リスクは、他の免疫抑制剤で治療された乾癬患者で観察されるリスクに匹敵します。
腫瘍は、臨床試験からシクロスポリンで治療された世界中の乾癬患者 1439 人のうち 32 人 (2.2%) で報告されました。シクロスポリンの市販後の経験で、7人の患者で追加の腫瘍が報告されています。これらの患者の 16 人 (1.1%) で皮膚悪性腫瘍が報告されました。 2 人を除く全員が以前に PUVA 療法を受けていた。メトトレキサートは 7 人の患者に投与されました。
UVB とコール タールは、それぞれ 2 名と 3 名の患者に使用されていました。 7 人の患者は、以前の皮膚癌の病歴があったか、シクロスポリン曝露前に潜在的に素因となる病変が存在していました。 16 人の皮膚がん患者のうち、11 人の患者は 18 の扁平上皮がん、7 人の患者は 10 の基底細胞がんを持っていました。
つのリンパ増殖性悪性腫瘍がありました。化学療法を必要とした非ホジキンリンパ腫の 1 例と、シクロスポリンの中止により自然に退縮した菌状息肉腫の 1 例。良性リンパ球浸潤の 4 つのケースがありました: 3 つはシクロスポリンの中止時に自然に退行しましたが、4 人目は薬剤の継続にもかかわらず退行しました。悪性腫瘍の残りの 13 例 (0.9%) は、さまざまな臓器に関与していました。
過剰な免疫抑制の可能性とその後の悪性腫瘍のリスクのため、患者はシクロスポリンと PUVA または UVB、他の放射線療法、または他の免疫抑制剤と同時に治療されるべきではありません。 (見る 禁忌 )。患者はまた、太陽の下で適切に身を守り、過度の日光への露出を避けるように警告する必要があります.患者は、悪性病変が乾癬プラークによって隠されている可能性があることを覚えておいて、治療前および治療中に悪性腫瘍の存在について徹底的に評価する必要があります。乾癬に典型的ではない皮膚病変は、治療を開始する前に生検する必要があります。患者は、疑わしい病変が完全に消散した後にのみ、他の治療オプションがない場合にのみ、ネオーラルで治療する必要があります。 乾癬患者のための特別なモニタリング )。
特殊賦形剤
アルコール(エタノール)
アルコール含有量(参照 説明 ネオーラル 100 mg は、アルコール摂取を避けるか最小限に抑える必要がある患者、例えば、妊娠中または授乳中の女性、肝疾患またはてんかんを呈している患者、アルコール依存症の患者、または小児患者に投与する場合に考慮する必要があります。体重 70 kg の成人の場合、1 日最大経口摂取量は約 1 グラムのアルコールを提供します。これは、標準的な飲み物に含まれるアルコール量の約 6% です。
予防
全般的
高血圧症
ネオーラルの有効成分はシクロスポリンです。高血圧は、シクロスポリン療法の一般的な副作用であり、持続する可能性があります( 有害反応 と 投薬と管理 推奨事項の監視用)。軽度または中等度の高血圧は、重度の高血圧よりも頻繁に発生し、発生率は時間とともに減少します。シクロスポリンで治療された腎臓、肝臓、および心臓の同種移植片のレシピエントでは、降圧療法が必要になる場合があります( 関節リウマチの特別なモニタリング と 乾癬患者 )。ただし、シクロスポリンは高カリウム血症を引き起こす可能性があるため、カリウム保持性利尿薬は使用しないでください。カルシウム拮抗薬は、シクロスポリン関連高血圧の治療に有効な薬剤である可能性がありますが、シクロスポリンの代謝を妨げる可能性があります ( 薬物相互作用 )。
ワクチン
シクロスポリンによる治療中は、ワクチン接種の効果が低下する可能性があります。弱毒生ワクチンの使用は避けるべきです。
関節リウマチ患者の特別モニタリング
治療を開始する前に、血圧測定 (少なくとも 2 回) およびベースラインを推定するための 2 つのクレアチニン レベルを含む、注意深い身体検査を実施する必要があります。血圧と血清クレアチニンは、最初の 3 か月間は 2 週間ごとに評価し、患者が安定している場合は毎月評価する必要があります。非ステロイド性抗炎症薬(NSAID)の用量を増やした後、およびNeoral 25mg治療中に新しいNSAID療法を開始した後は、常に血清クレアチニンと血圧を監視することをお勧めします.メトトレキサートと同時投与する場合は、CBC および肝機能検査を毎月モニタリングすることが推奨されます (以下を参照)。 予防 、 一般、高血圧 )。
シクロスポリンを投与されている患者では、高血圧が発生した場合、ネオーラルの用量を 25% から 50% 減らす必要があります。高血圧が持続する場合は、ネオーラル 100mg の用量をさらに減らすか、降圧剤で血圧をコントロールする必要があります。ほとんどの場合、シクロスポリンを中止すると、血圧はベースラインに戻りました。
関節リウマチ患者のプラセボ対照試験では、収縮期高血圧(2回の収縮期血圧測定値が140 mmHgを超えることと定義)および拡張期高血圧(2回の拡張期血圧測定値が90 mmHgを超えることと定義)が患者の33%と19%で発生しました。それぞれシクロスポリンで治療された患者。対応するプラセボ率は 22% と 8% でした。
乾癬患者のための特別なモニタリング
治療を開始する前に、血圧測定(少なくとも 2 回)を含む慎重な皮膚科および身体検査を実施する必要があります。 Neoral は免疫抑制剤であるため、患者は最初の身体検査で潜伏性感染症の存在を評価し、最初は腫瘍の存在を評価する必要があります。乾癬に典型的ではない皮膚病変は、ネオーラルを開始する前に生検する必要があります。皮膚の悪性または前悪性変化を有する患者は、そのような病変の適切な治療後、および他の治療オプションが存在しない場合にのみ、ネオーラル 100mg で治療する必要があります。
ベースライン検査室には、血清クレアチニン (2 回)、BUN、CBC、血清マグネシウム、カリウム、尿酸、および脂質を含める必要があります。
シクロスポリン腎症のリスクは、開始用量が低く (2.5 mg/kg/日)、最大用量が 4.0 mg/kg/日を超えず、シクロスポリンの投与中は定期的に血清クレアチニンをモニターし、ネオーラルの用量がクレアチニンの上昇が患者の治療前レベルよりも 25% 以上高い場合、25mg を減らします。クレアチニンの増加は、通常、ネオーラルの適時の減量または中止により元に戻ります。
血清クレアチニンと BUN は、治療の最初の 3 か月間は 2 週間ごとに評価し、患者が安定している場合は毎月評価する必要があります。血清クレアチニンが患者の治療前レベルより 25% 以上高い場合、血清クレアチニンを 2 週間以内に再測定する必要があります。血清クレアチニンの変化がベースラインより 25% 以上高いままである場合、ネオラル 25mg を 25% から 50% 減らす必要があります。の場合 いつでも 血清クレアチニンが治療前レベルよりも 50% 以上増加する場合、Neoral 25mg は 25% から 50% 減少させる必要があります。 2回の用量変更後に血清クレアチニンの可逆性(ベースラインの25%以内)が達成できない場合、ネオーラルは中止する必要があります。非ステロイド性抗炎症薬の投与量を増やした後、およびNeoral 25mg治療中に新しい非ステロイド性抗炎症療法を開始した後は、血清クレアチニンを監視することをお勧めします.
血圧は、治療の最初の 3 か月間は 2 週間ごとに評価し、患者が安定している場合は毎月、または投与量の調整が行われる場合はより頻繁に評価する必要があります。ネオーラルによる治療を開始する前に高血圧の既往歴のない患者は、高血圧が持続していることが判明した場合、薬剤を 25% から 50% 減量する必要があります。ネオーラル 25mg を複数回減量しても患者の高血圧が続く場合は、ネオーラルを中止する必要があります。高血圧治療中の患者の場合、ネオーラル 100mg 治療を開始する前に、ネオーラル服用中に高血圧をコントロールできるように投薬を調整する必要があります。高血圧管理の変更が効果的でない、または許容できない場合は、ネオーラル 100mg を中止する必要があります。
CBC、尿酸、カリウム、脂質、およびマグネシウムも、治療の最初の 3 か月間は 2 週間ごとに監視し、患者が安定している場合は月 1 回、または投与量の調整が行われる場合はより頻繁に監視する必要があります。 Neoral 25mg の投与量は、臨床的に懸念される異常がある場合は 25% から 50% 減量する必要があります。
乾癬患者におけるシクロスポリンの対照試験では、シクロスポリンの血中濃度は、改善または腎機能障害などの副作用と十分に相関していませんでした.
臨床検査
シクロスポリンで治療されたすべての患者において、血清クレアチニン、BUN、血清ビリルビン、および肝酵素を測定することにより、腎機能と肝機能を繰り返し評価する必要があります。血清脂質、マグネシウム、およびカリウムも監視する必要があります。
移植患者では、シクロスポリンの血中濃度を定期的に監視する必要があります( 投薬と管理 、 移植患者の血中濃度モニタリング )、および定期的に関節リウマチ患者を監視します。
発がん、突然変異誘発、生殖能力の障害
発がん性試験は、雌雄のラットおよびマウスで実施されました。 78 週間のマウス試験では、雌のリンパ球性リンパ腫について統計的に有意な傾向の証拠が見つかり、中用量の雄の肝細胞癌の発生率は対照値を有意に上回った。ラットの 24 ヶ月試験では、膵島細胞腺腫が低用量レベルで対照率を大幅に上回った。マウスおよびラットの研究で使用された用量は、臨床維持用量 (6 mg/kg) の 0.01 ~ 0.16 倍でした。肝細胞癌および膵島細胞腺腫は、用量に関係がなかった。公開されたレポートは、UV 照射とシクロスポリンまたは他の免疫抑制剤によるヘアレス マウスの共治療が、UV 照射単独と比較して皮膚腫瘍形成までの時間を短縮することを示しています。
シクロスポリンは適切な試験系で変異原性を示さなかった。シクロスポリンは、Ames 試験、V79-HGPRT 試験、マウスおよびチャイニーズハムスターにおける小核試験、チャイニーズハムスター骨髄における染色体異常試験、マウス優性致死試験、および処理されたマウスの精子における DNA 修復テスト。 in vitro でヒトリンパ球を使用してシクロスポリンによる姉妹染色分体交換 (SCE) 誘導を分析した最近の研究では、この系の高濃度で正の効果 (すなわち、SCE の誘導) が示されました。発表された 2 つの調査研究では、子宮内でサイクロスポリン (10 mg/kg/日、皮下) にさらされたウサギは、35 週齢までネフロン数の減少、腎肥大、全身性高血圧および進行性腎不全を示しました。 12 mg/kg/日のシクロスポリンを静脈内投与された妊娠ラット (推奨されるヒトの静脈内投与量の 2 倍) では、心室中隔欠損症の発生率が増加した胎児が生まれました。これらの発見は他の種では実証されておらず、人間との関連性は不明です.
雄および雌のラットでの研究では、生殖能力の障害は示されませんでした。
広範囲に分布する皮膚の乳頭腫症が、ヒトの初期乾癬治療用量である 2.5 mg/kg の 9 倍のシクロスポリンで犬を慢性的に治療した後に観察されました。用量は体表面積ベースで表されます。この乳頭腫症は、シクロスポリンの中止により自然退行を示した。
悪性腫瘍の発生率の増加は、臓器移植のレシピエントおよび関節リウマチおよび乾癬患者における免疫抑制の認識された合併症です。新生物の最も一般的な形態は、非ホジキンリンパ腫および皮膚の癌腫です。シクロスポリン受容者の悪性腫瘍のリスクは、正常で健康な集団よりも高くなりますが、他の免疫抑制療法を受けている患者と同様です。免疫抑制の軽減または中止により、病変が退縮する可能性があります。
シクロスポリンを服用している乾癬患者では、悪性腫瘍、特に皮膚の腫瘍の発生が報告されています( 警告 )。乾癬に典型的ではない皮膚病変は、シクロスポリン治療を開始する前に生検する必要があります。皮膚に悪性または前悪性の変化がある患者は、そのような病変を適切に治療した後、他に治療の選択肢がない場合にのみ、シクロスポリンで治療する必要があります。
妊娠
動物実験では、ラットとウサギで生殖毒性が示されています。シクロスポリンは、経口投与による標準的な試験システムで変異原性または催奇形性効果の証拠を示さなかった (経口で、ラットは 17 mg/kg まで、ウサギは 30 mg/kg まで)。ラットの生殖研究。シクロスポリンは、母体に毒性のある用量で経口投与した後、ラットおよびウサギで胚毒性および胎児毒性であることが示されています。胎児毒性は、ヒトの移植用量 6.0 mg/kg の 0.8 倍、ウサギでは 5.4 倍で認められました。用量補正は体表面積に基づいています。シクロスポリンは、関連する骨格遅滞とともに、出生前後の死亡率の増加と胎児の体重の減少によって示されるように、胚および胎児毒性がありました。
妊娠中の女性を対象とした適切で十分に管理された研究がないため、母親への潜在的な利益が胎児への潜在的なリスクを正当化しない限り、妊娠中はネオーラルを使用しないでください.
免疫抑制剤で治療されている妊娠中の移植レシピエントでは、早産のリスクが高くなります。以下のデータは、妊娠中にシクロスポリンを投与された女性の 116 の妊娠の報告された転帰を表しており、その 90% は移植患者であり、そのほとんどは妊娠期間全体にわたってシクロスポリンを投与されていました。異常の唯一の一貫したパターンは、早産 (妊娠期間 28 ~ 36 週) と在胎期間の低出生体重でした。 16 人の流産が発生した。妊娠のほとんど (100 例中 85 例) は、障害を合併していました。子癇前症、子癇、早産、胎盤早期剥離、羊水過少症、Rh不適合、および胎児胎盤機能不全を含む。早産は 47% で発生しました。 7 つの奇形が 5 人の生存している乳児と 2 人の胎児喪失で報告されました。乳児の 28% は在胎期間の割に小さかった。新生児の合併症は 27% で発生しました。したがって、妊娠中にネオーラルを使用するリスクと利点を慎重に検討する必要があります。
子宮内でシクロスポリンに暴露された子供の限られた数の観察が、約 7 歳まで利用可能です。これらの子供たちの腎機能と血圧は正常でした。
母体と胎児の相互作用が阻害される可能性があるため、妊娠中の乾癬患者にネオーラルを使用するリスク/ベネフィット比を慎重に検討し、ネオーラルの中止を真剣に検討する必要があります。
ネオーラル 100mg 製剤のアルコール含有量は、妊娠中の女性でも考慮に入れる必要があります ( 警告 、 特殊賦形剤 )。
授乳中の母親
シクロスポリンは母乳に含まれています。ネオーラル 100mg は授乳中の乳児に重篤な副作用を引き起こす可能性があるため、母親にとっての薬の重要性を考慮して、授乳を中止するか薬を中止するかを決定する必要があります。ネオーラルにはエタノールが含まれています。エタノールは、母親の血清に見られるのと同様のレベルで母乳に存在し、母乳に存在する場合、授乳中の乳児によって経口吸収されます( 警告 )。
小児用
小児を対象とした適切で十分に管理された研究は完了していませんが、1 歳という若さの移植レシピエントは、異常な副作用なしでネオーラルを受けています。 18 歳未満の若年性関節リウマチまたは乾癬の子供に対するネオーラル治療の安全性と有効性は確立されていません。
高齢者の使用
シクロスポリンによる関節リウマチの臨床試験では、患者の 17.5% が 65 歳以上でした。これらの患者は、治療中に収縮期高血圧を発症する可能性が高く、治療の 3 ~ 4 か月後に血清クレアチニンがベースラインより 50% 以上上昇する可能性が高くなりました。
移植患者および乾癬患者におけるネオーラル 100mg の臨床研究には、65 歳以上の被験者が若い被験者と異なる反応を示すかどうかを判断するのに十分な数の被験者が含まれていませんでした。他の報告された臨床経験では、年配の患者と若い患者の間の反応の違いは確認されていません。一般に、高齢患者の用量選択は慎重に行う必要があり、通常は用量範囲の下限から開始します。これは、肝臓、腎臓、または心機能の低下、および付随する疾患または他の薬物療法の頻度が高いことを反映しています。
過剰摂取
シクロスポリンの過剰摂取の経験はほとんどありません。強制嘔吐と胃洗浄は、ネオーラルの投与後 2 時間まで有効です。一過性の肝毒性および腎毒性が発生する可能性がありますが、これは薬物中止後に解消するはずです。 10 g (約 150 mg/kg) までのシクロスポリンの経口用量は、嘔吐、眠気、頭痛、頻脈などの比較的軽度の臨床的影響で許容されており、少数の患者では中程度の重度の可逆的な腎機能障害が認められています。しかし、未熟児にシクロスポリンを偶発的に非経口的に過剰投与した後、深刻な中毒症状が報告されています。過剰摂取のすべての場合に、一般的な支持手段と対症療法に従う必要があります。シクロスポリンはあまり透析できず、チャコール血液灌流によってもきれいに除去されません。実験動物の半数が死亡すると推定される経口投与量は、マウス、ラット、およびウサギにおける移植患者のヒト維持用量 (6mg/kg; 体表面積に基づく補正) の 31 倍、39 倍、および > 54 倍です。 .
禁忌
全般的
ネオーラル 100mg は、シクロスポリンまたは製剤のいずれかの成分に対して過敏症の患者には禁忌です。
関節リウマチ
異常な腎機能、制御されていない高血圧、または悪性腫瘍を有する関節リウマチ患者は、ネオーラルを受けるべきではありません。
乾癬
Neoral 100mgで治療されている乾癬患者は、併用PUVAまたはUVB療法、メトトレキサートまたは他の免疫抑制剤、コールタールまたは放射線療法を受けるべきではありません.異常な腎機能、制御されていない高血圧、または悪性腫瘍のある乾癬患者は、ネオーラルを受けるべきではありません。
臨床薬理学
シクロスポリンは強力な免疫抑制剤であり、皮膚、腎臓、肝臓、心臓、膵臓、骨髄、小腸、および肺を含む動物の同種異系移植の生存を延長します。シクロスポリンは、いくつかの体液性免疫を抑制することが実証されており、同種移植拒絶反応、遅発性過敏症、実験的アレルギー性脳脊髄炎、フロイントのアジュバント関節炎、さまざまな臓器の多くの動物種における移植片対宿主病などの細胞性免疫反応を大幅に抑制することが実証されています。 .
シクロスポリンの有効性は、細胞周期の G0 期および G1 期における免疫担当リンパ球の特異的かつ可逆的な阻害によってもたらされます。 Tリンパ球は優先的に阻害されます。ヘルパー T 細胞が主な標的ですが、T サプレッサー細胞も抑制される可能性があります。シクロスポリンは、インターロイキン-2 を含むリンホカインの産生と放出も阻害します。
貪食機能 (酵素分泌の変化、顆粒球の走化性遊走、マクロファージ遊走、インビボでの炭素クリアランス) への影響は、動物では検出されていません。シクロスポリンは、動物モデルまたはヒトで骨髄抑制を引き起こしません。
薬物動態
シクロスポリンの免疫抑制活性は、主に親薬によるものです。経口投与後、シクロスポリンの吸収は不完全です。シクロスポリンの吸収の程度は、個々の患者、患者集団、および製剤に依存します。シクロスポリンの排泄は主に胆汁によるもので、投与量 (親薬物と代謝物) のわずか 6% が尿中に排泄されます。血液からのシクロスポリンの体内動態は一般に二相性であり、最終半減期は約 8.4 時間 (範囲 5 ~ 18 時間) です。静脈内投与後のシクロスポリンの血中クリアランス (アッセイ: HPLC) は、腎臓または肝臓の同種移植片の成人レシピエントで約 5 ~ 7 mL/分/kg です。血中シクロスポリンクリアランスは、心臓移植患者ではわずかに遅いようです.
Neoral Soft Gelatin Capsules (シクロスポリン カプセル、USP) MODIFIED と Neoral Oral Solution (シクロスポリン経口溶液、USP) MODIFIED は生物学的に同等です。ネオーラル内用液 25mg をオレンジジュースまたはリンゴジュースで希釈したものは、ネオーラル内用液を水で希釈したものと生物学的に同等です。 Neoral Oral Solution として投与した場合のシクロスポリンのバイオアベイラビリティに対する牛乳の影響は評価されていません。
投与量と曝露の関係 (濃度対時間曲線下面積、AUC) は、治療用量範囲内で直線的です。ネオーラルまたはサンディミューンが投与された場合のシクロスポリン曝露 (AUC) の被験者間変動 (合計、%CV) は、腎移植患者で約 20% から 50% の範囲です。この被験者間の変動性は、最適な治療のための投与計画の個別化の必要性に寄与します( 投薬と管理 )。
腎移植レシピエントにおける AUC の被験者内変動 (%CV) は、Neoral で 9% から 21%、Sandimmune で 19% から 26% でした。同じ研究で、トラフ濃度 (%CV) の被験者内変動性は、Neoral で 17% から 30%、Sandimmune で 16% から 38% でした。
吸収
Neoral は、Sandimmune と比較してバイオアベイラビリティが向上しています。サンディミューンとして投与されるシクロスポリンの絶対的なバイオアベイラビリティは、患者集団に依存し、肝臓移植患者では 10% 未満、一部の腎移植患者では 89% と推定されます。ネオーラルとして投与されたシクロスポリンの絶対的なバイオアベイラビリティは、成人では決定されていません。腎移植、関節リウマチおよび乾癬患者の研究では、平均シクロスポリン AUC は約 20% から 50% 高く、ピーク血中シクロスポリン濃度 Cmax は、サンディミューンの投与後と比較して、ネオーラル 100mg の投与後に約 40% から 106% 大きかった。 .移植の 28 日後に Neoral を投与された de novo 肝移植患者の用量正規化 AUC は、Sandimmune を投与された患者よりも 50% 大きく、Cmax は 90% 大きかった。心臓移植患者では AUC と Cmax も増加しますが (Sandimmune と比較して Neoral)、データは非常に限られています。 AUC および Cmax 値は、サンディミューンと比較してネオーラル 100mg の方が高くなっていますが、投与前のトラフ濃度 (用量で正規化) は 2 つの製剤で類似しています。
ネオーラルの経口投与後、最高血中シクロスポリン濃度 (Tmax) までの時間は 1.5 時間から 2.0 時間の範囲でした。 Neoral 25mg を含む食品の投与は、シクロスポリンの AUC と Cmax を減少させます。高脂肪食 (669 kcal、脂肪 45 グラム) は、Neoral 25 mg 投与前の 30 時間以内に消費され、AUC が 13% 減少し、Cmax が 33% 減少しました。低脂肪食 (667 kcal、脂肪 15 グラム) の効果は同様でした。
ネオーラル 25mg からのシクロスポリンの吸収に対する胆汁の T 管分流の影響を、11 人の新規肝移植患者で調べた。患者に胆汁の T 管分流の有無にかかわらず Neoral を投与した場合、T 管を閉じた状態での投与前の値からの最大血中濃度の変化によって測定されるように、吸収の差はほとんど観察されませんでした。オープン: 6.9 ± 41% (範囲 55% ~ 68%)。
患者集団分布
シクロスポリンは、主に血液量の外側に分布しています。静脈内投与中の定常状態の分布量は、固形臓器移植レシピエントで 3 ~ 5 L/kg と報告されています。血液中の分布は濃度に依存します。およそ 33% から 47% が血漿に、4% から 9% がリンパ球に、5% から 12% が顆粒球に、41% から 58% が赤血球に含まれています。高濃度では、白血球と赤血球の結合能力が飽和します。血漿では、約 90% がタンパク質、主にリポタンパク質に結合しています。シクロスポリンは母乳中に排泄されます( 予防 、 授乳中の母親 )。
代謝
シクロスポリンは、肝臓ではシトクロム P-450 3A 酵素系によって広範囲に代謝され、胃腸管および腎臓ではより少ない程度で代謝されます。シクロスポリンの代謝は、さまざまな薬剤の同時投与によって変化する可能性があります。 予防 、 薬物相互作用 )。ヒトの胆汁、糞便、血液、および尿から、少なくとも 25 の代謝物が同定されています。代謝産物の生物学的活性と毒性への寄与は、親化合物よりもかなり低くなります。主要な代謝産物 (M1、M9、および M4N) は、それぞれ 1-ベータ、9-ガンマ、および 4-N-脱メチル化位置での酸化に起因します。サンディミューンの経口投与後の定常状態では、M1、M9、および M4N の血中濃度の平均 AUC は、血中シクロスポリン濃度の AUC のそれぞれ約 70%、21%、および 7.5% です。安定した腎移植患者(クロスオーバー試験でネオーラルとサンディミューンを投与された 13 人の患者)からの血中濃度データ、および de novo 肝移植患者(ネオーラル 100mg を投与された 4 人、サンディミューンを投与された 3 人)からの胆汁濃度データに基づいて、 M1、M9、および M4N の代謝物は、ネオーラル 25mg またはサンディミューンのいずれかを投与した場合と同様です。
排泄
シクロスポリン投与量のわずか 0.1% が、そのまま尿中に排泄されます。排泄は主に胆汁で行われ、投与量 (親薬物と代謝物) のわずか 6% が尿中に排泄されます。透析も腎不全も、シクロスポリンのクリアランスを著しく変化させません。
薬物相互作用
(見る 予防 、 薬物相互作用 関節リウマチ患者にジクロフェナクまたはメトトレキサートをシクロスポリンと併用投与すると、ジクロフェナクとメトトレキサートのそれぞれの AUC が有意に増加しました ( 予防 、 薬物相互作用 )。シクロスポリンとアスピリン、ケトプロフェン、ピロキシカム、またはインドメタシンとの間で、臨床的に重要な薬物動態学的相互作用は発生しませんでした。
特定の集団
腎障害
末期腎疾患 (クレアチニンクリアランス
肝障害
シクロスポリンは肝臓で広範囲に代謝されます。重度の肝機能障害はシクロスポリンへの曝露を著しく増加させる可能性があるため、これらの患者ではシクロスポリンの投与量を減らす必要があるかもしれません.
小児人口
ネオーラルまたはサンディミューンを投与された小児患者の薬物動態データは非常に限られています。 3~16 歳の 15 人の腎移植患者では、サンディミューンの IV 投与後のシクロスポリン全血クリアランスは 10.6 ± 3.7 mL/min/kg でした (アッセイ: Cyclo-trac 特異的 RIA)。 2 歳から 16 歳の 7 人の腎移植患者の研究では、シクロスポリンのクリアランスは 9.8 から 15.5 mL/min/kg の範囲でした。年齢 0.6 ~ 5.6 歳の 9 人の肝移植患者では、クリアランスは 9.3 ± 5.4 mL/min/kg (アッセイ: HPLC) でした。
小児集団では、ネオーラルはサンディミューンと比較してバイオアベイラビリティの向上も示しています。 1.4 歳から 10 歳までの 7 人の肝臓 de novo 移植患者では、ネオーラルの絶対バイオアベイラビリティは 43% (範囲 30% から 68%) であり、同じ個人におけるサンディミューンの絶対バイオアベイラビリティは 28% (範囲 17% から 42%) でした。
高齢者人口
正常な高齢者ボランティア (N = 18、平均年齢 69 歳) と高齢の関節リウマチ患者 (N = 16、平均年齢 68 歳) の両方からの単回投与データと、若年成人ボランティア (N = 16、平均年齢) の単回投与データの比較26 歳) は、薬物動態パラメータに有意差を示さなかった。
臨床試験
関節リウマチ
重度の関節リウマチの治療におけるサンディミューンとネオーラル 100mg の有効性は、合計 728 人のシクロスポリン治療患者と 273 人のプラセボ治療患者を含む 5 つの臨床研究で評価されました。
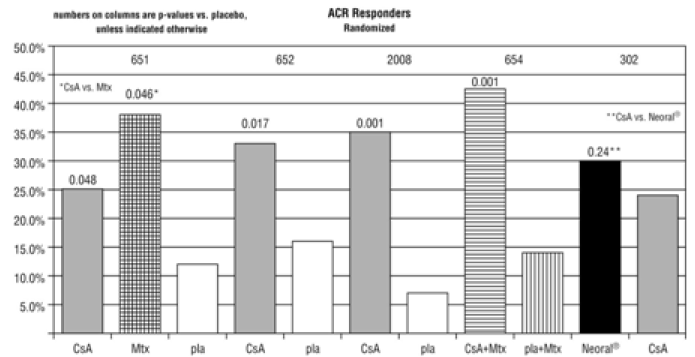
結果の要約は、治療グループごとの「レスポンダー」率について提示されます。レスポンダーは、圧痛と腫れた関節数が 20% 改善し、2 つの関節が 20% 改善して試験を完了した患者として定義されます。研究 651 および 652 については研究者全体、患者全体、障害、および赤血球沈降速度 (ESR) の 4 つ、研究 2008、654 および 302 については研究者全体、患者全体、障害、視覚的アナログの痛み、および ESR の 5 つのうち 3 つ。
スタディ 651 は、少なくとも 20 の関節に関与する活動性関節リウマチ患者 264 人を登録し、少なくとも 1 つの主要な RA 治療薬で効果が得られなかった患者を、3:3:2 のランダム化を使用して、次の 3 つのグループのいずれかに割り当てました。 5 mg/kg/日、(2) 7.5 ~ 15 mg/週のメトトレキサート、または (3) プラセボ。治療期間は24週間でした。最後の訪問時の平均シクロスポリン用量は 3.1 mg/kg/日でした。以下のグラフを参照してください。
研究 652 には、少なくとも 1 つの主要な RA 治療薬で効果がなかった 6 つ以上の活動性関節痛または圧痛を伴う活動性 RA 患者 250 人が登録されました。患者は、3:3:2 の無作為化を使用して、(1) 1.5 ~ 5 mg/kg/日のシクロスポリン、(2) 2.5 ~ 5 mg/kg/日のシクロスポリン、および (3) 3 つの治療群のうちの 1 つに無作為化されました。プラセボ。治療期間は16週間でした。最後の訪問時のグループ 2 の平均シクロスポリン用量は 2.92 mg/kg/日でした。以下のグラフを参照してください。
2008年の研究では、アスピリンと金またはペニシラミンの治療コースが失敗した活動性RAと6つ以上の活動性関節を有する144人の患者が登録されました。患者は、2 つの治療群 (1) シクロスポリン 2.5 ~ 5 mg/kg/日で、最初の 1 か月後に目標のトラフ レベルを達成するように調整されたもの、および (2) プラセボのうちの 1 つに無作為に割り付けられました。治療期間は24週間でした。最後の訪問時の平均シクロスポリン用量は 3.63 mg/kg/日でした。以下のグラフを参照してください。
スタディ 654 には、最大耐量のメトトレキサートを少なくとも 3 か月間投与したにもかかわらず、関節数が 6 以上であった 148 人の患者が登録されました。患者は現在の用量のメトトレキサートを引き続き服用し、さらに次のいずれかの薬剤を投与するよう無作為に割り付けられました: (1) シクロスポリン 2.5 mg/kg/日。有意な毒性なしに活動関節数が 30% 未満減少した場合、毒性の証拠はなく、8 週目と 16 週目にさらに 0.5 mg/kg/日の増加がありました。用量の減少は、毒性または (2) プラセボのためにいつでも行うことができます。治療期間は24週間でした。最後の訪問時の平均シクロスポリン用量は 2.8 mg/kg/日 (範囲: 1.3 から 4.1) でした。以下のグラフを参照してください。
研究 302 には重度の活動性 RA 患者 299 人が登録され、その 99% は少なくとも 1 つの主要な RA 治療薬に反応しないか不耐性でした。患者は 2 つの治療群 (1) ネオーラル 25mg および (2) シクロスポリンのうちの 1 つに無作為に割り付けられました。どちらも 2.5 mg/kg/日で開始し、4 週間後に非効果のために 0.5 mg/kg/日ずつ増加させて最大 5 mg/kg/日であり、毒性のためにいつでも減少します。治療期間は24週間でした。最後の訪問時の平均シクロスポリン用量は、ネオーラルで 2.91 mg/kg/日 (範囲: 0.72 から 5.17)、シクロスポリンで 3.27 mg/kg/日 (範囲: 0.73 から 5.68) でした。以下のグラフを参照してください。
臨床研究
対照研究では、ネオーラルで治療された 493 人の移植患者で観察された有害事象の性質、重症度、および発生率は、これらの同じ研究で 2 つの薬剤の投与量が調整された場合にサンディミューンを受けた 208 人の移植患者で観察されたものと同等でした。同じシクロスポリン血中トラフ濃度を達成するために。
サンディミューンの過去の経験に基づくと、腎臓、心臓、および肝臓移植の臨床試験に関与した 892 人の患者の 3% 以上で、以下の反応が発生しました。
臨床試験でシクロスポリン経口溶液(サンディミューン)で治療された705人の腎臓移植患者のうち、治療中止の理由は5.4%の腎毒性、0.9%の感染、1.4%の効果の欠如、1.0%の急性尿細管壊死、リンパ増殖性疾患でした。患者の 0.3% で、0.3% で高血圧、および 0.7% の患者で他の理由。
以下の反応は、シクロスポリン治療患者の 2% 以下で発生しました: アレルギー反応、貧血、食欲不振、錯乱、結膜炎、浮腫、発熱、もろい爪、胃炎、難聴、しゃっくり、高血糖、片頭痛 (Neoral)、筋肉痛、消化性潰瘍、血小板減少症、耳鳴り。
次の反応はまれに発生しました: 不安、胸の痛み、便秘、うつ病、断髪、血尿、関節痛、無気力、口内炎、心筋梗塞、寝汗、膵炎、かゆみ、嚥下困難、うずき、上部消化管出血、視覚障害、衰弱、体重減少。
シクロスポリンおよびシクロスポリンを含むレジメンを含む免疫抑制療法を受けている患者は、感染症(ウイルス、細菌、真菌、寄生虫)のリスクが高くなります。全身感染と局所感染の両方が発生する可能性があります。既存の感染症も悪化する可能性があります。致命的な結果が報告されています( 警告 )。
市販後の経験、腎臓、肝臓、心臓移植
肝毒性
胆汁うっ滞、黄疸、肝炎、肝不全などの肝毒性および肝障害の症例;重大および/または致命的な転帰が報告されています (参照 警告 、 肝毒性 )。
感染リスクの増加
JC ウイルス関連の進行性多巣性白質脳症 (PML) の症例で、時には致命的です。およびポリオーマウイルス関連腎症(PVAN)、特に移植片喪失をもたらす BK ウイルスが報告されている( 警告 、 ポリオーマウイルス感染症 )。
片頭痛を含む頭痛
片頭痛の症例が報告されています。場合によっては、患者がシクロスポリンを継続できない場合もありますが、治療中止の最終決定は、ベネフィットとリスクを慎重に評価した後、担当医が行う必要があります。
下肢の痛み
シクロスポリンに関連して、下肢の痛みの孤立した症例が報告されています。下肢の痛みは、文献に記載されているように、カルシニューリン阻害剤誘発性疼痛症候群 (CIPS) の一部としても指摘されています。
関節リウマチ
関節リウマチにおけるシクロスポリンの使用に伴う主な副作用は、腎機能障害です( 警告 )、高血圧(を参照) 予防 )、頭痛、胃腸障害、および多毛症/多毛症。
臨床試験で推奨用量範囲内で治療された関節リウマチ患者では、シクロスポリン療法は、高血圧のために5.3%の患者で中止され、クレアチニンの増加のために7%の患者で中止されました。これらの変化は通常、適時に用量を減らすか、薬剤を中止することで元に戻せます。血清クレアチニン上昇の頻度と重症度は、シクロスポリン療法の用量と期間とともに増加します。これらの上昇は、減量または中止しなければ、より顕著になる可能性があります。
以下の有害事象が対照臨床試験で発生しました。
さらに、対照臨床試験において、シクロスポリン治療群の関節リウマチ患者の1%から
自律神経系: 口渇、発汗の増加
全身: アレルギー、無力症、のぼせ、倦怠感、過剰摂取、処置 NOS*、腫瘍 NOS*、体重減少、体重増加
心臓血管: 心音異常、心不全、心筋梗塞、末梢虚血
中枢および末梢神経系: 感覚鈍麻、神経障害、めまい
内分泌: 甲状腺腫
胃腸: 便秘、嚥下障害、粘膜疹、おくび、食道炎、胃潰瘍、胃炎、胃腸炎、歯肉出血、舌炎、消化性潰瘍、唾液腺肥大、舌障害、歯障害
感染: 膿瘍、細菌感染、蜂窩織炎、毛包炎、真菌感染、単純ヘルペス、帯状疱疹、腎膿瘍、モニリア症、扁桃炎、ウイルス感染
血液学: 貧血、鼻出血、白血球減少症、リンパ節腫脹
肝臓と胆道系: ビリルビン血症
代謝と栄養: 糖尿病、高カリウム血症、高尿酸血症、低血糖
筋骨格系: 関節痛、骨折、滑液包炎、関節脱臼、筋肉痛、こわばり、滑膜嚢胞、腱障害
新生物: 乳房線維腺症、がん
精神的: 不安、混乱、性欲減退、情緒不安定、集中力低下、性欲増進、神経過敏、パロニリア、傾眠
生殖(女性): 乳房痛、子宮出血
呼吸器系: 異常な胸音、気管支痙攣
皮膚と付属物: 異常色素沈着、血管浮腫、皮膚炎、乾燥肌、湿疹、爪障害、かゆみ、皮膚障害、蕁麻疹
特別な感覚: 視力異常、白内障、結膜炎、難聴、眼痛、味覚異常、耳鳴り、前庭障害
泌尿器系: 異常尿、血尿、BUN上昇、尿意切迫、夜間頻尿、多尿、腎盂腎炎、尿失禁
*NOS = 特に指定なし
乾癬
乾癬患者におけるシクロスポリンの使用に関連する主な副作用は、腎機能障害、頭痛、高血圧、高トリグリセリド血症、多毛症/多毛症、知覚異常または知覚過敏、インフルエンザ様症状、吐き気/嘔吐、下痢、腹部不快感、無気力、および筋骨格です。または関節痛。
推奨用量範囲内で米国の対照臨床試験で治療された乾癬患者では、シクロスポリン療法は、高血圧のために患者の 1.0% で中止され、クレアチニンの増加のために患者の 5.4% で中止されました。ほとんどの場合、これらの変化はシクロスポリンの減量または中止後に元に戻りました。
乾癬におけるシクロスポリンの使用に関連した死亡例が 1 例報告されています。 27 歳の男性は、腎臓の悪化を発症し、シクロスポリンを継続しました。彼は進行性の腎不全に陥り、死に至りました。
血清クレアチニンの頻度と重症度は、シクロスポリン療法の用量と期間とともに増加します。これらの上昇はより顕著になる可能性が高く、用量の減量または中止なしでは不可逆的な腎障害を引き起こす可能性があります。
以下のイベントは、シクロスポリンで治療された乾癬患者の 1% から 3% 未満で発生しました。
全身: 発熱、フラッシュ、ホットフラッシュ
心臓血管: 胸痛
中枢および末梢神経系: 食欲増進、不眠、めまい、神経過敏、めまい
胃腸: 腹部膨満、便秘、歯肉出血
肝臓と胆道系: 高ビリルビン血症
新生物: 皮膚悪性腫瘍 [扁平上皮がん(0.9%)および基底細胞がん(0.4%)]
細網内皮: 血小板、出血、および凝固障害、赤血球障害
呼吸器: 感染、ウイルスおよびその他の感染
皮膚と付属物: にきび、毛包炎、角化症、かゆみ、発疹、乾燥肌
泌尿器系: 排尿頻度
ヴィジョン: 異常な視力
軽度の低マグネシウム血症と高カリウム血症が発生することがありますが、無症候性です。尿酸の増加が起こることがあり、痛風の発作はめったに報告されていません.肝細胞の損傷がなくても、用量に関連する軽微な高ビリルビン血症が観察されています。シクロスポリン療法は、血清トリグリセリドまたはコレステロールのわずかな増加と関連している可能性があります。トリグリセリドの上昇 (> 750 mg/dL) は、乾癬患者の約 15% で発生します。乾癬患者の 3% 未満でコレステロールの上昇 (> 300 mg/dL) が観察されます。一般に、これらの臨床検査値の異常は、シクロスポリンの用量を減らすか中止すると元に戻ります。
市販後の経験、乾癬
慢性尋常性乾癬患者におけるシクロスポリンの中止または減量により、紅皮症性乾癬または汎発性膿疱性乾癬に移行した症例が報告されています。
患者情報
投与量の変更が必要になる可能性があるため、シクロスポリン製剤の変更は医師の監督下で慎重に行う必要があることを患者に説明する必要があります。
患者は、シクロスポリンを投与されている間、臨床検査を繰り返す必要があることを知らされるべきです。患者は、妊娠中の潜在的なリスクについて知らされ、腫瘍形成のリスクが高まることを知らされるべきです。高血圧や腎機能障害のリスクについても患者に説明する必要があります。
シクロスポリンによる治療中は、ワクチン接種の効果が低下する可能性があり、弱毒生ワクチンの使用を避ける必要があることを患者に説明する必要があります。
患者には慎重な投与指示を与える必要があります。 Neoral Oral Solution (シクロスポリン経口溶液、USP) MODIFIED は、できれば室温のオレンジまたはリンゴ ジュースで希釈する必要があります。 Neoral Oral Solution (シクロスポリン経口液剤、USP) MODIFIED と牛乳の組み合わせは、口に合わない場合があります。
患者は、時間帯および食事との関係に関して一貫したスケジュールでネオーラル 100mg を服用するようにアドバイスされるべきです。グレープフルーツとグレープフルーツ ジュースは代謝に影響を与え、シクロスポリンの血中濃度を上昇させるため、避ける必要があります。
