Zocor 5mg, 10mg, 20mg, 40mg Simvastatin 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Zocor とは何ですか? どのように使用されますか?
Zocor (シンバスタチン) は、「悪玉」コレステロール (低密度リポタンパク質または LDL) のレベルを下げ、「善玉」コレステロール (高密度リポタンパク質または HDL) のレベルを上げ、トリグリセリンを下げるために使用される処方薬です。脳卒中や心臓発作のリスクを軽減します。 Zocor は、単独で使用することも、他の薬と併用することもできます。
Zocor は、脂質低下剤、スタチン、HMG-CoA レダクターゼ阻害剤と呼ばれる薬物のクラスに属します。
Zocor が 10 歳未満の子供に安全で有効であるかどうかはわかっていません。
Zocor の副作用にはどのようなものがありますか?
Zocor 20mg は、次のような重大な副作用を引き起こす可能性があります。
- 食欲減少、
- 右上腹部の痛み、
- 疲れ、
- かゆみ、
- 暗い尿、
- 粘土色の便、および
- 皮膚や目の黄変
上記の症状がある場合は、すぐに医療機関を受診してください。
Zocor の最も一般的な副作用は次のとおりです。
- 頭痛、
- 吐き気、
- 胃痛、
- 便秘、および
- かぜの症状(鼻づまり、くしゃみ、のどの痛み)
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Zocor の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
ZOCOR (シンバスタチン) は、Aspergillus terreus の発酵産物から合成的に得られる脂質低下剤です。経口摂取後、不活性なラクトンであるシンバスタチンは、対応するβ-ヒドロキシ酸の形に加水分解されます。これは、3-ヒドロキシ-3-メチルグルタリル補酵素 A (HMG-CoA) レダクターゼの阻害剤です。この酵素は、HMG-CoA からメバロン酸への変換を触媒します。これは、コレステロールの生合成における初期の律速段階です。
シンバスタチンはブタン酸、2,2-ジメチル-,1,2,3,7,8,8a-ヘキサヒドロ-3,7-ジメチル-8-[2-(テトラヒドロ-4ヒドロキシ-6-オキソ-2H-ピラン- 2-イル)-エチル]-1-ナフタレニルエステル、[1S-[1α,3α,7β,8β(2S*,4S*),-8aβ]]。シンバスタチンの実験式は C25H38O5 で、分子量は 418.57 です。その構造式は次のとおりです。
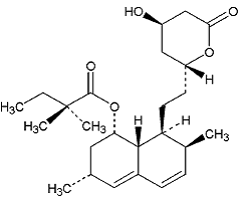
シンバスタチンは、白色からオフホワイトの非吸湿性の結晶性粉末で、実質的に水に溶けず、クロロホルム、メタノール、エタノールに自由に溶けます。
経口投与用の錠剤 ZOCOR には、5 mg、10 mg、20 mg、40 mg、または 80 mg のシンバスタチンと、アスコルビン酸、クエン酸、ヒドロキシプロピルセルロース、ヒプロメロース、酸化鉄、ラクトース、ステアリン酸マグネシウム、微結晶性セルロースのいずれかが含まれています。 、でんぷん、タルク、二酸化チタン。防腐剤としてブチル化ヒドロキシアニソールが添加されています。
適応症
高コレステロール血症によるアテローム性動脈硬化性血管疾患のリスクが有意に高い個人では、脂質改変剤による治療は、複数の危険因子介入の 1 つの構成要素にすぎないはずです。薬物療法は、飽和脂肪とコレステロールを制限した食事やその他の非薬理学的対策だけでは不十分な場合に、食事の補助として適応されます。冠状動脈性心疾患 (CHD) または CHD のリスクが高い患者では、ZOCOR® を食事と同時に開始できます。
CHD死亡率および心血管イベントのリスクの低減
既存の冠動脈疾患、糖尿病、末梢血管疾患、脳卒中またはその他の脳血管疾患の既往があるために冠動脈イベントのリスクが高い患者では、ZOCOR 5mg は以下に適応されます。
- CHDによる死亡を減らすことにより、総死亡リスクを減らします。
- 致命的ではない心筋梗塞や脳卒中のリスクを減らします。
- 冠動脈および非冠動脈血行再建術の必要性を減らします。
高脂血症
ZOCOR は以下に適応されます。
- 上昇した総コレステロール (total-C)、低比重リポタンパク質コレステロール (LDL-C)、アポリポタンパク質 B (Apo B)、トリグリセリド (TG) を減らし、高比重リポタンパク質コレステロール (HDL-C) を増加させます。原発性高脂血症 (フレドリクソン IIa 型、ヘテロ接合体の家族性および非家族性) または混合型脂質異常症 (フレドリクソン IIb 型)。
- 高トリグリセリド血症 (フレドリクソン IV 型高脂血症) 患者の TG の上昇を軽減します。
- 原発性異常βリポタンパク血症 (フレドリクソン III 型高脂血症) 患者の TG および VLDL-C の上昇を抑えます。
- ホモ接合型家族性高コレステロール血症(HoFH)の患者では、他の脂質低下治療(LDL アフェレーシスなど)の補助として、またはそのような治療が利用できない場合は、総 C および LDL-C を減らします。
ヘテロ接合性家族性高コレステロール血症(HeFH)の思春期患者
ZOCOR は、初経後少なくとも 1 年、10 ~ 17 歳の HeFH を有する思春期の少年少女の総 C、LDL-C、および Apo B レベルを低下させるための食事療法の補助として示されています。食事療法の適切な試験では、次の所見が存在します。
- 若年性心血管疾患(CVD)または
- 思春期の患者には、他の 2 つ以上の CVD 危険因子が存在します。
小児および思春期患者の治療の最小目標は、平均 LDL-C
使用制限
ZOCOR 20mg は、主要な異常がカイロミクロンの上昇である状態 (つまり、高脂血症のフレドリクソン I 型および V 型) では研究されていません。
投薬と管理
推奨用量
通常、1日5~40mgが目安です。 CHDまたはCHDのリスクが高い患者では、ZOCORを食事と同時に開始できます。推奨される通常の開始用量は、1日1回夕方に10または20mgです。既存のCHD、糖尿病、末梢血管疾患、脳卒中または他の脳血管疾患の病歴によりCHDイベントのリスクが高い患者の場合、推奨される開始用量は40mg/日です。脂質測定は、4 週間の治療後に実施し、その後は定期的に実施する必要があります。
80mgの制限された投薬
横紋筋融解症を含むミオパシーのリスクが高まるため、特に治療の最初の 1 年間は、80 mg の ZOCOR の使用は、シンバスタチン 80 mg を慢性的に (例えば、12 か月以上) 服用している患者に限定する必要があります。筋肉毒性の証拠なし[参照 警告と注意事項 ]。
現在、ZOCOR の 80 mg の用量を許容している患者で、シンバスタチンの禁忌または用量上限に関連する相互作用薬を開始する必要がある患者は、薬物相互作用の可能性がより低い代替スタチンに切り替える必要があります。
ZOCOR 40mgの80mg用量に関連する横紋筋融解症を含むミオパシーのリスクの増加により、ZOCOR 5mgの40mg用量を利用してLDL-C目標を達成できない患者は、80mg用量に漸増すべきではありません。 、しかし、より大きなLDL-C低下を提供する代替LDL-C低下治療に配置する必要があります.
他の薬剤との併用
ベラパミル、ジルチアゼム、またはドロネダロンを服用している患者
- ZOCOR の投与量は 10 mg/日を超えてはなりません [参照 警告と注意事項 、 薬物相互作用 、 と 臨床薬理学 ]。
アミオダロン、アムロジピンまたはラノラジンを服用している患者
- ZOCOR 10mg の用量は、1 日あたり 20mg を超えてはならない [参照 警告と注意事項 、 薬物相互作用 、 と 臨床薬理学 ]。
ホモ接合性家族性高コレステロール血症の患者
推奨用量は、夕方に40mg/日です。 投薬と管理 、 80mgの制限された投薬 ]。 ZOCOR 5mg は、これらの患者またはそのような治療が利用できない場合に、他の脂質低下治療 (LDL アフェレーシスなど) の補助として使用する必要があります。
シンバスタチンへの曝露は、ロミタピドの併用により約 2 倍になります。したがって、ロミタピドを開始する場合は、ZOCOR の用量を 50% 減らす必要があります。ロミタピドを服用している間、ZOCOR 5mgの投与量は20mg/日を超えてはなりません(または、以前にZOCOR 80mg/日を慢性的に、たとえば12か月以上、筋肉毒性の証拠なしに服用した患者の場合は40mg/日)。
ヘテロ接合性家族性高コレステロール血症の青年(10~17歳)
推奨される通常の開始用量は、1日1回夕方に10mgです。推奨用量範囲は 10 ~ 40 mg/日です。最大推奨用量は 40 mg/日です。投与量は、推奨される治療目標に従って個別化する必要があります [参照 NCEP小児科パネルガイドライン1 と 臨床研究 ]。調整は 4 週間以上の間隔で行う必要があります。
腎障害のある患者
ZOCOR 5mg は重大な腎排泄を受けないため、軽度から中等度の腎障害のある患者では投与量の変更は必要ありません。ただし、ZOCOR 20mgを重度の腎障害のある患者に投与する場合は注意が必要です。そのような患者は 5 mg/日から開始し、注意深く監視する必要があります [参照 警告と注意事項 と 臨床薬理学 ]。
供給方法
剤形と強度
- 錠剤 ZOCOR 5 mg は、バフ、楕円形、フィルムコーティング錠で、片面に MSD 726、もう片面に ZOCOR 5 とコード化されています。
- 錠剤 ZOCOR 10 mg は、桃色の楕円形のフィルムコーティング錠で、片面に MSD 735 がコードされ、もう片面には無地です。
- 錠剤 ZOCOR 20 mg は、黄褐色の楕円形のフィルムコーティングされた錠剤で、片面に MSD 740 とコード化され、もう片面には無地です。
- 錠剤 ZOCOR 40 mg は、赤レンガ色の楕円形のフィルムコーティング錠で、片面に MSD 749 とコード化され、もう片面には無地です。
- 錠剤 ZOCOR 80 mg は、片面に 543、もう片面に 80 とコード化されたレンガ色のカプセル型のフィルムコーティング錠です。
保管と取り扱い
No.8146 - ゾコール錠10mg 桃色の楕円形のフィルムコーティング錠で、片面に MSD 735 とコード化され、もう片面は無地です。それらは次のように提供されます。
NDC 0006-0735-31 使用本数30本 NDC 0006-0735-54 使用本数90本。
No.8147 - ゾコール錠20mg 黄褐色の楕円形のフィルムコーティング錠で、片面に MSD 740 とコード化され、もう片面には無地です。それらは次のように提供されます。
NDC 0006-0740-31 使用本数30本 NDC 0006-0740-54 使用本数90本。
No.8148 - ゾコール錠40mg レンガ色の楕円形のフィルムコーティングされた錠剤で、片面は MSD 749 でコード化され、もう片面は無地です。それらは次のように提供されます。
NDC 0006-0749-31 使用本数30本 NDC 0006-0749-54 使用本数90本。
No.6577 - ゾコール錠80mg 片面は 543、もう片面は 80 とコード化された赤レンガ色のカプセル型のフィルムコーティング錠です。それらは次のように提供されます。
NDC 0006-0543-31 使用本数30本 NDC 0006-0543-54 使用本数90本。
保管所
5~30°C (41~86°F) で保管してください。
1全米コレステロール教育プログラム (NCEP): 小児および青年の血中コレステロールレベルに関する専門家パネルのレポートのハイライト。小児科。 89(3):495-501。 1992年。
製造元: Merck Sharp & Dohme Ltd. Cramlington, Northumberland, UK NE23 3JU.改訂: 2020 年 9 月
副作用
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
市販前対照臨床試験およびその自由延長試験(追跡期間の中央値が約 18 か月の患者 2,423 人)では、患者の 1.4% が副作用のために中止されました。治療中止に至った主な副作用は、胃腸障害(0.5%)、筋肉痛(0.1%)、関節痛(0.1%)でした。シンバスタチンを対照とした臨床試験で最も多く報告された副作用 (発生率 ≥5%) は、上気道感染症 (9.0%)、頭痛 (7.4%)、腹痛 (7.3%)、便秘 (6.6%)、吐き気 (5.4%) でした。 %)。
スカンジナビアのシンバスタチン生存研究
4,444 人 (年齢範囲 35 ~ 71 歳、女性 19%、白人 100%) が関与する 4S では、20 ~ 40 mg/日の ZOCOR (n=2,221) またはプラセボ (n=2,223) で中央値 5.4 年にわたって治療されました。患者の 2% 以上で報告され、プラセボより高い割合で報告された反応を表 2 に示します。
心臓保護研究
ZOCOR 40 mg/日 (n=10,269) またはプラセボ (n= 10,267) 平均 5 年間で、重篤な副作用と何らかの副作用による中止のみが記録されました。副作用による中止率は、プラセボで治療された患者の 5.1% と比較して、ZOCOR 10mg で治療された患者で 4.8% でした。ミオパシー/横紋筋融解症の発生率は、ZOCOR で治療された患者で 0.1% 未満でした。
その他の臨床研究
心筋梗塞の既往のある12,064人の患者がZOCORで治療された臨床試験(平均追跡期間6.7年)では、ミオパシー(原因不明の筋力低下または血清クレアチンキナーゼ[CK]による痛みとして定義される)の発生率が10倍以上正常値の上限 [ULN]) は、1 日 20 mg の患者の 0.02% と比較して、80 mg/日の患者の約 0.9% でした。横紋筋融解症(CK が ULN の 40 倍を超えるミオパシーと定義)の発生率は、80 mg/日を投与された患者では約 0.4% でしたが、20 mg/日を投与された患者では 0% でした。横紋筋融解症を含むミオパシーの発生率は、治療の最初の年に最も高く、その後の数年間で著しく減少しました。この試験では、患者を注意深く監視し、相互作用のある医薬品を除外しました。
臨床試験で報告されたその他の副作用は、下痢、発疹、消化不良、鼓腸、無力症でした。
臨床検査
肝トランスアミナーゼの顕著な持続的上昇が認められている[参照 警告と注意事項 ]。アルカリホスファターゼとγ-グルタミルトランスペプチダーゼの上昇も報告されています。約 5% の患者で 1 回以上、正常値の 3 倍以上の CK レベルの上昇が見られました。これは、CK の心臓以外の部分に起因するものでした。 [見る 警告と注意事項 ]
思春期の患者(10~17歳)
初経後少なくとも 1 年、年齢 10 ~ 17 歳(女性 43.4%、白人 97.7%、ヒスパニック系 1.7%、多民族系 0.6%)のヘテロ接合体家族性高コレステロール血症の思春期の少年少女を対象とした 48 週間の対照研究(n=175)、プラセボまたは ZOCOR (1 日 10 ~ 40 mg) で治療した場合、両群で観察された最も一般的な有害反応は、上気道感染症、頭痛、腹痛、および吐き気でした [ 特定の集団での使用 と 臨床研究 ]。
市販後の経験
以下の反応は、不確実な規模の集団から自発的に報告されているため、一般に、それらの頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることはできません.シンバスタチンの承認後の使用中に、次の追加の有害反応が確認されました:かゆみ、脱毛症、さまざまな皮膚の変化(結節、変色、皮膚/粘膜の乾燥、髪/爪の変化など)、めまい、筋肉のけいれん、筋肉痛、膵炎、感覚異常、末梢神経障害、嘔吐、貧血、勃起不全、間質性肺疾患、横紋筋融解症、肝炎/黄疸、致命的および非致命的な肝不全、およびうつ病。
スタチンの使用に関連する免疫介在性壊死性ミオパチーのまれな報告がある[参照 警告と注意事項 ]。
明らかな過敏症症候群がまれに報告されており、以下の特徴のいくつかが含まれています:アナフィラキシー、血管浮腫、ループス紅斑様症候群、リウマチ性多発筋痛症、皮膚筋炎、血管炎、紫斑病、血小板減少症、白血球減少症、溶血性貧血、陽性ANA、ESR増加、好酸球増加症、関節炎、関節痛、蕁麻疹、無力症、光線過敏症、発熱、悪寒、紅潮、倦怠感、呼吸困難、中毒性表皮壊死融解症、スティーブンス・ジョンソン症候群を含む多形紅斑。
スタチンの使用に関連する認知障害(例:記憶喪失、物忘れ、健忘症、記憶障害、錯乱)のまれな市販後報告がある。これらの認知の問題は、すべてのスタチンで報告されています。報告は一般に重篤ではなく、スタチンの中止により回復可能であり、症状の発症までの時間 (1 日から数年) と症状の消失 (中央値で 3 週間) はさまざまです。
薬物相互作用
強力な CYP3A4 阻害剤、シクロスポリン、またはダナゾール
強力な CYP3A4 阻害剤: シンバスタチンは、HMG-CoA レダクターゼの他のいくつかの阻害剤と同様に、CYP3A4 の基質です。シンバスタチンは CYP3A4 によって代謝されますが、CYP3A4 阻害活性はありません。したがって、CYP3A4 によって代謝される他の薬物の血漿中濃度に影響を与えるとは考えられません。
HMG-CoAレダクターゼ阻害活性の血漿レベルの上昇は、特にシンバスタチンの高用量で、ミオパシーおよび横紋筋融解症のリスクを高めます。 [見る 警告と注意事項 と 臨床薬理学 CYP3A4阻害作用が強いと表示されている薬剤との併用は禁忌です。 禁忌 ]。イトラコナゾール、ケトコナゾール、ポサコナゾール、ボリコナゾール、エリスロマイシン、クラリスロマイシン、またはテリスロマイシンによる治療が避けられない場合、治療中はシンバスタチンによる治療を中断する必要があります。
シクロスポリンまたはダナゾール:横紋筋融解症を含むミオパシーのリスクは、シクロスポリンまたはダナゾールの同時投与によって増加します。したがって、これらの薬物の併用は禁忌です[参照 禁忌 、 警告と注意事項 と 臨床薬理学 ]。
単独で投与するとミオパシーを引き起こす可能性のある脂質低下薬
ゲムフィブロジル
シンバスタチンとの禁忌[参照 禁忌 と 警告と注意事項 ]。
その他のフィブラート
シンバスタチンを処方するときは注意が必要です。 警告と注意事項 ]。
アミオダロン、ドロネダロン、ラノラジン、またはカルシウムチャネル遮断薬
横紋筋融解症を含むミオパシーのリスクは、アミオダロン、ドロネダロン、ラノラジン、またはベラパミル、ジルチアゼム、アムロジピンなどのカルシウムチャネル遮断薬の併用によって増加します[ 投薬と管理 と 警告と注意事項 、およびの表 3 臨床薬理学 ]。
ナイアシン
ミオパシー/横紋筋融解症の症例は、ナイアシン含有製品の脂質修飾用量 (≥1 g/日ナイアシン) と同時投与されたシンバスタチンで観察されています。ミオパチーのリスクは、中国人患者の方が高い。心血管疾患のリスクが高く、LDL-C 値が十分に管理されている患者を対象とした臨床試験 (追跡期間の中央値 3.9 年) では、エゼチミブ 10 mg/日を併用する場合と併用しない場合で、シンバスタチン 40 mg/日を投与した場合に増加する利益はありませんでした。ナイアシンの脂質修飾用量(≥1 g /日)の追加による心血管転帰。 ZOCOR とナイアシンの脂質修飾用量 (≥1 g/日) との同時投与は、中国人患者には推奨されません。このリスクが他のアジア人患者に当てはまるかどうかは不明です[参照 警告と注意事項 と 特定の集団での使用 ]。
ジゴキシン
ある研究では、ジゴキシンとシンバスタチンの併用投与により、血漿中のジゴキシン濃度がわずかに上昇しました。ジゴキシンを服用している患者は、シンバスタチンの開始時に適切に監視する必要があります[参照 臨床薬理学 ]。
クマリン抗凝固剤
つの臨床研究、1 つは正常なボランティア、もう 1 つは高コレステロール血症患者を対象としたもので、シンバスタチン 20 ~ 40 mg/日がクマリン抗凝固剤の効果をわずかに増強しました。ボランティア研究と患者研究では、それぞれ 1.8 から 2.6 から 3.4 です。他のスタチンでは、クマリン抗凝固剤を併用している少数の患者で、臨床的に明らかな出血および/またはプロトロンビン時間の増加が報告されています。そのような患者では、シンバスタチンを開始する前にプロトロンビン時間を測定し、早期治療中に十分な頻度で測定して、プロトロンビン時間の有意な変化が起こらないようにする必要があります。安定したプロトロンビン時間が記録されたら、クマリン抗凝固薬を服用している患者に通常推奨される間隔でプロトロンビン時間を監視できます。シンバスタチンの投与量を変更または中止した場合は、同じ手順を繰り返す必要があります。シンバスタチン療法は、抗凝固薬を服用していない患者の出血やプロトロンビン時間の変化とは関連していません。
コルヒチン
横紋筋融解症を含むミオパチーの症例は、シンバスタチンとコルヒチンの併用で報告されており、シンバスタチンとコルヒチンを処方する場合は注意が必要です。
ダプトマイシン
横紋筋融解症の症例は、ダプトマイシンと一緒に投与されたシンバスタチンで報告されています。シンバスタチンとダプトマイシンはどちらも、単独で投与するとミオパチーと横紋筋融解症を引き起こす可能性があり、ミオパシーと横紋筋融解症のリスクは併用投与によって増加する可能性があります。ダプトマイシンを服用している患者では、ZOCOR を一時的に中止する [参照 警告と注意事項 ]。
警告
の一部として含まれています "予防" セクション
予防
ミオパシー/横紋筋融解症
シンバスタチンは、筋肉痛、圧痛、またはクレアチンキナーゼ (CK) が正常上限 (ULN) の 10 倍を超える筋力低下として現れるミオパチーを引き起こすことがあります。ミオパシーは、ミオグロビン尿に続発する急性腎不全を伴うまたは伴わない横紋筋融解症の形をとることがあり、まれに死亡例が発生しています。ミオパシーのリスクは、シンバスタチンおよびシンバスタチン酸の血漿レベルの上昇によって増加します。ミオパシーの素因には、高齢 (65 歳以上)、女性、制御不能な甲状腺機能低下症、および腎障害が含まれます。中国人患者は、ミオパシーのリスクが高い可能性があります[参照 特定の集団での使用 ]。
横紋筋融解症を含むミオパシーのリスクは、用量に関連しています。 41,413 人の患者が ZOCOR 10mg で治療された臨床試験データベースでは、そのうち 24,747 人 (約 60%) が追跡調査の中央値 4 年以上の研究に登録され、ミオパシーの発生率は約 0.03% と 0.08% でした。それぞれ 20 および 40 mg/日で。 80 mg (0.61%) のミオパシーの発生率は、低用量で観察されたものよりも不釣り合いに高かった.これらの試験では、患者を注意深く監視し、相互作用のある医薬品を除外しました。
心筋梗塞の既往のある12,064人の患者がZOCORで治療された臨床試験(平均追跡期間6.7年)では、ミオパシー(原因不明の筋力低下または血清クレアチンキナーゼ[CK]による痛みとして定義される)の発生率が10倍以上正常値の上限 [ULN]) は、1 日 20 mg の患者の 0.02% と比較して、80 mg/日の患者の約 0.9% でした。横紋筋融解症(CK が ULN の 40 倍を超えるミオパシーと定義)の発生率は、80 mg/日を投与された患者では約 0.4% でしたが、20 mg/日を投与された患者では 0% でした。横紋筋融解症を含むミオパシーの発生率は、治療の最初の年に最も高く、その後の数年間で著しく減少しました。この試験では、患者を注意深く監視し、相互作用のある医薬品を除外しました。
横紋筋融解症を含むミオパシーのリスクは、シンバスタチン 80 mg を服用している患者で、LDL-C 低下効果が同等またはそれ以上の他のスタチン療法と比較して、またシンバスタチンの低用量と比較して、より高くなっています。したがって、ZOCOR の 80 mg 用量は、筋肉毒性の証拠がなく、シンバスタチン 80 mg を慢性的に (例えば、12 か月以上) 服用している入院患者にのみ使用する必要があります。 [見る 投薬と管理 、 80mgの制限された投薬 ]。 ただし、現在 80 mg の ZOCOR の用量に耐えている患者が、禁忌である、またはシンバスタチンの用量上限に関連する相互作用する薬剤を開始する必要がある場合、その患者は、より少ない可能性のある代替スタチンに切り替える必要があります。薬物間相互作用。患者は、横紋筋融解症を含むミオパチーのリスクが高いことを知らされ、説明のつかない筋肉の痛み、圧痛または筋力低下があれば速やかに報告する必要があります。症状が現れた場合は、直ちに治療を中止する必要があります。 [見る 免疫介在性壊死性ミオパチー ]
ZOCOR 20mg による治療を開始するすべての患者、または ZOCOR の用量を増量するすべての患者は、横紋筋融解症を含むミオパシーのリスクについて説明し、原因不明の筋肉痛、圧痛または筋力低下があれば、特に倦怠感または発熱を伴う場合、または筋肉の徴候がある場合は速やかに報告するように指示する必要があります。 ZOCORを中止しても症状が持続する。ミオパシーが診断または疑われる場合は、ZOCOR 療法を直ちに中止する必要があります。 ほとんどの場合、治療を速やかに中止すると、筋肉の症状と CK の増加が解消されました。 ZOCOR 5mg による治療を開始する患者、または用量を増やしている患者では、定期的な CK 測定を考慮することができますが、そのようなモニタリングがミオパシーを予防するという保証はありません。
シンバスタチンによる治療で横紋筋融解症を発症した患者の多くは、通常、長年にわたる真性糖尿病の結果としての腎不全を含む、複雑な病歴を持っています。そのような患者は、より綿密なモニタリングに値します。著しく上昇した CPK レベルが発生した場合、またはミオパチーが診断または疑われる場合は、ZOCOR 療法を中止する必要があります。横紋筋融解症(敗血症など)に続発する腎不全の発症の素因となる急性または重篤な状態を経験している患者では、ZOCOR 療法も一時的に控える必要があります。低血圧;主要な手術;外傷;重度の代謝、内分泌、または電解質障害;または制御されていないてんかん。
薬物相互作用
ミオパシーおよび横紋筋融解症のリスクは、シンバスタチンおよびシンバスタチン酸の血漿レベルの上昇によって増加します。シンバスタチンは、シトクロム P450 アイソフォーム 3A4 によって代謝されます。この代謝経路を阻害する特定の薬物は、シンバスタチンの血漿レベルを上昇させ、ミオパチーのリスクを高める可能性があります.これらには、イトラコナゾール、ケトコナゾール、ポサコナゾール、ボリコナゾール、マクロライド系抗生物質のエリスロマイシンとクラリスロマイシン、およびケトライド系抗生物質のテリスロマイシン、HIV プロテアーゼ阻害剤、ボセプレビル、テラプレビル、抗うつ薬のネファゾドン、コビシスタット含有製品、またはグレープフルーツ ジュースが含まれます。 臨床薬理学 ]。これらの薬とシンバスタチンの併用は禁忌です。強力な CYP3A4 阻害剤による短期間の治療が避けられない場合、治療期間中はシンバスタチンによる治療を中断する必要があります [ 禁忌 と 薬物相互作用 ]。
シンバスタチンとゲムフィブロジル、シクロスポリン、またはダナゾールとの併用は禁忌です[ 禁忌 と 薬物相互作用 ]。
シンバスタチンと一緒に他のフィブラート系薬剤を処方する場合は注意が必要です。これらの薬剤は、単独で投与するとミオパチーを引き起こす可能性があり、併用するとリスクが高まるためです。 薬物相互作用 ]。
横紋筋融解症を含むミオパチーの症例は、シンバスタチンとコルヒチンの併用で報告されており、シンバスタチンとコルヒチンを処方する場合は注意が必要です[ 薬物相互作用 ]。
シンバスタチンと次の薬剤との併用の利点は、併用の潜在的なリスクと比較して慎重に検討する必要があります:またはラノラジン [参照 投薬と管理 、 薬物相互作用 ]。
横紋筋融解症を含むミオパシーの症例は、ナイアシン含有製品の脂質修飾用量 (≥1 g/日ナイアシン) と同時投与されたシンバスタチンで観察されています [ 薬物相互作用 ]。
横紋筋融解症の症例は、ダプトマイシンと一緒に投与されたシンバスタチンで報告されています。ダプトマイシンを服用している患者では、ZOCOR を一時的に中止する [参照 薬物相互作用 ]。
相互作用する薬剤の処方に関する推奨事項を表 1 にまとめています [以下も参照してください]。 投薬と管理 、 薬物相互作用 、 臨床薬理学 ]。
免疫介在性壊死性ミオパチー
スタチンの使用に関連する自己免疫性ミオパシーである免疫介在性壊死性ミオパチー (IMNM) のまれな報告があります。 IMNM の特徴は次のとおりです。近位筋の筋力低下と血清クレアチンキナーゼの上昇。陽性の抗HMG CoAレダクターゼ抗体;壊死性ミオパシーを示す筋生検;免疫抑制剤で改善。追加の神経筋および血清学的検査が必要になる場合があります。免疫抑制剤による治療が必要な場合があります。別のスタチンを開始する前に、IMNM のリスクを慎重に検討してください。別のスタチンで治療を開始する場合は、IMNM の徴候と症状を監視します。
肝機能障害
血清トランスアミナーゼの持続的な増加 (ULN の 3 倍以上) は、臨床研究でシンバスタチンを投与された患者の約 1% で発生しています。 これらの患者で薬物治療が中断または中止されると、トランスアミナーゼのレベルは通常、治療前のレベルまでゆっくりと低下しました。この増加は、黄疸やその他の臨床徴候や症状とは関連していませんでした。過敏症の証拠はありませんでした。
Scandinavian Simvastatin Survival Study (4S) [参照 臨床研究 ]、研究の過程で ULN の 3 倍を超える 1 つ以上のトランスアミナーゼ上昇を示した患者の数は、シンバスタチン群とプラセボ群の間で有意差はありませんでした (14 [0.7%] 対 12 [0.6%])。トランスアミナーゼの上昇により、シンバスタチン群では 8 人の患者 (n=2,221)、プラセボ群では 5 人 (n=2,223) の患者が治療を中止しました。ベースラインで正常な肝機能検査 (LFT) を有する 4S のシンバスタチン治療患者 1,986 人のうち、8 人 (0.4%) が ULN の 3 倍を超える連続した LFT 上昇を発症し、および/または 5.4 年間 (追跡調査の中央値) の間にトランスアミナーゼ上昇のために中止されました。 )研究の。これらの 8 人の患者のうち、5 人は最初の 1 年以内にこれらの異常を最初に発症しました。この研究のすべての患者は、20 mg のシンバスタチンの開始用量を受け取りました。 37% が 40 mg に滴定されました。
1,105 人の患者を対象とした 2 つの対照臨床研究では、薬物関係に関係なく持続的な肝トランスアミナーゼ上昇の 12 か月の発生率は、40 mg および 80 mg の用量でそれぞれ 0.9% および 2.1% でした。所定の用量での治療の最初の 6 か月後に持続的な肝機能異常を発症した患者はいなかった。
肝機能検査は、治療開始前に実施することをお勧めします。 シンバスタチンを含むスタチンを服用している患者の致命的および非致命的な肝不全のまれな市販後の報告がありました. ZOCOR 5mgによる治療中に臨床症状を伴う重篤な肝障害および/または高ビリルビン血症または黄疸が発生した場合は、直ちに治療を中断してください。別の病因が見つからない場合は、ZOCOR を再起動しないでください。 ALT は筋肉から発生する可能性があるため、CK とともに上昇する ALT はミオパシーを示している可能性があることに注意してください [ ミオパシー/横紋筋融解症 ]。
この薬は、相当量のアルコールを摂取している患者、および/または過去に肝疾患の病歴がある患者には注意して使用する必要があります。活動性肝疾患または原因不明のトランスアミナーゼ上昇は、シンバスタチンの使用に対する禁忌です。
シンバスタチンによる治療後、血清トランスアミナーゼの中程度の (ULN の 3 倍未満) 上昇が報告されています。これらの変化は、シンバスタチンによる治療の開始後すぐに現れ、多くの場合一過性であり、症状を伴わず、治療の中断を必要としませんでした.
内分泌機能
ZOCORを含むHMG-CoAレダクターゼ阻害剤により、HbA1cおよび空腹時血清グルコースレベルの増加が報告されています。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
72 週間の発がん性試験では、マウスに 25、100、および 400 mg/kg 体重のシンバスタチンを毎日投与した結果、平均血漿薬物レベルは、平均ヒト血漿薬物よりも約 1、4、および 8 倍高くなりました。 80mgの経口投与後のそれぞれのレベル(AUCに基づく総阻害活性として)。肝がんは、高用量群の雌と中用量および高用量群の雄で有意に増加し、雄の最大発生率は 90% でした。肝臓の腺腫の発生率は、中用量および高用量の雌で有意に増加しました。薬物治療は、中用量および高用量の雄および雌の肺腺腫の発生率も有意に増加させました。ハーダー腺 (げっ歯類の眼の腺) の腺腫は、コントロールよりも高用量マウスで有意に多かった。 25mg/kg/日で腫瘍形成効果の証拠は観察されなかった。
別の 92 週間の発がん性試験で、最大 25 mg/kg/日をマウスに投与したところ、腫瘍形成効果の証拠は観察されませんでした (平均血漿薬物レベルは、AUC で測定した 80 mg シンバスタチンを投与されたヒトよりも 1 倍高かった)。
25 mg/kg/日のラットでの 2 年間の研究では、80 mg のシンバスタチンを投与されたヒトよりも約 11 倍高いレベルのシンバスタチンに曝露されたメスのラットで、甲状腺濾胞腺腫の発生率が統計的に有意に増加しました。 AUCで測定)。
50 および 100 mg/kg/日の用量での 2 年間のラット発がん性試験では、肝細胞腺腫および肝細胞癌が発生しました (雌ラットでは両用量で、雄ラットでは 100 mg/kg/日で)。両方の用量で雌雄で甲状腺濾胞細胞腺腫が増加した。 100mg/kg/日の雌で甲状腺濾胞細胞癌が増加した。甲状腺腫瘍の発生率の増加は、他のスタチンによる所見と一致しているようです。これらの治療レベルは、80ミリグラムの毎日の投与後の平均ヒト血漿薬物曝露の約7および15倍(男性)および22および25倍(女性)の血漿薬物レベル(AUC)を表しています。
ラットまたはマウスの肝臓代謝活性化の有無にかかわらず、微生物変異原性 (Ames) 試験では、変異原性の証拠は観察されませんでした。さらに、ラット肝細胞を用いた in vitro アルカリ溶出試験、V-79 哺乳動物細胞前方突然変異試験、CHO 細胞を用いた in vitro 染色体異常試験、または in vivo 染色体異常試験において、遺伝物質への損傷の証拠は認められませんでした。マウスの骨髄で。
25 mg/kg 体重のシンバスタチンを 34 週間投与した雄ラットでは、受胎能が低下しました (80 mg/日を投与された患者の AUC に基づく最大ヒト暴露レベルの 4 倍)。しかし、この効果は、シンバスタチンがこの同じ用量レベルで雄ラットに 11 週間投与されたその後の受胎能研究では観察されませんでした (精巣上体成熟を含む精子形成の全サイクル)。どちらの研究からも、ラットの精巣に微視的な変化は観察されませんでした。 180 mg/kg/日 (表面積 mg/m2 に基づいて 80 mg/日を摂取するヒトの暴露レベルの 22 倍の暴露レベルを生成) で、精細管変性 (壊死および精子形成上皮の喪失) が観察されました。イヌでは、薬物関連の精巣萎縮、精子形成の減少、精母細胞変性および巨細胞形成が 10 mg/kg/日で見られた (AUC に基づくと、80 mg/日でのヒト暴露の約 2 倍)。これらの所見の臨床的意義は不明です。
特定の集団での使用
妊娠
妊娠カテゴリーX [参照 禁忌 ]
ZOCOR は、妊娠中または妊娠する可能性のある女性には禁忌です。正常な胎児の発育にはコレステロールおよびコレステロール誘導体が必要であるため、脂質低下薬は妊娠中には効果がありません。アテローム性動脈硬化は慢性的なプロセスであり、妊娠中の脂質低下薬の中止は、一次高コレステロール血症治療の長期転帰にほとんど影響を与えないはずです.妊娠中の ZOCOR の使用に関する十分に管理された研究はありません。ただし、子宮内でスタチンにさらされた乳児の先天異常のまれな報告があります。ラットおよびウサギにおけるシンバスタチンの動物生殖研究では、催奇形性の証拠は示されませんでした。血清コレステロールとトリグリセリドは正常な妊娠中に増加し、コレステロールまたはコレステロール誘導体は胎児の発育に不可欠です。スタチンはコレステロール合成を減少させ、おそらくコレステロール由来の他の生物活性物質の合成を減少させるため、ZOCOR を妊婦に投与すると胎児に害を及ぼす可能性があります。妊娠中に ZOCOR 5mg を使用する場合、または患者がこの薬を服用中に妊娠した場合、患者は胎児への潜在的な危険性について知らされるべきです。
スタチンへの子宮内暴露後の先天異常のまれな報告があります。シンバスタチンまたは別の構造的に関連するスタチンに暴露された女性の妊娠を前向きに追跡した約 100 人のレビュー 2 では、先天異常、自然流産、および胎児死亡/死産の発生率は、一般集団で予想されるものを超えませんでした。しかし、この研究では、バックグラウンド率よりも3倍から4倍高い先天性異常のリスクを除外することしかできませんでした.これらの症例の 89% で、薬物治療は妊娠前に開始され、妊娠が確認された最初の妊娠中に中止されました。
シンバスタチンは、mg/m2 表面積に基づくヒトの暴露の 3 倍になる用量 (それぞれ 25、10 mg/kg/日) で、ラットまたはウサギにおいて催奇形性を示さなかった。ただし、別の構造的に関連するスタチンを使用した研究では、ラットとマウスで骨格奇形が観察されました。
Manson、JM、Freysinges、C.、Ducrocq、MB、Stephenson、WP、妊娠中のロバスタチンおよびシンバスタチン暴露の市販後調査、生殖毒性学、10(6):439-446、1996。
脂質障害のためにZOCOR 5mgによる治療を必要とする出産の可能性のある女性は、効果的な避妊法を使用するようにアドバイスされるべきです.妊娠を希望している女性は、ZOCOR の中止を検討する必要があります。妊娠が発生した場合、ZOCOR は直ちに中止する必要があります。
授乳中の母親
シンバスタチンが母乳中に排泄されるかどうかは不明です。このクラスの別の薬物は母乳中に少量排泄されるため、授乳中の乳児に深刻な副作用が生じる可能性があるため、シンバスタチンを服用している女性は乳児を授乳してはなりません。母親にとっての薬物の重要性を考慮して、授乳を中止するか薬物を中止するかを決定する必要があります。 禁忌 ]。
小児用
ヘテロ接合性家族性高コレステロール血症の 10 ~ 17 歳の患者におけるシンバスタチンの安全性と有効性は、思春期の男子および初経後 1 年以上の女子を対象とした対照臨床試験で評価されています。シンバスタチンで治療された患者は、プラセボで治療された患者と同様の有害反応プロファイルを示しました. この集団では、40 mg を超える用量は研究されていません。 この限定された対照研究では、思春期の男の子または女の子の成長または性成熟、または女の子の月経周期に有意な影響はありませんでした. [見る 投薬と管理 、 有害反応 、 臨床研究 思春期の女性は、シンバスタチン療法を受けている間、適切な避妊法についてカウンセリングを受ける必要があります [参照 禁忌 と 妊娠 ]。シンバスタチンは、10 歳未満の患者や初潮前の女児では研究されていません。
高齢者の使用
第 III 相臨床試験で ZOCOR 5mg を投与された 2,423 人の患者と、ZOCOR 40mg を投与された Heart Protection Study の 10,269 人の患者のうち、それぞれ 363 人 (15%) と 5,366 人 (52%) が 65 歳以上でした。 HPS では、615 人 (6%) が 75 歳以上でした。これらの被験者と若い被験者の間で安全性または有効性の全体的な違いは観察されず、他の報告された臨床経験では、高齢者と若い患者の間の反応の違いは確認されていませんが、一部の高齢者の感度が高いことは除外できません.高齢(65歳以上)はミオパシーの素因となるため、ZOCORは高齢者には慎重に処方する必要があります。 [見る 臨床薬理学 ]
シンバスタチンの薬物動態研究では、スタチン活性の平均血漿レベルが、18~30 歳の患者と比較して 70~78 歳の高齢患者で約 45% 高いことが示されました。 4S では、4,444 人の患者のうち 1,021 人 (23%) が 65 歳以上でした。脂質低下効果は、若年患者と比較して高齢患者で少なくとも同程度であり、ZOCORはCHDの既往歴のある高齢患者の総死亡率とCHD死亡率を大幅に減少させました. HPS では、患者の 52% が高齢者でした (4,891 人の患者が 65 ~ 69 歳、5,806 人の患者が 70 歳以上)。冠動脈疾患による死亡、非致死性心筋梗塞、冠動脈および非冠動脈血行再建術、脳卒中の相対リスク低下は、年配の患者と若い患者で同様であった[参照 臨床研究 ]。 HPS では、アクティブな慣らし期間に入る 32,145 人の患者のうち、ミオパシー/横紋筋融解症の 2 例がありました。これらの患者は 67 歳と 73 歳であった。 4SまたはHPSのいずれかの若い患者。
高齢(65 歳以上)は横紋筋融解症を含むミオパシーの素因となるため、ゾコール 40mg は高齢者には慎重に処方する必要があります。シンバスタチン 80 mg/日で治療された患者の臨床試験では、65 歳以上の患者は、65 歳未満の患者と比較して、横紋筋融解症を含むミオパシーのリスクが増加しました。 [見る 警告と注意事項 と 臨床薬理学 ]
腎障害
重度の腎機能障害のある患者にゾコール 20mg を投与する場合は注意が必要です。 投薬と管理 ]
肝障害
ZOCOR 10mg は、肝トランスアミナーゼレベルの原因不明の持続的な上昇を含む可能性のある活動性肝疾患の患者には禁忌です [参照 禁忌 と 警告と注意事項 ]。
中国人患者
心血管疾患のリスクが高い患者がシンバスタチン 40 mg/日で治療された臨床試験 (追跡期間の中央値 3.9 年) では、ミオパシーの発生率は非中国人患者 (n=7367) で約 0.05% であり、中国人患者の場合は 0.24% (n=5468)。シンバスタチン 40 mg/日またはエゼチミブ/シンバスタチン 10/40 mg/日を徐放性ナイアシン 2 g/日と併用投与した中国人患者のミオパシーの発生率は 1.24% でした。
中国人患者はミオパシーのリスクが高い可能性があるため、患者を適切に監視してください。 ZOCOR 10mg とナイアシン含有製品の脂質修飾用量 (≥1 g/日ナイアシン) との同時投与は、中国人患者には推奨されません [ 警告と注意事項 、 薬物相互作用 ]。
過剰摂取
g/m2 の単回経口投与後、マウスに有意な致死率が観察されました。それぞれ 30 および 100 g/m2 の用量で処理されたラットまたはイヌでは、致死の証拠は観察されませんでした。げっ歯類では、特定の診断的徴候は観察されませんでした。これらの用量で犬に見られた唯一の兆候は、嘔吐と粘液便でした.
ZOCOR の過剰摂取の事例がいくつか報告されています。服用した最大用量は3.6gでした。すべての患者は後遺症なく回復しました。過剰摂取の場合は、支持的な措置を講じる必要があります。ヒトにおけるシンバスタチンおよびその代謝産物の透析性は、現在知られていない.
禁忌
ZOCOR 40mg は、次の条件では禁忌です。
- 強力なCYP3A4阻害剤(例、イトラコナゾール、ケトコナゾール、ポサコナゾール、ボリコナゾール、HIVプロテアーゼ阻害剤、ボセプレビル、テラプレビル、エリスロマイシン、クラリスロマイシン、テリスロマイシン、ネファゾドン、およびコビシスタット含有製品)の併用投与[ 警告と注意事項 ]。
- ゲムフィブロジル、シクロスポリン、またはダナゾールの同時投与 [参照 警告と注意事項 ]。
- この薬の成分に対する過敏症[参照 有害反応 ]。
- 肝トランスアミナーゼレベルの原因不明の持続的上昇を含む活動性肝疾患[参照 警告と注意事項 ]。
- 妊娠中または妊娠の可能性がある女性。血清コレステロールとトリグリセリドは正常な妊娠中に増加し、コレステロールまたはコレステロール誘導体は胎児の発育に不可欠です。 HMG-CoAレダクターゼ阻害剤(スタチン)はコレステロール合成を減少させ、おそらくコレステロールに由来する他の生物活性物質の合成を減少させるため、ZOCOR 40mgを妊婦に投与すると胎児に害を及ぼす可能性があります.アテローム性動脈硬化は慢性的なプロセスであり、妊娠中の脂質低下薬の中止は、原発性高コレステロール血症の長期治療の結果にほとんど影響を与えないはずです.妊娠中の ZOCOR の使用に関する十分に管理された研究はありません。ただし、まれな報告では、スタチンへの子宮内曝露後に先天異常が観察されました。ラットおよびウサギの動物繁殖研究では、シンバスタチンは催奇形性の証拠を示さなかった。 ZOCOR は、出産可能年齢の女性が妊娠する可能性が非常に低い場合にのみ投与する必要があります。 この薬を服用中に患者が妊娠した場合は、ZOCOR を直ちに中止し、胎児への潜在的な危険性について患者に通知する必要があります。 特定の集団での使用 ]。
- 授乳中の母親。シンバスタチンが母乳に排泄されるかどうかは不明です。ただし、このクラスの別の薬物の少量は母乳に移行します。スタチンは授乳中の乳児に重篤な副作用を引き起こす可能性があるため、ZOCOR による治療が必要な女性は乳児に母乳を与えないでください [参照 特定の集団での使用 ]。
臨床薬理学
作用機序
シンバスタチンはプロドラッグであり、投与後、その活性なβ-ヒドロキシ酸の形態であるシンバスタチン酸に加水分解されます。シンバスタチンは、3-ヒドロキシ-3-メチルグルタリル-コエンザイム A (HMG-CoA) レダクターゼの特異的阻害剤であり、HMG-CoA からメバロン酸への変換を触媒する酵素であり、コレステロールの生合成経路における初期の律速段階です。さらに、シンバスタチンは VLDL と TG を減少させ、HDL-C を増加させます。
薬力学
疫学的研究は、総 C 値、LDL-C 値の上昇、および HDL-C 値の低下が、アテローム性動脈硬化症の発症および心血管リスクの増加と関連していることを示しています。 LDL-C を下げると、このリスクが減少します。ただし、HDL-C の上昇または TG の低下が、冠動脈および心血管の罹患率と死亡率のリスクに及ぼす独立した効果は特定されていません。
薬物動態
シンバスタチンは、HMG-CoAレダクターゼの強力な阻害剤である対応するβ-ヒドロキシ酸にin vivoで容易に加水分解されるラクトンです。 HMG-CoAレダクターゼの阻害は、シンバスタチン投与後の血漿中のβ-ヒドロキシ酸代謝産物(活性阻害剤)、および塩基加水分解後の活性阻害剤と潜在阻害剤(総阻害剤)の薬物動態研究におけるアッセイの基礎です。
14C 標識シンバスタチンをヒトに経口投与した後、投与量の 13% が尿中に、60% が糞中に排泄された。総放射能(シンバスタチンと 14C 代謝物)の血漿中濃度は、投与後 4 時間でピークに達し、投与後 12 時間までにピークの約 10% まで急速に低下しました。シンバスタチンは肝臓で大量の初回通過抽出を受けるため、全身循環への薬物の利用可能性は低くなります (
シンバスタチンとそのβ-ヒドロキシ酸代謝物の両方が、ヒト血漿タンパク質に高度に結合しています (約 95%)。ラットの研究では、放射性標識シンバスタチンを投与すると、シンバスタチン由来の放射能が血液脳関門を通過したことが示されています。
ヒト血漿中に存在するシンバスタチンの主な活性代謝物は、シンバスタチンの β-ヒドロキシ酸と、その 6'-ヒドロキシ、6'-ヒドロキシメチル、および 6'-エキソメチレン誘導体です。活性阻害剤と全阻害剤の両方のピーク血漿濃度は、投与後 1.3 ~ 2.4 時間以内に達成されました。推奨される治療用量範囲は 5 ~ 40 mg/日ですが、用量を 120 mg まで増やしても、全身循環における阻害剤の AUC の直線性からの実質的な逸脱はありませんでした。アメリカ心臓協会が推奨する低脂肪食の直前にシンバスタチンを投与した場合、絶食状態と比較して、インヒビターの血漿プロファイルは影響を受けませんでした。
ZOCOR 40 mg/日を投与された 70 ~ 78 歳の 16 人の高齢患者を含む研究では、HMG-CoA レダクターゼ阻害活性の平均血漿レベルは、18 ~ 30 歳の 18 人の患者と比較して約 45% 増加しました。高齢者 (n=1522) の臨床研究の経験は、高齢者と若年患者の間で安全性に全体的な違いがなかったことを示唆しています [参照 特定の集団での使用 ]。
同様の主な消失経路を持つ別のスタチンを用いた速度論的研究は、特定の用量レベルで、重度の腎機能不全の患者でより高い全身曝露が達成される可能性があることを示唆しています(クレアチニンクリアランスで測定).
シンバスタチン酸は、輸送タンパク質 OATP1B1 の基質です。輸送タンパク質 OATP1B1 の阻害剤である医薬品の併用投与は、シンバスタチン酸の血漿濃度の増加とミオパシーのリスクの増加につながる可能性があります。たとえば、シクロスポリンはスタチンの AUC を増加させることが示されています。メカニズムは完全には理解されていませんが、シンバスタチン酸の AUC の増加は、部分的には CYP3A4 および/または OATP1B1 の阻害によるものと考えられます。
ミオパシーのリスクは、血漿中の高レベルの HMG-CoA レダクターゼ阻害活性によって増加します。 CYP3A4 の阻害剤は、HMG-CoA レダクターゼ阻害活性の血漿レベルを上昇させ、ミオパシーのリスクを高める可能性があります [参照 警告と注意事項 と 薬物相互作用 ]。
12 人の健康なボランティアを対象とした研究では、80 mg の用量のシンバスタチンは、プローブ シトクロム P450 アイソフォーム 3A4 (CYP3A4) 基質であるミダゾラムとエリスロマイシンの代謝に影響を与えませんでした。これは、シンバスタチンが CYP3A4 の阻害剤ではないことを示しており、したがって、CYP3A4 によって代謝される他の薬物の血漿レベルに影響を与えるとは予想されません。
シンバスタチンの同時投与 (40 mg QD を 10 日間) により、心臓活性ジゴキシン (10 日目に 0.4 mg を 1 回投与) の最大平均レベルが約 0.3 ng/mL 増加しました。
動物毒物学および/または薬理学
中枢神経系毒性
視神経変性は、臨床的に正常な犬に 180 mg/kg/日のシンバスタチンを 14 週間投与した場合に見られ、平均血漿薬物レベルは、80 mg/日を摂取したヒトの平均血漿薬物レベルの約 12 倍高くなりました。
このクラスの化学的に類似した薬物は、臨床的に正常な犬において、60 mg/kg/日から用量依存的に視神経変性 (網膜原線維のワラー変性) を引き起こしました。最高推奨用量を服用しているヒトの平均血漿薬物レベルよりも高い値です (総酵素阻害活性によって測定)。この同じ薬物は、180 mg/kg/日で 14 週間治療された犬で、前庭内耳のウォーラー様変性と網膜神経節細胞の色素溶解も引き起こしました。日用量。
平均的な血漿を生成する用量である 360 mg/kg/日の用量のシンバスタチンを投与したイヌでは、血管周囲出血および浮腫、血管周囲腔への単核細胞浸潤、血管周囲フィブリン沈着および小血管の壊死を特徴とする CNS 血管病変が見られた。これは、1 日 80 mg を摂取したヒトの平均血漿薬物レベルの約 14 倍の薬物レベルでした。同様の CNS 血管病変が、このクラスの他のいくつかの薬剤で観察されています。
50 および 100 mg/kg/日 (それぞれ 80 mg/kg でヒト AUC の 22 倍および 25 倍) を 2 年間投与した雌ラットと、90 mg/kg/日を 3 か月投与したイヌで白内障が発生しました ( 19 回) および 50 mg/kg/日で 2 年 (5 回)。
臨床研究
成人における臨床研究
CHD死亡率および心血管イベントのリスクの低減
4Sでは、総死亡率に対するZOCOR 20mgによる治療の効果が、ベースライン総コレステロール212~309 mg/dL (5.5~8.0 mmol/L)のCHD患者4,444人で評価されました。この多施設、無作為化、二重盲検、プラセボ対照試験では、患者は食事療法を含む標準治療と、ゾコール 20~40 mg/日 (n=2,221) またはプラセボ (n=2,223) のいずれかで中央期間治療されました。 5.4年。研究の過程で、ZOCORによる治療により、総C、LDL-C、およびTGがそれぞれ25%、35%、および10%減少し、HDL-Cが8%増加しました. ZOCOR は、死亡リスクを 30% 大幅に減少させました (p=0.0003、ZOCOR 40mg 群の 182 人の死亡に対して、プラセボ群の 256 人の死亡)。 CHD による死亡のリスクは 42% 大幅に減少しました (p=0.00001、111 対 189 の死亡)。非心血管死亡率では、グループ間に統計的に有意な差はありませんでした。 ZOCOR は、主要な冠動脈イベント (CHD による死亡率と、病院で確認された無症状の非致死性心筋梗塞 [MI]) の発生リスクを 34% 大幅に減少させました (p
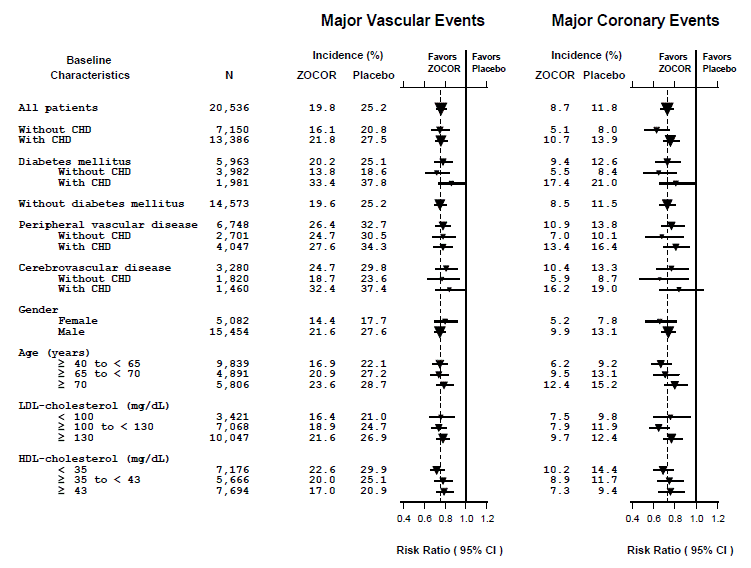
Heart Protection Study (HPS) は、20,536 人の患者 (10,269 人が ZOCOR 40 mg で、10,267 人が ZOCOR 40 mg で、10,267 人がプラセボで) を対象に実施された平均期間 5 年間の大規模な多施設プラセボ対照二重盲検試験でした。患者は、すでに登録されている患者の 10 の重要なベースライン特性の分布を考慮し、グループ間でのこれらの特性の不均衡を最小限に抑える共変量適応法 3 を使用して治療に割り当てられました。患者の平均年齢は 64 歳 (40 ~ 80 歳の範囲) で、97% が白人であり、CHD (65%)、糖尿病 (2 型、26%、1 型、3%)、脳卒中または他の脳血管疾患の病歴(16%)、末梢血管疾患(33%)、または65歳以上の男性の高血圧(6%)。ベースラインでは、3,421 人の患者 (17%) の LDL-C レベルが 100 mg/dL 未満で、そのうち 953 人 (5%) の LDL-C レベルが 80 mg/dL 未満でした。 7,068 人の患者 (34%) のレベルは 100 ~ 130 mg/dL でした。 10,047 人の患者 (49%) が 130 mg/dL を超えていました。
DR Taves、最小化: 患者を治療群と対照群に割り当てる新しい方法。クリン。薬理学。そこ。 15 (1974), pp. 443-453
HPS の結果は、ZOCOR 40 mg/日が大幅に減少したことを示しました。総死亡率と CHD 死亡率。非致死性心筋梗塞、脳卒中、および血行再建術(冠動脈および非冠動脈)(表 4 を参照)。
ベースライン特性の範囲全体で相対的なリスク低減を評価するのに十分なイベントを得るために、2 つの複合エンドポイントが定義されました (図 1 を参照)。主要な冠動脈イベント (MCE) の複合は、CHD 死亡率と非致命的心筋梗塞で構成されていました (最初のイベントまでの時間で分析; ZOCOR 5 mg で治療された 898 人の患者にイベントがあり、プラセボの患者 1,212 人にイベントがありました)。主要血管イベント (MVE) の複合は、MCE、脳卒中、および冠動脈、末梢およびその他の非冠動脈処置を含む血行再建処置で構成されました (最初のイベントまでの時間で分析; ZOCOR 10 mg で治療された 2,033 人の患者にイベントが発生し、2,585 人の患者が治療を受けました)。プラセボにはイベントがありました)。両方の複合エンドポイントで有意な相対リスクの低下が観察されました (MCE で 27%、MVE で 24%、p
図 1 HPS における主要な血管イベントおよび主要な冠動脈イベントに対する ZOCOR 5mg による治療の効果
血管造影検査
多施設抗アテローム研究では、アテローム性動脈硬化症に対するシンバスタチンの効果が、CHD の高コレステロール血症患者の定量的冠動脈造影法によって評価されました。この無作為二重盲検対照試験では、患者はシンバスタチン 20 mg/日またはプラセボで治療されました。血管造影は、ベースライン、2年および4年で評価されました。主要な研究のエンドポイントは、患者ごとの最小および平均管腔直径の平均変化であり、それぞれ局所およびびまん性疾患を示しています。 ZOCOR は、4 年目の血管造影図で測定されたように、両方のパラメーターと直径狭窄率の変化によって、病変の進行を大幅に遅らせました。さらに、シンバスタチンは、新しい病変および新しい完全閉塞を伴う患者の割合を大幅に減少させました。
脂質プロファイルの変更
原発性高脂血症(フレドリクソンIIa型およびIIb型)
ZOCOR は、ヘテロ接合型の家族性および非家族性高脂血症、および混合性高脂血症において、総 C および LDL-C を減少させるのに有効であることが示されています。最大からほぼ最大の応答は、一般に 4 ~ 6 週間以内に達成され、慢性治療中も維持されます。 ZOCOR は総 C、LDL-C、総 C/HDL-C 比、および LDL-C/HDL-C 比を有意に減少させました。 ZOCOR はまた、TG を減少させ、HDL-C を増加させました (表 5 を参照)。
高トリグリセリド血症(フレドリクソン IV 型)
130 人の患者、二重盲検、プラセボ対照、3 期間のクロスオーバー研究からの IV 型高脂血症の 74 人の患者におけるサブグループ分析の結果を表 6 に示します。
異常βリポタンパク血症(フレドリクソンIII型)
130 人の患者、二重盲検、プラセボ対照、3 期間のクロスオーバー研究からの III 型高脂血症 (dysbetalipoproteinemia) (apo E2/2) (VLDL-C/TG>0.25) の 7 人の患者におけるサブグループ分析の結果表 7 に示します。
ホモ接合型家族性高コレステロール血症
対照臨床研究では、ホモ接合型家族性高コレステロール血症の 15 歳から 39 歳の 12 人の患者が、シンバスタチン 40 mg/日を 1 回または 3 回に分けて、または 80 mg/日を 3 回に分けて投与されました。 LDL-C が減少した 11 人の患者では、40 mg および 80 mg の用量での平均 LDL-C 変化は 14% (範囲 8% から 23%、中央値 12%) および 30% (範囲 14% から 46%) でした。 、中央値 29%)、それぞれ。 1 人の患者は、LDL-C が 15% 増加しました。 LDL-C 受容体機能がない別の患者は、80 mg の用量で LDL-C が 41% 減少しました。
内分泌機能
臨床研究では、シンバスタチンは副腎予備能を損なうことも、基礎血漿コルチゾール濃度を大幅に低下させることもありませんでした.男性の基礎血漿テストステロンのベースラインからのわずかな減少が、シンバスタチンを用いた臨床研究で観察されました。この効果は、他のスタチンおよび胆汁酸捕捉剤コレスチラミンでも観察されました.血漿ゴナドトロピンレベルには影響がありませんでした。プラセボ対照の 12 週間の研究では、ヒト絨毛性ゴナドトロピンに対する血漿テストステロン応答に対するシンバスタチン 80 mg の有意な効果はありませんでした。別の 24 週間の研究では、シンバスタチン 20 ~ 40 mg は精子形成に検出可能な影響を与えませんでした。 4,444 人の患者がシンバスタチン 20-40 mg/日またはプラセボに無作為に割り付けられ、期間の中央値が 5.4 年であった 4S では、2 つの治療群における男性の性的有害事象の発生率に有意差はありませんでした。これらの要因により、血漿テストステロンのわずかな変化が臨床的に重要であるとは考えにくい.閉経前の女性の下垂体 - 性腺軸への影響があるとしても、その影響は不明です。
青少年の臨床研究
二重盲検プラセボ対照研究では、ヘテロ接合体家族性高コレステロール血症 (HeFH) の 175 人の患者 (99 人の思春期の男児と 76 人の初潮後の女児) 10 ~ 17 歳 (平均年齢 14.1 歳) がシンバスタチンに無作為に割り付けられました (n= 106) またはプラセボ (n=67) を 24 週間 (基本研究)。この研究に含めるには、ベースラインの LDL-C レベルが 160 ~ 400 mg/dL であり、LDL-C レベルが 189 mg/dL を超える親が少なくとも 1 人必要でした。シンバスタチンの投与量 (1 日 1 回夕方) は、最初の 8 週間は 10 mg、次の 8 週間は 20 mg、その後は 40 mg でした。 24 週間の延長で、144 人の患者がシンバスタチン 40 mg またはプラセボによる治療の継続を選択しました。
ZOCOR 20mg は、total-C、LDL-C、および Apo B の血漿レベルを有意に低下させました (表 8 を参照)。 48 週での延長の結果は、基礎試験で観察された結果と同等でした。
24週間の治療後、達成された平均LDL-C値は、207.8mg/dL(範囲:128.0-334.0mg/dL)と比較して、ZOCOR 40mg群では124.9mg/dL(範囲:64.0289.0mg/dL)でした。プラセボ群で。
1 日 40 mg を超える用量の安全性と有効性は、HeFH の子供では研究されていません。成人期の罹患率と死亡率を低下させる小児期のシンバスタチン療法の長期的な有効性は確立されていません。
患者情報
患者には、National Cholesterol Education Program (NCEP) が推奨する食事、定期的な運動プログラム、空腹時脂質パネルの定期的な検査を順守するようにアドバイスする必要があります。
シンバスタチンと同時に服用してはならない物質について、患者に助言する必要があります。 [見る 禁忌 と 警告と注意事項 ]。 患者は、新しい薬を処方している、または既存の薬の用量を増やしている他の医療専門家に、ZOCOR を服用していることを知らせるようにアドバイスする必要があります。
筋肉痛
ZOCOR による治療を開始するすべての患者は、横紋筋融解症を含むミオパシーのリスクについて助言を受け、特に倦怠感や発熱を伴う場合、または ZOCOR の中止後もこれらの筋肉の徴候や症状が続く場合は、説明のつかない筋肉の痛み、圧痛、または脱力感を速やかに報告するように指示する必要があります。 80 mg の用量を使用している患者には、80 mg の用量を使用すると、横紋筋融解症を含むミオパチーのリスクが高まることを知らせる必要があります。 横紋筋融解症を含むミオパシーのリスクは、特定の種類の薬を服用したり、グレープフルーツ ジュースを摂取したりすると、ZOCOR 40mg の使用で発生します。患者は、処方薬と店頭販売の両方のすべての薬について、医療専門家と話し合う必要があります。
肝酵素
ZOCOR 20mg の開始前、およびその後臨床的に必要な場合は、肝機能検査を実施することをお勧めします。 ZOCOR で治療を受けたすべての患者は、疲労、食欲不振、右上腹部の不快感、暗色尿、黄疸など、肝臓の損傷を示す可能性のある症状があれば、速やかに報告するようにアドバイスする必要があります。
妊娠
妊娠可能な年齢の女性は、ZOCOR を使用している間、効果的な避妊法を使用して妊娠を防ぐようにアドバイスする必要があります。将来の妊娠計画について患者と話し合い、妊娠を希望している場合は ZOCOR 40mg の服用を中止する時期について話し合ってください。患者は、妊娠した場合は ZOCOR の使用を中止し、医療専門家に連絡するようにアドバイスする必要があります。
母乳育児
授乳中の女性は ZOCOR を使用しないでください。脂質障害があり、授乳中の患者には、医療専門家と選択肢について話し合うようにアドバイスする必要があります。
