Tricor 160mg, 200mg Fenofibrate 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Tricor とは何ですか?また、どのように使用されますか?
Tricor は、血液中のコレステロールとトリグリセリド (脂肪酸) の症状を軽減するために使用される処方薬です。 Tricor は、単独で使用することも、他の薬と併用することもできます。
- Tricor は、Fibric Acid Agents と呼ばれる薬物のクラスに属します。
- Tricor 200mgが子供に安全で効果があるかどうかはわかっていません
Tricor の考えられる副作用は何ですか?
Tricor 200mg は、次のような重大な副作用を引き起こす可能性があります。
- 背中や肩甲骨に広がる鋭い胃の痛み、
- 食欲減少、
- 食事をした直後の胃の痛み.
- 皮膚や目の黄変(黄疸)、
- 熱、
- 寒気、
- 弱点、
- 喉の痛み、
- 口内炎、
- 異常なあざや出血、
- 胸痛、
- 突然の咳、
- 喘鳴、
- 速い呼吸、
- 喀血、そして
- 腕や脚の腫れ、熱感、発赤
上記の症状がある場合は、すぐに医療機関を受診してください。
Tricor の最も一般的な副作用は次のとおりです。
- 鼻水が出る、
- くしゃみ、そして
- 異常な臨床検査
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは Tricor の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
TRICOR (フェノフィブラート錠) は、経口投与用の錠剤として入手できる脂質調節剤です。各錠剤には 54 mg または 160 mg のフェノフィブラートが含まれています。フェノフィブラートの化学名は、2-[4-(4-クロロベンゾイル) フェノキシ]-2-メチル-プロパン酸、1-メチルエチル エステルで、次の構造式を持ちます。
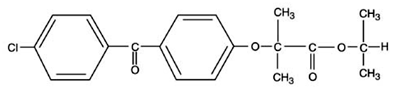
実験式は C20H21O4Cl で、分子量は 360.83 です。フェノフィブラートは水に溶けません。融点は79~82℃です。フェノフィブラートは、通常の条件下では安定な白色の固体です。
不活性成分
各錠剤には、コロイド状二酸化ケイ素、クロスポビドン、ラクトース一水和物、レシチン、微結晶性セルロース、ポリビニル アルコール、ポビドン、ラウリル硫酸ナトリウム、フマル酸ステアリル ナトリウム、タルク、二酸化チタン、およびキサンタンガムが含まれています。さらに、54 mg の個々の錠剤には、D&C 黄色 10 号、FD&C 黄色 6 号、FD&C 青色 2 号が含まれています。
適応症
原発性高コレステロール血症または混合性脂質異常症
TRICOR は、低密度リポタンパク質コレステロール (LDL-C)、総コレステロール (Total-C)、トリグリセリドおよびアポリポタンパク質 B (Apo B) の上昇を減らし、高密度リポタンパク質コレステロール (HDL- C) 原発性高コレステロール血症または混合性脂質異常症の成人患者。
重度の高トリグリセリド血症
TRICOR 200mg は、重度の高トリグリセリド血症の成人患者の治療のための食事補助療法としても適応されます。空腹時カイロミクロン血症を示す糖尿病患者の血糖コントロールを改善すると、通常、薬理学的介入の必要がなくなります。
血清トリグリセリドのレベルが著しく上昇すると(例:> 2,000 mg/dL)、膵炎を発症するリスクが高まる可能性があります。このリスクの軽減に対するフェノフィブラート療法の効果は、十分に研究されていません。
使用上の重要な制限
145 mg の TRICOR に相当する用量のフェノフィブラートは、2 型糖尿病患者を対象とした大規模な無作為対照試験で、冠状動脈性心疾患の罹患率と死亡率を低下させることが示されませんでした [ 警告と注意事項 ]。
投薬と管理
一般的な考慮事項
患者は、TRICOR 160mg を投与される前に適切な脂質低下食を摂取する必要があり、TRICOR による治療中もこの食事を継続する必要があります。 TRICOR 錠は食事に関係なく投与できます。
脂質異常症の初期治療は、リポタンパク質異常のタイプに特化した食事療法です。過剰な体重と過剰なアルコール摂取は、高トリグリセリド血症の重要な要因である可能性があり、薬物療法の前に対処する必要があります.身体運動は、重要な補助的手段になり得ます。甲状腺機能低下症や真性糖尿病など、高脂血症の一因となる疾患を探し、適切に治療する必要があります。エストロゲン療法、サイアザイド利尿薬、およびベータ遮断薬は、特に家族性高トリグリセリド血症の被験者において、血漿トリグリセリドの大幅な上昇と関連することがあります.そのような場合、特定の病因物質の中止により、高トリグリセリド血症の特定の薬物療法の必要性がなくなる可能性があります。
脂質レベルは定期的に監視する必要があり、脂質レベルが目標範囲を大幅に下回る場合は、TRICOR の投与量を減らすことを検討する必要があります。
日 1 回の最大推奨用量 145 mg で 2 か月の治療を行っても十分な反応が得られない患者では、治療を中止する必要があります。
原発性高コレステロール血症または混合性脂質異常症
トリコール 200mg の初回投与量は、1 日 1 回 145mg です。
重度の高トリグリセリド血症
初回投与量は 1 日 48 ~ 145 mg です。投与量は患者の反応に応じて個別化する必要があり、必要に応じて、4 ~ 8 週間間隔で脂質測定を繰り返した後に調整する必要があります。最大用量は 1 日 1 回 145 mg です。
腎機能障害
TRICOR 200mg による治療は、腎機能が軽度から中等度に障害されている患者では、1 日あたり 48mg の用量で開始し、この用量での腎機能および脂質レベルへの影響を評価した後にのみ増量する必要があります。重度の腎機能障害のある患者では、TRICOR の使用を避ける必要があります。 特定の集団での使用 と 臨床薬理学 ]。
高齢患者
高齢者の用量選択は、腎機能に基づいて行われるべきである[参照 特定の集団での使用 ]。
供給方法
剤形と強度
- コード識別文字「FI」が刻印された48mgの黄色の錠剤。
- 48 mg の黄色の錠剤で、「a」のロゴとコード識別文字「FI」が刻印されています。
- コード識別文字「FO」が刻印された145mgの白い錠剤。
- 145 mg の白い錠剤で、「a」のロゴとコード識別文字「FO」が刻印されています。
保管と取り扱い
TRICOR®(フェノフィブラート錠) には、次の 2 つの強度があります。
48mg
コード識別文字「FI」が刻印された黄色の錠剤で、90 個入りのボトルで入手できます ( NDC 0074-3173-90)。
「a」のロゴとコード識別文字「FI」が刻印された黄色の錠剤で、90 個入りのボトルで入手できます ( NDC 0074-6122-90)。
145mg
コード識別文字「FO」が刻印された白色の錠剤で、90 個入りのボトルで入手できます ( NDC 0074-3189-90)。
「a」のロゴとコード識別文字「FO」が刻印された白色の錠剤で、90 個入りのボトルで入手できます ( NDC 0074-6123-90)。
保管所
25°C (77°F) で保管してください。 15 ~ 30°C (59 ~ 86°F) まで許容されるエクスカーション。
[USP 制御室温を参照]。子供の手の届かないところに保管してください。湿気から保護してください。
AbbVie Inc., North Chicago, IL 60064, USA のために、Fournier Laboratories Ireland Limited, Anngrove, Carrigtwohill Co. Cork, Ireland によって製造されています。改訂:2021年3月
副作用
次の重篤な副作用は、以下およびラベルの他の場所に記載されています。
- 死亡率および冠動脈疾患の罹患率 [参照 警告と注意事項 ]
- 肝毒性 [参照 警告と注意事項 ]
- 膵炎 [参照 警告と注意事項 ]
- 過敏反応 [参照 警告と注意事項 ]
- 静脈血栓塞栓症 [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用の発生率を別の医薬品の臨床試験で観察された発生率と直接比較することはできず、実際に観察された発生率を反映していない可能性があります。
因果関係に関係なく、二重盲検プラセボ対照試験中にフェノフィブラートで治療された(およびプラセボよりも多い)患者の2%以上によって報告された有害事象を以下の表1に示します。有害事象により、フェノフィブラートで治療された患者の 5.0%、プラセボで治療された患者の 3.0% で治療が中止されました。肝機能検査の増加が最も頻繁なイベントであり、二重盲検試験で 1.6% の患者でフェノフィブラート治療の中止を引き起こしました。
対照試験では、蕁麻疹はフェノフィブラート患者とプラセボ患者のそれぞれ 1.1% 対 0% で、発疹は 1.4% 対 0.8% で見られました。
肝臓酵素の増加
10件のプラセボ対照試験の併合解析では、フェノフィブラートを毎日96mgから145mgのTRICORに相当する用量で服用している患者の5.3%でALTが正常上限の3倍以上に増加したのに対し、プラセボで治療された患者の1.1%で発生した[見る 警告と注意事項 ]。 8 週間の研究では、ALT または AST の上昇が正常上限の 3 倍以上になる発生率は、1 日 96 mg ~ 145 mg の TRICOR に相当する用量を投与された患者では 13% であり、48 mg に相当する用量を投与された患者では 0% でした。毎日TRICOR以下またはプラセボ。
市販後の経験
フェノフィブラートの承認後の使用中に、以下の副作用が確認されています。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません: 筋肉痛、横紋筋融解症、膵炎、急性腎不全、筋肉痙攣、肝炎、肝硬変、増加総ビリルビン、貧血、関節痛、ヘモグロビンの減少、ヘマトクリットの減少、白血球の減少、無力症、HDL-コレステロール値の大幅な低下、および間質性肺疾患。開始後数日から数ヶ月で光線過敏反応が起こる。これらのケースのいくつかでは、患者はケトプロフェンに対する以前の光過敏反応を報告しました。
薬物相互作用
クマリン抗凝固剤
PT/INR の延長に伴い、クマリン型の抗凝固効果の増強が観察されています。
クマリン抗凝固剤をTRICORと併用する場合は注意が必要です。抗凝固薬の投与量を減らして、PT/INR を望ましいレベルに維持し、出血の合併症を防ぐ必要があります。 PT/INR が安定したと明確に判断されるまで、PT/INR を頻繁に測定することをお勧めします。 警告と注意事項 ]。
免疫抑制剤
シクロスポリンやタクロリムスなどの免疫抑制剤は、クレアチニンクリアランスの低下や血清クレアチニンの上昇を伴う腎毒性を引き起こす可能性があり、TRICOR を含むフィブラート系薬剤は腎排泄が主な消失経路であるため、相互作用により腎機能が低下するリスクがあります。 TRICOR (フェノフィブラート錠) を免疫抑制剤やその他の潜在的に腎毒性のある薬剤と一緒に使用することの利点とリスクを慎重に検討し、最低有効用量を採用し、腎機能を監視する必要があります。
胆汁酸結合樹脂
胆汁酸結合レジンは同時に投与される他の薬剤と結合する可能性があるため、胆汁酸結合レジンの吸収を妨げないように、患者は胆汁酸結合レジンの少なくとも 1 時間前または 4 ~ 6 時間後に TRICOR 200mg を服用する必要があります。
コルヒチン
横紋筋融解症を含むミオパシーの症例は、コルヒチンと併用投与されたフェノフィブラートで報告されており、フェノフィブラートとコルヒチンを処方する場合は注意が必要です。
警告
の一部として含まれています 予防 セクション。
予防
死亡率と冠動脈疾患の罹患率
冠状動脈性心疾患の罹患率と死亡率、および非心血管死亡率に対するTRICOR 160mgの効果は確立されていません。
糖尿病脂質における心血管リスクを制御するためのアクション(ACCORD Lipid)試験は、フェノフィブラートで治療された背景スタチン療法を受けている 2 型糖尿病患者 5,518 人の無作為化プラセボ対照試験でした。追跡調査の平均期間は 4.7 年でした。フェノフィブラートとスタチンの併用療法は、致命的ではない心筋梗塞、致命的ではない脳卒中、および心血管疾患による死亡の複合である主要な有害心血管イベント (MACE) の主要転帰において、有意ではない 8% の相対リスクの減少を示しました (ハザード比 [ HR] 0.92、95% CI 0.79-1.08) (p=0.32) スタチン単剤療法と比較。性別サブグループ分析では、併用療法を受けた男性とスタチン単剤療法の MACE のハザード比は 0.82 (95% CI 0.69-0.99) であり、併用療法とスタチン単剤療法を受けた女性の MACE のハザード比は 1.38 (95% CI 95% CI) でした。 0.98-1.94) (相互作用 p=0.01)。このサブグループ所見の臨床的意義は不明です。
Fenofibrate Intervention and Event Lowering in Diabetes (FIELD) 研究は、フェノフィブラートで治療された 2 型糖尿病患者 9795 人を対象とした 5 年間の無作為化プラセボ対照研究でした。フェノフィブラートは、冠状動脈性心疾患イベントの一次転帰を有意ではないが 11% 減少させ (ハザード比 [HR] 0.89、95% CI 0.75-1.05、p=0.16)、二次転帰全体を有意に 11% 減少させた。心血管疾患イベント (HR 0.89 [0.80-0.99]、p=0.04)。フェノフィブラートにより、総死亡率と冠状動脈性心疾患死亡率がそれぞれ 11% (HR 1.11 [0.95, 1.29], p=0.18) および 19% (HR 1.19 [0.90, 1.57], p=0.22) 増加しましたが、有意ではありませんでした。プラセボと比較して。
TRICOR (フェノフィブラート錠)、クロフィブラート、およびゲムフィブロジルの間の化学的、薬理学的、および臨床的類似性のため、これらの他のフィブラート薬を使用した 4 つの大規模な無作為化プラセボ対照臨床研究における有害な発見は、TRICOR にも当てはまる可能性があります。
クロフィブラートで 5 年間治療された患者の心筋梗塞後の大規模研究である冠動脈疾患治療プロジェクトでは、クロフィブラート群とプラセボ群の間で死亡率に差は見られませんでした。しかし、手術を必要とする胆石症と胆嚢炎の発生率には、2 つのグループ間で差がありました (3.0% 対 1.8%)。
世界保健機関 (WHO) が実施した研究では、既知の冠動脈疾患のない 5,000 人の被験者がプラセボまたはクロフィブラートで 5 年間治療され、さらに 1 年間追跡されました。クロフィブラート群では、プラセボ群と比較して統計的に有意な、より高い年齢調整済み全死因死亡率がありました (5.70% 対 3.96%、p =
Helsinki Heart Study は、冠動脈疾患の病歴のない中年男性を対象とした大規模な (n=4081) 研究でした。被験者はプラセボまたはゲムフィブロジルのいずれかを 5 年間投与され、その後 3.5 年間の開放延長が行われました。総死亡率は、ゲムフィブロジル無作為化グループで数値的に高かったが、統計的有意性は得られなかった (p = 0.19、相対リスク G:P = .91-1.64 の 95% 信頼区間)。がんによる死亡はゲムフィブロジル群でより高い傾向にありましたが (p = 0.11)、がん (基底細胞がんを除く) は両方の研究グループで同じ頻度で診断されました。研究の規模が限られているため、原因を問わない死亡の相対リスクは、世界保健機関の研究からの 9 年間の追跡データで見られたものと変わらないことが示されました (RR=1.29)。
Helsinki Heart Study の二次予防コンポーネントには、冠状動脈性心臓病が既知または疑われるために一次予防研究から除外された中年男性が登録されました。被験者はゲムフィブロジルまたはプラセボを 5 年間投与されました。心臓死はゲムフィブロジル群でより高い傾向にありましたが、これは統計的に有意ではありませんでした (ハザード比 2.2、95% 信頼区間: 0.94-5.05)。胆嚢手術の割合は、研究グループ間で統計的に有意ではありませんでしたが、ゲムフィブロジル グループでより高い傾向がありました (1.9% 対 0.3%、p = 0.07)。
肝毒性
肝移植や死亡を含む重篤な薬物性肝障害 (DILI) は、TRICOR の市販後に報告されています。 DILIは、治療の最初の数週間以内または治療の数ヶ月後に報告されており、場合によってはTRICOR 200mg治療の中止で回復しました. DILI 患者は、暗色尿、異常な便、黄疸、倦怠感、腹痛、筋肉痛、体重減少、掻痒、吐き気などの徴候や症状を経験しています。多くの患者で、総ビリルビン、血清アラニントランスアミナーゼ (ALT)、およびアスパラギン酸トランスアミナーゼ (AST) が同時に上昇していました。 DILI は、肝細胞性肝炎、慢性活動性肝炎、胆汁うっ滞性肝炎として特徴付けられており、慢性活動性肝炎に関連して肝硬変が発生しています。
臨床試験では、毎日96mgから145mgのTRICOR 160mgに相当する用量のフェノフィブラートは、血清ASTまたはALTの増加と関連しています。トランスアミナーゼの増加の発生率は、用量に関連している可能性があります[参照 有害反応 ]。
TRICOR 160mg は、原発性胆汁性肝硬変および原因不明の持続性肝機能異常を有する患者を含む、活動性肝疾患を有する患者には禁忌です。 禁忌 ]。患者の肝機能 (血清 ALT、AST、総ビリルビンなど) を、ベースライン時および TRICOR による治療期間中定期的に監視します。肝障害の徴候または症状が現れた場合、または酵素レベルの上昇が持続する場合 (ALT または AST が正常上限の 3 倍を超える場合、またはビリルビンの上昇を伴う場合)、TRICOR 200mg を中止してください。肝障害の別の説明がない場合は、これらの患者にTRICOR 160mgを再開しないでください.
ミオパチーと横紋筋融解症
フィブラートはミオパシーのリスクを高め、横紋筋融解症と関連しています。深刻な筋肉毒性のリスクは、高齢者や糖尿病、腎不全、または甲状腺機能低下症の患者で増加するようです.
びまん性筋肉痛、筋肉の圧痛または衰弱、および/またはクレアチンホスホキナーゼ (CPK) レベルの著しい上昇を伴う患者では、ミオパシーを考慮する必要があります。
患者は、特に倦怠感や発熱を伴う場合、原因不明の筋肉痛、圧痛、脱力感を速やかに報告するようにアドバイスされるべきです。これらの症状を報告している患者ではCPKレベルを評価する必要があり、CPKレベルが著しく上昇した場合、またはミオパチー/筋炎が疑われるか診断された場合は、TRICOR 200mgの治療を中止する必要があります.
観察研究のデータは、フィブラート系薬剤、特にゲムフィブロジルをスタチンと併用すると、横紋筋融解症のリスクが高まることを示しています。脂質レベルのさらなる変化の利点が、この薬物の組み合わせによるリスクの増加を上回る可能性がない限り、この組み合わせは避けるべきです[ 臨床薬理学 ]。
横紋筋融解症を含むミオパチーの症例は、コルヒチンと併用投与されたフェノフィブラートで報告されており、フェノフィブラートとコルヒチンを処方する場合は注意が必要です[ 薬物相互作用 ]。
セラム・クレアチン
フェノフィブラートを服用している患者では、血清クレアチニンの上昇が報告されています。これらの上昇は、フェノフィブラートの中止後にベースラインに戻る傾向があります。これらの観察結果の臨床的意義は不明です。 TRICOR を服用している腎機能障害患者の腎機能を監視します。高齢者や糖尿病患者など、腎不全のリスクがあるTRICORを服用している患者についても、腎モニタリングを検討する必要があります。
胆石症
フェノフィブラートは、クロフィブラートやゲムフィブロジルと同様に、コレステロールの胆汁への排泄を増加させ、胆石症を引き起こす可能性があります。胆石症が疑われる場合は、胆嚢の検査が必要です。胆石が見つかった場合は、TRICOR 160mg 療法を中止する必要があります。

クマリン抗凝固剤
プロトロンビン時間/国際正規化比 (PT/INR) の延長におけるクマリン型抗凝固効果の増強のため、クマリン抗凝固剤を TRICOR 160mg と併用して投与する場合は注意が必要です。出血性合併症を予防するために、PT/INR が安定するまで、PT/INR を頻繁にモニタリングし、抗凝固薬の用量を調整することが推奨されます。 薬物相互作用 ]。
膵炎
膵炎は、フェノフィブラート、ゲムフィブロジル、およびクロフィブラートを服用している患者で報告されています。この発生は、重度の高トリグリセリド血症、直接的な薬物効果、または総胆管の閉塞を伴う胆道結石またはスラッジ形成を介した二次現象を有する患者における有効性の失敗を表している可能性があります。
血液学的変化
フェノフィブラート療法開始後の患者では、ヘモグロビン、ヘマトクリット、白血球の軽度から中等度の減少が観察されています。ただし、これらのレベルは長期投与中に安定します。血小板減少症および無顆粒球症は、フェノフィブラートで治療された個人で報告されています。 TRICOR 投与の最初の 12 か月間は、赤血球数と白血球数を定期的にモニタリングすることをお勧めします。
過敏反応
急性過敏症
アナフィラキシーおよび血管性浮腫は、フェノフィブラートの市販後に報告されています。場合によっては、反応は生命を脅かし、緊急治療を必要としました。患者が急性過敏反応の徴候または症状を発症した場合は、直ちに医師の診察を受け、フェノフィブラートを中止するようアドバイスしてください。
遅発性過敏症
スティーブンス・ジョンソン症候群、中毒性表皮壊死融解症、および好酸球増加症および全身症状を伴う薬物反応 (DRESS) を含む重度の皮膚有害薬物反応 (SCAR) が市販後に報告されており、フェノフィブラートの開始から数日から数週間後に発生します。 DRESSの症例は、皮膚反応(発疹や剥脱性皮膚炎など)と、好酸球増加症、発熱、全身臓器障害(腎臓、肝臓、または呼吸器)の組み合わせに関連していました。 SCARが疑われる場合は、フェノフィブラートを中止し、患者を適切に治療してください。
静脈血栓塞栓症
FIELD 試験では、肺塞栓症 (PE) および深部静脈血栓症 (DVT) が、プラセボ治療群よりもフェノフィブラート群で高い割合で観察されました。 FIELD に登録された 9,795 人の患者のうち、4,900 人がプラセボ群に、4,895 人がフェノフィブラート群にいました。 DVT については、プラセボ群で 48 件 (1%)、フェノフィブラート群で 67 件 (1%) でした (p = 0.074)。 PE については、プラセボ群で 32 件 (0.7%)、フェノフィブラート群で 53 件 (1%) のイベントが発生しました (p = 0.022)。
冠動脈治療薬プロジェクトでは、クロフィブラート群のより高い割合が、プラセボ群よりも確実なまたは疑わしい致死的または非致死的な肺塞栓症または血栓性静脈炎を経験しました (5 年で 5.2% 対 3.3%; p
HDLコレステロール値の逆説的な減少
フィブラート療法を開始した糖尿病患者および非糖尿病患者で HDL コレステロール値が大幅に低下した (2 mg/dL 程度) という市販後および臨床試験の報告があります。 HDL-C の減少は、アポリポタンパク質 A1 の減少によって反映されます。この減少は、フィブラート療法の開始後 2 週間から数年以内に起こると報告されています。フィブラート療法が中止されるまで、HDL-C レベルは低下したままです。フィブラート療法の中止に対する反応は迅速かつ持続的です。この HDL-C の減少の臨床的意義は不明です。フィブラート療法開始後、最初の数ヶ月以内に HDL-C レベルをチェックすることをお勧めします。重度の HDL-C レベルの低下が検出された場合は、フィブラート療法を中止し、ベースラインに戻るまで HDL-C レベルを監視し、フィブラート療法を再開しないでください。
非臨床毒性学
発がんおよび突然変異誘発および生殖能力の障害
フェノフィブラートを使用したラットで 2 つの食事性発がん性試験が実施されました。最初の 24 か月の試験では、Wistar ラットにフェノフィブラートを 10、45、および 200 mg/kg/日で投与しました。これは、1 日あたりフェノフィブラート 300 mg の最大推奨用量 (MRHD) の約 0.3、1、および 6 倍であり、145 に相当します。 mg TRICOR 160mg を毎日、体表面積の比較に基づきます。 200 mg/kg/日 (MRHD の 6 倍) の用量で、肝癌の発生率は男女とも有意に増加しました。 MRHD の 1 倍と 6 倍の男性では、膵臓癌の統計的に有意な増加が観察されました。膵臓腺腫と良性の精巣間質細胞腫瘍の増加は、男性の MRHD の 6 倍で観察されました。別の系統のラット (Sprague-Dawley) における 2 回目の 24 か月ラット発がん性試験では、10 および 60 mg/kg/日 (MRHD の 0.3 倍および 2 倍) の用量で膵腺房腺腫の発生率が有意に増加しました。 MRHDの2倍で男性の精巣間質細胞腫瘍が増加します。
ラットで 117 週間の発がん性試験が実施され、次の 3 つの薬剤が比較されました。ゲムフィブロジル (250 mg/kg/日; mg/m² 表面積に基づくヒト用量の 2 倍)。フェノフィブラートは、男女ともに膵腺房腺腫を増加させた。クロフィブラートは、男性では肝細胞癌および膵腺房腺腫を増加させ、女性では肝腫瘍性結節を増加させた。ゲムフィブロジルは、男性と女性で肝腫瘍性結節を増加させましたが、3 つの薬剤はすべて、男性で精巣間質細胞腫瘍を増加させました。
CF-1 マウスでの 21 か月の研究では、フェノフィブラート 10、45、および 200 mg/kg/日 (体表面積の比較に基づいて、MRHD の約 0.2、1、および 3 倍) は、両方のマウスで肝臓癌を有意に増加させました。 MRHDの3倍の性別。 10、60、および 200 mg/kg/日での 2 番目の 18 か月の研究では、フェノフィブラートは MRHD の 3 倍で雄マウスの肝臓癌および雌マウスの肝臓腺腫を有意に増加させました。
電子顕微鏡研究は、ラットへのフェノフィブラート投与後のペルオキシソームの増殖を示しています。ヒトにおけるペルオキシソームの増殖をテストするための十分な研究は行われていませんが、同じ個体での治療前後の肝生検を比較すると、フィブラート クラスの他のメンバーによる治療後のヒトでペルオキシソームの形態と数の変化が観察されています。
フェノフィブラートは、次の試験で変異原性の可能性がないことが実証されています:エイムズ、マウスリンパ腫、染色体異常、初代ラット肝細胞における不定期 DNA 合成。
生殖能力試験では、ラットにフェノフィブラートを経口食餌投与し、オスは交配の 61 日前に、メスは交配の 15 日前に離乳を通じて投与されました。 MRHD、体表面積の比較に基づく)。
特定の集団での使用
妊娠
リスクの概要
妊娠中の女性におけるフェノフィブラートの使用に関する限られた利用可能なデータは、主要な先天性欠損症、流産、または母体または胎児の有害転帰の薬物関連リスクを決定するには不十分です。動物の繁殖研究では、器官形成期のラットとウサギにフェノフィブラートを体表面積に基づいて 1 日あたり 145 mg の最大推奨臨床用量 (mg/ ㎡)。母体毒性が存在する場合、より高い用量で生殖への有害転帰が発生した( データ )。潜在的な利益が胎児への潜在的なリスクを正当化する場合にのみ、TRICOR 200mg を妊娠中に使用する必要があります。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2 ~ 4% および 15 ~ 20% です。
データ
動物データ
器官形成期の妊娠 6 ~ 15 日目から 14、127、および 361 mg/kg/日の経口混餌用量を与えられた妊娠ラットでは、14 mg/kg/日 (臨床暴露量よりも少ない) で有害な発生所見は観察されませんでした。体表面積の比較に基づいて、1 日あたり 145 mg の TRICOR に相当する、1 日あたり 300 mg のフェノフィブラートの最大推奨ヒト用量 [MRHD] で)。胎児の骨格奇形の増加は、母体の体重増加を有意に抑制した母体毒性用量 (361 mg/kg/日、MRHD での臨床暴露の 12 倍に相当) で観察された。
器官形成期の妊娠 618 日目から 15、150、300 mg/kg/日を強制経口投与した妊娠ウサギにおいて、15 mg/kg/日 (体表面積の比較に基づいて、MRHD での臨床曝露を概算します)。母体の体重増加を抑制する母体毒性用量 (MRHD での臨床曝露の 10 倍以上に相当する 150 mg/kg/日以上) で流産した同腹仔が観察された。
妊娠 15 日目から授乳 21 日目 (離乳期) まで 15、75、および 300 mg/kg/日の経口混餌用量を与えられた妊娠ラットでは、15 mg/kg/日 (臨床暴露量よりも少ない) で有害な発生影響は観察されませんでした。母体毒性(体重増加の減少)にもかかわらず、MRHDで、体表面積の比較に基づく)。母体毒性 (体重増加の減少) の存在下で、75 mg/kg/日以上 (MRHD での臨床曝露の 2 倍以上) で移植後の損失が観察されました。 300 mg/kg/日 (MRHD での臨床曝露の 10 倍) で子犬の生存率の低下が認められ、これは母体の体重増加の減少/母体の無視と関連していた。
授乳
リスクの概要
母乳中のフェノフィブラートの存在、授乳中の乳児に対する薬剤の影響、または乳生産への影響に関する入手可能な情報はありません。フェノフィブラートはラットの乳に存在するため、ヒトの乳に存在する可能性が高い.乳児の脂質代謝の混乱など、母乳で育てられた乳児に深刻な有害反応が起こる可能性があるため、女性はTRICOR 200mgによる治療中および最終投与後5日間は母乳で育てるべきではありません。 禁忌 ]。
小児用
小児患者における安全性と有効性は確立されていません。
高齢者の使用
フェノフィブリン酸は腎臓から実質的に排泄されることが知られており、腎機能が低下している患者では、この薬剤に対する副作用のリスクが高くなる可能性があります。フェノフィブリン酸への曝露は年齢による影響を受けません。高齢患者は腎機能障害の発生率が高いため、高齢者の用量選択は腎機能に基づいて行う必要があります[参照 投薬と管理 と 臨床薬理学 ]。腎機能が正常な高齢患者は、用量を変更する必要はありません。 TRICOR を服用している高齢患者の腎機能のモニタリングを検討してください。
腎障害
重度の腎機能障害のある患者では、TRICOR 160mg の使用を避ける必要があります。 禁忌 ]。軽度から中等度の腎障害のある患者では、減量が必要です。 投薬と管理 と 臨床薬理学 ]。腎障害のある患者では腎機能のモニタリングが推奨されます。
肝障害
TRICOR 200mg の使用は、肝障害のある被験者では評価されていません [参照 禁忌 と 臨床薬理学 ]。
過剰摂取
TRICOR の過剰摂取に対する特別な治療法はありません。過剰摂取が発生した場合は、バイタルサインの監視や臨床状態の観察など、患者の一般的な支持療法が必要です。必要に応じて、吸収されなかった薬物を嘔吐または胃洗浄によって除去する必要があります。気道を維持するために、通常の予防措置を講じる必要があります。フェノフィブリン酸は血漿タンパクとの結合が強いため、血液透析は考慮すべきではありません。
禁忌
TRICOR 200mg は以下の患者には禁忌です。
- 透析を受けている患者を含む、重度の腎機能障害のある患者 [参照 臨床薬理学 ]。
- 原発性胆汁性肝硬変および原因不明の持続性肝機能異常を有する患者を含む活動性肝疾患の患者[参照 警告と注意事項 ]。
- 既存の胆嚢疾患のある患者 [参照 警告と注意事項 ]。
- 授乳中の母親 [参照 特定の集団での使用 ]。
- フェノフィブラートまたはフェノフィブリン酸に対する既知の過敏症を有する患者 [参照 警告と注意事項 ]。
臨床薬理学
作用機序
TRICOR の活性部分はフェノフィブリン酸です。動物とヒトの両方におけるフェノフィブリン酸の薬理学的効果は、フェノフィブラートの経口投与を通じて広く研究されてきました。
臨床現場で見られるフェノフィブリン酸の脂質修飾効果は、ペルオキシソーム増殖因子活性化受容体α(PPARα)の活性化により、トランスジェニックマウスの in vivo およびヒト肝細胞培養の in vitro で説明されています。このメカニズムを通じて、フェノフィブラートは、リポタンパク質リパーゼを活性化し、アポタンパク質 C-III (リポタンパク質リパーゼ活性の阻害剤) の産生を減少させることにより、脂肪分解と血漿からのトリグリセリドに富む粒子の除去を増加させます。
結果として生じる TG の減少により、LDL のサイズと組成が、小さくて密な粒子 (酸化しやすいため、アテローム形成を引き起こすと考えられている) から、浮力のある大きな粒子に変化します。これらのより大きな粒子は、コレステロール受容体に対する親和性が高く、急速に異化されます。 PPARαの活性化は、アポリポタンパク質 AI、A-II、および HDL-コレステロールの合成の増加も誘導します。
フェノフィブラートはまた、尿酸の尿中排泄を増加させることにより、高尿酸血症および正常な個人の血清尿酸レベルを低下させます。
薬力学
さまざまな臨床研究により、LDL 膜複合体である総 C、LDL-C、およびアポ B のレベルの上昇が、ヒトのアテローム性動脈硬化症と関連していることが実証されています。同様に、HDL-C およびその輸送複合体であるアポリポプロテイン A (apo AI および apo AII) のレベルの低下は、アテローム性動脈硬化症の発症と関連しています。疫学的調査により、心血管疾患の罹患率と死亡率は、総 C、LDL-C、および TG のレベルによって直接変化し、HDL-C のレベルによって逆に変化することが確立されています。 HDL-C の上昇またはトリグリセリド (TG) の低下が、心血管疾患の罹患率および死亡率のリスクに及ぼす独立した効果は、特定されていません。
フェノフィブラートの活性代謝物であるフェノフィブリン酸は、治療を受けた患者の総コレステロール、LDL コレステロール、アポリポタンパク質 B、総トリグリセリド、およびトリグリセリド リッチ リポタンパク質 (VLDL) を減少させます。さらに、フェノフィブラートによる治療は、高密度リポタンパク質 (HDL) およびアポリポタンパク質 apoAI および apoAII の増加をもたらします。
薬物動態
3 つの 48 mg 錠剤または 1 つの 145 mg 錠剤の投与後のフェノフィブリン酸の血漿濃度は、摂食条件下で 1 つの 200 mg 微粉化フェノフィブラート カプセルと同等です。
フェノフィブラートは、活性化学部分フェノフィブリン酸のプロドラッグです。フェノフィブラートは、体内でエステル加水分解によってフェノフィブリン酸に変換されます。フェノフィブリン酸は、循環で測定可能な活性成分です。
吸収
フェノフィブラートの絶対的なバイオアベイラビリティは、化合物が注射に適した水性媒体に実質的に不溶であるため、決定できません。しかし、フェノフィブラートは消化管からよく吸収されます。健康なボランティアに経口投与した後、放射性標識フェノフィブラートの単回投与量の約 60% が、主にフェノフィブリン酸とそのグルクロン酸抱合体として尿中に現れ、25% が糞便中に排泄されました。フェノフィブリン酸のピーク血漿レベルは、投与後 6 ~ 8 時間以内に発生します。
Cmax および AUC によって測定される血漿中のフェノフィブリン酸への曝露は、145 mg の単回用量のフェノフィブラートが絶食下または非絶食下で投与された場合に有意差はありません。
分布
フェノフィブラートを複数回投与すると、フェノフィブリン酸は 9 日以内に定常状態に達します。定常状態でのフェノフィブリン酸の血漿濃度は、単回投与後の値の約 2 倍です。血清タンパク質結合は、正常および高脂血症の被験者で約 99% でした。
代謝
経口投与後、フェノフィブラートはエステラーゼによって活性代謝物であるフェノフィブリン酸に急速に加水分解されます。血漿中に未変化のフェノフィブラートは検出されません。
フェノフィブリン酸は主にグルクロン酸と結合し、尿中に排泄されます。少量のフェノフィブリン酸は、カルボニル部分でベンズヒドロール代謝産物に還元され、次にグルクロン酸と結合して尿中に排泄されます。
in vivo代謝データは、フェノフィブラートもフェノフィブリン酸も酸化的代謝(例えばシトクロムP450)をほとんど受けないことを示している。
排除
吸収後、フェノフィブラートは主に代謝産物、主にフェノフィブリン酸およびフェノフィブリン酸グルクロニドの形で尿中に排泄されます。放射性標識フェノフィブラートの投与後、投与量の約 60% が尿中に現れ、25% が糞便中に排泄されました。
フェノフィブリン酸は半減期 20 時間で消失するため、1 日 1 回の服用が可能です。
特別な集団
老年医学
77 ~ 87 歳の年配のボランティアでは、フェノフィブラートの単回経口投与後のフェノフィブリン酸の経口クリアランスは 1.2 L/h であり、これは若年成人の 1.1 L/h と比較されます。これは、薬物または代謝産物の蓄積を増加させることなく、腎機能が正常な高齢者でも同様の投与計画を使用できることを示しています。 投薬と管理 と 特定の集団での使用 ]。
小児科
TRICOR 160mg の薬物動態は、小児集団では研究されていません。
性別
フェノフィブラートについては、男性と女性の間で薬物動態の違いは観察されていません。
人種
フェノフィブラートの薬物動態に対する人種の影響は研究されていませんが、フェノフィブラートは民族間変動を示すことが知られている酵素によって代謝されません。
腎障害
フェノフィブリン酸の薬物動態は、軽度、中等度、および重度の腎障害を持つ患者で調べられました。重度の腎機能障害 (推定糸球体濾過率 [eGFR] 投薬と管理 ]。
肝障害
肝機能障害のある患者を対象とした薬物動態試験は実施されていません。
薬物間相互作用
ヒト肝ミクロソームを使用した in vitro 研究では、フェノフィブラートとフェノフィブリン酸はシトクロム (CYP) P450 アイソフォーム CYP3A4、CYP2D6、CYP2E1、または CYP1A2 の阻害剤ではないことが示されています。これらは、CYP2C8、CYP2C19、および CYP2A6 の弱い阻害剤であり、治療濃度で CYP2C9 の軽度から中等度の阻害剤です。
表 2 は、フェノフィブリン酸の全身曝露に対する同時投与薬物の影響を示しています。表 3 は、併用投与されたフェノフィブラートまたはフェノフィブリン酸が他の薬剤に及ぼす影響を示しています。
臨床研究
原発性高コレステロール血症(ヘテロ接合性家族性および非家族性)および混合性脂質異常症
日あたり 145 mg の TRICOR (フェノフィブラート錠剤) に相当する用量でのフェノフィブラートの効果は、次の平均ベースライン脂質値を持つ患者を含む 4 つの無作為化、プラセボ対照、二重盲検、並行群間研究から評価されました。 mg/dL; LDL-C 213.8mg/dL; HDL-C 52.3mg/dL;およびトリグリセリド 191.0 mg/dL。 TRICOR 200mg療法は、LDL-C、Total-C、およびLDL-C/HDL-C比を低下させました。 TRICOR 療法はまた、トリグリセリドを低下させ、HDL-C を上昇させました (表 4 を参照)。
被験者のサブセットでは、apo B の測定が行われました。 TRICOR 200mg 治療は、プラセボと比較して、ベースラインからエンドポイントまでアポ B を有意に減少させました (-25.1% 対 2.4%、p
重度の高トリグリセリド血症
血清トリグリセリドに対するフェノフィブラートの効果は、147 人の高トリグリセリド血症患者の 2 つの無作為二重盲検プラセボ対照臨床試験で研究されました。患者は、ベースライン TG レベルが 500 ~ 1500 mg/dL の患者と他の TG レベルが 350 ~ 500 mg/dL の患者を入力したことのみが異なるプロトコルの下で 8 週間治療を受けました。高カイロミクロン血症の有無にかかわらず、高トリグリセリド血症および正常なコレステロール血症の患者では、1日あたりTRICOR 145 mgに相当する用量のフェノフィブラートによる治療により、主に超低密度リポタンパク質(VLDL)トリグリセリドおよびVLDLコレステロールが減少しました。トリグリセリドが上昇した患者の治療は、しばしば LDL-C の上昇をもたらします (表 5 を参照)。
心血管疾患の罹患率と死亡率に対するTRICOR 160mgの効果は決定されていません。
患者情報
患者には次のことを助言する必要があります。
- TRICOR の潜在的な利点とリスクについて説明します。
- フェノフィブラートまたはフェノフィブリン酸に対する既知の過敏症がある場合は、TRICOR を使用しないでください。
- トリコールと併用してはいけない薬。
- 彼らがクマリン抗凝固剤を服用している場合、TRICOR 160mgは抗凝固効果を高める可能性があり、監視を強化する必要があるかもしれません.
- TRICOR を服用している間は、適切な脂質調節食を続けてください。
- TRICOR 160mg を 1 日 1 回、食事の有無にかかわらず、所定の用量を 1 錠丸ごと飲み込むこと。
- 定期的なモニタリングのために医師のオフィスに戻ります。
- 服用しているすべての薬、サプリメント、ハーブ製剤、および病状の変化を医師に知らせるため。患者はまた、新しい薬を処方する医師に、TRICOR を服用していることを知らせるようにアドバイスされるべきです。
- 肝障害の症状(黄疸、腹痛、吐き気、倦怠感、暗色尿、異常便、かゆみなど)を医師に知らせる。筋肉痛、圧痛、または衰弱;またはその他の新しい症状。
- TRICOR の投与中および最終投与後 5 日間は、授乳しないでください。
