Lopid 300mg Gemfibrozil 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Lopid 300mg とは何ですか? どのように使用されますか?
ロピッド (ゲムフィブロジル) は、膵炎患者の非常に高いコレステロールおよびトリグリセリド レベルを治療するために使用される脂質調節剤であり、また、高コレステロールおよびトリグリセリドを持つ人々の脳卒中、心臓発作、またはその他の心臓合併症のリスクを下げるために使用されます。他の治療法では助けられませんでした。 Lopid はジェネリック形式で入手できます。
Lopid 300mgの副作用は何ですか?
Lopid 300mg の一般的な副作用は次のとおりです。
- 胃の不調、
- 胃・腹痛、
- 吐き気、
- 嘔吐、
- 下痢、
- 頭痛、
- めまい、
- 眠気、
- 関節痛や筋肉痛、
- セックスへの興味の喪失、
- インポテンツ、
- オーガズムを持つのが難しい、
- しびれやチクチク感、
- 変わった味や
- 鼻づまり、くしゃみ、のどの痛みなどのかぜの症状。
Lopid 300mg は、まれに胆石や肝臓の問題を引き起こす可能性があります。
Lopid 300mg の次の可能性は低いが深刻な副作用に気付いた場合は、医師に相談してください。
- 重度の胃/腹痛、
- 持続的な吐き気や嘔吐、
- 目や皮膚の黄ばみ、および
- 暗い尿。
説明
LOPID® (ゲムフィブロジル錠剤、USP) は脂質調節剤です。経口投与用の錠剤として入手できます。各錠剤には600mgのゲムフィブロジルが含まれています。各錠剤には、ステアリン酸カルシウム、NFも含まれています。キャンデリラワックス、FCC;微結晶性セルロース、NF;ヒドロキシプロピルセルロース、NF;ヒプロメロース、USP;メチルパラベン、NF;オスプレーホワイト;ポリエチレングリコール、NF;ポリソルベート 80、NF;プロピルパラベン、NF;コロイド状二酸化ケイ素、NF; α化デンプン、NF。化学名は 5-(2,5-ジメチルフェノキシ)-2,2-ジメチルペンタン酸で、次の構造式を持ちます。
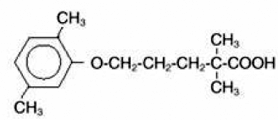
実験式は C15H22O3 で、分子量は 250.35 です。水と酸への溶解度は 0.0019% で、希塩基では 1% を超えます。融点は 58° ~ 61°C です。ゲムフィブロジルは、通常の条件下では安定な白色の固体です。
適応症
LOPID(ゲムフィブロジル錠剤、USP)は、以下の食事療法の補助療法として適応されます。
ベースラインでの HDL コレステロール値が中央値を超える (46.4 mg/dL を超える) ヘルシンキ心臓研究の患者のサブグループ分析では、重篤な冠動脈イベントの発生率は、ゲムフィブロジルとプラセボのサブグループで同様でした (表 I を参照)。
脂質異常症の初期治療は、リポタンパク質異常のタイプに特化した食事療法です。過剰な体重と過剰なアルコール摂取は、高トリグリセリド血症の重要な要因である可能性があり、薬物療法の前に管理する必要があります.運動は重要な補助的手段であり、HDL コレステロールの上昇と関連しています。甲状腺機能低下症や真性糖尿病などの高脂血症の一因となる疾患を探し、適切に治療する必要があります。エストロゲン療法は、特に家族性高トリグリセリド血症の被験者において、血漿トリグリセリドの大幅な上昇を伴うことがあります。このような場合、エストロゲン療法を中止すると、高トリグリセリド血症の特定の薬物療法の必要性がなくなる可能性があります。薬物の使用は、薬物を使用しない方法で満足のいく結果を得るために合理的な試みがなされた場合にのみ考慮する必要があります。薬物を使用する決定が下された場合、患者は、これによって食事療法を遵守することの重要性が低下しないことを説明する必要があります。
投薬と管理
成人の推奨用量は、朝夕の食事の30分前に1回1200mgを2回に分けて服用することです。 臨床薬理学 )。
供給方法
ロピッド (Tablet 737)、それぞれ 600 mg のゲムフィブロジルを含む白色の楕円形フィルム コーティング割線付き錠剤は、次のように入手できます。
NDC 0071-0737-20: 60本入 NDC 0071-0737-30:500本入
制御された室温 20° ~ 25°C (68° ~ 77°F) で保管してください [USP を参照]。光と湿気から保護してください。
Pfizer Inc, NY, NY 10017 の Parke-Davis Division によって配布されています。改訂: 2020 年 12 月
副作用
Helsinki Heart Studyの一次予防コンポーネントの二重盲検対照段階では、2046人の患者が最大5年間LOPIDを受けました。その研究では、LOPID グループの被験者では、以下の有害反応が統計的により頻繁に見られました。
胆嚢手術 LOPID 300mg の 0.9% とプラセボ被験者の 0.5% で一次予防コンポーネントで実施され、64% 過剰であり、WHO 研究のプラセボ群と比較してクロフィブラート群で観察された胆嚢手術の過剰と統計的に異ならない.胆嚢手術も、二次予防コンポーネントにおいて、プラセボ群と比較してLOPID群でより頻繁に実施された(1.9%対0.3%、p=0.07)。ゲムフィブロジル群における虫垂切除術の統計的に有意な増加は、二次予防コンポーネントでも見られました (ゲムフィブロジルで 6 対プラセボで 0、p=0.014)。
神経系および特殊感覚の有害反応は、LOPID 300mg 群でより一般的でした。これらには、感覚鈍麻、感覚異常、および味覚倒錯が含まれていました。その他、LOPID 300mg 投与群の被験者に多くみられたが、因果関係が確立されていない副作用として、白内障、末梢血管疾患、脳内出血が挙げられます。
他の研究から、LOPID 300mg が MUSCULOSKELETAL SYMPTOMS の発生と因果関係がある可能性が高いようです ( 警告 )、および異常な肝機能検査および血液学的変化(を参照) 予防 )。
ウイルスおよび細菌感染症(風邪、咳、尿路感染症)の報告は、805人の患者の他の対照臨床試験でゲムフィブロジル治療を受けた患者でより一般的でした.ゲムフィブロジルについて報告された追加の副作用は、システムごとに以下にリストされています。これらは、LOPID による治療との因果関係が確立されているか確立されていないかによって分類されます。
その他、胆嚢炎、胆石症などの副作用が報告されています。 (見る 警告 )。
薬物相互作用
HMG-CoAレダクターゼ阻害剤
シンバスタチンとのLOPID 300mgの同時投与は禁忌です( 禁忌 と 警告 )。 LOPID とロスバスタチンの併用は避けてください。併用が避けられない場合は、ロスバスタチン 5 mg を 1 日 1 回から開始してください。ロスバスタチンの用量は、1 日 1 回 10 mg を超えてはなりません。ミオパシーと横紋筋融解症のリスクは、ゲムフィブロジルと HMG-CoA レダクターゼ阻害剤療法を併用すると増加します。急性腎不全を伴うまたは伴わないミオパシーまたは横紋筋融解症は、併用療法の開始から 3 週間後または数か月後に早くも報告されています。 警告 )。クレアチンキナーゼの定期的なモニタリングが重度のミオパシーや腎臓の損傷の発生を防ぐという保証はありません.
抗凝固剤
ワルファリンをロピッドと併用する場合は注意が必要です。ワーファリンの投与量を減らして、プロトロンビン時間を望ましいレベルに維持し、出血の合併症を防ぐ必要があります。プロトロンビンレベルが安定したと明確に判断されるまでは、頻繁なプロトロンビン測定が推奨されます。
CYP2C8 基質
ゲムフィブロジルは CYP2C8 の強力な阻害剤であり、主に CYP2C8 によって代謝される薬物(例、ダブラフェニブ、エンザルタミド、ロペラミド、モンテルカスト、パクリタキセル、ピオグリタゾン、ロシグリタゾン)への暴露を増加させる可能性があります。したがって、ゲムフィブロジルを併用する場合は、主に CYP2C8 酵素によって代謝される薬物の減量が必要になる場合があります (以下を参照)。 警告 )。
レパグリニド
健康なボランティアでは、ゲムフィブロジル (600 mg を 1 日 2 回、3 日間) と同時投与すると、8.1 倍 (範囲 5.5 から 15.0 倍) 高いレパグリニド AUC および 28.6 倍 (範囲 18.5 から 80.1 倍) が得られました。レパグリニドの血漿中濃度は、投与から 7 時間後に上昇しました。同じ研究で、ゲムフィブロジル (600 mg を 1 日 2 回、3 日間) + イトラコナゾール (1 日目に朝 200 mg と夜に 100 mg、その後 2~3 日目に 100 mg を 1 日 2 回) を投与すると、19.4-(範囲12.9〜24.7倍)より高いレパグリニドAUCおよび70.4倍(範囲42.9〜119.2倍)より高いレパグリニド血漿濃度は、投与後7時間であった.さらに、ゲムフィブロジル単独またはゲムフィブロジル + イトラコナゾールは、レパグリニドの血糖降下作用を延長しました。ゲムフィブロジルとレパグリニドの同時投与は、重度の低血糖のリスクを高めるため、禁忌です( 禁忌 )。
ダサブビル
ゲムフィブロジルとダサブビルの同時投与は、CYP2C8 阻害により、ダサブビルの AUC と Cmax を増加させました (比率: それぞれ 11.3 と 2.01)。ダサブビルへの曝露が増えると QT 延長のリスクが高まる可能性があるため、ゲムフィブロジルとダサブビルの併用は禁忌です( 禁忌 )。
セレキシパグ
ゲムフィブロジルとセレキシパグの同時投与により、セレキシパグへの曝露が 2 倍になり、活性代謝物への曝露が約 11 倍増加しました。ゲムフィブロジルとセレキシパグの併用は禁忌です( 禁忌 )。
エンザルタミド
ゲムフィブロジル 600 mg を 1 日 2 回投与した後にエンザルタミド 160 mg を単回投与した健康なボランティアでは、エンザルタミドと活性代謝物 (N-デスメチルエンザルタミド) の AUC が 2.2 倍増加し、対応する Cmax が 16% 減少しました。エンザルタミドへの曝露が増えると、発作のリスクが高まる可能性があります。併用が必要と考えられる場合は、エンザルタミドの用量を減らす必要があります ( 警告 )。
OATP1B1 基質
ゲムフィブロジルは OATP1B1 トランスポーターの阻害剤であり、OATP1B1 の基質である薬物(例、アトラセンタン、アトルバスタチン、ボセンタン、エゼチミブ、フルバスタチン、グリブリド、SN-38 [イリノテカンの活性代謝物]、ロスバスタチン、ピタバスタチン、プラバスタチン、リファンピン、バルサルタン、オルメサルタン)。したがって、ゲムフィブロジルを併用する場合は、OATP1B1 の基質である薬剤の減量が必要になる場合があります (以下を参照)。 警告 )。ゲムフィブロジルと OATP1B1 基質であるシンバスタチンまたはレパグリニドとの併用療法は禁忌です( 禁忌 )。
CYP 酵素、UGTA 酵素、および OATP1B1 トランスポーターの in vitro 研究
in vitro 研究では、ゲムフィブロジルが CYP1A2、CYP2C8、CYP2C9、CYP2C19、OATP1B1、および UDP-グルクロノシルトランスフェラーゼ (UGT) 1A1 および 1A3 の阻害剤であることが示されています ( 警告 )。
胆汁酸結合樹脂
ゲムフィブロジル AUC は、ゲムフィブロジル (600 mg) をコレスチポールなどの樹脂顆粒剤 (5 g) と同時に投与した場合、30% 減少しました。コレスチポールから 2 時間間隔で投与した場合、ゲムフィブロジルへの暴露は有意な影響を受けなかったため、2 時間以上間隔をあけて薬剤を投与することをお勧めします。
コルヒチン
横紋筋融解症を含むミオパシーは、治療用量のコルヒチンの慢性投与で報告されています。 LOPID の併用は、ミオパシーの発症を促進する可能性があります。腎機能障害のある患者や高齢の患者はリスクが高くなります。特に高齢者や腎機能障害のある患者では、LOPID とコルヒチンを併用する場合は注意が必要です。
警告
ヘルシンキ心臓研究の規模がより限られているため、LOPID 300mg 群とプラセボ群の間で観察されたあらゆる原因による死亡率の差は、別の WHO 研究でクロフィブラート群で報告された 29% の超過死亡率と統計的に有意な差はありません。 9年間のフォローアップ(参照 臨床薬理学 )。非冠動脈性心疾患関連の死亡率は、主に非盲検延長中に観察された癌による死亡により、最初にLOPIDに無作為化されたグループで過剰を示しました。
ヘルシンキ心臓研究の 5 年間の一次予防コンポーネント中、あらゆる原因による死亡率は、LOPID 300mg グループで 44 (2.2%)、プラセボ グループで 43 (2.1%) でした。試験が完了してからの 3.5 年間の追跡調査期間を含め、原因を問わない累積死亡率は、LOPID グループで 101 (4.9%)、プラセボに最初に無作為化されたグループで 83 (4.1%) でした (ハザード比 1:20 が有利)プラセボの)。ヘルシンキ心臓研究の規模がより限定されているため、5 年目または 8.5 年目における LOPID 300mg 群とプラセボ群の間で観察されたあらゆる原因による死亡率の差は、29% の超過死亡率と統計的に有意な差はありません。 9年間のフォローアップでの別のWHO研究におけるクロフィブラート群。非冠動脈性心疾患に関連する死亡率は、8.5 年の追跡調査で最初に LOPID 300mg に無作為化されたグループで過剰を示しました (65 の LOPID 300mg 対 45 のプラセボ非冠動脈死亡)。
試験中および試験終了後 3.5 年で発見された癌 (基底細胞癌を除く) の発生率は、最初に無作為化された両群で 51 (2.5%) でした。さらに、最初にLOPID 300mgに無作為化されたグループには16個の基底細胞癌があり、最初にプラセボに無作為化されたグループには9個ありました(p=0.22)。最初にLOPID 300mgに無作為化されたグループでは30人(1.5%)が癌に起因する死亡であり、最初にプラセボに無作為化されたグループでは18人(0.9%)でした(p=0.11)。 Helsinki Heart Study の二次予防コンポーネントにおいて、冠動脈疾患の既往歴または疑いのある男性を対象とした対応する研究では、ゲムフィブロジル患者で冠動脈イベントを含む有害転帰が高かった( 臨床薬理学 )。
このクラスの 3 つの薬物を比較する比較発がん性研究もラットで行われました。ゲムフィブロジル (250 mg/kg; 人間の用量の 1.7 倍)。膵腺房腺腫は、フェノフィブラートの男性と女性で増加しました。肝細胞癌および膵腺房腺腫は男性で増加し、女性では肝腫瘍性結節がクロフィブラートで治療された。肝腫瘍性結節は、クロフィブラートで治療された男性と女性で増加しました。ゲムフィブロジルで治療された男性と女性で肝臓の腫瘍性結節が増加し、3つの薬剤すべてで男性で精巣間質細胞(ライディッヒ細胞)腫瘍が増加しました。
予防
初期治療
脂質レベルが一貫して異常であることを確認するために、臨床検査を行う必要があります。 LOPID 療法を開始する前に、適切な食事、運動、肥満患者の減量、および脂質異常の一因となる糖尿病や甲状腺機能低下症などの医学的問題の管理により、血清脂質をコントロールするためのあらゆる試みを行う必要があります。
継続治療
血清脂質を定期的に測定し、3 か月の治療後に脂質応答が不十分な場合は、薬剤を中止する必要があります。
発がん、突然変異誘発、生殖能力の障害
長期試験は、ヒト曝露の 0.2 倍および 1.3 倍(AUC に基づく)でラットで実施された。良性肝結節および肝癌の発生率は、高用量の雄ラットで有意に増加した。肝癌の発生率は低用量の雄でも増加したが、この増加は統計的に有意ではなかった (p=0.1)。雄ラットでは、良性ライディッヒ細胞腫瘍が用量依存的かつ統計的に有意に増加した。高用量の雌ラットでは、良性および悪性の肝臓新生物の合計発生率が有意に増加した。
ヒトの曝露量の 0.1 倍および 0.7 倍(AUC に基づく)でマウスを用いた長期試験が実施されています。肝臓腫瘍の発生率において、コントロールと統計的に有意な差はありませんでしたが、テストされた用量は、他のフィブラートで発がん性が示されている用量よりも低かった.
電子顕微鏡研究は、オスのラットにLOPIDを投与した後、血色の良い肝臓のペルオキシソーム増殖を示しました。ペルオキシソームの増殖をテストするための適切な研究はヒトでは行われていませんが、ペルオキシソームの形態の変化が観察されています.ペルオキシソームの増殖は、フィブラート系の他の 2 つの薬剤のいずれかを使用したヒトで発生することが示されており、同じ個人で治療前後の肝生検を比較しました。
ヒト用量の約 2 倍 (表面積に基づく) を雄ラットに 10 週間投与すると、用量に関連した受胎能の低下が生じた。その後の研究では、この影響は約8週間の薬物のない期間後に元に戻り、子孫には伝わらないことが示されました.
妊娠
LOPID 300mg は、ヒトの用量の 0.5 ~ 3 倍の用量 (表面積に基づく) で、ラットおよびウサギに悪影響を与えることが示されています。妊娠中の女性を対象とした、十分に管理された研究はありません。 LOPID 300mg は、潜在的な利益が胎児への潜在的なリスクを正当化する場合にのみ、妊娠中に使用する必要があります。
LOPID 300mg を妊娠前および妊娠中にヒト用量の 2 倍 (表面積に基づく) で雌ラットに投与すると、用量に関連した受胎率の低下、死産の増加、および授乳中の子犬の体重のわずかな減少が引き起こされました。また、用量に関連した骨格変化の増加も見られました。無眼球症が発生しましたが、めったにありません。
妊娠 15 日目から離乳期までの雌ラットへの LOPID のヒト用量の 0.6 倍および 2 倍 (表面積に基づく) の投与は、用量に関連した出生時体重の減少および授乳中の子犬の成長の抑制を引き起こした。
器官形成期の雌ウサギへのLOPID 300mgのヒト用量(表面積に基づく)の1倍および3倍の投与は、同腹子数の用量依存的な減少を引き起こし、高用量では、頭頂骨の変動の発生率が増加しました。
授乳中の母親
この薬が母乳中に排泄されるかどうかは不明です。多くの薬物が母乳中に排泄され、動物実験で LOPID に腫瘍原性の可能性が示されているため、母親にとっての薬物の重要性を考慮して、授乳を中止するか薬物を中止するかを決定する必要があります。
血液学的変化
軽度のヘモグロビン、ヘマトクリット、および白血球の減少は、LOPID 療法の開始後に時折患者に観察されています。ただし、これらのレベルは長期投与中に安定します。まれに、重度の貧血、白血球減少症、血小板減少症、および骨髄形成不全が報告されています。
したがって、LOPID 300mg 投与の最初の 12 か月間は、定期的な血球計算が推奨されます。
肝機能
LOPIDの投与中に、AST、ALT、LDH、ビリルビン、アルカリホスファターゼの上昇など、肝機能検査の異常が時折観察されています。これらは通常、LOPID 300mg を中止すると元に戻ります。したがって、定期的な肝機能検査が推奨され、異常が持続する場合はLOPID 300mgの治療を中止する必要があります。
腎機能
ベースラインの血漿クレアチニン値が 2.0 mg/dL を超える患者に LOPID 療法を追加すると、腎不全が悪化するという報告があります。そのような患者では、低用量のLOPIDのリスクと利点に照らして、代替療法の使用を検討する必要があります。
小児用
小児患者における安全性と有効性は確立されていません。
過剰摂取
LOPIDの過剰摂取の事例が報告されています。あるケースでは、7 歳の子供が最大 9 グラムの LOPID を摂取した後に回復しました。過剰摂取で報告された症状は、腹部痙攣、異常な肝機能検査、下痢、CPK の上昇、関節と筋肉の痛み、吐き気と嘔吐でした。過剰摂取が発生した場合は、対症療法を行う必要があります。
禁忌
臨床薬理学
LOPID は、血清トリグリセリドと超低密度リポタンパク質 (VLDL) コレステロールを減少させ、高密度リポタンパク質 (HDL) コレステロールを増加させる脂質調節剤です。 LOPID 300mg療法では、総コレステロールと低密度リポタンパク質(LDL)コレステロールのわずかな減少が観察される場合がありますが、IV型高リポタンパク質血症によるトリグリセリドが上昇した患者の治療は、多くの場合、LDLコレステロールの上昇をもたらします.血清 LDL コレステロールとトリグリセリドの両方が上昇している IIb 型患者の LDL コレステロールレベルは、一般に、LOPID 300mg 治療による影響は最小限です。ただし、LOPID 300mg は通常、このグループの HDL コレステロールを有意に上昇させます。 LOPID 300mg は、高密度リポタンパク質 (HDL) サブフラクション HDL2 および HDL3、ならびにアポリポタンパク質 AI および AII のレベルを増加させます。疫学的研究は、低 HDL コレステロールと高 LDL コレステロールの両方が冠状動脈性心疾患の独立した危険因子であることを示しています。
40 歳から 55 歳までの 4081 人の男性患者が無作為化二重盲検プラセボ対照法で研究された Helsinki Heart Study の一次予防コンポーネントでは、LOPID 300mg 治療は総血漿トリグリセリドの有意な減少と関連していました。高密度リポタンパク質コレステロールの有意な増加。総血漿コレステロールと低密度リポタンパク質コレステロールの中程度の減少が LOPID 治療群全体で観察されましたが、脂質応答は、特にさまざまなフレドリクソン型の間で不均一でした。この研究には、血清非 HDL コレステロールが 200 mg/dL を超え、冠状動脈性心疾患の既往歴のない被験者が参加しました。 5 年間の研究期間中、LOPID 300mg 群では、プラセボと比較して、重篤な冠動脈イベント (心臓突然死と致命的および非致死的心筋梗塞) の発生率が 1.4% 絶対 (34% 相対) 減少しました。p=0.04 (表 1)。プラセボと比較して、致死的でない心筋梗塞の発生率が 37% 減少しました。これは、1000 人あたり 13.1 イベントという治療関連の差に相当します。研究の二重盲検期間中のあらゆる原因による死亡は、LOPID 300mg 無作為化群で合計 44 人 (2.2%)、プラセボ群で 43 人 (2.1%) でした。
フレドリクソン型のうち、ヘルシンキ心臓研究の一次予防コンポーネントの 5 年間の二重盲検期間中に、LDL コレステロールと総血漿の両方が上昇した IIb 型患者で、重篤な冠動脈イベントの発生率が大幅に低下しました。トリグリセリド。 IIb 型ゲムフィブロジル群患者のこのサブグループは、LDL コレステロールと正常な血漿トリグリセリドが上昇した IIa 型サブグループよりも、ベースラインでの平均 HDL コレステロール レベルが低かった。この研究における IIb 型患者の HDL コレステロールの平均増加は、プラセボと比較して 12.6% でした。タイプ IIb 患者の LDL コレステロールの平均変化は、プラセボ サブグループでの 3.9% の上昇と比較して、LOPID で -4.1% でした。 Helsinki Heart Study の IIb 型被験者は、プラセボと比較してゲムフィブロジル群の 5 年間で 1,000 人あたりの冠動脈イベントが 26 回少なかった. LDLコレステロールが175mg/dL以上(4.5ミリモル以上)、トリグリセリドが200mg/dL以上(2.2ミリモル以上)、HDLが3つの患者のサブグループでは、LOPID 300mgとプラセボの間で冠動脈イベントの差が大幅に大きかった-コレステロール
さらなる情報は、ヘルシンキ心臓研究に参加したすべての被験者の 3.5 年 (累積 8.5 年) の追跡調査から入手できます。 Helsinki Heart Study の完了時に、被験者は LOPID の投与を開始、停止、または継続することを選択できました。自分自身の脂質値や二重盲検治療を知らずに、最初にプラセボに無作為に割り付けられた患者の 60% が LOPID 300mg で治療を開始し、最初に LOPID に無作為に割り付けられた患者の 60% が投薬を継続しました。無作為化から約 6.5 年後、すべての患者は、元の治療群と 5 年間の二重盲検治療中の脂質値を知らされました。 LOPID 治療ステータスの選択的変更をさらに行った後、最初に LOPID にランダム化されたグループの患者の 61% が薬を服用していました。最初にプラセボに無作為化されたグループでは、65% が LOPID を服用していました。非盲検フォローアップ期間中に発生した 1000 あたりのイベント率を表 II に示します。
8.5 年間の累積死亡率は、LOPID 300mg に最初に無作為化されたグループと最初に無作為化されたプラセボ群の 20% の相対過剰死亡と、最初に LOPID 300mg に無作為化されたグループと最初に無作為化されたプラセボ群の心臓イベントの 20% の相対的減少を示しました。 (表 III を参照)。最初に無作為化された「治療の意図」集団のこの分析は、非盲検段階での治療切り替えの複雑な影響の可能性を無視しています。 6.5 歳から 8.5 歳までの非盲検治療状態を考慮してハザード比を調整すると、報告された死亡率のハザード比が 1 に近づく可能性があります。
Helsinki Heart Studyの一次予防コンポーネントの結果が、研究されていない脂質異常症集団の他のセグメント(女性、若い男性または年配の男性、またはHDLのみに限定された脂質異常のある人など)にどの程度外挿できるかは明らかではありません. -コレステロール)または他の脂質変化薬に。
ヘルシンキ心臓研究の二次予防コンポーネントは、狭心症、心筋梗塞、心筋梗塞の病歴のためにヘルシンキ心臓研究の一次予防コンポーネントから除外された 628 人の中年男性を対象に、フィンランドの同じセンターで 5 年間にわたって並行して実施されました。または原因不明の心電図の変化。この研究の主要な有効性評価項目は、心臓イベント (致死的および非致死的な心筋梗塞と心臓突然死の合計) でした。心臓イベントのハザード比 (LOPID:プラセボ) は 1.47 (95% 信頼限界 0.88–2.48、p=0.14) でした。心臓イベントを経験したLOPID 300mgグループの35人の患者のうち、12人の患者が研究の中止後にイベントを起こしました。心イベントを起こしたプラセボ群の 24 人の患者のうち、4 人の患者が研究の中止後にイベントに見舞われました。 LOPID 群で 17 例、プラセボ群で 8 例の心臓死がありました (ハザード比 2.18; 95% 信頼限界 0.94–5.05, p=0.06)。これらの死亡のうち、LOPID 群では 10 例、プラセボ群では 3 例が治療中止後に発生しました。冠状動脈性心疾患が既知または疑われる患者を対象としたこの研究では、LOPID 300mg 治療による心臓イベントまたは心臓死の減少の効果は認められませんでした。したがって、LOPID 300mg は、冠状動脈性心疾患が疑われるか確立されていない選択された脂質異常症の患者にのみ有益性を示しています。冠状動脈性心疾患の患者で、LDL コレステロールの上昇、トリグリセリドの上昇、HDL コレステロールの低下という三つ組の患者でさえ、冠動脈イベントに対する LOPID の影響の可能性は十分に研究されていません。
化学的および薬理学的に関連する薬剤であるクロフィブラートを用いた冠動脈治療薬プロジェクトでは、確立された冠状動脈性心疾患の患者に対する有効性は観察されませんでした。冠動脈治療薬プロジェクトは、1000 人のクロフィブラート、1000 人のニコチン酸、および 3000 人のプラセボ患者を対象とした 6 年間のランダム化二重盲検試験であり、既知の冠状動脈性心疾患を患っています。心筋梗塞の臨床的および統計的に有意な減少が、プラセボと比較して同時ニコチン酸グループで見られました。クロフィブラートによる減少は見られませんでした。
ゲムフィブロジルの作用機序は明確に確立されていません。男性では、LOPID 300mg は末梢脂肪分解を阻害し、遊離脂肪酸の肝臓抽出を減少させ、肝臓トリグリセリド産生を減少させることが示されています。 LOPID 300mg は合成を阻害し、VLDL キャリアであるアポリポタンパク質 B のクリアランスを増加させ、VLDL 産生の減少につながります。
動物研究は、ゲムフィブロジルが、HDL-コレステロールの上昇に加えて、新たに形成されたトリグリセリドへの長鎖脂肪酸の取り込みを減らし、ターンオーバーと肝臓からのコレステロールの除去を促進し、糞便中のコレステロールの排泄を増加させる可能性があることを示唆しています.ロピッド 300mg は、経口投与後、消化管からよく吸収されます。ピーク血漿レベルは 1 ~ 2 時間で発生し、複数回投与後の血漿半減期は 1.5 時間です。
ゲムフィブロジルは、LOPID 300mg 錠剤の経口投与後に完全に吸収され、投与後 1 ~ 2 時間で最高血漿濃度に達します。ゲムフィブロジルの薬物動態は、投与時間に対する食事のタイミングによって影響を受けます。ある研究 (参考文献 4) では、食事の 0.5 時間前に投与すると、薬物の吸収率と吸収範囲の両方が大幅に増加しました。 LOPID を食後に投与すると、食前 0.5 時間に比べて平均 AUC が 14 ~ 44% 減少しました。その後の研究では、LOPID 300mg の吸収率は食事の 0.5 時間前に投与した場合に最大となり、Cmax は食事または絶食時に投与した場合よりも 50 ~ 60% 高くなりました。この研究では、食事に対する投与のタイミングの AUC に有意な影響はありませんでした ( 投薬と管理 )。
LOPIDは主に環のメチル基が酸化され、ヒドロキシメチルとカルボキシルの代謝物を順次形成します。投与されたヒト用量の約 70% が尿中に排泄され、ほとんどがグルクロニド抱合体として排泄され、未変化のゲムフィブロジルとして排泄されるのは 2% 未満です。投与量の 6% は糞便中に含まれています。ゲムフィブロジルは血漿タンパク質に強く結合し、他の薬物との置換相互作用の可能性があります ( 予防 )。
患者情報
情報が提供されていません。を参照してください。 警告 と 予防 セクション。
