Zetia 10mg Ezetimibe 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Zetia とは何ですか? どのように使用されますか?
Zetia は、高コレステロールの症状を治療し、コレステロールを下げるために使用される処方薬です。 Zetia は、単独で使用することも、他の薬と併用することもできます。
Zetia は、脂質低下剤、2-アゼチジノンと呼ばれる薬物のクラスに属します。
Zetia 10mg が 10 歳未満の子供に安全で有効であるかどうかはわかっていません。
Zetiaの考えられる副作用は何ですか?
Zetia は、次のような重大な副作用を引き起こす可能性があります。
- 筋肉痛、
- 筋肉の圧痛または衰弱、
- 熱、
- 異常な疲労感と
- 濃い色の尿
上記の症状がある場合は、すぐに医療機関を受診してください。
Zetia 10mg の最も一般的な副作用は次のとおりです。
- 筋肉痛や関節痛、
- 鼻づまり、
- 副鼻腔の痛み、
- 喉の痛み、
- 下痢、および
- 腕や脚の痛み
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Zetia の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
ZETIA (エゼチミベ) は、コレステロールおよび関連する植物ステロールの腸管吸収を選択的に阻害する脂質低下化合物のクラスに属します。エゼチミブの化学名は、1-(4-フルオロフェニル)-3(R)-[3-(4-フルオロフェニル)-3(S)-ヒドロキシプロピル]-4(S)-(4-ヒドロキシフェニル)-2-アゼチジノンです。 .実験式は C24H21F2NO3 です。分子量は 409.4 で、構造式は次のとおりです。
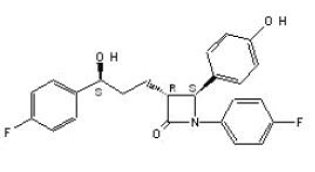
エゼチミベは白色の結晶性粉末で、エタノール、メタノール、アセトンに溶けやすく、水にはほとんど溶けません。エゼチミベの融点は約 163°C で、周囲温度で安定しています。 ZETIA 10mg は、10 mg のエゼチミブと次の不活性成分を含む経口投与用の錠剤として入手できます: クロスカルメロース ナトリウム NF、ラクトース一水和物 NF、ステアリン酸マグネシウム NF、微結晶セルロース NF、ポビドン USP、およびラウリル硫酸ナトリウム NF。
適応症
高コレステロール血症によるアテローム性動脈硬化性血管疾患のリスクが有意に高い個人では、脂質改変剤による治療は、複数の危険因子介入の 1 つの構成要素にすぎないはずです。薬物療法は、飽和脂肪とコレステロールを制限した食事やその他の非薬理学的対策だけでは不十分な場合に、食事の補助として適応されます。
原発性高脂血症
単剤療法
単独で投与される ZETIA® は、総コレステロール (total-C)、低密度リポタンパク質コレステロール (LDL-C)、アポリポタンパク質 B (Apo B)、および非高密度リポタンパク質コレステロールの上昇を減少させるための食事の補助療法として適応されます。 (非 HDL-C) 原発性 (ヘテロ接合性家族性および非家族性) 高脂血症の患者。
HMG-CoAレダクターゼ阻害剤(スタチン)との併用療法
3-ヒドロキシ-3-メチルグルタリル-コエンザイム A (HMG-CoA) レダクターゼ阻害剤 (スタチン) と組み合わせて投与される ZETIA 10mg は、総 C、LDL-C、Apo の上昇を抑えるための食事の補助療法として適応されます。 B、原発性(ヘテロ接合性家族性および非家族性)高脂血症の患者における非 HDL-C。
フェノフィブラートとの併用療法
フェノフィブラートと組み合わせて投与される ZETIA 10mg は、混合型高脂血症の成人患者における総 C、LDL-C、Apo B、および非 HDL-C の上昇を抑えるための食事の補助療法として適応されます。
ホモ接合性家族性高コレステロール血症 (HoFH)
ZETIA 10mg とアトルバスタチンまたはシンバスタチンの併用は、HoFH 患者の総 C 値および LDL-C 値の上昇を抑えるために、他の脂質低下治療 (LDL アフェレーシスなど) の補助として、またはそのような治療が利用できない場合に適応となります。 .
ホモ接合性シトステロール血症
ZETIA 10mg は、ホモ接合性家族性シトステロール血症患者のシトステロールおよびカンペステロールの上昇を抑えるための食事補助療法として適応されます。
使用制限
ZETIA が心血管疾患の罹患率と死亡率に及ぼす影響はまだ確認されていません。
ZETIA は、フレドリクソン I、III、IV、および V 型脂質異常症では研究されていません。
投薬と管理
一般的な投与情報
ZETIAの推奨用量は、1日1回10mgです。
ZETIA 10mg は食事の有無にかかわらず投与できます。
併用脂質低下療法
ZETIA 10mg は、スタチン(原発性高脂血症患者)またはフェノフィブラート(混合型高脂血症患者)と併用して効果を高めることができます。便宜上、ZETIA の 1 日用量は、それぞれの医薬品の推奨用量に従って、スタチンまたはフェノフィブラートと同時に服用することができます。
胆汁酸封鎖剤との同時投与
ZETIA の投与は、胆汁酸封鎖剤の投与の 2 時間以上前または投与の 4 時間以上前に行う必要があります。 薬物相互作用 ]。
肝障害のある患者
軽度の肝障害のある患者では、用量調整は必要ありません。 警告と注意事項 ]。
腎障害のある患者
腎障害のある患者では投与量の調整は必要ありません [参照 臨床薬理学 ]。中等度から重度の腎機能障害 (推定糸球体濾過量 特定の集団での使用 ]。
高齢患者
高齢患者では投与量の調整は必要ありません。 臨床薬理学 ]。
供給方法
剤形と強度
10 mg 錠は白色からオフホワイトのカプセル型の錠剤で、片面に「414」と刻印されています。
保管と取り扱い
No.3861 - ゼティア錠 10mg 、片面に「414」とデボス加工された白色からオフホワイトのカプセル型の錠剤です。それらは次のように提供されます。
NDC 66582-414-31 30本入 NDC 66582-414-54 90本入 NDC 66582-414-74 500本入 NDC 5000本の66582-414-76ボトル NDC 66582-414-28 100 単位用量パッケージ。
保管所
25°C (77°F) で保管してください。 15 ~ 30°C (59 ~ 86°F) まで許容されるエクスカーション。 [見る USP制御の室温 】 湿気から守る。
MERCK & CO., INC., Whitehouse Station, NJ 08889, USA の子会社である Merck Sharp & Dohme Corp.。改訂: 2013 年 8 月
副作用
次の重篤な副作用については、ラベルの他のセクションで詳しく説明しています。
- 肝酵素異常[参照 警告と注意事項 ]
- 横紋筋融解症およびミオパチー[参照 警告と注意事項 ]
単剤療法研究
ZETIA 10mg 対照臨床試験データベース (プラセボ対照) の 2396 人の患者の中央値治療期間 12 週間 (範囲 0 から 39 週間) では、ZETIA 10mg の患者の 3.3% とプラセボの患者の 2.9% が有害性のために中止されました。反応。 ZETIA 10mgで治療された患者群で最も一般的で、治療の中止につながり、プラセボよりも高い割合で発生した副作用は次のとおりです。
- 関節痛 (0.3%)
- めまい (0.2%)
- γ-グルタミルトランスフェラーゼの増加 (0.2%)
2396 人の患者の ZETIA 単剤療法対照臨床試験データベースで最も一般的に報告された副作用 (発生率 ≥2% でプラセボより多い) は、上気道感染症 (4.3%)、下痢 (4.1%)、関節痛 (3.0%)、副鼻腔炎 (2.8%)、四肢の痛み (2.7%)。
スタチン併用試験
治療期間の中央値が 8 週間 (範囲 0 ~ 112 週間) の 11,308 人の患者の ZETIA + スタチン対照臨床試験データベースでは、ZETIA + スタチンの患者の 4.0%、スタチン単独の患者の 3.3% が副作用のために中止しました。 ZETIA + スタチンで治療された患者のグループで、治療の中止につながり、スタチン単独よりも高い割合で発生した最も一般的な副作用は次のとおりです。
- アラニンアミノトランスフェラーゼ増加 (0.6%)
- 筋肉痛 (0.5%)
- 疲労、アスパラギン酸アミノトランスフェラーゼの上昇、頭痛、四肢の痛み (それぞれ 0.2%)
11,308 人の患者の ZETIA + スタチン対照臨床試験データベースで最も一般的に報告された副作用 (発生率 ≥2% で、スタチン単独より多い) は、鼻咽頭炎 (3.7%)、筋肉痛 (3.2%)、上気道感染症 (2.9%) でした。 )、関節痛 (2.6%)、下痢 (2.5%)。
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用の発生率を別の医薬品の臨床試験で観察された発生率と直接比較することはできず、臨床現場で観察された発生率を反映していない可能性があります。
単剤療法
10件の二重盲検プラセボ対照臨床試験で、原発性高脂血症患者2396人(年齢範囲9~86歳、女性50%、白人90%、黒人5%、ヒスパニック3%、アジア人2%)およびLDL-C上昇ZETIA 10 mg/日の治療期間の中央値は 12 週間 (範囲 0 ~ 39 週間) でした。
ZETIA で治療された患者の 2% 以上で報告され、因果関係の評価に関係なく、ZETIA 10 mg のプラセボ対照試験でプラセボよりも高い発生率で報告された有害反応を表 1 に示します。
表 1: ZETIA 10mg で治療された患者の 2% 以上に発生し、因果関係に関係なく、プラセボより高い発生率で発生した臨床的有害反応
あまり一般的でない副作用の頻度は、ZETIA 10mg とプラセボの間で同等でした。
スタチンとの併用
28の二重盲検対照(プラセボまたは実薬対照)臨床試験では、原発性高脂血症患者11,308人(年齢範囲10~93歳、女性48%、白人85%、黒人7%、ヒスパニック4%、アジア人3%) LDL-Cが上昇した患者は、進行中のスタチン療法と同時に、またはスタチン療法に加えて、ZETIA 10mg/日で治療期間の中央値8週間(範囲0~112週間)で治療されました。
連続増加トランスアミナーゼ (≥3 × ULN) の発生率は、スタチンのみで治療された患者 (0.4%) よりも ZETIA 10mg をスタチンと共に投与された患者 (1.3%) で高かった。 [見る 警告と注意事項 ]
ZETIA + スタチンで治療された患者の 2% 以上で報告され、因果関係の評価に関係なく、スタチンよりも高い発生率で報告された臨床的有害反応を表 2 に示します。
表 2: ZETIA 10 mg をスタチンと併用投与し、因果関係に関係なくスタチンよりも高い発生率で治療した患者の 2% 以上に発生した臨床的有害反応
フェノフィブラートとの併用
混合脂質異常症の 625 人の患者 (年齢範囲 20 ~ 76 歳、女性 44%、白人 79%、黒人 0.1%、ヒスパニック系 11%、アジア人 5%) を含むこの臨床研究では、最大 12 週間治療を受け、576 人の患者が最大 12 週間治療されました。さらに 48 週間、ZETIA とフェノフィブラートの同時投与が評価されました。この研究は、まれなイベントについて治療グループを比較するようには設計されていません。フェノフィブラート単剤療法 (n=188) と ZETIA の同時投与で、肝トランスアミナーゼ値の臨床的に重要な上昇 (≧3 — ULN、連続) の発生率 (95% CI) は 4.5% (1.9、8.8) および 2.7% (1.2、5.4) でした。それぞれフェノフィブラート (n=183) を使用し、治療への曝露を調整しました。胆嚢摘出術の対応する発生率は、フェノフィブラート単剤療法およびフェノフィブラートと併用投与された ZETIA 10 mg で、それぞれ 0.6% (95% CI: 0.0%、3.1%) および 1.7% (95% CI: 0.6%、4.0%) でした [参照 薬物相互作用 ]。併用療法ならびにフェノフィブラートおよびエゼチミブの単剤療法を受けた患者数は、胆嚢疾患のリスクを評価するには不十分でした。いずれの治療群でも 10 を超える CPK 上昇はありませんでした — ULN。
市販後の経験
以下の反応は、不確実な規模の集団から自発的に報告されているため、一般に、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることはできません.
ZETIAの承認後の使用中に、次の追加の副作用が確認されました。
アナフィラキシー、血管性浮腫、発疹、蕁麻疹などの過敏反応;多形紅斑;関節痛;筋肉痛;クレアチンホスホキナーゼの上昇;ミオパシー/横紋筋融解症 [参照 警告と注意事項 ];肝トランスアミナーゼの上昇;肝炎;腹痛;血小板減少症;膵炎;吐き気;めまい;感覚異常;うつ;頭痛;胆石症;胆嚢炎。
薬物相互作用
[見る 臨床薬理学 ]
シクロスポリン
エゼチミブとシクロスポリンの両方への曝露が増加するため、ZETIA 10mg とシクロスポリンを併用する場合は注意が必要です。 ZETIA とシクロスポリンを投与されている患者では、シクロスポリン濃度を監視する必要があります。
エゼチミブ曝露の増加の程度は、重度の腎不全患者でより大きくなる可能性があります。シクロスポリンで治療されている患者では、併用によるエゼチミブへの暴露の増加の潜在的な影響を、エゼチミブによってもたらされる脂質レベルの変化の利点と慎重に比較検討する必要があります。
フィブラート
エゼチミブとフェノフィブラート以外のフィブラートとの併用の有効性と安全性は研究されていません。
フィブラートはコレステロールの胆汁への排泄を増加させ、胆石症を引き起こす可能性があります。イヌの前臨床試験では、エゼチミブは胆嚢胆汁中のコレステロールを増加させた[参照 非臨床毒性学 ]。患者での使用が十分に研究されるまで、フェノフィブラート以外のフィブラートとの ZETIA の同時投与は推奨されません。
フェノフィブラート
ZETIA 10mg とフェノフィブラートを投与されている患者で胆石症が疑われる場合は、胆嚢検査が必要であり、代替の脂質低下療法を検討する必要があります。 有害反応 およびフェノフィブラートの製品表示]。
コレスチラミン
併用コレスチラミン投与により、総エゼチミブの平均曲線下面積 (AUC) が約 55% 減少しました。エゼチミブをコレスチラミンに追加することによる増加する LDL-C の減少は、この相互作用によって減少する可能性があります。
クマリン抗凝固剤
エゼチミブをワルファリン、クマリン抗凝固剤に追加する場合、国際正規化比 (INR) を適切に監視する必要があります。
警告
の一部として含まれています 予防 セクション。
予防
スタチンまたはフェノフィブラートと併用
ZETIA と特定のスタチンまたはフェノフィブラートとの同時投与は、その医薬品の製品ラベルに従ってください。
肝酵素
対照臨床単剤療法研究では、肝臓トランスアミナーゼレベルの連続上昇(正常上限値[ULN]の3倍以上)の発生率は、ZETIA(0.5%)とプラセボ(0.3%)で同程度でした。
スタチンと同時に開始された ZETIA 10mg の対照臨床併用研究では、肝臓トランスアミナーゼレベルの連続上昇 (≧3 x ULN) の発生率は、スタチンを投与された ZETIA で治療された患者で 1.3%、スタチンのみで治療された患者で 0.4% でした。トランスアミナーゼのこれらの上昇は一般に無症候性であり、胆汁うっ滞とは関係がなく、治療の中止後または治療の継続によりベースラインに戻りました。 ZETIA をスタチンと併用投与する場合は、スタチンの推奨に従って、治療開始時に肝臓検査を実施する必要があります。 ALT または AST ≧3 x ULN の上昇が持続する場合は、ZETIA 10mg および/またはスタチンの中止を検討してください。
ミオパシー/横紋筋融解症
臨床試験では、関連する対照群(プラセボまたはスタチン単独)と比較して、ZETIA 10mgに関連するミオパシーまたは横紋筋融解症の過剰はありませんでした.ただし、ミオパシーと横紋筋融解症は、スタチンやその他の脂質低下薬に対する既知の副作用です。臨床試験では、クレアチンホスホキナーゼ (CPK) > 10 x ULN の発生率は、ZETIA で 0.2% 対 プラセボで 0.1%、スタチンと併用投与された ZETIA で 0.1% 対 スタチン単独で 0.4% でした。骨格筋毒性のリスクは、スタチンの高用量、高齢 (> 65)、甲状腺機能低下症、腎障害、および使用するスタチンに応じて他の薬剤の併用によって増加します。
ZETIAの市販後の経験では、ミオパチーや横紋筋融解症の症例が報告されています。横紋筋融解症を発症したほとんどの患者は、ZETIA を開始する前にスタチンを服用していました。しかし、横紋筋融解症は、ZETIA 10mg の単剤療法と、横紋筋融解症のリスク増加に関連することが知られている薬剤 (フィブラート系薬剤) に ZETIA 10mg を追加した場合に報告されています。ミオパシーが診断または疑われる場合は、患者が併用している ZETIA およびスタチンまたはフィブラートを直ちに中止する必要があります。筋肉の症状があり、CPK レベルが ULN の 10 倍を超えている場合は、ミオパシーを示します。
肝障害
中等度から重度の肝障害を持つ患者におけるエゼチミブへの曝露の増加による影響は不明であるため、これらの患者には ZETIA は推奨されません。 [見る 臨床薬理学 ]
患者相談情報
見る FDA 承認の患者ラベリング (患者情報)。
患者には、全米コレステロール教育プログラム (NCEP) で推奨されている食事、定期的な運動プログラム、空腹時脂質パネルの定期的な検査を順守するようにアドバイスする必要があります。
筋肉痛
エゼチミブによる治療を開始するすべての患者は、ミオパチーのリスクについて知らされ、説明のつかない筋肉の痛み、圧痛または筋力低下があれば速やかに報告するように指示されるべきです。特定の種類の薬を服用している場合、このリスクが高くなります。患者は、処方薬と店頭販売の両方のすべての薬について、医師と話し合う必要があります。
肝酵素
スタチン療法に ZETIA 10mg を追加する場合は、スタチンの推奨に従って肝臓検査を実施する必要があります。
妊娠
出産可能年齢の女性は、スタチン療法に加えて ZETIA を使用している間、効果的な避妊法を使用して妊娠を防ぐようにアドバイスする必要があります。将来の妊娠計画について患者と話し合い、妊娠を希望している場合は ZETIA 10mg とスタチン療法の併用をいつ中止するかを話し合ってください。患者は、妊娠した場合、ZETIA 10mg とスタチン療法の併用を中止し、医療専門家に連絡するようにアドバイスする必要があります。
母乳育児
授乳中の女性は、スタチン療法に追加された ZETIA を使用しないようにアドバイスする必要があります。脂質障害があり、授乳中の患者には、医療専門家と選択肢について話し合うようにアドバイスする必要があります。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
エゼチミブを用いた 104 週間の食事による発がん性試験が、最大 1500 mg/kg/日 (雄) および 500 mg/kg/日 (雌) の用量でラットで実施されました (AUC0 に基づく 1 日 10 mg でのヒト曝露の約 20 倍)。 -総エゼチミベの場合は24時間)。エゼチミブを用いた 104 週間の食事による発がん性試験も、500 mg/kg/日までの用量でマウスで実施されました (全エゼチミブの AUC0-24 時間に基づいて、1 日 10 mg でのヒト曝露の 150 倍を超える)。薬物治療を受けたラットまたはマウスの腫瘍発生率に統計的に有意な増加はありませんでした。
代謝活性化の有無にかかわらず、Salmonella typhimurium および Escherichia coli を用いた微生物変異原性 (Ames) 試験では、in vitro で変異原性の証拠は観察されませんでした。代謝活性化の有無にかかわらず、ヒト末梢血リンパ球の染色体異常アッセイでは、in vitro で染色体異常誘発性の証拠は観察されませんでした。さらに、in vivo マウス小核試験では遺伝毒性の証拠はありませんでした。
ラットで実施されたエゼチミブの経口(強制経口)受精能試験では、オスまたはメスのラットで 1000 mg/kg/日までの用量で生殖毒性の証拠はありませんでした(AUC0 に基づく 1 日 10 mg でのヒト曝露の約 7 倍)。総エゼチミベの24時間)。
特定の集団での使用
妊娠
妊娠カテゴリーC
妊娠中の女性におけるエゼチミブの適切で十分に管理された研究はありません。潜在的な利益が胎児へのリスクを正当化する場合にのみ、エゼチミブを妊娠中に使用する必要があります。
器官形成期のラットおよびウサギで実施されたエゼチミブの経口(強制経口)胚・胎児発生研究では、試験した用量(250、500、1000 mg/kg/日)で胚致死効果の証拠はなかった。ラットでは、1000 mg/kg/日で、一般的な胎児の骨格所見 (余分な一対の胸肋、骨化していない頸椎中心、短縮された肋骨) の発生率の増加が観察されました (AUC0-24hr に基づく 1 日 10 mg でのヒト曝露の約 10 倍)。総エゼチミベ)。エゼチミブで治療したウサギでは、1000 mg/kg/日で胸郭外肋骨の発生率の増加が観察されました (総エゼチミブの AUC0-24hr に基づいて、毎日 10 mg でのヒト曝露の 150 倍)。エゼチミベは、妊娠中のラットおよびウサギに複数回経口投与した場合、胎盤を通過しました。
器官形成期のラットとウサギにスタチンと組み合わせてエゼチミブを複数回投与した研究では、より高いエゼチミブとスタチンの曝露が得られました。生殖所見は、単剤療法と比較して、併用療法では低用量で発生します。
すべてのスタチンは、妊娠中および授乳中の女性には禁忌です。 ZETIA 10mgを妊娠の可能性のある女性にスタチンと一緒に投与する場合は、妊娠のカテゴリーとスタチンの製品ラベルを参照してください。 [禁忌を参照]
授乳中の母親
エゼチミブがヒトの母乳に排泄されるかどうかはわかっていません。ラットの研究では、授乳中の子犬の総エゼチミブへの曝露は、母体血漿で観察された曝露の最大半分でした。多くの薬物は母乳中に排泄されるため、授乳中の女性に ZETIA 10mg を投与する場合は注意が必要です。 ZETIA は、潜在的な利益が乳児への潜在的なリスクを正当化しない限り、授乳中の母親には使用しないでください。
小児用
シンバスタチン単剤療法 (n=122) と比較したシンバスタチン (n=126) との ZETIA 同時投与の効果は、ヘテロ接合体家族性高コレステロール血症 (HeFH) の思春期の少年少女で評価されています。多施設共同二重盲検対照試験とそれに続く非盲検段階で、10 歳から 17 歳の 142 人の男児と 106 人の初潮後の女児 (平均年齢 14.2 歳、女性 43%、白人 82%、アジア人 4%、黒人 2%) , 13% 多民族) HeFH 患者は、ZETIA 10mg をシンバスタチンと同時投与するか、シンバスタチン単独療法を受けるかのいずれかに無作為に割り付けられました。研究への参加には、1) 160~400 mg/dL のベースライン LDL-C レベル、および 2) HeFH と一致する病歴および臨床症状が必要でした。平均ベースライン LDL-C 値は、シンバスタチン単剤療法の 219 mg/dL (範囲: 149-336 mg/dL) と比較して、シンバスタチンと併用投与された ZETIA 10 mg のグループでは 225 mg/dL (範囲: 161-351 mg/dL) でした。グループ。患者は、ZETIA とシンバスタチン (10 mg、20 mg、または 40 mg) の同時投与、またはシンバスタチンの単独療法 (10 mg、20 mg、または 40 mg) を 6 週間受け、ZETIA と 40 mg のシンバスタチンまたは 40 mg のシンバスタチンの単独療法を 6 週間受けました。その後 27 週間、非盲検で ZETIA とシンバスタチン (10 mg、20 mg、または 40 mg) を 20 週間同時投与しました。
週目の試験結果を表 3 にまとめます。33 週目の結果は 6 週目の結果と一致していました。
表 3: ヘテロ接合性家族性高コレステロール血症の思春期患者における、プールされた ZETIA 10mg をシンバスタチン群と併用投与した群とプールされたシンバスタチン単剤療法群との間の 6 週目の平均差 (%)
試験開始から 33 週までに、ZETIA とシンバスタチンの併用群で 7 例(6%)、シンバスタチン単独療法群で 2 例(2%)の患者で副作用による中止が発生しました。
試験中、肝臓のトランスアミナーゼ上昇 (ALT および/または AST ≥3 x ULN の 2 回連続測定) が、シンバスタチンと併用投与された ZETIA 10mg 群の 4 人 (3%) およびシンバスタチン単剤療法の 2 人 (2%) で発生しました。グループ。 CPK の上昇 (≧10 x ULN) は、シンバスタチンと同時投与された ZETIA グループの 2 人 (2%) の個人で発生し、シンバスタチン単独療法グループの個人では 0 人で発生しました。
この限定された対照研究では、思春期の男の子または女の子の成長または性成熟、または女の子の月経周期に有意な影響はありませんでした.
ZETIA 10mg と 1 日 40mg を超える用量でのシンバスタチンとの同時投与は、青年では研究されていません。また、ZETIA 10mg は、10 歳未満の患者または初潮前の女児では研究されていません。
総エゼチミブ (エゼチミブ + エゼチミブ-グルクロニド) に基づくと、青年と成人の間に薬物動態の違いはありません。 10 歳未満の小児集団における薬物動態データは入手できません。
高齢者の使用
単剤療法研究
臨床試験で ZETIA 10mg を投与された 2,396 人の患者のうち、669 人 (28%) が 65 歳以上、111 人 (5%) が 75 歳以上でした。
スタチン併用試験
臨床研究で ZETIA + スタチンを投与された 11,308 人の患者のうち、3587 人 (32%) が 65 歳以上で、924 人 (8%) が 75 歳以上でした。
これらの患者と若年患者との間で安全性と有効性の全体的な違いは観察されず、他の報告された臨床経験では、高齢者と若年患者の間の反応の違いは特定されていませんが、一部の高齢者の感度が高いことを除外することはできません[参照] 臨床薬理学 ]。
腎障害
単剤で使用する場合、ゼティア10mgの用量調整は不要です。
中等度から重度の腎機能障害を持つ 9270 人の患者 (血清クレアチニンの中央値が 2.5 mg/dL、推定糸球体濾過率の中央値が 25.6 mL/min/1.73 m²、 3,023 人の透析患者)、重篤な有害事象、研究治療の中止につながる有害事象、または特に関心のある有害事象 (筋骨格系の有害事象、肝酵素異常、偶発がん) の発生率は、これまでにエゼチミブ 10 mg プラスに割り当てられた患者間で類似していました。シンバスタチン 20 mg (n=4650) またはプラセボ (n=4620) を追跡期間中央値 4.9 年間に投与した。しかし、腎障害はスタチン関連ミオパシーの危険因子であるため、中等度から重度の腎障害のある患者に ZETIA を併用投与する場合、20 mg を超えるシンバスタチンの用量は慎重に使用し、注意深く監視する必要があります。
肝障害
ZETIA は、中等度から重度の肝障害のある患者には推奨されません [参照 警告と注意事項 と 臨床薬理学 ]。
スタチンと同時に投与される ZETIA 10mg は、活動性肝疾患のある患者、または原因不明の肝トランスアミナーゼレベルの持続的な上昇がある患者には禁忌です [参照 禁忌 ; 警告と注意事項 と 臨床薬理学 ]。
過剰摂取
臨床試験では、エゼチミブ 50 mg/日を 15 人の健康な被験者に最大 14 日間、40 mg/日を原発性高脂血症の 18 人の患者に最大 56 日間、40 mg/日をホモ接合型シトステロール血症の患者 27 人に投与した。 26 週間は一般的に忍容性が良好でした。ホモ接合性シトステロール血症の 1 人の女性患者が、エゼチミブ 120 mg/日を 28 日間偶発的に過剰摂取しましたが、臨床的または実験的有害事象は報告されていません。
過剰摂取の場合は、対症療法および支持療法を採用する必要があります。
禁忌
ZETIA は、次の条件では禁忌です。
- ZETIA 10mg とスタチンの併用は、活動性肝疾患または原因不明の肝トランスアミナーゼレベルの持続的上昇を有する患者には禁忌です。
- 妊娠中または妊娠の可能性がある女性。スタチンはコレステロール合成を減少させ、おそらくコレステロール由来の他の生物学的に活性な物質の合成を減少させるため、ZETIA をスタチンと併用すると、妊婦に投与すると胎児に害を及ぼす可能性があります。さらに、妊娠中の治療に明らかな利点はなく、妊婦の安全性は確立されていません.患者がこの薬を服用中に妊娠した場合、患者は胎児への潜在的な危険性と、妊娠中の継続使用による既知の臨床的利益の欠如について知らされるべきです. [見る 特定の集団での使用 ]
- 授乳中の母親。スタチンは母乳に移行する可能性があり、スタチンは授乳中の乳児に深刻な有害反応を引き起こす可能性があるため、スタチンと組み合わせて ZETIA 治療を必要とする女性は、乳児を授乳しないようにアドバイスする必要があります。 特定の集団での使用 ]。
- この製品のいずれかの成分に対して既知の過敏症のある患者。アナフィラキシー、血管性浮腫、発疹、蕁麻疹などの過敏症反応が ZETIA で報告されています。 有害反応 ]。
臨床薬理学
作用機序
エゼチミブは、小腸によるコレステロールの吸収を阻害することにより、血中コレステロールを低下させます。 18 人の高コレステロール血症患者を対象とした 2 週間の臨床試験では、プラセボと比較して、ZETIA 10mg は腸のコレステロール吸収を 54% 抑制しました。 ZETIA は、脂溶性ビタミン A、D、および E の血漿濃度に臨床的に意味のある影響を与えず (患者 113 人の研究)、副腎皮質ステロイド ホルモンの産生を阻害しませんでした (患者 118 人の研究)。
肝臓のコレステロール含有量は、主に 3 つのソースに由来します。肝臓は、コレステロールを合成したり、血液中の循環リポタンパク質からコレステロールを吸収したり、小腸で吸収されたコレステロールを吸収したりできます。腸内コレステロールは、主に胆汁中に分泌されるコレステロールと食事性コレステロールに由来します。
エゼチミブは、他のクラスのコレステロール低下化合物 (スタチン、胆汁酸封鎖剤 [樹脂]、フィブリン酸誘導体、植物スタノール) とは異なる作用機序を持っています。エゼチミベの分子標的は、ステロール輸送体であるニーマン-ピック C1-Like 1 (NPC1L1) であることが示されています。これは、コレステロールと植物ステロールの腸内取り込みに関与しています。
エゼチミブは、肝臓でのコレステロール合成を阻害したり、胆汁酸排泄を増加させたりしません。代わりに、エゼチミブは小腸の刷子縁に局在し、コレステロールの吸収を阻害し、腸から肝臓へのコレステロールの送達を減少させます。これにより、肝臓のコレステロール貯蔵が減少し、血液からのコレステロールのクリアランスが増加します。この明確な機序は、スタチンおよびフェノフィブラートの機序を補完するものです [ 臨床研究 ]。
薬力学
臨床研究では、LDL の主要なタンパク質構成要素である総 C、LDL-C、および Apo B のレベルの上昇が、ヒトのアテローム性動脈硬化を促進することが実証されています。さらに、HDL-C レベルの低下は、アテローム性動脈硬化症の発症と関連しています。疫学的研究により、心血管疾患の罹患率と死亡率は総 C と LDL-C のレベルに正比例し、HDL-C のレベルに反比例することが立証されています。 LDL と同様に、超低密度リポタンパク質 (VLDL)、中間密度リポタンパク質 (IDL)、およびレムナントを含む、コレステロールが豊富なトリグリセリドに富むリポタンパク質も、アテローム性動脈硬化を促進する可能性があります。 HDL-C の上昇または TG の低下が、冠状動脈および心血管の罹患率と死亡率のリスクに及ぼす独立した効果は、特定されていません。
ZETIA は、高脂血症患者の総 C、LDL-C、Apo B、非 HDL-C、および TG を減少させ、HDL-C を増加させます。 ZETIA 10mg とスタチンの併用投与は、血清総 C、LDL-C、Apo B、non-HDL-C、TG、および HDL-C をいずれかの治療単独よりも改善するのに効果的です。 ZETIA 10mg とフェノフィブラートの投与は、いずれかの治療単独と比較して、混合性高脂血症患者の血清総 C、LDL-C、Apo B、および非 HDL-C の改善に効果的です。エゼチミブを単独で、またはスタチンまたはフェノフィブラートに加えて投与した場合の、心血管疾患の罹患率および死亡率に対する効果は確立されていません。
薬物動態
吸収
経口投与後、エゼチミブは吸収され、薬理学的に活性なフェノール性グルクロニド (エゼチミブ-グルクロニド) に広く結合します。絶食した成人に ZETIA 10mg の 10mg を単回投与した後、平均エゼチミブ ピーク血漿濃度 (Cmax) は 3.4 ~ 5.5 ng/mL で、4 ~ 12 時間 (Tmax) 以内に達成されました。エゼチミブ-グルクロニドの平均 Cmax 値 45 ~ 71 ng/mL が 1 ~ 2 時間 (Tmax) で達成されました。 5 から 20 mg の間で、用量比例性からの実質的な逸脱はありませんでした。エゼチミブの絶対的なバイオアベイラビリティは、化合物が注射に適した水性媒体に実質的に不溶であるため、決定できません。
経口吸収に対する食物の影響
ZETIA 10 mg 錠剤として投与した場合、食事の同時投与 (高脂肪または無脂肪の食事) は、エゼチミブの吸収の程度に影響を与えませんでした。エゼチミブの C 値は、高脂肪食の摂取により 38% 増加しました。 ZETIA は食事の有無にかかわらず投与できます。
分布
エゼチミブおよびエゼチミブ-グルクロニドは、ヒト血漿タンパク質に強く結合します (> 90%)。
代謝と排泄
エゼチミブは、主に小腸と肝臓でグルクロニド抱合 (第 II 相反応) を介して代謝され、続いて胆汁と腎から排泄されます。評価したすべての種で、最小限の酸化的代謝(フェーズ I 反応)が観察されました。
ヒトでは、エゼチミブは急速にエゼチミブ-グルクロニドに代謝されます。エゼチミブおよびエゼチミベグルクロニドは、血漿中で検出される主要な薬物由来化合物であり、それぞれ血漿中の全薬物の約 10 ~ 20% および 80 ~ 90% を占めています。エゼチミブとエゼチミベ-グルクロニドはどちらも血漿から排出され、エゼチミベとエゼチミベグルクロニドの両方の半減期は約 22 時間です。血漿濃度-時間プロファイルは複数のピークを示し、腸肝リサイクルを示唆しています。
ヒト対象への 14C-エゼチミブ (20 mg) の経口投与後、総エゼチミブ (エゼチミブ + エゼチミブ-グルクロニド) は、血漿中の総放射能の約 93% を占めた。 48 時間後、血漿中に検出可能なレベルの放射能はありませんでした。
投与された放射能の約 78% と 11% が、10 日間の収集期間にわたって糞便と尿からそれぞれ回収されました。エゼチミブは糞便中の主成分であり、投与量の 69% を占め、エゼチミブ-グルクロニドは尿中の主成分であり、投与量の 9% を占めた。
特定の集団
高齢患者: エゼチミブ 10 mg を 1 日 1 回 10 日間投与した複数回投与試験では、総エゼチミブの血漿中濃度は、若い被験者と比較して、高齢者 (65 歳以上) の健康な被験者で約 2 倍高かった。
小児患者: [見る 特定の集団での使用 ]
性別: エゼチミブ 10 mg を 1 日 1 回 10 日間投与した複数回投与試験では、総エゼチミブの血漿中濃度は男性よりも女性の方がわずかに高かった (
人種: 複数回投与の薬物動態研究のメタ分析に基づくと、黒人と白人の被験者の間に薬物動態の違いはありませんでした。アジア人を対象とした研究では、エゼチミブの薬物動態が白人対象で見られるものと同様であることが示されました。
肝障害: エゼチミブ 10 mg の単回投与後、総エゼチミブの平均 AUC は、健康な被験者と比較して、軽度の肝障害 (Child-Pugh スコア 5 ~ 6) の患者で約 1.7 倍増加しました。総エゼチミブおよびエゼチミブの平均 AUC 値は、中等度 (Child-Pugh スコア 7 ~ 9) または重度の肝障害 (Child-Pugh スコア10 から 15)。中等度の肝障害を持つ患者を対象とした 14 日間の反復投与試験 (1 日 10 mg) では、総エゼチミブとエゼチミブの平均 AUC 値は、健康な被験者と比較して、1 日目と 14 日目に約 4 倍増加しました。中等度または重度の肝障害のある患者におけるエゼチミブへの暴露増加の影響は不明であるため、これらの患者には ZETIA は推奨されない [ 警告と注意事項 ]。
腎障害: 重度の腎疾患患者 (n=8; 平均 CrCl ≥ 30 mL/min/1.73 m²) に 10 mg のエゼチミブを単回投与した後、総エゼチミブ、エゼチミブ-グルクロニド、およびエゼチミブの平均 AUC 値は約 1.5 増加しました。 -倍、健康な被験者と比較して(n = 9)。
薬物相互作用
[こちらもご覧ください 薬物相互作用 ]
ZETIA 10mg は、健康な 12 人の「カクテル」研究において、シトクロム P450 (1A2、2D6、2C8/9、および 3A4) によって代謝されることが知られている一連のプローブ薬 (カフェイン、デキストロメトルファン、トルブタミド、および IV ミダゾラム) に対して有意な効果を示さなかった。成人男性。これは、エゼチミブがこれらのシトクロム P450 アイソザイムの阻害剤でも誘導剤でもないことを示しており、エゼチミブがこれらの酵素によって代謝される薬物の代謝に影響を与える可能性は低いです。
表 4:エゼチミブ総量に対する同時投与薬物の影響
表 5:エゼチミブ併用投与が他の薬剤への全身暴露に及ぼす影響
動物毒物学および/または薬理学
エゼチミブのコレステロール低下効果は、コレステロールを与えられたアカゲザル、イヌ、ラット、およびヒト コレステロール代謝のマウス モデルで評価されました。エゼチミブは、サルの血漿コレステロール値の上昇を抑制する ED50 値が 0.5 μg/kg/day であることがわかりました。イヌ、ラット、マウスにおける ED50 値は、それぞれ 7、30、700 μg/kg/日であった。これらの結果は、ZETIA が強力なコレステロール吸収阻害剤であることと一致しています。
エゼチミブのグルクロニド代謝産物 (SCH 60663) が十二指腸内に投与されたラットモデルでは、代謝産物は親化合物 (SCH 58235) と同程度にコレステロールの吸収を阻害する強力であり、グルクロニド代謝産物が親化合物と同様の活性を有することが示唆されました。薬。
エゼチミブ (0.03 ~ 300 mg/kg/日) を与えられたイヌでの 1 か月間の研究では、胆嚢胆汁中のコレステロール濃度が約 2 ~ 4 倍に増加しました。しかし、犬に 1 年間 300 mg/kg/日の用量を投与しても、胆石の形成やその他の肝胆道への悪影響はありませんでした。エゼチミブ (0.3 ~ 5 mg/kg/日) を与えられ、低脂肪またはコレステロールが豊富な食事を与えられたマウスでの 14 日間の研究では、胆嚢胆汁中のコレステロール濃度は、それぞれ影響を受けないか、正常レベルに減少しました。
コレステロール吸収を阻害するための ZETIA の選択性を決定するために、一連の急性前臨床試験が実施されました。エゼチミブは、14C-コレステロールの吸収を阻害し、トリグリセリド、脂肪酸、胆汁酸、プロゲステロン、エチニルエストラジオール、脂溶性ビタミン A および D の吸収には影響しませんでした。
マウスでの 4 ~ 12 週間の毒性試験では、エゼチミブはシトクロム P450 薬物代謝酵素を誘導しませんでした。毒性研究では、エゼチミブとスタチン(親またはその活性ヒドロキシ酸代謝産物)との薬物動態学的相互作用が、ラット、イヌ、およびウサギで見られました。
臨床研究
原発性高脂血症
ZETIA 10mg は、高脂血症患者の総 C、LDL-C、Apo B、非 HDL-C、および TG を減少させ、HDL-C を増加させます。通常、最大からほぼ最大の反応が 2 週間以内に達成され、慢性治療中も維持されます。
単剤療法
原発性高脂血症患者 1,719 人を対象とした 2 つの多施設二重盲検プラセボ対照 12 週間試験で、ZETIA は総 C、LDL-C、Apo B、非 HDL-C、および TG を有意に低下させ、HDL-を増加させました。プラセボと比較して C (表 6 を参照)。 LDL-C の減少は、年齢、性別、およびベースラインの LDL-C で一貫していました。
表 6: 原発性高脂血症患者における ZETIA 10mg に対する反応 (未治療のベースラインからの平均変化率†)
スタチンとの併用
継続中のスタチン療法に ZETIA 10mg を追加
多施設、二重盲検、プラセボ対照、8 週間の研究では、原発性高脂血症、既知の冠状動脈性心疾患、またはすでにスタチン単剤療法を受けているが、NCEP ATP II 目標 LDL を満たしていない複数の心血管危険因子を有する 769 人の患者-C 目標は、継続中のスタチンに加えて、ZETIA 10mg またはプラセボのいずれかを受け取るように無作為化されました。
進行中のスタチン療法に追加された ZETIA 10mg は、スタチン単独投与と比較して、総 C、LDL-C、Apo B、非 HDL-C、および TG を有意に低下させ、HDL-C を増加させました (表 7 を参照)。 ZETIA 10mg によって誘発された LDL-C の減少は、すべてのスタチンで一般的に一貫していました。
表 7: 高脂血症患者における継続中のスタチン療法への ZETIA 10mg の追加に対する反応 (治療ベースラインからの平均 % 変化‡)
スタチンと同時に ZETIA を開始
つの多施設、二重盲検、プラセボ対照、12 週間の試験で、2,382 人の高脂血症患者を対象に、ZETIA またはプラセボを単独で、またはさまざまな用量のアトルバスタチン、シンバスタチン、プラバスタチン、またはロバスタチンと一緒に投与しました。
ZETIA とスタチンを投与されたすべての患者を、対応するスタチンのみを投与されたすべての患者と比較すると、ZETIA 10 mg は、総 C、LDL-C、Apo B、非 HDL-C、および TG を有意に低下させ、プラバスタチンを除いて、単独で投与されたスタチンと比較して、HDL-Cが増加しました。 ZETIA 10mg によって誘発された LDL-C の減少は、すべてのスタチンで一般的に一貫していました。 (脚注 、表 8 ~ 11 を参照してください。)
表8:原発性高脂血症患者におけるZETIA 10mgとアトルバスタチンの同時開始に対する反応(未治療のベースラインからの平均変化率†)
表 9: 原発性高脂血症患者における ZETIA 10mg とシンバスタチンの同時開始に対する反応 (未治療のベースラインからの平均変化率†)
表 10: 原発性高脂血症患者で同時に開始された ZETIA およびプラバスタチンに対する反応 (未治療のベースラインからの平均 % 変化†)
表 11: 原発性高脂血症患者で同時に開始された ZETIA およびロバスタチンに対する反応 (未治療のベースラインからの平均 % 変化†)
フェノフィブラートとの併用
混合性高脂血症患者を対象とした多施設二重盲検プラセボ対照臨床試験では、625 人の患者が最大 12 週間、576 人がさらに最大 48 週間治療を受けました。患者は、12 週間の試験で、プラセボ、ZETIA 単独、160 mg のフェノフィブラート単独、または ZETIA 10 mg と 160 mg のフェノフィブラートを投与される群に無作為に割り付けられました。 12 週間の研究を完了した後、適格な患者は、さらに 48 週間、フェノフィブラートまたはフェノフィブラート単独療法と同時投与される ZETIA に割り当てられました。
ZETIA 10mg をフェノフィブラートと併用投与すると、フェノフィブラートを単独で投与した場合と比較して、総 C、LDL-C、Apo B、および非 HDL-C が有意に低下しました。フェノフィブラートと同時投与された ZETIA の TG のパーセント減少および HDLC のパーセント増加は、単独で投与されたフェノフィブラートの場合と同等でした (表 12 を参照)。
表 12: 混合性高脂血症患者における ZETIA 10mg とフェノフィブラートの同時開始に対する反応 (12 週間での未治療ベースラインからの平均変化率†)
フェノフィブラートと併用投与された ZETIA またはフェノフィブラート単独でさらに 48 週間治療した後の脂質エンドポイントの変化は、上記の 12 週間のデータと一致していました。
ホモ接合性家族性高コレステロール血症 (HoFH)
HoFH の治療における ZETIA の有効性を評価するための研究が実施されました。この二重盲検、無作為化、12 週間の研究では、アトルバスタチンまたはシンバスタチン (40 mg) をすでに投与されており、付随する LDL アフェレーシスの有無にかかわらず、HoFH の臨床的および/または遺伝子型診断を受けた 50 人の患者が登録されました。患者は、アトルバスタチンまたはシンバスタチン (80 mg)、ZETIA 10 mg とアトルバスタチンまたはシンバスタチン (40 mg)、または ZETIA とアトルバスタチンまたはシンバスタチン (80 mg) の 3 つの治療グループのいずれかに無作為に割り付けられました。コレスチラミンを併用している患者では、エゼチミブのバイオアベイラビリティが低下するため [参照 薬物相互作用 ]、エゼチミブは樹脂投与の少なくとも4時間前または4時間後に投与された。ベースラインの平均 LDL-C は、アトルバスタチン 80 mg またはシンバスタチン 80 mg 単独に無作為に割り付けられた患者で 341 mg/dL、ZETIA 10 mg とアトルバスタチン 40 または 80 mg またはシンバスタチン 40 または 80 mg に無作為に割り付けられたグループで 316 mg/dL でした。アトルバスタチンまたはシンバスタチン (40 mg および 80 mg のスタチン群、プール) と一緒に投与された ZETIA 10 mg は、シンバスタチンまたはアトルバスタチンの単剤療法の用量を 40 から 80 mg (7%) に増やした場合 (7%) と比較して、LDL-C を有意に減少させました (21%)。 ZETIA 10mg と 80mg のアトルバスタチン、または ZETIA 10mg と 80mg のシンバスタチンで治療された患者では、LDL-C が 27% 減少しました。
ホモ接合性シトステロール血症(フィトステロール血症)
ホモ接合性シトステロール血症の治療における ZETIA の有効性を評価するために、研究が実施されました。この多施設、二重盲検、プラセボ対照、8 週間の試験では、血漿シトステロール濃度が上昇した (> 5 mg/dL) ホモ接合型シトステロール血症の 37 人の患者が、現在の治療レジメン (食事療法、胆汁酸結合樹脂、スタチン、回腸バイパス手術および/または LDL アフェレーシス) は、ZETIA (n=30) またはプラセボ (n=7) を受けるように無作為化されました。コレスチラミンを併用している患者では、エゼチミブのバイオアベイラビリティが低下するため [参照 薬物相互作用 ]、エゼチミブは樹脂投与の少なくとも 2 時間前または 4 時間後に投与されました。 LDL アフェレーシスを受けた 1 人の被験者を除くと、ZETIA は血漿シトステロールとカンペステロールをベースラインからそれぞれ 21% と 24% 大幅に低下させました。対照的に、プラセボを投与された患者では、シトステロールとカンペステロールがベースラインからそれぞれ 4% と 3% 増加しました。 ZETIA 10mgで治療された患者では、植物ステロールの平均血漿レベルは、研究の過程で徐々に減少しました.血漿シトステロールとカンペステロールの減少が心血管疾患の罹患率と死亡率のリスクを軽減する効果は確立されていません.
シトステロールとカンペステロールの減少は、胆汁酸封鎖剤と併用して ZETIA 10mg を服用している患者 (n=8) と、胆汁酸封鎖剤療法を併用していない患者 (n=21) の間で一貫していました。
使用制限
ZETIA 10mg の心血管疾患の罹患率および死亡率に対する効果は、まだ確認されていません。
患者情報
ゼティア® (エゼチミベ)錠
ZETIA(zet´-ea)に関する患者情報
一般名:エゼチミベ(e-zet´-e-mib)
ZETIA®の摂取を開始する前、およびZETIAを摂取するたびに、この情報を注意深くお読みください。新しい情報があるかもしれません。この情報は、あなたの病状や治療について医師と話すことに代わるものではありません。 ZETIAについてご不明な点がございましたら、医師にご相談ください。 ZETIAがあなたに適しているかどうかを判断できるのは、あなたの医師だけです。
ZETIAとは?
ZETIA は、血中の総コレステロールと LDL (悪玉) コレステロールのレベルを下げるために使用される薬です。 ZETIAは、食事や運動だけではコレステロール値をコントロールできない患者さん向けの製品です。高コレステロールを治療するために、単独で、または他の薬と一緒に使用できます。この薬を服用している間は、コレステロールを下げる食事を続けてください。
ZETIA は、体が吸収するコレステロールの量を減らすように働きます。 ZETIA 10mg は体重を減らすのに役立ちません。 ZETIA 10mg が心臓病や心臓発作を予防することは証明されていません。
コレステロールの詳細については、「高コレステロールについて何を知っておくべきですか?」を参照してください。次のセクション。
ZETIA 10mgを服用してはいけない人は?
- ZETIAの有効成分であるエゼチミブ、または不活性成分にアレルギーがある場合は、ZETIA 10mgを服用しないでください。不活性成分のリストについては、次の「不活性成分」セクションを参照してください。
- 活動性の肝疾患がある場合は、スタチンと呼ばれるコレステロール低下薬を服用している間は ZETIA 10mg を服用しないでください。
- 妊娠中または授乳中の方は、スタチンを服用している間は ZETIA を服用しないでください。
- 妊娠適齢期の女性は、スタチン療法にZETIAを併用しながら効果的な避妊法で避妊する必要があります。
ZETIA は 10 歳未満の子供では研究されていません。
ZETIA 10mgを服用する前と服用中は、医師に何を伝えるべきですか?
自然療法または薬草療法を含む、現在服用中または服用予定の処方薬および非処方薬について医師に伝えてください。
アレルギーを含むすべての病状について医師に伝えてください。
次の場合は医師に相談してください。
- 肝臓に問題があったことがあります。 ZETIA 10mgはあなたに合わないかもしれません.
- 妊娠している、または妊娠する予定がある。 ZETIA 10mg があなたに適しているかどうかについては、担当の医師と相談してください。
- 授乳中です。 ZETIA 10mg が母乳を通じて赤ちゃんに移行するかどうかはわかりません。 ZETIA 10mg があなたに適しているかどうかについては、担当の医師と相談してください。
- 原因不明の筋肉痛、圧痛、または筋力低下を経験する。
ZETIA 10mgの服用方法は?
- 食事の有無にかかわらず、ゼティアを 1 日 1 回服用してください。朝食、夕食、または就寝前など、毎日同じ時間に服用すると、服用を覚えやすくなる場合があります.コレステロールを下げるために別の薬も服用している場合は、同時に服用できるかどうか医師に相談してください.
- ZETIAを飲み忘れた場合は、気がついたときにすぐに服用してください。ただし、ゼティアの1日1回以上の服用は避けてください。
- ZETIAを服用している間は、コレステロールを下げる食事を続けてください.食事に関する情報が必要な場合は、医師に相談してください。
- 医師の指示がない限り、ZETIA 10mg を服用し続けてください。気分が悪くなくてもゼティア10mgを飲み続けることが大切です。
- 定期的に医師の診察を受けて、コレステロール値をチェックし、副作用がないか確認してください。スタチンと一緒に ZETIA の服用を開始する前、および治療中に、医師が血液検査を行って肝臓をチェックする場合があります。
ZETIAの考えられる副作用は何ですか?
臨床研究では、患者は ZETIA の服用中にほとんど副作用が報告されていません。これらには、下痢、関節痛、疲労感が含まれます。
患者は、ZETIA 10mg を服用しているときに、通常は ZETIA 10mg をスタチン薬に追加したときに、重度の筋肉の問題を経験しています。 ZETIAの服用中に原因不明の筋肉痛、圧痛、または脱力感を感じた場合は、すぐに医師に連絡してください.まれに、これらの筋肉の問題が深刻な場合があり、筋肉の分解が腎臓の損傷を引き起こす可能性があるため、これを迅速に行う必要があります.
さらに、次の副作用が一般的な使用で報告されています: アレルギー反応 (すぐに治療が必要な場合があります) 呼吸や嚥下の困難を引き起こす可能性のある顔、唇、舌、喉の腫れ、発疹、蕁麻疹など;隆起した赤い発疹、時には標的型の病変を伴う。関節痛;筋肉痛;いくつかの実験室の血液検査の変化;肝臓の問題;胃痛;膵臓の炎症;吐き気;めまい;チクチクする感覚;うつ;頭痛;胆石;胆嚢の炎症。
ZETIAの服用中にこれらまたはその他の医学的問題がある場合は、医師に相談してください.副作用の完全なリストについては、医師または薬剤師にお尋ねください。
高コレステロールについて何を知っておくべきですか?
コレステロールは、血液中に見られる脂肪の一種です。総コレステロールは、LDL コレステロールと HDL コレステロールで構成されています。
LDL コレステロールは、動脈壁に蓄積してプラークを形成する可能性があるため、「悪玉」コレステロールと呼ばれます。時間が経つにつれて、プラークの蓄積が動脈の狭窄を引き起こす可能性があります.この狭窄により、心臓、脳、その他の臓器への血流が遅くなったり、ブロックされたりする可能性があります。高 LDL コレステロールは心臓病の主な原因であり、脳卒中の原因の 1 つです。
HDL コレステロールは、悪玉コレステロールが動脈に蓄積するのを防ぐため、「善玉」コレステロールと呼ばれます。
トリグリセリドは、血液中に見られる脂肪でもあります。
ZETIAの一般情報
医薬品は、患者情報リーフレットに記載されていない状態に対して処方されることがあります。 ZETIA 10mg を処方されていない状態に使用しないでください。他の人があなたと同じ状態であっても、ZETIA を与えないでください。それらに害を及ぼす可能性があります。
これは、ZETIAに関する最も重要な情報をまとめたものです。さらに詳しい情報が必要な場合は、医師に相談してください。医療専門家向けに書かれた ZETIA 10mg に関する情報については、薬剤師または医師にお尋ねください。
不活性成分 :
クロスカルメロースナトリウム、ラクトース一水和物、ステアリン酸マグネシウム、微結晶性セルロース、ポビドン、およびラウリル硫酸ナトリウム。
