Crestor 10mg, 20mg, 5mg Rosuvastatin 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
クレストールとは何ですか?
クレストールは、血中の LDL コレステロール (低密度リポタンパク質) とトリグリセリドを低下させ、血管内のプラークの進行を遅らせ、脳卒中や心臓発作のリスクを軽減するために使用される処方薬です。クレストール 20mg は、単独で使用することも、他の薬と併用することもできます。
クレストールは、脂質低下剤、スタチン、HMG-CoA レダクターゼ阻害剤です。
クレストールが 8 歳未満の子供に安全で有効であるかどうかはわかっていません。
クレストールの副作用にはどのようなものがありますか?
クレストールは、次のような重大な副作用を引き起こす可能性があります。
- 原因不明の筋肉痛
- 筋肉の圧痛
- 筋力低下
- 錯乱
- メモリの問題
- 胃の上部の痛み
- 疲れ
- 食欲減少
- 暗い尿
- 皮膚や目が黄色くなる(黄疸)
上記の症状がある場合は、すぐに医療機関を受診してください。
クレストールの最も一般的な副作用は次のとおりです。
- 頭痛
- 弱点
- 筋肉痛
- 吐き気
- 胃痛
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、クレストールの考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
クレストール(ロスバスタチンカルシウム)は、経口投与用の合成脂質低下剤です。
ロスバスタチンカルシウムの化学名は、ビス[(E)-7-[4-(4-フルオロフェニル)-6-イソプロピル-2-[メチル(メチルスルホニル)アミノ]ピリミジン-5-イル](3R,5S)-3です。 ,5-ジヒドロキシヘプタ-6-エン酸]カルシウム塩で、次の構造式:
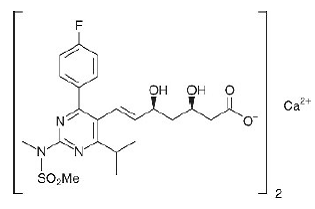
ロスバスタチン カルシウムの実験式は (C22H27FN3O6S)2Ca で、分子量は 1001.14 です。ロスバスタチン カルシウムは、水とメタノールにやや溶けにくく、エタノールにわずかに溶ける白色の無定形粉末です。ロスバスタチン カルシウムは、pH 7.0 で分配係数 (オクタノール/水) が 0.13 の親水性化合物です。
経口投与用のクレストール錠には、5、10、20、または 40 mg のロスバスタチンと次の不活性成分が含まれています。トリアセチン NF、二酸化チタン USP、黄色酸化第二鉄、および赤色酸化第二鉄 NF。
適応症
高脂血症および混合性脂質異常症
クレストールは、原発性高脂血症または混合型脂質異常症の成人患者において、Total-C、LDL-C、ApoB、nonHDL-C、およびトリグリセリドの上昇を抑え、HDL-C を増加させるための食事補助療法として適応されます。食事や非薬理学的介入だけでは不十分な場合は、飽和脂肪とコレステロールを制限した食事に加えて、脂質改変剤を使用する必要があります。
家族性高コレステロール血症の小児患者
クレストール 10mg は、以下の食事の補助として適応されます。
- 食事療法の適切な試験の後、次の所見が存在する場合、ヘテロ接合体家族性高コレステロール血症の8歳から17歳の小児および青年のTotal-C、LDL-C、およびApoBレベルを下げる: LDL-C >190 mg/dL、または >160 mg/dL と、早期心血管疾患 (CVD) または 2 つ以上の他の CVD 危険因子の家族歴があります。
- 家族性高コレステロール血症のホモ接合体である 7 歳から 17 歳の小児および青年の LDL-C、Total-C、nonHDL-C、および ApoB を、単独で、または他の脂質低下治療(LDL アフェレーシスなど)とともに減少させる。
高トリグリセリド血症
クレストールは、高トリグリセリド血症の成人患者の治療のための食事補助療法として適応されます。
原発性β-リポタンパク血症(III型高リポタンパク血症)
クレストールは、原発性異常βリポタンパク血症(III型高リポタンパク血症)の成人患者の治療のための食事の補助として適応されます。
ホモ接合性家族性高コレステロール血症の成人患者
CRESTOR は、他の脂質低下治療(LDL アフェレーシスなど)の補助療法として適応されるか、ホモ接合型家族性高コレステロール血症の成人患者で LDL-C、Total-C、および ApoB を低下させる治療が利用できない場合は単独で適応となります。
アテローム性動脈硬化症の進行を遅らせる
クレストール 5mg は、Total-C と LDL-C を目標レベルまで下げる治療戦略の一環として、成人患者のアテローム性動脈硬化の進行を遅らせるための食事補助療法として適応されます。
心血管疾患の一次予防
臨床的に明らかな冠状動脈性心疾患を有していないが、男性で 50 歳以上、女性で 60 歳以上、hsCRP ≧2 mg/L、および少なくとも 1 つの追加の心血管疾患の存在に基づいて、心血管疾患のリスクが高い個人高血圧、低 HDL-C、喫煙、または早期冠状動脈性心疾患の家族歴などの危険因子がある場合、CRESTOR は次のように適応されます。
- 脳卒中のリスクを減らす
- 心筋梗塞のリスクを減らす
- 動脈血行再建術のリスクを軽減
使用制限
クレストールは、フレドリクソン I 型および V 型脂質異常症では研究されていません。
投薬と管理
一般的な投与情報
成人のクレストール5mgの用量範囲は、1日1回経口で5~40mgです。通常、1日1回10~20mgから開始します。ホモ接合型家族性高コレステロール血症の成人患者における通常の開始用量は、1 日 1 回 20 mg です。
クレストール 20mg の最大用量である 40mg は、20mg の用量を使用しても LDL-C の目標を達成できなかった患者にのみ使用する必要があります。 警告と注意事項 ]。
クレストール 5mg は、食事の有無にかかわらず、いつでも単回投与できます。錠剤は丸ごと飲み込む必要があります。
クレストール療法を開始するとき、または別のHMG-CoAレダクターゼ阻害薬療法から切り替えるときは、最初に適切なクレストール10mgの開始用量を使用し、その後、患者の反応と治療の個々の目標に従って漸増する必要があります.
クレストールの開始後または滴定後、脂質レベルを 2 ~ 4 週間以内に分析し、それに応じて用量を調整する必要があります。
小児への投与
ヘテロ接合型家族性高コレステロール血症では、推奨用量範囲は、8 歳から 10 歳未満の患者では 5 から 10 mg を 1 日 1 回経口で、10 歳から 17 歳の患者では 1 日 1 回経口で 5 から 20 mg です。
ホモ接合型家族性高コレステロール血症では、推奨用量は 7 歳から 17 歳の患者で 1 日 1 回経口で 20 mg です。
アジア人患者への投与
アジアの患者さんでは、ロスバスタチンの血漿中濃度が上昇しているため、1 日 1 回 5 mg のクレストール 20 mg 療法の開始を検討してください。 1 日 20 mg までの用量で十分に管理されていないアジア人患者を治療する場合は、全身暴露の増加を考慮に入れる必要があります。 特定の集団での使用 と 臨床薬理学 ]。
併用療法での使用
シクロスポリンを服用している患者
クレストール 20mg の用量は、1 日 1 回 5mg を超えてはならない [ 警告と注意事項 、 薬物相互作用 と 臨床薬理学 ]。
ゲムフィブロジルを服用している患者
クレストールとゲムフィブロジルの併用は避けてください。併用が避けられない場合は、クレストール5mgを1日1回から開始してください。クレストールの用量は、1 日 1 回 10 mg を超えてはなりません。 警告と注意事項 、 薬物相互作用 と 臨床薬理学 ]。
アタザナビルとリトナビル、ロピナビルとリトナビル、またはシメプレビルを服用している患者
クレストール 10mg 療法は、1 日 1 回 5mg から開始してください。クレストールの用量は、1 日 1 回 10 mg を超えてはなりません。 警告と注意事項 、 薬物相互作用 と 臨床薬理学 ]。
重度の腎障害のある患者への投与
血液透析を受けていない重度の腎機能障害 (CLcr 特定の集団での使用 と 臨床薬理学 ]。
供給方法
剤形と強度
5 mg: 黄色、円形、両凸、コーティング錠。錠剤の片面に「CRESTOR」と「5」のデボス加工。
10mg:ピンク色、丸型、両凸型、コーティング錠。錠剤の片面に「CRESTOR」と「10」の刻印。
20mg:ピンク色、丸型、両凸型、コーティング錠。錠剤の片面に「CRESTOR」と「20」の刻印。
40 mg: ピンク、楕円形、両凸、コーティング錠。片面に「CRESTOR」、もう片面に「40」のデボス加工。
保管と取り扱い
クレストール®(ロスバスタチンカルシウム)錠 次のように提供されます。
NDC 0310-0755-90: 5mg。黄色、丸型、両凸、コーティング錠。片面に「CRESTOR」と「5」の型押し。 90錠のボトル
NDC 0310-0751-90: 10mg。ピンク、丸、両凸、コーティング錠。片面に「CRESTOR」と「10」の型押し。 90錠のボトル
NDC 0310-0751-39: 10mg。ピンク、丸、両凸、コーティング錠。片面に「CRESTOR」と「10」の型押し。 100個の単位用量パッケージ
NDC 0310-0752-90: 20mg。ピンク、丸、両凸、コーティング錠。片面に「CRESTOR」と「20」の型押し。 90本のボトル
NDC 0310-0752-39: 20mg。ピンク、丸、両凸、コーティング錠。片面に「CRESTOR」と「20」の型押し。 100個の単位用量パッケージ
NDC 0310-0754-30: 40mg。ピンク、楕円形、両凸、コーティング錠。片面に「CRESTOR」、もう片面に「40」のデボス加工。 30本のボトル
保管所
制御された室温、20 ~ 25°C (68 ~ 77°F) で保管してください [ USP制御の室温 ]。湿気から保護してください。
販売元: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. 改訂: 2018 年 9 月
副作用
次の重篤な副作用については、ラベルの他のセクションで詳しく説明しています。
- ミオグロビン尿および急性腎不全およびミオパチー(筋炎を含む)を伴う横紋筋融解症[参照 警告と注意事項 ]
- 肝酵素異常[参照 警告と注意事項 ]
臨床研究経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用の発生率を別の医薬品の臨床試験で観察された発生率と直接比較することはできず、臨床現場で観察された発生率を反映していない可能性があります。
平均治療期間15週間の5394人の患者のCRESTOR対照臨床試験データベース(プラセボまたは実薬対照)では、患者の1.4%が副作用のために中止されました。治療の中止につながった最も一般的な副作用は次のとおりです。
- 筋肉痛
- 腹痛
- 吐き気
5,394 人の患者のクレストール 5mg 対照臨床試験データベースで最も一般的に報告された副作用 (発生率 ≥2%) は次のとおりです。
- 頭痛
- 筋肉痛
- 腹痛
- 無力症
- 吐き気
プラセボ対照臨床試験で 2% 以上の患者で報告され、プラセボよりも高い率で報告された有害反応を表 1 に示します。これらの試験では、最大 12 週間の治療期間がありました。
臨床試験で報告されたその他の副作用は、腹痛、めまい、過敏症(発疹、かゆみ、蕁麻疹、血管性浮腫を含む)、膵炎でした。次の臨床検査値異常も報告されています:ディップスティック陽性のタンパク尿および顕微鏡的血尿[ 警告と注意事項 ];クレアチンホスホキナーゼ、トランスアミナーゼ、グルコース、グルタミルトランスペプチダーゼ、アルカリホスファターゼ、およびビリルビンの上昇;そして甲状腺機能異常。
ロスバスタチン 40 mg (n=700) またはプラセボ (n=281) で治療され、平均治療期間が 1.7 年の 981 人の参加者を含む METEOR 研究では、クレストール 5mg で治療された被験者の 5.6% に対して、プラセボで治療された被験者の 2.8% でした。副作用のため中止。治療の中止につながった最も一般的な副作用は、筋肉痛、肝酵素の増加、頭痛、および吐き気でした。 臨床研究 ]。
患者の 2% 以上でプラセボより高い率で報告された有害反応を表 2 に示します。
JUPITER 研究では、17,802 人の参加者がロスバスタチン 20 mg (n=8901) またはプラセボ (n=8901) で平均 2 年間治療されました。ロスバスタチンで治療された患者とプラセボで治療された患者の割合がそれぞれ 6.6% と 6.2% と高く、治療の因果関係に関係なく、有害事象のために治験薬を中止しました。筋肉痛は、治療中止に至った最も一般的な副作用でした。
JUPITER では、ロスバスタチンを服用している患者 (2.8%) とプラセボを服用している患者 (2.3%) で糖尿病の頻度が有意に高かったことが報告されました。平均 HbA1c は、プラセボ治療患者と比較して、ロスバスタチン治療患者で 0.1% 有意に増加しました。試験終了時に HbA1c が 6.5% を超える患者の数は、ロスバスタチンで治療された患者とプラセボで治療された患者で有意に高かった [参照 警告と注意事項 と 臨床研究 ]。
患者の 2% 以上でプラセボより高い率で報告された有害反応を表 3 に示します。
ヘテロ接合性家族性高コレステロール血症の小児患者
家族性高コレステロール血症ヘテロ接合体の 10 歳から 17 歳の男児および初潮後の女児を対象とした 12 週間の対照試験では、1 日あたり 5 ~ 20 mg のクレストールを使用した [参照 特定の集団での使用 と 臨床研究 ]、血清クレアチンホスホキナーゼ(CK)の上昇> 10 x ULNが、プラセボ治療を受けた子供と比較して、ロスバスタチンでより頻繁に観察されました。ロスバスタチンで治療された 130 人中 4 人 (3%) の子供 (2 人は 10 mg で治療され、2 人は 20 mg で治療された) は、プラセボの子供 46 人中 0 人と比較して、CK が 10 x ULN を超えて増加した。
市販後の経験
クレストールの承認後の使用中に、以下の有害反応が確認されています:関節痛、致命的および非致命的な肝不全、肝炎、黄疸、血小板減少症、うつ病、睡眠障害(不眠症および悪夢を含む)、末梢神経障害、間質性肺疾患および女性化乳房。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
スタチンの使用に関連する免疫介在性壊死性ミオパチーのまれな報告がある[参照 警告と注意事項 ]。
スタチンの使用に関連する認知障害(例:記憶喪失、物忘れ、健忘症、記憶障害、および錯乱)のまれな市販後の報告がありました。これらの認知の問題は、すべてのスタチンで報告されています。報告は一般に重篤ではなく、スタチンの中止により回復可能であり、症状の発症までの時間 (1 日から数年) と症状の消失 (中央値で 3 週間) はさまざまです。
薬物相互作用
シクロスポリン
シクロスポリンはロスバスタチンへの曝露を増加させ、ミオパチーのリスクを高める可能性があります。したがって、シクロスポリンを服用している患者では、クレストール 10mg の用量は 1 日 1 回 5mg を超えてはなりません。 投薬と管理 、 警告と注意事項 と 臨床薬理学 ]。
ゲムフィブロジル
ゲムフィブロジルは、ロスバスタチンへの曝露を大幅に増加させました。ミオパシー/横紋筋融解症のリスク増加が観察されているため、クレストールとゲムフィブロジルの併用療法は避けるべきです。併用する場合、クレストール 10mg の用量は 1 日 1 回 10mg を超えてはなりません。 臨床薬理学 ]。
プロテアーゼ阻害剤
ロスバスタチンと特定のプロテアーゼ阻害剤との同時投与は、ロスバスタチンへの曝露にさまざまな影響を及ぼし、ミオパシーのリスクを高める可能性があります。 C型肝炎ウイルス(HCV)プロテアーゼ阻害剤であるシメプレビル、またはHIV-1プロテアーゼ阻害剤であるアタザナビル/リトナビルまたはロピナビル/リトナビルの組み合わせは、ロスバスタチン曝露を増加させる[表4を参照- 臨床薬理学 ]。これらのプロテアーゼ阻害剤の場合、クレストール 5mg の用量は 1 日 1 回 10mg を超えてはなりません。 HIV-1 プロテアーゼ阻害剤であるホスアンプレナビル/リトナビルまたはチプラナビル/リトナビルの組み合わせは、ロスバスタチン曝露にほとんどまたはまったく変化を生じません。ロスバスタチンをプロテアーゼ阻害剤と併用する場合は注意が必要です[ 投薬と管理 、 警告と注意事項 と 臨床薬理学 ]。
クマリン抗凝固剤
クレストール 20mg は、クマリン抗凝固剤を投与されている患者の INR を有意に増加させました。したがって、クマリン抗凝固剤をクレストールと併用する場合は注意が必要です。クマリン抗凝固薬とクレストールを同時に服用している患者では、クレストールを開始する前に INR を測定し、INR の有意な変化が起こらないことを確認するために早期治療中に十分な頻度で測定する必要があります。 警告と注意事項 と 臨床薬理学 ]。
ナイアシン
クレストール 5mg をナイアシンの脂質修飾用量 (≥1 g/日) と組み合わせて使用すると、骨格筋への影響のリスクが高まる可能性があります。クレストールを処方するときは注意が必要です。 警告と注意事項 ]。
フェノフィブラート
クレストール 20mg をフェノフィブラートと併用投与した場合、ロスバスタチンまたはフェノフィブラートの AUC に臨床的に有意な増加は認められませんでした。 HMG-CoAレダクターゼ阻害剤による治療中のミオパシーのリスクは、フェノフィブラートの併用によって増加することが知られているため、フェノフィブラートとクレストールを処方する場合は注意が必要です[ 警告と注意事項 と 臨床薬理学 ]。
コルヒチン
横紋筋融解症を含むミオパシーの症例は、ロスバスタチンを含む HMG-CoA レダクターゼ阻害剤をコルヒチンと併用投与した場合に報告されており、CRESTOR とコルヒチンを処方する場合は注意が必要です。 警告と注意事項 ]。
警告
の一部として含まれています 予防 セクション。
予防
骨格筋効果
ミオグロビン尿症に続発する急性腎不全を伴うミオパシーおよび横紋筋融解症の症例は、CRESTOR を含む HMG-CoA レダクターゼ阻害剤で報告されています。これらのリスクはどの用量レベルでも発生する可能性がありますが、最高用量 (40 mg) で増加します。
クレストール 5mg は、ミオパシーの素因を有する患者 (例、65 歳以上、治療が不十分な甲状腺機能低下症、腎障害) を有する患者には注意して処方する必要があります。クレストール 5mg による治療中のミオパシーのリスクは、他の脂質低下療法(フィブラートまたはナイアシン)、ゲムフィブロジル、シクロスポリン、アタザナビル/リトナビル、ロピナビル/リトナビル、またはシメプレビルの同時投与によって増加する可能性があります。 投薬と管理 と 薬物相互作用 ]。横紋筋融解症を含むミオパシーの症例は、ロスバスタチンを含むHMG-CoAレダクターゼ阻害剤をコルヒチンと併用投与した場合に報告されており、クレストールとコルヒチンを処方する際には注意が必要です[ 薬物相互作用 ]。
クレアチンキナーゼレベルが著しく上昇した場合、またはミオパシーが診断または疑われる場合は、クレストール療法を中止する必要があります。ミオパシーを示唆する、または横紋筋融解症に続発する腎不全の発症の素因となる急性の重篤な状態(例えば、敗血症、低血圧、脱水、大手術、外傷、重度の代謝、内分泌、および電解質障害、または制御不能な発作)。
スタチンの使用に関連する自己免疫性ミオパシーである免疫介在性壊死性ミオパチー (IMNM) のまれな報告があります。 IMNM の特徴は次のとおりです。近位筋の筋力低下と血清クレアチンキナーゼの上昇。重大な炎症のない壊死性ミオパシーを示す筋生検;免疫抑制剤で改善。
すべての患者は、特に倦怠感や発熱を伴う場合、またはクレストールの中止後も筋肉の徴候や症状が持続する場合に、原因不明の筋肉痛、圧痛、または筋力低下を速やかに医師に報告するようにアドバイスする必要があります。
肝酵素異常
クレストール10mgの投与開始前、および肝障害の徴候または症状が発生した場合は、肝酵素検査を実施することをお勧めします。
血清トランスアミナーゼ [AST (SGOT) または ALT (SGPT)] の増加は、CRESTOR を含む HMG-CoA レダクターゼ阻害剤で報告されています。ほとんどの場合、上昇は一時的なものであり、治療を継続するか、治療を短時間中断した後に解消または改善されました。クレストール治療との関連が不明な黄疸は 2 例認められたが、治療中止後に回復した。これらの試験では、肝不全や不可逆的な肝疾患の症例はありませんでした。プラセボ対照試験のプール分析では、血清トランスアミナーゼが正常上限の 3 倍以上に増加したのは、クレストール 5mg を服用した患者の 1.1% に対して、プラセボを服用した患者の 0.5% でした。
ロスバスタチンを含むスタチンを服用している患者の致命的および非致命的な肝不全のまれな市販後の報告がありました.クレストール20mgの治療中に、臨床症状を伴う重篤な肝障害および/または高ビリルビン血症または黄疸が発生した場合は、直ちに治療を中断してください。別の病因が見つからない場合は、CRESTOR を再起動しないでください。
クレストール 5mg は、相当量のアルコールを摂取している患者、および/または慢性肝疾患の病歴がある患者には注意して使用する必要があります [ 臨床薬理学 ]。原因不明の持続的なトランスアミナーゼ上昇を含む可能性のある活動性肝疾患は、クレストールの使用に対する禁忌です[ 禁忌 ]。
併用クマリン抗凝固薬
プロトロンビン時間/INRの延長におけるクマリン型抗凝固剤の効果を増強するため、抗凝固剤をクレストールと併用して投与する場合は注意が必要です。クマリン抗凝固剤とクレストールを併用している患者では、クレストール10mgを開始する前にINRを測定し、早期治療中に頻繁にINRの有意な変化が起こらないことを確認する必要があります。 薬物相互作用 ]。
蛋白尿と血尿
CRESTOR 臨床試験プログラムでは、CRESTOR 治療を受けた患者に尿試験紙陽性のタンパク尿と顕微鏡的血尿が観察されました。これらの所見は、低用量のクレストール 20mg または比較対象の HMG-CoA レダクターゼ阻害剤と比較して、クレストール 40mg を服用している患者でより頻繁に見られましたが、一般的に一過性であり、腎機能の悪化とは関連していませんでした。この所見の臨床的意義は不明ですが、定期的な尿検査中に原因不明の持続性タンパク尿および/または血尿がみられるクレストール療法を受けている患者には、減量を検討する必要があります。
内分泌への影響
CRESTORを含むHMG-CoAレダクターゼ阻害剤により、HbA1cおよび空腹時血清グルコースレベルの上昇が報告されています。クレストールの臨床試験データに基づくと、場合によっては、これらの増加が糖尿病の診断のしきい値を超える可能性があります [参照 有害反応 ]。
臨床試験では、クレストール 10mg 単独では血漿コルチゾールの基礎濃度が低下したり、副腎予備能が損なわれたりしないことが示されていますが、ケトコナゾール、スピロノラクトン、およびシメチジン。
患者相談情報
患者に、FDA 承認の患者ラベル ( 患者情報 )。
クレストールを 12 時間以内に 2 回服用しないように患者に指示する必要があります。
骨格筋効果
特に倦怠感や発熱を伴う場合、またはこれらの筋肉の徴候や症状がクレストールの中止後も持続する場合は、説明のつかない筋肉の痛み、圧痛、または筋力低下を速やかに報告するよう患者に助言する必要があります。
制酸剤の併用
クレストール5mgを水酸化アルミニウム・マグネシウム配合制酸剤と併用する場合、制酸剤はクレストール10mg投与後2時間以上あけて服用してください。
胚胎児毒性
女性には、胎児へのリスクの生殖能力、治療中は効果的な避妊法を使用すること、妊娠または妊娠の疑いがある場合は医療提供者に知らせることをアドバイスしてください。 [見る 禁忌 と 特定の集団での使用 ]。
授乳
クレストールによる治療中は授乳しないように女性に助言する[参照 禁忌 と 特定の集団での使用 ]。
肝酵素
クレストールの開始前、および肝障害の徴候または症状が発生した場合は、肝酵素検査を実施することをお勧めします。クレストールで治療を受けているすべての患者は、疲労、食欲不振、右上腹部の不快感、暗色尿、黄疸など、肝臓の損傷を示す可能性のある症状があれば速やかに報告するように指導する必要があります。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
強制経口経口投与による 2、20、60、または 80 mg/kg/日の用量レベルでのラットにおける 104 週間の発がん性試験では、子宮間質ポリープの発生率は、全身投与で 80 mg/kg/日の雌で有意に増加した。 AUC に基づく 40 mg/日でのヒトの暴露の 20 倍の暴露。低用量では、ポリープの発生率の増加は見られませんでした。
10、60、または 200 mg/kg/日を強制経口投与したマウスの 107 週間の発がん性試験で、肝細胞腺腫/がんの発生率の増加が、ヒト暴露の 20 倍の全身暴露で 200 mg/kg/日で観察されました。 AUCに基づいて40 mg /日で。肝細胞腫瘍の発生率の増加は、低用量では見られませんでした。
ロスバスタチンは、ネズミチフス菌および大腸菌を用いたエイムズ試験、マウスリンパ腫試験、およびチャイニーズハムスター肺細胞における染色体異常試験において、代謝活性化の有無にかかわらず、変異原性または染色体異常誘発性を示さなかった。ロスバスタチンは、in vivo マウス小核試験で陰性でした。
5、15、50 mg/kg/日の経口強制経口投与によるラット受精能試験では、雄は交配前と交配中の 9 週間、雌は交配の 2 週間前と交配中の妊娠 7 日まで投与されました。 50 mg/kg/日で受胎能への影響が観察された (AUC に基づく 40 mg/日でのヒト暴露の最大 10 倍の全身暴露)。ロスバスタチンを 30 mg/kg/日で 1 か月間投与したイヌの精巣では、精子巨細胞が見られました。精細管上皮の空胞化に加えて、30 mg/kg/日での 6 ヶ月間処理後のサルにおいて、精子巨細胞が観察された。体表面積に基づいて、40 mg/日でのヒトの暴露量のイヌでの暴露量は 20 倍、サルでは 10 倍でした。同様の所見は、このクラスの他の薬でも見られています。
特定の集団での使用
妊娠
リスクの概要
妊娠中の女性に対する安全性が確立されておらず、妊娠中のクレストール 20mg による治療に明らかな利点がないため、クレストール 5mg は妊婦への使用は禁忌です。 HMG-CoAレダクターゼ阻害剤は、コレステロール合成を減少させ、コレステロール由来の他の生物学的に活性な物質の合成を減少させる可能性があるため、妊娠中の女性にクレストールを投与すると、胎児に害を及ぼす可能性があります.クレストール5mgは、妊娠が確認されたらすぐに中止する必要があります[ 禁忌 ]。ロスバスタチンの使用に関する限られた公開データは、主要な先天性奇形または流産の薬物関連リスクを判断するには不十分です。動物の繁殖研究では、ラットまたはウサギにおける 40 mg/日の最大推奨ヒト用量 (MRHD) に相当する全身暴露での器官形成中のロスバスタチンの経口投与による有害な発達への影響はありませんでした (それぞれ AUC および体表面積に基づく)。 )。ラットとウサギでは、40 mg/日の MRHD に相当する 12 倍の時点で、仔/胎児の生存率が低下した [参照 データ ]。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2 ~ 4% および 15 ~ 20% です。
データ
ヒューマンデータ
ロスバスタチンに関する限られた公開データでは、重大な先天性奇形または流産のリスク増加は示されていません。他のスタチンへの子宮内曝露後に、先天性異常のまれな報告が寄せられています。シンバスタチンまたはロバスタチンに暴露された女性の妊娠を前向きに追跡した約 100 人のレビューでは、先天異常、自然流産、および胎児死亡/死産の発生率は、一般集団で予想されるものを超えませんでした。症例数は、バックグラウンド発生率の 3 ~ 4 倍以上の先天異常の増加を除外するのに十分です。前向きに追跡された妊娠の 89% で、薬物治療は妊娠前に開始され、妊娠が確認された最初の学期のある時点で中止されました。
動物データ
ロスバスタチンはラットとウサギの胎盤を通過し、ラットの妊娠 16 日目に 25 mg/kg を単回強制経口投与した後、胎児組織と羊水に母体血漿濃度のそれぞれ 3% と 20% で検出されます。妊娠 18 日目に 1 mg/kg を単回強制経口投与したウサギでは、より高い胎児組織分布 (母体血漿濃度 25%) が観察されました。
ロスバスタチンの投与は、ラットでは 25 mg/kg/日以下、またはウサギでは 3 mg/kg/日以下で催奇形作用を示さなかった (それぞれ AUC と体表面積に基づく MRHD 40 mg/日と同等の用量)。
交配前に 5、15、および 50 mg/kg/日を与えられ、妊娠 7 日まで継続した雌ラットでは、50 mg/kg/日で胎児体重 (雌仔) の減少と骨化の遅延が生じた (ヒトでの暴露の 10 倍)。 AUC に基づく 40 mg/日の MRHD 用量)。
妊娠 7 日目から授乳 21 日目 (離乳期) まで 2、10、50 mg/kg/日のロスバスタチンを投与された妊娠ラットでは、50 mg/kg/日 (40 mg の MRHD の 12 倍に相当する用量) で仔の生存率が低下した/日ベースの体表面積)。
0.3、1、および 3 mg/kg/日のロスバスタチンを妊娠 6 日から 18 日まで投与した妊娠ウサギでは、3 mg/kg/日で胎児生存率の低下と母体死亡率が観察された (40 mg/kg の MRHD に相当する用量)。体表面積に基づく日)。
授乳
リスクの概要
授乳中のロスバスタチンの使用は禁忌です [ 禁忌 ]。限られたデータは、クレストールが母乳に存在することを示しています。母乳で育てられた乳児への薬の影響、または乳生産への薬の影響に関する入手可能な情報はありません。母乳育児中の乳児に重篤な副作用が生じる可能性があるため、クレストールによる治療中は母乳育児は推奨されないことを患者に伝えてください。
生殖能力のある雌と雄
避妊
クレストールは、妊婦に投与すると胎児に害を及ぼす可能性があります [参照 特定の集団での使用 ]。生殖能力のある女性には、クレストールによる治療中は効果的な避妊法を使用するようにアドバイスしてください。
小児用
ヘテロ接合型家族性高コレステロール血症の 8 ~ 17 歳の小児および青年において、総コレステロール、LDL-C、および ApoB レベルを低下させるための食事補助としてのクレストール 10mg の安全性と有効性は、食事療法の適切な試験の後、LDL -C が 190 mg/dL を超えるか、LDL-C が 160 mg/dL を超え、早発性 CVD または 2 つ以上の他の CVD 危険因子の家族歴があり、1 つの対照試験および 1 つの非盲検、非対照で確立されたトライアル[参照 臨床研究 ]。成人期の罹患率と死亡率を低下させるために小児期に開始されたクレストール療法の長期的な有効性は確立されていません。
10~17歳のヘテロ接合体家族性高コレステロール血症の小児および青年におけるクレストール5mgの安全性と有効性は、12週間の対照臨床試験とその後の40週間の非盲検曝露で評価されました。 1 日 5 mg、10 mg、および 20 mg のクレストール 10 mg を投与された患者は、プラセボを投与された患者とほぼ同様の副作用プロファイルを示しました。成長、体重、BMI (体格指数)、または性的成熟に対するクレストールの影響は検出されませんでした [参照 臨床研究 小児および青年(10~17 歳)。
CRESTOR は、思春期前の患者または 10 歳未満のヘテロ接合性家族性高コレステロール血症患者を対象とした対照臨床試験では研究されていません。しかし、クレストールの安全性と有効性は、ヘテロ接合体の家族性高コレステロール血症の 8 歳から 17 歳までの小児および青年を対象とした 2 年間の非盲検非対照試験で評価されました。 臨床研究 ]。 LDL-C の低下におけるクレストール 5mg の安全性と有効性は、非対照試験デザインの制限にもかかわらず、成人患者で観察されたものとほぼ一致しているように見えました。
家族性高コレステロール血症のホモ接合体を有する 7 歳から 15 歳の小児および青年を対象に、クレストール 20 mg を 1 日 1 回投与し、続いて 12 週間の非盲検治療を行った 6 週間の無作為化プラセボ対照クロスオーバー試験が実施されました。 臨床研究 ]。一般に、この試験の安全性プロファイルは、以前に確立された成人の安全性プロファイルと一致していました。
成人集団で特定されたすべての有害反応が小児および青年患者の臨床試験で観察されたわけではありませんが、成人と同じ警告および予防措置を小児および青年に対して考慮する必要があります。思春期の女性は、クレストール 5mg 治療中の適切な避妊方法についてカウンセリングを受ける必要があります。 特定の集団での使用 ]。
高齢者の使用
クレストールの臨床試験に参加した 10,275 人の患者のうち、3,159 人 (31%) が 65 歳以上、698 人 (6.8%) が 75 歳以上でした。これらの被験者と若い被験者の間で安全性または有効性の全体的な違いは観察されず、他の報告された臨床経験では、高齢者と若い患者の間の反応の違いは確認されていませんが、一部の高齢者の感度が高いことは除外できません.
高齢患者はミオパシーのリスクが高く、高齢者にはクレストールを慎重に処方する必要があります。 警告と注意事項 と 臨床薬理学 ]。
腎障害
ロスバスタチンへの暴露は、軽度から中等度の腎障害 (CLcr ≥30 mL/min/1.73 m²) の影響を受けません。ロスバスタチンへの曝露は、血液透析を受けていない重度の腎機能障害 (CLcr 投薬と管理 、 警告と注意事項 と 臨床薬理学 ]。
肝障害
クレストールは、肝トランスアミナーゼレベルの原因不明の持続的上昇を含む可能性がある活動性肝疾患の患者には禁忌です。慢性アルコール肝疾患は、ロスバスタチン曝露を増加させることが知られています。これらの患者には、クレストール 20mg を慎重に使用する必要があります。 禁忌 、 警告と注意事項 と 臨床薬理学 ]。
アジアの患者
薬物動態研究では、白人対照と比較した場合、アジア人被験者におけるロスバスタチンへの暴露中央値が約 2 倍増加することが実証されています。アジア人患者では、クレストールの投与量を調整する必要があります。 投薬と管理 と 臨床薬理学 ]。
過剰摂取
過剰摂取した場合の特別な治療法はありません。過剰摂取の場合、患者は対症療法を受け、必要に応じて支援措置を講じる必要があります。血液透析は、ロスバスタチンのクリアランスを大幅に向上させません。
禁忌
クレストール 20mg は、次の条件では禁忌です。
- この製品のいずれかの成分に対して既知の過敏症のある患者。発疹、かゆみ、蕁麻疹、血管性浮腫などの過敏反応がクレストールで報告されています。 有害反応 ]。
- 肝トランスアミナーゼレベルの原因不明の持続的上昇を含む可能性のある活動性肝疾患の患者[参照 警告と注意事項 ]。
- 妊娠[参照 特定の集団での使用 ]。
- 授乳。限られたデータは、クレストール 20mg が母乳に存在することを示しています。スタチンは授乳中の乳児に重篤な副作用を引き起こす可能性があるため、クレストール治療を必要とする女性は乳児に母乳を与えるべきではありません[参照 特定の集団での使用 ]。
臨床薬理学
作用機序
クレストール 10mg は、3-ヒドロキシ-3-メチルグルタリル補酵素 A をコレステロールの前駆体であるメバロン酸に変換する律速酵素である HMG-CoA レダクターゼの選択的かつ競合的な阻害剤です。動物での in vivo 研究、および培養動物およびヒト細胞での in vitro 研究は、ロスバスタチンが、コレステロール低下の標的器官である肝臓での作用に対して高い取り込みと選択性を有することを示しています。 in vivo および in vitro 研究では、ロスバスタチンは 2 つの方法で脂質修飾効果を生み出します。第一に、細胞表面上の肝臓の LDL 受容体の数を増加させ、LDL の取り込みと異化を促進します。第二に、ロスバスタチンは VLDL の肝臓での合成を阻害し、VLDL と LDL 粒子の総数を減少させます。
薬力学
クレストール 5mg は、用量依存的に上昇した LDL コレステロールを減少させ、総コレステロールとトリグリセリドを減少させ、HDL コレステロールを増加させます。 臨床研究 ]。クレストール 5mg に対する治療反応は、治療開始から 1 週間以内に明らかになり、最大反応の 90% は通常 2 週間で達成されます。最大の反応は通常 4 週間までに達成され、その後も維持されます。薬物投与量の個別化は、治療反応に基づいている必要があります[を参照してください。 投薬と管理 ]。
薬物動態
吸収
ヒトの臨床薬理試験では、ロスバスタチンのピーク血漿濃度は、経口投与後 3 ~ 5 時間で到達しました。 Cmax と AUC の両方が、クレストール 10mg の投与量にほぼ比例して増加しました。ロスバスタチンの絶対バイオアベイラビリティは約 20% です。
食物と一緒にクレストールを投与しても、ロスバスタチンの AUC に影響はありませんでした。
ロスバスタチンの AUC は、夕方または朝の薬物投与の後で違いはありません。
分布
ロスバスタチンの定常状態での平均分布量は約 134 リットルです。ロスバスタチンは 88% が血漿タンパク質、主にアルブミンに結合しています。この結合は可逆的であり、血漿濃度とは無関係です。
排除
ロスバスタチンは、主に糞便中への排泄によって除去されます。ロスバスタチンの消失半減期は約 19 時間です。
代謝
ロスバスタチンは広範囲に代謝されません。放射性標識線量の約 10% が代謝物として回収されます。主要な代謝産物は N-デスメチル ロスバスタチンであり、これは主にシトクロム P450 \ 2C9 によって形成され、in vitro 研究では、N-デスメチル ロスバスタチンが親化合物の HMG-CoA レダクターゼ阻害活性の約 6 分の 1 から 1/2 を有することが実証されています。 .全体として、活性な血漿HMG-CoAレダクターゼ阻害活性の90%以上が親化合物によって占められています。
排泄
経口投与後、ロスバスタチンとその代謝物は主に糞便中に排泄されます (90%)。静脈内投与後、全身クリアランスの約 28% が腎臓経由で、72% が肝臓経由でした。
特定の集団
人種または民族グループ
母集団の薬物動態分析では、白人、ヒスパニック系、および黒人またはアフリカ系カリブ人のグループ間で薬物動態に臨床的に関連する違いがないことが明らかになりました。しかし、米国で実施されたものを含む薬物動態研究では、白人の対照群と比較した場合、アジア人被験者の暴露中央値 (AUC および Cmax) が約 2 倍上昇することが示されています。
男性と女性の患者
男性と女性の間でロスバスタチンの血漿濃度に差はありませんでした。
小児患者
それぞれ 10 歳から 17 歳と 8 歳から 17 歳のヘテロ接合体家族性高コレステロール血症の患者を対象とした 2 つの小児科試験の母集団薬物動態分析では、ロスバスタチン曝露は成人患者のロスバスタチン曝露と同等かそれよりも低いように見えました。
高齢患者
非高齢者集団と高齢者集団(65 歳以上)の間で、ロスバスタチンの血漿濃度に差はありませんでした。
腎障害のある患者
軽度から中等度の腎障害 (CLcr ≥30 mL/min/1.73 m²) は、ロスバスタチンの血漿濃度に影響を与えませんでした。しかし、血液透析を受けていない重度の腎機能障害患者 (CLcr 80 mL/min/ 1.73㎡)。
血液透析
慢性血液透析患者のロスバスタチンの定常状態の血漿濃度は、正常な腎機能を持つ健康なボランティア被験者と比較して約 50% 高かった。
肝障害のある患者
慢性アルコール性肝疾患の患者では、ロスバスタチンの血漿濃度がわずかに上昇しました。
Child-Pugh A 病の患者では、肝機能が正常な患者と比較して、Cmax と AUC がそれぞれ 60% と 5% 増加しました。 Child-Pugh B 病の患者では、肝機能が正常な患者と比較して、Cmax と AUC がそれぞれ 100% と 21% 増加しました。
薬物相互作用研究
ロスバスタチンのクリアランスは、シトクロム P450 3A4 による代謝に臨床的に有意な程度には依存していません。
ロスバスタチンは、肝臓取り込みトランスポーター有機陰イオン輸送ポリタンパク質 1B1 (OATP1B1) および排出トランスポーター乳癌耐性タンパク質 (BCRP) を含む特定のトランスポータータンパク質の基質です。クレストール 10mg とこれらのトランスポータータンパク質の阻害剤(シクロスポリン、特定の HIV プロテアーゼ阻害剤など)を同時に投与すると、ロスバスタチンの血漿濃度が上昇する可能性があります。 投薬と管理 と 薬物相互作用 ]。
ファーマコゲノミクス
ロスバスタチンを含む HMG-CoA レダクターゼ阻害剤の性質には、OATP1B1 および他のトランスポータータンパク質が関与します。 OATP1B1 (SLCO1B1 521T > C) をコードする遺伝子の機能低下対立遺伝子を 2 つ持つ非常に少数の患者グループ (n=3 ~ 5) で、より高い血漿中ロスバスタチン濃度が報告されています。この遺伝子型 (すなわち、SLCO1B1 521 C/C) の頻度は、ほとんどの人種/民族グループで一般に 5% 未満です。ロスバスタチンの有効性および/または安全性に対するこの多型の影響は、明確に確立されていません。
動物毒物学および/または薬理学
中枢神経系毒性
血管周囲出血、浮腫、および血管周囲空間の単核細胞浸潤を特徴とする CNS 血管病変は、この薬剤クラスの他のいくつかのメンバーで治療された犬で観察されています。このクラスの化学的に類似した薬物は、最高推奨用量を摂取したヒトの平均薬物レベルより約 30 倍高い血漿薬物レベルを生成する用量で、犬に用量依存性の視神経変性 (網膜原線維のワラー変性) を引き起こしました。脈絡叢の間質の浮腫、出血、および部分的壊死が、24 日目に瀕死の状態で屠殺された雌イヌで 90 mg/kg/日を経口強制経口投与 (40 mg/日でのヒト暴露の 100 倍の全身暴露) で観察された。 AUC)。角膜混濁は、6 mg/kg/日で 52 週間強制経口投与されたイヌで見られた (全身暴露は、AUC に基づく 40 mg/日でのヒト暴露の 20 倍)。白内障は、30 mg/kg/日で経口胃管栄養法により 12 週間処置されたイヌで見られた (全身暴露は、AUC に基づく 40 mg/日でのヒト暴露の 60 倍)。網膜異形成および網膜喪失は、90 mg/kg/日 (AUC に基づく 40 mg/日でのヒト暴露の 100 倍の全身暴露) の経口胃管栄養法により 4 週間処置されたイヌで見られました。投与量が 30 mg/kg/日以下 (AUC に基づく 40 mg/日でのヒト暴露の 60 倍以下の全身暴露) では、最大 1 年間の治療中に網膜所見は明らかになりませんでした。
若年毒性研究
若年試験では、離乳からペアリング前の 9 週間、ペアリング中およびオスの場合は剖検の前日まで、メスの場合は妊娠 7 日目まで、ラットに 10 または 50 mg/kg/日を強制経口投与しました。性的発達、精巣および精巣上体の外観または生殖能力への影響は、いずれの用量レベルでも観察されませんでした (小児の最大用量 20 mg/日でのヒト曝露 (AUC) の 2 倍または最大 24 倍)。
臨床研究
高脂血症および混合性脂質異常症
クレストール 5mg は、高脂血症および混合性脂質異常症の成人患者において、Total-C、LDL-C、ApoB、nonHDL-C、および TG を減少させ、HDL-C を増加させます。
用量範囲研究
高脂血症患者を対象とした多施設二重盲検プラセボ対照用量範囲試験で、クレストールを1日1回6週間投与すると、全C、LDL-C、非HDL-C、およびApoBが有意に減少しました。範囲 (表 6)。
実薬対照研究
クレストール 5mg は、高脂血症または混合性脂質異常症の患者 2,240 人を対象とした多施設非盲検用量範囲試験で、HMG-CoA レダクターゼ阻害剤であるアトルバスタチン、シンバスタチン、およびプラバスタチンと比較されました。無作為化後、患者はクレストール 20mg、アトルバスタチン、シンバスタチン、プラバスタチンのいずれかを 1 日 1 回 6 週間投与されました(図 1 および表 7)。
図1:高脂血症または混合性脂質異常症患者におけるクレストール20mg、アトルバスタチン、シンバスタチン、およびプラバスタチンの6週目の用量によるLDL-C変化率 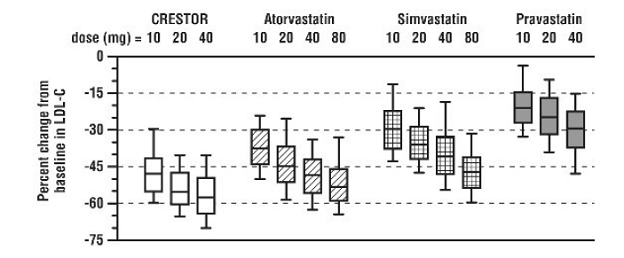
ボックス プロットは、25、50、および 75 パーセンタイル値を表し、ひげは 10 および 90 パーセンタイル値を表します。平均ベースライン LDL-C: 189 mg/Dl
ヘテロ接合性家族性高コレステロール血症
実薬対照研究
ヘテロ接合型 FH (ベースライン平均 LDL 291) を有する患者の研究では、患者はクレストール 20 mg またはアトルバスタチン 20 mg に無作為に割り付けられました。用量は 6 週間間隔で増量されました。ベースラインからの有意な LDL-C の減少が、両方の治療群で各用量で見られました (表 8)。
高トリグリセリド血症
用量反応研究
ベースラインTGレベルが273~817 mg/dLの患者を対象とした二重盲検プラセボ対照用量反応研究では、クレストール10mgを1日1回(5~40 mg)6週間にわたって投与すると、血清TGレベルが有意に低下しました(表 9)。
原発性β-リポタンパク血症(III型高リポタンパク血症)
ランダム化された多施設二重盲検クロスオーバー研究では、32 人の患者 (27 人がε2/ε2、4 人が apo E 変異 [Arg145Cys] を持つ原発性異常βリポタンパク血症 (III 型高リポタンパク血症) で、NCEP で 6 週間の食事導入期間に入りました。治療的ライフスタイル変更 (TLC) 食事. 食事導入に続いて、患者は、ロスバスタチン 10 mg に続いてロスバスタチン 20 mg またはロスバスタチン 20 mg に続いてロスバスタチン 10 mg の各 6 週間、TLC 食事と組み合わせた一連の治療に無作為に割り付けられました。 . クレストールは、非 HDL-C (一次エンドポイント) および循環残存リポタンパク質レベルを低下させました. 結果を下の表に示します.
ホモ接合型家族性高コレステロール血症
用量滴定研究
非盲検の強制漸増試験では、ホモ接合型 FH 患者 (n=40、8~63 歳) が、6 週間間隔で漸増されたクレストール 20 ~ 40 mg に対する反応を評価されました。全体集団では、ベースラインからの平均 LDL-C 減少は 22% でした。患者の約 3 分の 1 が 20 mg から 40 mg に用量を増やすことで恩恵を受け、さらに LDL が 6% 以上低下しました。 LDL-C が少なくとも 15% 減少した 27 人の患者では、平均 LDL-C 減少は 30% (中央値 28% 減少) でした。 LDL-C が 15% 未満減少した 13 人の患者のうち、3 人は LDL-C に変化がないか、増加していました。 LDL-C の 15% 以上の低下が、既知の受容体陰性状態の患者 5 人中 3 人で観察されました。
ホモ接合性家族性高コレステロール血症の小児患者
CRESTOR は、家族性高コレステロール血症ホモ接合体の 14 人の小児および青年を対象に、無作為化二重盲検プラセボ対照多施設クロスオーバー研究で研究されました。この研究には、患者が毎日クレストール10 mgを投与する4週間の食事導入フェーズ、ランダムな順序でクレストール20 mgまたはプラセボのいずれかを6週間投与する2回のクロスオーバーフェーズ、続いて12回の投与が含まれていました。すべての患者がクレストール 20 mg を投与された 1 週間の非盲検期。患者の年齢は 7 ~ 15 歳 (中央値 11 歳) で、50% が男性、71% が白人、21% がアジア人、7% が黒人で、ヒスパニック系の患者はいなかった。 50% がアフェレーシス療法を受けており、57% がエゼチミブを服用していました。アフェレーシス療法またはエゼチミブで研究に参加した患者は、研究全体を通して治療を続けました。ベースラインでの平均 LDL-C は 416 mg/dL (範囲 152 ~ 716 mg/dL) でした。合計 13 人の患者が、無作為クロスオーバーフェーズの両方の治療期間を完了しました。 1 人の患者は、クロスオーバー段階で採血ができなかったために同意を撤回しました。
クレストール 20 mg は、プラセボと比較して、LDL-C、総コレステロール、ApoB、および非 HDL-C を有意に減少させました (表 11)。
ヘテロ接合性家族性高コレステロール血症の小児患者
二重盲検、無作為化、多施設、プラセボ対照、12 週間の研究では、176 人 (男性 97 人、女性 79 人) の家族性高コレステロール血症のヘテロ接合体の小児および青年が、毎日ロスバスタチン 5、10、または 20 mg またはプラセボに無作為に割り付けられました。患者の年齢は 10 歳から 17 歳 (中央値は 14 歳) で、患者の約 30% が 10 歳から 13 歳で、約 17%、18%、40%、および 25% がタナー病期 II、III、IV でした。と V、それぞれ。女性は初潮後少なくとも 1 年であった。ベースラインでの平均 LDL-C は 233 mg/dL (129 ~ 399 の範囲) でした。 12 週間の二重盲検期に続いて、40 週間の非盲検用量調節期が続き、すべての患者 (n=173) が 5 mg、10 mg、または 20 mg のロスバスタチンを毎日投与されました。
ロスバスタチンは、プラセボと比較して、各用量で LDL-C (主要評価項目)、総コレステロール、および ApoB レベルを有意に低下させました。結果を以下の表12に示す。
12 週間の二重盲検治療期間の終わりに、110 mg/dL (2.8 mmol/L) 未満の LDL-C 目標を達成した患者の割合は、プラセボで 0%、ロスバスタチン 5 mg で 12% でした。 、ロスバスタチン 10 mg で 41%、ロスバスタチン 20 mg で 41%。 40 週間の非盲検フェーズでは、患者の 71% が最大用量の 20 mg まで滴定され、患者の 41% が 110 mg/dL の LDL-C 目標を達成しました。
ロスバスタチンは、8歳から17歳のヘテロ接合性家族性高コレステロール血症の小児および青年175人(男子79人、女子96人)を含む、2年間の非盲検非対照の目標漸増試験でも研究されました。すべての患者は、LDL受容体またはApoBに記録された遺伝的欠陥を持っていました。約 89% が白人、7% がアジア人、1% が黒人、1% 未満がヒスパニック系でした。ベースラインでの平均 LDL-C は 236 mg/dL でした。 58 人 (33%) の患者はベースラインで思春期前でした。すべての小児および青年に対するロスバスタチンの開始用量は、1 日 1 回 5 mg でした。 8 歳から 10 歳未満の子供 (ベースラインで n=41) は、1 日 1 回最大用量 10 mg まで滴定でき、10 歳から 17 歳の子供および青年は、1 日 1 回最大用量 20 mg まで滴定できます。
ベースラインからの LDL-C の低下は、成人および小児対照試験の両方での以前の経験と同様に、試験内の年齢層全体で一般的に一貫していました。
小児期に開始されたロスバスタチン療法が成人期の罹患率と死亡率を低下させる長期的な有効性は確立されていません。
アテローム性動脈硬化症の進行を遅らせる
内膜中膜の厚さに対する効果の測定: ロスバスタチン 40 mg の評価 (METEOR) 研究では、CRESTOR による頸動脈アテローム性動脈硬化症に対する治療効果が、LDL-C が上昇した低リスク (フラミンガム リスク
プラセボ群のベースラインからの年間変化率は、+0.0131 mm/年 (p
クレストールで治療されたグループの個々の患者レベルでは、52.1%の患者が疾患の進行がないことを示しました(マイナスの年換算変化率として定義されます)、プラセボ群の患者の37.7%と比較して。
心血管疾患の一次予防
一次予防におけるスタチンの使用の正当化: ロスバスタチンを評価する介入試験 (JUPITER) 研究では、主要な心血管 (CV) 疾患イベントの発生に対するクレストール (ロスバスタチンカルシウム) の効果が 17,802 人の男性 (50 歳以上) で評価されました。 ) および臨床的に明らかな心血管疾患がなく、LDL-C 値が 130 mg/dL (3.3 mmol/l) 未満で、hs-CRP 値が 2 mg/L 以上の女性 (60 歳以上)。 Framingham のリスク基準に基づくと、研究集団のベースライン冠動脈疾患リスクは 10 年間で 11.6% と推定され、高血圧 (58%)、低 HDL-C レベル (23%) などの追加の危険因子を持つ患者の割合が高かった。 )、喫煙(16%)、または早期CHDの家族歴(12%)。研究参加者のベースライン LDL-C の中央値は 108 mg/dL、hsCRP は 4.3 mg/L でした。研究参加者は、プラセボ (n=8901) またはロスバスタチン 20 mg 1 日 1 回投与 (n=8901) に無作為に割り当てられ、平均 2 年間追跡されました。 JUPITER 研究は、ロスバスタチンで治療された被験者の有効性について事前に定義された中止規則を満たしているため、データ安全監視委員会によって早期に中止されました。
主要エンドポイントは、次のいずれかの主要な心血管イベントの最初の発生までの時間からなる複合エンドポイントでした: 心血管死、致命的ではない心筋梗塞、致命的ではない脳卒中、不安定狭心症による入院、または動脈血行再建術。
ロスバスタチンは主要な CV イベントのリスクを有意に減少させ (プラセボ群で 252 件のイベントに対してロスバスタチン群で 142 件のイベント)、統計的に有意な (p
図 2: JUPITER での主要な心血管イベントの最初の発生までの時間 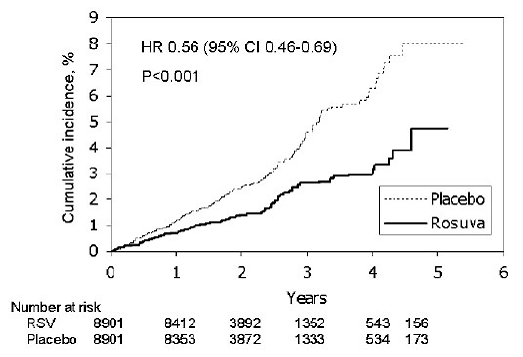
主要評価項目の個々の構成要素を図 3 に示します。ロスバスタチンは、致命的ではない心筋梗塞、致命的ではない脳卒中、および動脈血行再建術のリスクを大幅に低下させました。心血管系の原因による死亡または不安定狭心症による入院について、ロスバスタチン群とプラセボ群の間に有意な治療差はありませんでした。
ロスバスタチンは、心筋梗塞のリスク (プラセボ治療被験者で 6 つの致命的イベントと 62 の非致命的イベント対ロスバスタチン治療被験者で 9 つの致命的イベントと 22 の非致命的イベント) および脳卒中のリスク (6 つの致命的イベントと 58 の非致命的イベント) を大幅に減少させました。プラセボで治療された被験者 vs. ロスバスタチンで治療された被験者での 3 つの致命的なイベントと 30 の非致命的なイベント)。
hsCRP ≥2 mg/L で、他の従来の危険因子がない (喫煙、BP ≥140/90、または降圧薬の服用、低HDL-C) を除いて、高 HDL-C で調整した後、ロスバスタチン治療による有意な治療効果はありませんでした。
図 3: JUPITER における治療グループ別の主要な CV イベント 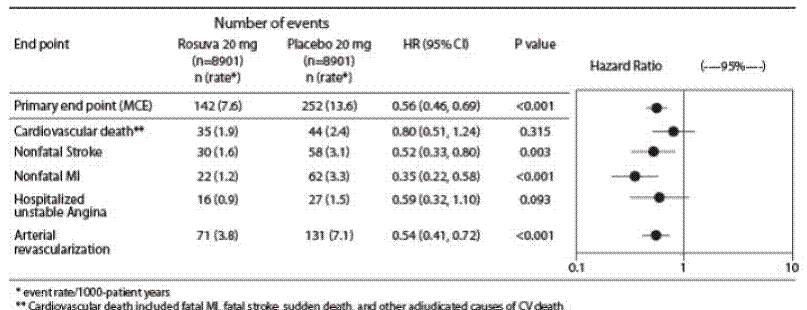
1 年後、ロスバスタチンは HDL-C を増加させ、LDL-C、hsCRP、総コレステロール、および血清トリグリセリド レベルを低下させました (すべて対プラセボで p
患者情報
クレストール® (クレストール)ロスバスタチンカルシウム錠
クレストール 20mg の服用を開始する前、および補充を受けるたびに、この患者情報をよくお読みください。クレストールについてご不明な点がございましたら、医師にご相談ください。クレストールがあなたに適しているかどうかを判断できるのは、あなたの医師だけです。
クレストールとは
クレストール20mgは、ロスバスタチンカルシウムというコレステロール低下薬を配合した処方薬です。血液中のコレステロールのほとんどは肝臓で作られます。クレストール 20mg は、2 つの方法でコレステロールを減らすことによって機能します。クレストール 5mg は肝臓の酵素をブロックし、肝臓によるコレステロールの生成を減らします。クレストール 20mg は、すでに血中にあるコレステロールの肝臓による取り込みと分解を増加させます。
- クレストールは以下の目的で食事とともに使用されます。
- 「悪玉」コレステロール(LDL)のレベルを下げる
- あなたの「善玉」コレステロール(HDL)のレベルを上げる
- 血液中の脂肪(トリグリセリド)のレベルを下げる
- 血管壁に脂肪沈着物(プラーク)が蓄積するのを遅らせる
- クレストールは以下の治療に使用されます:
- 食事や運動だけではコレステロール値をコントロールできない成人
- ヘテロ接合型家族性高コレステロール血症(高レベルの LDL を引き起こす遺伝性疾患)の 8 歳から 17 歳の子供
- ホモ接合性家族性高コレステロール血症 (高レベルの LDL を引き起こす遺伝性疾患) の 7 歳から 17 歳の子供。
クレストール 20mg は、8 歳未満のヘテロ接合性家族性高コレステロール血症の小児への使用、または 7 歳未満のホモ接合性家族性高コレステロール血症の小児への使用は承認されていません。
クレストール 5mg は、50 歳以上の男性および 60 歳以上の女性で、既知の心臓病を持っていないが、特定の追加の危険因子がある心臓発作および脳卒中のリスクを軽減するために使用されます。
クレストール 10mg がフレドリクソン I 型および V 型脂質異常症の人に安全かつ有効であるかどうかはわかっていません。
クレストールを服用してはいけない人
次の場合は、クレストールを服用しないでください。
- ロスバスタチンカルシウムまたはクレストールのいずれかの成分にアレルギーがある.クレストールの全成分リストについては、このリーフレットの最後をご覧ください。
- 肝臓に問題があります。
- 妊娠している、または妊娠している可能性があると考えている、または妊娠を計画している.クレストール 20mg は胎児に害を及ぼす可能性があります。妊娠した場合は、クレストールの服用を中止し、すぐに医師に連絡してください。妊娠する予定がない場合は、クレストールを服用している間は効果的な避妊(避妊)を行う必要があります。
- 授乳中です。クレストール5mgのような薬は母乳に移行し、赤ちゃんに害を及ぼす可能性があります.
クレストールを服用する前と服用中は、医師に何を伝えるべきですか?
次の場合は医師に相談してください。
- 原因不明の筋肉痛または衰弱がある
- 腎臓に問題がある、またはあったことがある
- 肝臓に問題がある、またはあったことがある
- 毎日2杯以上のアルコールを飲む
- 甲状腺に問題がある
- 65歳以上である
- アジア系である
- 妊娠している、または妊娠している可能性があると考えている、または妊娠を計画している
- 授乳中です
服用しているすべての薬について医師に伝えてください。 処方薬および市販薬、ビタミン、ハーブサプリメントを含みます。
新しい薬の服用を開始する前に、医師に相談してください。
クレストール20mgを他の特定の薬と一緒に服用すると、互いに影響を及ぼし、副作用を引き起こす可能性があります.クレストールは他の薬の働きに影響を与える可能性があり、他の薬はクレストールの働きに影響を与える可能性があります.
特に次の場合は医師に相談してください。
- シクロスポリン(免疫系の薬)
- ゲムフィブロジル(フィブリン酸コレステロール低下薬)
- HIVまたはC型肝炎プロテアーゼ阻害剤(ロピナビル、リトナビル、ホスアンプレナビル、チプラナビル、アタザナビル、またはシメプレビルなど)を含む抗ウイルス薬
- 特定の抗真菌薬(イトラコナゾール、ケトコナゾール、フルコナゾールなど)
- クマリン抗凝固剤(ワルファリンなどの血栓を予防する薬)
- ナイアシンまたはニコチン酸
- フィブリン酸誘導体(フェノフィブラートなど)
- コルヒチン(痛風の治療に使用される薬)
よくわからない場合は、医師または薬剤師にこれらの薬のリストを尋ねてください。
あなたが服用しているすべての薬を知っています。それらのリストを保管して、新しい薬を入手したときに医師や薬剤師に見せてください。
クレストール10mgの服用方法は?
- クレストールは、医師の指示どおりに服用してください。
- クレストールを1日1回経口摂取してください。錠剤全体を飲み込んでください。
- クレストールは食事の有無にかかわらず、いつでも服用できます。
- しない 気分が良くても、医師に相談することなく、用量を変更するか、クレストール 10mg を中止してください。
- 医師は、クレストールによる治療の前と治療中にコレステロール値をチェックするために血液検査を行うことがあります。必要に応じて、医師がクレストール 10mg の投与量を変更することがあります。
- 医師は、クレストールを投与する前に、コレステロールを下げる食事を開始することがあります。クレストールを服用するときは、この食事を続けてください。
- クレストールを服用後、少なくとも2時間待って、水酸化アルミニウムと水酸化マグネシウムの組み合わせを含む制酸剤を服用してください.
- クレストール10mgを飲み忘れた場合は、気がついたらすぐに服用してください。でも、 クレストール 10mg を 12 時間以内に 2 回服用しないでください。
- クレストール 20mg を過剰に服用した場合、または過剰摂取した場合は、すぐに医師に連絡するか、最寄りの病院の緊急治療室に行ってください。
クレストール20mgで起こりうる副作用は?
クレストール 10mg は、次のような重大な副作用を引き起こす可能性があります。
- 筋肉痛、圧痛および筋力低下 (ミオパシー)。 筋肉の分解を含む筋肉の問題は、一部の人では深刻な場合があり、死に至る可能性のある腎臓の損傷を引き起こすことはめったにありません.次の場合は、すぐに医師に相談してください。
- 原因不明の筋肉痛、圧痛、脱力感があり、特に発熱や普段より疲れている場合はクレストールを服用してください。
- 医師からクレストールの服用を中止するように言われた後でも、筋肉の問題が解消されない場合。医師は、筋肉の問題の原因を診断するためにさらに検査を行う場合があります。
次の場合、筋肉の問題が発生する可能性が高くなります。
- クレストールを服用している間、特定の他の薬を服用している
- 65歳以上である
- コントロールされていない甲状腺の問題(甲状腺機能低下症)がある
- 腎臓に問題がある
- 高用量のクレストールを服用している
- 肝臓の問題。 医師は、クレストール 5mg の服用を開始する前に血液検査を行って肝臓をチェックする必要があります。次のような肝臓の問題の症状がある場合は、すぐに医師に連絡してください。
- 異常に疲れている、または衰弱していると感じる
- 食欲減少
- 上腹部の痛み
- 暗い尿
- 皮膚や白目が黄色くなる
最も一般的な副作用には次のものがあります。 頭痛、筋肉痛、腹痛、衰弱、吐き気。
クレストールで報告されているその他の副作用には、記憶喪失や錯乱などがあります。
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらはクレストールの考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
クレストール20mgの保存方法を教えてください。
- クレストール 10mg は室温、68°F ~ 77°F (20°C ~ 25°C) の乾燥した場所に保管してください。
- 期限切れまたは不要になった薬を安全に廃棄します。
クレストール10mgおよびすべての医薬品は、小児の手の届かないところに保管してください。
クレストールの成分は?
有効成分: ロスバスタチンカルシウムとしてのロスバスタチン
不活性成分: 微結晶セルロース NF、ラクトース一水和物 NF、リン酸三カルシウム NF、クロスポビドン NF、ステアリン酸マグネシウム NF、ヒプロメロース NF、トリアセチン NF、二酸化チタン USP、黄色三二酸化鉄、赤色三二酸化鉄 NF。
クレストールの安全で効果的な使用に関する一般情報
医薬品は、患者情報リーフレットに記載されている以外の目的で処方されることがあります。クレストール 10mg は、処方されていない状態には使用しないでください。他の人があなたと同じ病状を持っている場合でも、クレストール 20mg を与えないでください。それらに害を及ぼす可能性があります。
医療専門家向けに書かれたクレストール 5mg に関する情報については、薬剤師または医師にお尋ねください。
この患者情報は、米国食品医薬品局によって承認されています 2018 年 9 月改訂
