Ceftin 250mg, 500mg, 125mg Cefuroxime 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
セフチン 500mg とは何ですか? どのように使用されますか?
セフチン 500mg は、細菌感染症の症状を治療するために使用される処方薬です。セフチンは、単独で使用することも、他の薬と併用することもできます。
セフチン 250mg はセファロスポリン系抗生物質です。
Ceftin が生後 3 か月未満の子供に安全で有効であるかどうかはわかっていません。
セフチンの副作用の可能性は何ですか?
セフチン 250mg は、次のような重大な副作用を引き起こす可能性があります。
- 激しい胃痛、
- 下痢(血の有無にかかわらず)、
- 皮膚や目の黄変、
- 皮膚発疹、
- あざ、
- 重度のうずきやしびれ、
- 発作(けいれん)、
- 困難または痛みを伴う排尿、
- 足、足首、顔、舌の腫れ、
- 疲れ、
- 呼吸困難、
- 熱、
- 喉の痛み、
- あなたの目に燃える、
- 赤または紫の発疹を伴う皮膚の痛み、
- 皮膚の水疱と剥離
上記の症状がある場合は、すぐに医療機関を受診してください。
セフチンの最も一般的な副作用は次のとおりです。
- 下痢、
- 吐き気、
- 嘔吐、
- あなたの口の中で異常または不快な味、
- 幼児のおむつかぶれ、
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Ceftin の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
セフチン 500mg 錠剤および経口懸濁液用セフチンには、セフロキシム アキセチルとしてセフロキシムが含まれています。 CEFTIN は、経口投与用の半合成セファロスポリン抗菌薬です。
セフロキシム アキセチル (セフロキシムの 1-(アセチルオキシ) エチル エステル) の化学名は、(RS)-1- ヒドロキシエチル (6R,7R)-7-[2-(2-フリル)グリオキシル-アミド]-3-(ヒドロキシメチル)-8-オキソ-5-チア-1-アザビシクロ[4.2.0]-オクタ-2-エン-2-カルボキシレート、72-(Z)-(O-メチル-オキシム)、1-アセテート 3-カルバメート。その分子式は C20H22N4O10S で、分子量は 510.48 です。
セフロキシム アキセチルは非晶質で、次の構造式を持っています。
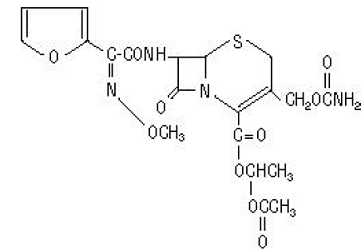
錠剤はフィルムコーティングされており、セフロキシム アキセチルとして 250 または 500 mg 相当のセフロキシムが含まれています。錠剤には、不活性成分のコロイド状二酸化ケイ素、クロスカルメロース ナトリウム、硬化植物油、ヒプロメロース、メチルパラベン、微結晶性セルロース、プロピレン グリコール、プロピルパラベン、安息香酸ナトリウム、ラウリル硫酸ナトリウム、および二酸化チタンが含まれています。
経口懸濁液は、水で再構成すると、5 mL あたり 125 mg または 250 mg のセフロキシム (セフロキシム アキセチルとして) に相当します。経口懸濁液には、不活性成分のアセスルファム カリウム、アスパルテーム、ポビドン K30、ステアリン酸、スクロース、トゥッティフルッティ香料、キサンタンガムが含まれています。
適応症
咽頭炎/扁桃炎
CEFTIN 125mg 錠剤は、影響を受けやすい化膿性連鎖球菌株によって引き起こされる軽度から中等度の咽頭炎/扁桃炎の成人患者および小児患者 (13 歳以上) の治療に適応されます。
経口懸濁液用のセフチン 500mg は、影響を受けやすい化膿性連鎖球菌株によって引き起こされる軽度から中等度の咽頭炎/扁桃炎を患っている生後 3 か月から 12 歳までの小児患者の治療に適応されます。
使用制限
- リウマチ熱の予防におけるセフチンの有効性は、臨床試験では確立されていません。
- 化膿連鎖球菌のペニシリン耐性株の治療におけるセフチン 125mg の有効性は、臨床試験で実証されていません。
急性細菌性中耳炎
セフチン 125mg 錠剤は、肺炎球菌、インフルエンザ菌 (β-ラクタマーゼ産生株を含む)、モラクセラ・カタラーリス (β-ラクタマーゼを含む) の感受性株によって引き起こされる急性細菌性中耳炎の小児患者 (錠剤全体を飲み込むことができる) の治療に適応されます。産生株)、または化膿連鎖球菌。
経口懸濁液用のセフチンは、肺炎連鎖球菌、インフルエンザ菌(β-ラクタマーゼ産生株を含む)、モラクセラ・カタラーリス(β-ラクタマーゼを含む)の感受性株によって引き起こされる急性細菌性中耳炎を有する生後3か月から12歳の小児患者の治療に適応されます。産生株)、または化膿連鎖球菌。
急性細菌性上顎洞炎
セフチン錠は、肺炎連鎖球菌またはインフルエンザ菌(非β-ラクタマーゼ産生株のみ)の感受性菌株によって引き起こされる軽度から中等度の急性細菌性上顎副鼻腔炎の成人および小児患者(13 歳以上)の治療に適応されます。
経口懸濁液用のセフチン 250mg は、感受性の肺炎連鎖球菌またはインフルエンザ菌 (非β-ラクタマーゼ産生株のみ) に起因する軽度から中等度の急性細菌性上顎副鼻腔炎の 3 か月から 12 歳までの小児患者の治療に適応されます。 .
使用制限
β-ラクタマーゼを産生するインフルエンザ菌またはモラクセラ・カタラーリスによる急性細菌性上顎副鼻腔炎患者の副鼻腔感染症に対するセフチンの有効性は、臨床試験におけるこれらの分離株の数が不十分であるため、確立されていません。 臨床研究 ]。
慢性気管支炎の急性細菌性増悪
セフチン錠は、肺炎連鎖球菌、インフルエンザ菌(β-ラクタマーゼ陰性株)の感受性株によって引き起こされる慢性気管支炎の軽度から中等度の急性細菌性増悪を伴う成人患者および小児患者(13歳以上)の治療に適応されます。またはヘモフィルス・パラ・インフルエンザ(β-ラクタマーゼ陰性株)。
合併症のない皮膚および皮膚構造の感染症
セフチン 250mg 錠剤は、黄色ブドウ球菌(β-ラクタマーゼ産生株を含む)または化膿連鎖球菌の感受性株によって引き起こされる複雑でない皮膚および皮膚組織の感染症を有する成人患者および小児患者(13 歳以上)の治療に適応されます。
合併症のない尿路感染症
CEFTIN 500mg 錠剤は、大腸菌または肺炎桿菌の感受性株によって引き起こされる合併症のない尿路感染症の成人患者および小児患者 (13 歳以上) の治療に適応されます。
合併症のない淋病
セフチン錠は、ペニシリナーゼ産生性および非ペニシリナーゼ産生性ナイセリア・ゴノレーの感受性菌株に起因する尿道および子宮頸部の合併症のない淋病および女性の合併症のない淋病(直腸)の成人患者および小児患者(13歳以上)の治療に適応されます。 、ペニシリナーゼを産生しないナイセリア・ゴノレーの感受性株によって引き起こされます。
初期のライム病(遊走性紅斑)
CEFTIN 錠剤は、ボレリア・ブルグドルフェリの感受性株によって引き起こされる初期のライム病 (遊走性紅斑) の成人患者および小児患者 (13 歳以上) の治療に適応されます。
とびひ
経口懸濁液用のセフチン 250mg は、黄色ブドウ球菌(プラクタマーゼ産生株を含む)または化膿連鎖球菌の感受性株によって引き起こされる膿痂疹を伴う生後 3 か月から 12 歳の小児患者の治療に適応されます。
使用法
薬剤耐性菌の発生を減らし、セフチンやその他の抗菌薬の有効性を維持するために、セフチン 500mg は、感受性菌が原因であることが証明されている、または強く疑われる感染症の治療または予防にのみ使用してください。培養および感受性の情報が利用可能である場合、それらは抗菌療法の選択または変更において考慮されるべきです。そのようなデータがない場合、地域の疫学および感受性パターンが治療の経験的選択に寄与する可能性があります。
投薬と管理
重要な管理手順
- CEFTIN 錠剤と経口懸濁液用の CEFTIN は生物学的に同等ではないため、ミリグラム単位で代替することはできません [ 臨床薬理学 ]。
- 適切な投与量ガイドラインに記載されているように、セフチン錠剤または経口懸濁液を投与します [参照 セフチン 500mg 錠剤の投与量、セフチン 250mg 経口懸濁液の投与量 と 経口懸濁液用のセフチン 125mg の調製と投与 ]。
- セフチン 500mg 錠剤を食事の有無にかかわらず投与してください。
- セフチン 500mg を食事と一緒に経口懸濁液として投与します。
- セフチン 125mg 錠を丸ごと飲み込むことができない小児患者 (13 歳以上) は、セフチンを経口懸濁液として服用する必要があります。 セフチン錠の投与量 ]。
セフチン 500mg 錠の投与量
セフチン 250mg 錠剤は、以下の用量ガイドラインの表に記載されているように、食事の有無にかかわらず投与してください。
経口懸濁液用セフチンの投与量
下記の投与量ガイドラインの表に記載されているように、セフチンを経口懸濁液として食事とともに投与してください。
経口懸濁液用セフチンの調製と投与
次のように分注時に懸濁液を調製します。
- 使用前に経口懸濁液をよく振ってください。
- 開けるたびにキャップをしっかりと閉めてください。
- 再構成された懸濁液は 2° ~ 8°C (36° ~ 46°F) で冷蔵保存してください。
- 10 日後に再構成された懸濁液を破棄します。
腎機能障害のある患者における投与量
セフロキシムは主に腎臓によって排泄されるため、以下の表 4 に示すように、クレアチニンクリアランスが 30 mL/min 未満の患者には投与間隔の調整が必要です。 臨床薬理学 ]。
供給方法
剤形と強度
セフチン錠は、白色のカプセル型のフィルムコーティング錠で、次の強度があります。
- 250 mg のセフロキシム (セフロキシム アキセチルとして)。片面に「GX ES7」と刻印され、もう片面は空白。
- 500 mg のセフロキシム (セフロキシム アキセチルとして)、片面に「GX EG2」と刻印され、もう片面は空白。
経口懸濁液用のセフチンは、乾燥した白色からオフホワイトのトゥッティフルッティ風味の粉末として提供されます。指示に従って再構成すると、懸濁液は 5 mL あたり 125 mg または 250 mg のセフロキシム (セフロキシム アキセチルとして) に相当します。
保管と取り扱い
セフチン錠、セフロキシム 250 mg (セフロキシム アキセチルとして) は、白いカプセル型のフィルム コーティング錠で、次のように片面に「GX ES7」と刻印され、もう片面は空白です: 20 錠/ボトル NDC 0173-0387-00
セフチン錠、500 mg のセフロキシム (セフロキシム アキセチルとして) は、白色のカプセル型のフィルムコーティング錠で、片面に「GX EG2」と刻印され、もう片面には次のように空白です: 20 錠/ボトル NDC 0173-0394-00
錠剤は 15° ~ 30°C (59° ~ 86°F) で保管してください。開けるたびにキャップをしっかりと閉めてください。
セフチン 500mg 経口懸濁剤 乾燥した白色からオフホワイトのトゥッティフルッティ風味の粉末として提供されます。指示に従って再構成すると、懸濁液は 5 mL あたり 125 mg または 250 mg のセフロキシム (セフロキシム アキセチルとして) に相当します。次のように琥珀色のガラス瓶で提供されます。
125mg/5mL
100mL懸濁液 NDC 0173-0740-00
250mg/5mL
50mL懸濁液 NDC 0173-0741-10 100mL 懸濁液 NDC 0173-0741-00
再構成する前に、乾燥粉末を 2° ~ 30°C (36° ~ 86°F) で保管してください。
再構成後、すぐに懸濁液を 2° ~ 8°C (36° ~ 46°F) で冷蔵保存します。 10 日後に破棄します。
GlaxoSmithKline, Research Triangle Park, NC 27709. 改訂: 2017 年 10 月
副作用
次の重篤な、または重要な副作用は、ラベルの警告と予防措置のセクションに詳細に記載されています。
アナフィラキシー反応 [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用の発生率を別の医薬品の臨床試験で観察された発生率と直接比較することはできず、実際に観察された発生率を反映していない可能性があります。
錠剤
7~10日間の複数回投与レジメン
複数回投与の臨床試験では、912 人の被験者がセフチン (125 ~ 500 mg を 1 日 2 回) で治療されました。 1 日 2 回 125 mg は承認された用量ではないことに注意してください。 20 人 (2.2%) の被験者が副作用のために投薬を中止しました。治療を中止した被験者 20 人中 17 人 (85%) は、下痢、吐き気、嘔吐、および腹痛を含む胃腸障害のために治療を中止しました。副作用のために治験薬を中止したセフチンで治療された被験者の割合は、1,000、500、および 250 mg の 1 日用量で同様でした (それぞれ 2.3%、2.1%、および 2.2%)。しかし、胃腸の有害反応の発生率は、推奨用量が高くなるにつれて増加しました。
表 5 の副作用は、反復投与臨床試験でセフチン 250mg を投与された被験者 (n = 912) のものです。
以下の有害反応は、反復投与臨床試験でセフチンで治療された被験者 (n = 912) の 1% 未満であるが 0.1% 以上で発生しました。
免疫系疾患 :蕁麻疹、舌の腫れ。
代謝と栄養障害 :食欲不振。
神経系疾患 : 頭痛。
心疾患 : 胸痛。
呼吸器疾患 : 呼吸困難。
胃腸障害 :腹痛、腹部けいれん、鼓腸、消化不良、口内炎。
皮膚および皮下組織の疾患 :かぶれ、かゆみ。
腎および尿路疾患 :排尿障害。
生殖器系と乳房の病気 :膣炎、外陰部のかゆみ。
一般的な疾患と投与部位の状態 :悪寒、眠気、喉の渇き。
調査 陽性クームス検定。
20日間のレジメンによる初期のライム病
件の多施設試験で、CEFTIN 500 mg を 1 日 2 回、20 日間評価しました。最も一般的な薬物関連の有害事象は、下痢 (10.6%)、ヤリッシュ・ヘルクスハイマー反応 (5.6%)、および膣炎 (5.4%) でした。その他の有害な経験は、7~10 日間の投与で報告されたものと同等の頻度で発生しました。
合併症のない淋病に対する単回投与レジメン
セフチン 250mg を 1,000mg 単回投与した臨床試験では、1,061 人の被験者が合併症のない淋病の治療を受けました。表 6 の副作用は、米国の臨床試験でセフチン 1,000 mg を単回投与された被験者のものです。
以下の副作用は、米国の臨床試験において、合併症のない淋病に対してセフチン 1,000 mg を単回投与した被験者 (n = 1,061) の 1% 未満であるが 0.1% 以上で発生しました。
感染症と蔓延 :膣カンジダ症。
神経系疾患 :頭痛、めまい、傾眠。
心疾患 :胸の圧迫感・痛み、頻脈。
胃腸障害 :腹痛、消化不良。
皮膚および皮下組織の疾患 :紅斑、かぶれ、かゆみ。
筋骨格疾患および結合組織疾患 :筋肉のけいれん、筋肉のこわばり、首の筋肉のけいれん、ロックジョー型の反応。
腎および尿路疾患 :尿道の出血/痛み、腎臓の痛み。
生殖器系と乳房の病気 :膣のかゆみ、おりもの。
経口懸濁液
セフチン 250mg を複数回投与する臨床試験では、小児被験者 (96.7% が 12 歳未満) がセフチン (20 ~ 30 mg/kg/日を 1 日 2 回、最大用量 500 または 1,000 mg/日まで分割) で治療されました。それぞれ)。 11 人 (1.2%) の米国人被験者が、副作用のために投薬を中止しました。中止は、主に胃腸障害、通常は下痢または嘔吐のためでした。 13 名 (1.4%) の米国の小児被験者が、味および/または薬物投与の問題により治療を中止しました。
表 7 の副作用は、反復投与臨床試験でセフチンを投与された米国の被験者 (n = 931) のものです。
以下の有害反応は、反復投与臨床試験でセフチン経口懸濁液で治療された米国の被験者 (n = 931) の 1% 未満であるが 0.1% 以上で発生しました。
感染症と蔓延 :胃腸感染症、カンジダ症、ウイルス性疾患、上気道感染症、副鼻腔炎、尿路感染症。
血液およびリンパ系の疾患 :好酸球増加症。
精神障害 :多動、過敏な行動。
胃腸障害 :腹痛、鼓腸、胸焼け。
皮膚および皮下組織の疾患 :発疹。
筋骨格疾患および結合組織疾患 :関節の腫れ、関節痛。
生殖器系と乳房の病気 :膣刺激。
一般的な疾患と投与部位の状態 :咳、発熱。
調査 :肝酵素上昇、クームステスト陽性。
市販後の経験
セフチンの承認後の使用中に、次の副作用が確認されました。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
血液およびリンパ系の疾患
溶血性貧血、白血球減少症、汎血球減少症、血小板減少症。
胃腸障害
偽膜性大腸炎 [参照 警告と注意事項 ]。
肝胆道疾患
肝炎や胆汁うっ滞、黄疸などの肝障害。
免疫系疾患
アナフィラキシー、血清病様反応。
調査
プロトロンビン時間の増加。
神経系疾患
発作、脳症。
腎および尿路疾患
腎機能障害。
皮膚および皮下組織の疾患
血管性浮腫、多形紅斑、スティーブンス・ジョンソン症候群、中毒性表皮壊死融解症、蕁麻疹。
薬物相互作用
経口避妊薬
セフロキシム アキセチルは腸内フローラに影響を与える可能性があり、エストロゲンの再吸収を低下させ、エストロゲンとプロゲステロンを組み合わせた経口避妊薬の有効性を低下させます。治療中は、代替の補助的な(ホルモン以外の)避妊手段を検討するよう患者に助言してください。
胃酸を下げる薬
胃の酸性度を低下させる薬は、絶食状態での投与と比較して、セフチンのバイオアベイラビリティを低下させる可能性があります。胃の酸性度を低下させる薬剤の投与は、食後の状態で投与された場合、セフチン 250mg の吸収増加による食物の影響を無効にする可能性があります。短時間作用型制酸剤の投与の少なくとも 1 時間前または 2 時間後に CEFTIN を投与します。ヒスタミン 2 (H2) 拮抗薬とプロトン ポンプ阻害薬は避ける必要があります。
プロベネシド
プロベネシドとセフロキシムアキセチル錠剤の併用投与により、セフロキシムの血清濃度が上昇する[参照 臨床薬理学 ]。プロベネシドとセフロキシム アキセチルの併用は推奨されません。
薬物/実験室試験の相互作用
尿中のブドウ糖に対する偽陽性反応は、銅還元試験(例えば、ベネディクト液またはフェーリング液)で発生する可能性がありますが、糖尿の酵素ベースの検査では発生しません.フェリシアニド試験では偽陰性の結果が生じる可能性があるため、セフロキシム アキセチルを投与されている患者の血中/血漿中グルコース濃度を測定するには、グルコース オキシダーゼ法またはヘキソキナーゼ法を使用することをお勧めします。セフロキシムの存在は、アルカリピクリン酸法による血清および尿中クレアチニンの測定を妨げません。
警告
の一部として含まれています 予防 セクション。
予防
アナフィラキシー反応
β-ラクタム系抗菌薬を服用している患者では、重篤で時に致命的な過敏症(アナフィラキシー)反応が報告されています。これらの反応は、β-ラクタム過敏症の病歴および/または複数のアレルゲンに対する過敏症の病歴を持つ個人で発生する可能性が高くなります.ペニシリン過敏症の病歴があり、セファロスポリンで治療すると重度の反応を経験したという報告があります。セフチン 500mg は、セフチンまたはその他のβ-ラクタム系抗菌薬に対する過敏症が知られている患者には禁忌です。 禁忌 ]。セフチンによる治療を開始する前に、ペニシリン、セファロスポリン、または他のアレルゲンに対する過去の過敏反応について質問してください。アレルギー反応が起きた場合は、セフチンを中止し、適切な治療を開始してください。
クロストリジウム・ディフィシル関連下痢症
クロストリジウム ディフィシル関連下痢症 (CDAD) は、CEFTIN を含むほぼすべての抗菌薬の使用で報告されており、重症度は軽度の下痢から致命的な大腸炎までさまざまです。抗菌剤による治療は、結腸の正常な細菌叢を変化させ、C. difficile の異常増殖を引き起こします。
C. difficile は、CDAD の発症に寄与する毒素 A および B を産生します。 C. difficile の高毒素産生株は、これらの感染症が抗菌療法に抵抗性である可能性があり、結腸切除が必要になる可能性があるため、罹患率と死亡率の増加を引き起こします。抗生物質の使用後に下痢を呈するすべての患者で、CDAD を考慮する必要があります。抗菌薬投与後 2 ヶ月以上の CDAD が報告されているため、慎重な病歴が必要です。
CDAD が疑われるか確認された場合、C. difficile に対するものではない継続的な抗生物質の使用を中止する必要があるかもしれません。適切な体液と電解質の管理、タンパク質の補給、C. difficile の抗生物質治療、および外科的評価を、臨床的に必要な場合に開始する必要があります。
微生物の過剰増殖の可能性
治療中は、真菌性病原体または細菌性病原体による重複感染の可能性を考慮する必要があります。
薬剤耐性菌の発生
証明された、または強く疑われる細菌感染がない場合、または予防適応症がない場合にセフチンを処方しても、患者に利益がもたらされる可能性は低く、薬剤耐性菌が発生するリスクが高まります。
フェニルケトン尿症
経口懸濁液 125 mg/5 mL 用のセフチン 125 mg には、再構成された懸濁液 5 mL (小さじ 1 杯) あたり 11.8 mg のフェニルアラニンが含まれています。経口懸濁液 250 mg/5 mL 用のセフチン 250 mg には、再構成された懸濁液 5 mL (小さじ 1 杯) あたり 25.2 mg のフェニルアラニンが含まれています。
グルコース試験への干渉
尿中のブドウ糖の偽陽性の結果は、銅還元試験で発生する可能性があり、血中/血漿グルコースの偽陰性の結果は、セフチンを投与された被験者のフェリシアン化物検査で発生する可能性があります[参照 薬物相互作用 ]。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん性の可能性を評価するための動物での生涯試験は実施されていませんが、一連の細菌変異試験でセフロキシム アキセチルの変異原性は検出されませんでした。 in vitro 染色体異常試験で陽性結果が得られました。しかし、最大 1.5 g/kg の用量での in vivo 小核試験では陰性の結果が見つかりました。 1,000 mg/kg/日 (体表面積に基づくヒトの推奨最大用量の 9 倍) までの用量でのラットの生殖研究では、繁殖力の障害がないことが明らかになりました。
特定の集団での使用
妊娠
妊娠カテゴリー B. 妊娠中の女性を対象とした、十分に管理された研究はありません。動物の生殖研究は常にヒトの反応を予測できるわけではないため、セフチンは明らかに必要な場合にのみ妊娠中に使用する必要があります.
生殖研究は、マウスでは最大 3,200 mg/kg/日 (体表面積に基づくヒトの推奨最大用量の 14 倍) の用量で、ラットでは最大 1,000 mg/kg/日 (推奨最大用量の 9 倍) の用量で実施されています。体表面積に基づいたヒトの用量)であり、セフロキシムアキセチルによる受胎能の障害または胎児への害の証拠は明らかにされていません。
授乳中の母親
セフロキシムは母乳中に排泄されるため、セフチン 500mg を授乳中の女性に投与する場合は注意が必要です。
小児用
CEFTIN 250mg の安全性と有効性は、成人での承認に基づいて、急性細菌性上顎副鼻腔炎の生後 3 か月から 12 歳までの小児患者に対して確立されています。小児患者におけるセフチンの使用は、成人および小児患者における薬物動態および安全性データ、ならびに成人における急性細菌性上顎副鼻腔炎および中耳炎を伴う急性中耳炎の治療に関する適切かつ十分に管理された試験からの臨床および微生物学的データによって裏付けられています。小児患者。また、市販後の有害事象調査にも対応しています。 [見る 適応症と使用法 、 投薬と管理 、 有害反応 、 臨床薬理学 ]
高齢者の使用
20 の臨床試験でセフチン 250mg を投与された被験者の総数のうち、375 人が 65 歳以上で、151 人が 75 歳以上でした。これらの被験者と若年成人の被験者の間で、安全性または有効性の全体的な違いは観察されませんでした。報告された臨床経験では、高齢者と若年成人患者の間の反応の違いは確認されていませんが、一部の高齢者の感度が高いことは除外できません.
セフロキシムは実質的に腎臓から排泄され、腎機能障害のある患者では副作用のリスクが高くなる可能性があります。高齢患者は腎機能が低下している可能性が高いため、投与量の選択には注意が必要であり、腎機能のモニタリングが役立つ場合があります。
腎障害
重度の腎機能障害(クレアチニンクリアランス 投薬と管理 、 臨床薬理学 ]。
過剰摂取
セファロスポリンの過剰摂取は、痙攣や脳症につながる脳の刺激を引き起こす可能性があります。セフロキシムの血清レベルは、血液透析および腹膜透析によって低下させることができます。
禁忌
セフチンは、セフチンやその他のβ-ラクタム系抗菌薬(ペニシリンやセファロスポリンなど)に対する過敏症(アナフィラキシーなど)が知られている患者には禁忌です。
臨床薬理学
作用機序
CEFTIN 250mg は抗菌薬です。 微生物学 ]。
薬物動態
吸収
経口投与後、セフロキシムアキセチルは消化管から吸収され、腸粘膜および血液中の非特異的エステラーゼによって急速に加水分解されてセフロキシムになります。成人にセフチン錠 250mg を投与したときのセフロキシムの血清薬物動態パラメータを表 8 に示す。
食事効果
錠剤の吸収は、食事の後に服用すると大きくなります (絶対バイオアベイラビリティが 37% から 52% に増加します)。この吸収の違いにもかかわらず、被験者の臨床的および細菌学的反応は、これが評価された2つの試験で、錠剤投与時の食物摂取とは無関係でした.
懸濁液製剤を使用した小児被験者におけるすべての薬物動態学的および臨床的有効性および安全性試験は、摂食状態で実施されました。絶食した小児患者に投与した場合の懸濁製剤の吸収速度に関するデータはありません。
生物学的同等性の欠如
健康な成人で試験した場合、経口懸濁液は錠剤と生物学的に同等ではありませんでした。錠剤および経口懸濁液製剤は、ミリグラムあたりの代替えはできません。懸濁液の曲線下面積の平均は錠剤のそれの 91% であり、懸濁液のピーク血漿濃度は錠剤のピーク血漿濃度の平均 71% でした。したがって、錠剤と経口懸濁製剤の両方の安全性と有効性は、別々の臨床試験で確立されました。
分布
セフロキシムは細胞外液全体に分布しています。血清セフロキシムの約 50% がタンパク質に結合しています。
代謝
アキセチル部分はアセトアルデヒドと酢酸に代謝されます。
排泄
セフロキシムはそのまま尿中に排泄されます。成人では、投与量の約 50% が 12 時間以内に尿中に回収されます。小児被験者におけるセフロキシムの薬物動態は研究されていません。さらなるデータが利用可能になるまで、成人で確立されたセフロキシムアキセチルの腎排泄は、小児被験者に外挿されるべきではありません.
特定の集団
腎障害
正常な腎機能または重度の腎機能障害 (クレアチニンクリアランス 投薬と管理 ]。
小児患者
経口懸濁剤としてセフチンを投与された小児被験者におけるセフロキシムの血清薬物動態パラメーターを表 9 に示します。
高齢患者
平均クレアチニンクリアランスが 34.9 mL/min である 20 人の高齢者 (平均年齢 = 83.9 歳) の試験では、平均血清排出半減期が 3.5 時間に延長されました。ただし、高齢患者ではセフロキシムの排泄率が低いにもかかわらず、年齢に基づく用量調整は必要ありません[参照 特定の集団での使用 ]。
薬物相互作用
プロベネシドとセフロキシム アキセチル錠剤の併用投与により、血清濃度対時間曲線の下のセフロキシム面積と最大血清濃度がそれぞれ 50% と 21% 増加します。
微生物学
作用機序
セフロキシム アキセチルは、細菌の細胞壁合成を阻害することによって作用する殺菌剤です。セフロキシム アキセチルは、グラム陰性菌およびグラム陽性菌のいくつかの β-ラクタマーゼ (ペニシリナーゼとセファロスポリナーゼの両方) の存在下で活性を示します。
抵抗のメカニズム
セフロキシム アキセチルに対する耐性は、主に β-ラクタマーゼによる加水分解、ペニシリン結合タンパク質 (PBP) の変化、透過性の低下、および細菌排出ポンプの存在によるものです。
セフロキシム アキセチルに対する感受性は、地域や時間によって異なります。可能であれば、局所的な感受性データを参照する必要があります。ベータ-ラクタマーゼ陰性、アンピシリン耐性 (BLNAR) インフルエンザ菌の分離株は、セフロキシム アキセチルに耐性があると考えるべきです。
セフロキシム アキセチルは、in vitro および臨床感染症の両方で、以下の細菌のほとんどの分離株に対して活性があることが示されています [参照 適応症と使用法 ]:
グラム陽性菌
黄色ブドウ球菌(メチシリン感受性分離株のみ) 肺炎連鎖球菌 化膿連鎖球菌
グラム陰性菌
Escherichia colia Klebsiella pneumoniaea インフルエンザ菌 Haemophilus parainfluenzae Moraxella catarrhalis Neisseria gonorrhoeae a 最も拡張されたスペクトルの β-ラクタマーゼ (ESBL) 産生およびカルバペネマーゼ産生分離株は、セフロキシムアキセチルに耐性があります。スピロヘータ ボレリア・ブルグドルフェリ
以下の in vitro データが利用可能ですが、それらの臨床的意義は不明です。以下の微生物の少なくとも 90% は、1 mcg/mL のセフロキシム アキセチルの感受性ブレークポイント以下の in vitro 最小発育阻止濃度 (MIC) を示します。しかし、これらの微生物による臨床感染症の治療におけるセフロキシム アキセチルの有効性は、十分に管理された適切な臨床試験では確立されていません。
グラム陽性菌
Staphylococcus epidermidis (メチシリン感受性分離株のみ) Staphylococcus saprophyticus (メチシリン感受性分離株のみ) Streptococcus agalactiae
グラム陰性菌
Morganella morganii Proteus inconstans Proteus mirabilis Providencia rettgeri 嫌気性細菌 Peptococcus niger
感受性試験方法
利用可能な場合、臨床微生物検査室は、地元の病院および診療所で使用される抗菌薬製品の in vitro 感受性試験の結果を、院内感染および市中感染病原体の感受性プロファイルを説明する定期報告として医師に提供する必要があります。これらのレポートは、医師が治療用の抗菌薬を選択するのに役立つはずです。
希釈法
定量的方法は、抗菌性 MIC を決定するために使用されます。これらの MIC は、抗菌化合物に対する細菌の感受性の再現可能な推定値を提供します。 MIC は、標準化された試験方法 (培養液または寒天) を使用して決定する必要があります。1, 2 MIC 値は、表 10.2,3 に示す基準に従って解釈する必要があります。
拡散テクニック
ゾーンの直径の測定を必要とする定量的方法も、抗菌化合物に対する細菌の感受性の再現可能な推定値を提供します。ゾーンのサイズは、抗菌化合物に対する細菌の感受性の推定値を提供します。ゾーンのサイズは、標準化された試験方法を使用して決定する必要があります。4 この手順では、セフロキシム アキセチルに対する微生物の感受性を試験するために、30 mcg のセフロキシム アキセチルを含浸させた紙ディスクを使用します。ディスク拡散の解釈基準を表 10.3 に示します。
セフロキシムに対するブドウ球菌の感受性は、ペニシリンとセフォキシチンまたはオキサシリンのいずれかのみをテストすることから推測できます。
Streptococcus pyogenes の感受性は、ペニシリンの検査から推定される場合があります。
「感受性」の報告は、抗菌薬が感染部位で通常達成可能な濃度に達した場合、抗菌薬が病原体の増殖を阻害する可能性が高いことを示しています。 「中間」のレポートは、結果が曖昧であると見なされるべきであることを示し、微生物が代替の臨床的に実行可能な薬剤に対して完全に感受性でない場合、試験を繰り返す必要があることを示します。このカテゴリーは、薬物が生理学的に集中している身体部位、または高用量の薬物を使用できる状況での臨床応用の可能性を示唆しています。このカテゴリは、制御されていない小さな技術的要因が解釈に大きな矛盾を引き起こすのを防ぐ緩衝地帯も提供します。 「耐性」の報告は、抗菌薬が感染部位で通常達成可能な濃度に達した場合、抗菌薬が病原体の増殖を阻害する可能性が低いことを示しています。他の治療法を選択する必要があります。
品質管理
標準化された感受性試験手順では、実験室での管理を使用して、アッセイで使用される消耗品と試薬の精度と精度、および試験を実施する個人の技術を監視および確認する必要があります.1,2,4 MIC およびディスク拡散の QC 範囲30 mcg ディスクを使用したテストを表 11.3 に示します。
臨床研究
急性細菌性上顎洞炎
急性細菌性上顎副鼻腔炎の被験者を対象に、十分に管理された 1 つの試験が実施されました。この試験では、推定急性細菌性副鼻腔炎の治療が開始される前に、各被験者は副鼻腔穿刺によって収集された上顎洞吸引物を持っていました。すべての被験者は、急性上顎洞炎のレントゲン写真および臨床的証拠を持っていました。この試験では、急性上顎洞炎の治療におけるセフチンの臨床効果は、特定のβ-ラクタマーゼ阻害剤を含む経口抗菌剤に匹敵しました。しかし、微生物学的データは、セフチンが、肺炎連鎖球菌またはβ-ラクタマーゼを産生しないインフルエンザ菌のみによる急性細菌性上顎副鼻腔炎の治療に有効であることを示しました。 β-ラクタマーゼを産生するインフルエンザ菌とモラクセラ・カタラーリスの分離株は、この 2 つの微生物による急性細菌性上顎副鼻腔炎の治療におけるセフチンの有効性を適切に評価するには、この試験では不十分でした。
この試験では、米国で 132 人、南米で 185 人の 317 人の成人被験者が無作為化されました。表 12 は、治療目的分析の結果を示しています。
この試験とそれを支持する上顎穿刺試験では、評価可能な 15 人の被験者が、特定された病原体としてβ-ラクタマーゼを産生しないインフルエンザ菌を持っていました。これらのうち、67% (10/15) でこの病原体が根絶されました。 18 人の評価可能な被験者は、同定された病原体として肺炎連鎖球菌を持っていました。これらのうち、83% (15/18) でこの病原体が根絶されました。
初期のライム病
初期のライム病の被験者を対象に、適切で十分に管理された 2 つの試験が実施されました。すべての被験者は、感染の全身症状の有無にかかわらず、医師が記録した遊走性紅斑を呈しました。被験者は、早期ライム病の治療の成功について治療後 1 か月で評価され(パート I)、後期ライム病の後遺症への進行防止の成功について治療後 1 年で評価されました(パート II)。
合計 355 人の成人被験者 (セフロキシム アキセチルで治療された 181 人、ドキシサイクリンで治療された 174 人) が 2 つの試験で無作為化され、79% (281/355) で早期ライム病の診断が確認されました。これらの被験者における早期ライム病の臨床診断は、1) 治療前の遊走性紅斑の皮膚病変の写真を専門家が盲検下で読み取ること、および 2) 血清学的確認 (酵素結合免疫吸着アッセイ [ELISA] および免疫ブロットアッセイを使用) によって検証されました。 [「ウェスタン」ブロット]) ライム病の病原体であるボレリア・ブルグドルフェリに特異的な抗体の存在。表 13 の有効性データは、この「検証済み」患者サブセットに固有のものですが、以下の安全性データは 2 つの試験の患者集団全体を反映しています。 「検証済み」患者サブセットの評価可能な被験者の臨床データを表 13 に示します。
セフチンとドキシサイクリンは、後期ライム病の後遺症の発症を予防するのに効果的でした.
薬物関連の胃腸の有害反応の発生率は 2 つの治療群で同様でしたが (セフロキシム アキセチル - 13%; ドキシサイクリン - 11%)、薬物関連の下痢の発生率はドキシサイクリン群よりもセフロキシム アキセチル群の方が高かった (11それぞれ % 対 3%)。
参考文献
1. Clinical and Laboratory Standards Institute (CLSI)。好気的に増殖する細菌の希釈抗菌薬感受性試験の方法;承認された標準 - 第 10 版。 2015. CLSI ドキュメント M07-A10、Clinical and Laboratory Standards Institute、950 West Valley Road、Suite 2500、Wayne、Pennsylvania 19087、USA。
2. Clinical and Laboratory Standards Institute (CLSI)。分離頻度の低い細菌または気難しい細菌の抗菌希釈およびディスク感受性試験の方法: 承認済みガイドライン - 第 2 版。 2010. CLSI ドキュメント M45-A2、Clinical and Laboratory Standards Institute、950 West Valley Road、Suite 2500、Wayne、Pennsylvania 19087、USA。
3. Clinical and Laboratory Standards Institute (CLSI)。抗菌薬感受性試験の性能基準;第 25 情報補足。 2015. CLSI ドキュメント M100-S25、Clinical and Laboratory Standards Institute、950 West Valley Road、Suite 2500、Wayne、Pennsylvania 19087、USA。
4. Clinical and Laboratory Standards Institute (CLSI)。抗菌ディスク拡散感受性試験の性能基準;承認された標準 - 第 12 版。 2015. CLSI ドキュメント M02-A12、Clinical and Laboratory Standards Institute、950 West Valley Road、Suite 2500、Wayne、Pennsylvania 19087、USA。
患者情報
アレルギー反応
セフチンはセファロスポリンであり、一部の人にアレルギー反応を引き起こす可能性があることを患者に伝えます[ 警告と注意事項 ]。
クロストリジウム・ディフィシル関連下痢症
下痢は抗菌薬によって引き起こされる一般的な問題であり、通常は抗菌薬を中止すると治まることを患者に伝えます。抗菌薬による治療を開始した後、最後に抗菌薬を服用してから 2 か月以上経っても水様便や血便(胃痙攣や発熱の有無にかかわらず)が現れることがあります。これが発生した場合は、できるだけ早く医師に連絡するよう患者にアドバイスしてください。
フェニルケトン尿症
経口懸濁液用セフチン 125mg にはフェニルアラニン (アスパルテームの成分) が含まれていることを患者と介護者に知らせる [ 警告と注意事項 ]。
錠剤の粉砕
錠剤をつぶさずに、錠剤全体を飲み込むように患者に指示してください。錠剤を丸ごと飲み込めない患者は、経口懸濁液を服用してください。
経口懸濁液
使用前に経口懸濁液をよく振り、冷蔵庫に保管し、10 日後に廃棄するように患者に指示します。経口懸濁液は食事と一緒に摂取する必要があります。
薬剤耐性
セフチンを含む抗菌薬は、細菌感染症の治療にのみ使用する必要があることを患者に伝えてください。ウイルス感染症(風邪など)は治療しません。細菌感染症の治療のためにセフチン 250mg を処方する場合は、治療の初期に気分が良くなるのが一般的ですが、指示どおりに服用する必要があることを患者に伝えてください。投与をスキップしたり、治療の全コースを完了しないと、(1) 当面の治療の有効性が低下し、(2) 細菌が耐性を獲得し、将来的にセフチン 500mg または他の抗菌薬で治療できなくなる可能性が高くなります。 .
