Suprax 100mg, 200mg Cefixime 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Suprax 200mg とは何ですか?
Suprax (セフィキシム) 経口懸濁液は、細菌によって引き起こされるさまざまな種類の感染症の治療に使用されるセファロスポリン系抗生物質です。
スープラックスの副作用は?
Suprax 100mg の一般的な副作用は次のとおりです。
- 胃のむかつき/痛み、
- 下痢、
- 吐き気、
- 便秘、
- 食欲減少、
- ガス、
- 頭痛、
- めまい、
- 不安、
- 眠気、
- 夜間の排尿の増加、
- 鼻水が出る、
- 喉の痛み、
- 咳、または
- 膣のかゆみまたは分泌物。
Suprax 200mg の次のようなまれではあるが非常に深刻な副作用が発生した場合は、医師に相談してください。
- 激しい胃や腹痛、
- 持続的な吐き気や嘔吐、
- 目や肌の黄ばみ、
- 暗い尿、
- 異常な疲労感
- 感染症の新たな徴候(例えば、持続性の喉の痛み、発熱)、
- あざや出血しやすい、
- 尿量の変化、または
- 精神/気分の変化 (混乱など)。
説明
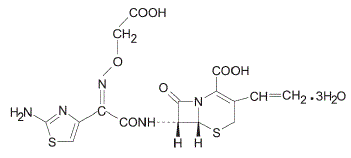
セフィキシムは、経口投与用の半合成セファロスポリン抗菌剤です。化学的には、(6R,7R)-7-[2-(2-アミノ-4-チアゾリル)グリオキシルアミド]-8-オキソ-3-ビニル-5-チア-1-アザビシクロ[4.2.0] oct-2 -エン-2-カルボン酸、72-(Z)-[O-(カルボキシメチル)オキシム]三水和物。
分子量 = 三水和物として 507.50。化学式はC16H15N5O7S2.3H2O
セフィキシムの構造式は次のとおりです。
- SUPRAX® (セフィキシム) 400 mg 錠剤 USP に含まれる不活性成分は、リン酸二カルシウム、ヒプロメロース、ラクトース一水和物、ステアリン酸マグネシウム、微結晶性セルロース、ポリエチレングリコール、アルファ化デンプン、二酸化チタン、およびトリアセチンです。
- SUPRAX® (セフィキシム) 400 mg カプセルに含まれる不活性成分は、コロイド状二酸化ケイ素、クロスポビドン、低置換ヒドロキシプロピルセルロース、ステアリン酸マグネシウム、およびマンニトールです。カプセル シェルには、酸化鉄黒、酸化鉄赤、ゼラチン、水酸化カリウム、プロピレン グリコール、セラック、ラウリル硫酸ナトリウム、および二酸化チタンの不活性成分が含まれています。
- SUPRAX® (セフィキシム) 100 mg または 150 mg または 200 mg チュアブル タブレットに含まれる不活性成分は、アスパルテーム、コロイド状二酸化ケイ素、クロスポビドン、FD&C Red # 40 アルミニウム レーキ、低置換度ヒドロキシプロピル セルロース、ステアリン酸マグネシウム、マンニトール、ファンタジー フレーバー パーマシール、そしてトゥッティフルッティ味。
- 経口懸濁液 USP 用の SUPRAX® (セフィキシム) 粉末に含まれる不活性成分は、コロイド状二酸化ケイ素、安息香酸ナトリウム、ストロベリーフレーバー、スクラロース (500 mg/5 mL 強度のみ)、スクロース、およびキサンタンガムです。
適応症
合併症のない尿路感染症
SUPRAX は、Escherichia coli および Proteus mirabilis の感受性分離株によって引き起こされる合併症のない尿路感染症を有する生後 6 か月以上の成人および小児患者の治療に適応されます。
中耳炎
SUPRAX は、インフルエンザ菌、モラクセラ・カタラーリス、化膿連鎖球菌の感受性分離株に起因する中耳炎の成人および生後 6 か月以上の小児患者の治療に適応されます。 (この器官系における化膿連鎖球菌に対する有効性は、10 未満の感染で研究されました。)
ノート
Streptococcus pneumoniae による中耳炎の患者では、セフィキシムの方が比較対象よりも全体的な反応が約 10% 低かった [参照 臨床研究 ]。
咽頭炎と扁桃炎
SUPRAX は、生後 6 か月以上の成人および小児患者の治療に適応されます。化膿性レンサ球菌の感受性分離株によって引き起こされる咽頭炎および扁桃炎を伴う。 (注:ペニシリンは、化膿性レンサ球菌感染症の治療において選択される通常の薬剤です。SUPRAX は一般に、化膿性レンサ球菌の鼻咽頭からの根絶に有効ですが、その後のリウマチ熱の予防における SUPRAX 100mg の有効性を確立するデータはありません。利用可能。)
慢性気管支炎の急性増悪
SUPRAX 200mg は、肺炎連鎖球菌およびインフルエンザ菌の感受性分離株によって引き起こされる慢性気管支炎の急性増悪を伴う、生後 6 か月以上の成人および小児患者の治療に適応されます。
合併症のない淋病(子宮頸部/尿道)
SUPRAX 100mg は、ナイセリア ゴノロエエの感受性分離株 (ペニシリナーゼおよび非ペニシリナーゼ産生分離株) によって引き起こされる合併症のない淋病 (子宮頸部/尿道) を有する生後 6 か月以上の成人および小児患者の治療に適応されます。
使用法
薬剤耐性菌の発生を減らし、SUPRAX 100mg および他の抗菌薬の有効性を維持するために、SUPRAX 100mg は、感受性のある細菌によって引き起こされることが証明されている、または強く疑われる感染症の治療にのみ使用する必要があります。培養と感受性の情報が利用できる場合、抗菌薬療法の選択または変更の際にそれらを考慮する必要があります。そのようなデータがない場合、地域の疫学および感受性パターンが治療の経験的選択に寄与する可能性があります。
投薬と管理
大人
セフィキシムの推奨用量は、1 日 400 mg です。これは、毎日 400 mg の錠剤またはカプセルとして投与するか、400 mg の錠剤を分割して 12 時間ごとに半錠として投与することができます。合併症のない子宮頸部/尿道の淋菌感染症の治療には、400 mg の単回経口投与が推奨されます。カプセルおよび錠剤は、食物に関係なく投与することができる。
化膿連鎖球菌による感染症の治療では、治療用量のセフィキシムを少なくとも 10 日間投与する必要があります。
小児患者(生後6ヶ月以上)
推奨用量は、懸濁液の 8 mg/kg/日です。これは、1 日 1 回の投与量として投与することも、12 時間ごとに 4 mg/kg として 2 回に分けて投与することもできます。
ノート
推奨用量は、小児の体重範囲ごとに決定されています。表 1 を参照してください。経口懸濁液用の SUPRAX は 3 つの異なる濃度 (100 mg/5 mL、200 mg/5 mL、および 500 mg/5 mL) で入手できるため、用量をミリリットル単位で指定するすべての注文に濃度が含まれていることを確認してください。
体重が 45 kg を超える子供または 12 歳以上の子供は、成人の推奨用量で治療する必要があります。 SUPRAX (セフィキシム) チュアブル錠は、飲み込む前に噛むか、砕いてください。
中耳炎は、チュアブル錠または懸濁液で治療する必要があります。中耳炎の臨床試験は、チュアブル錠または懸濁液を用いて実施され、チュアブル錠または懸濁液は、同じ用量で投与された場合、錠剤よりも高いピーク血中レベルをもたらしました。
したがって、中耳炎の治療において、チュアブル錠または懸濁液の代わりに錠剤またはカプセルを使用するべきではありません。 臨床薬理学 ]。
化膿連鎖球菌による感染症の治療では、治療用量のセフィキシムを少なくとも 10 日間投与する必要があります。
腎障害
SUPRAX 200mg は、腎機能障害がある場合に投与することができます。クレアチニンクリアランスが 60 mL/min 以上の患者では、通常の用量とスケジュールを使用することができます。腎機能障害のある成人の用量調整については、表 2 を参照してください。血液透析も腹膜透析も、体からかなりの量の薬物を除去しません。
経口懸濁液の再構成方法
再構成後、懸濁液を室温または冷蔵下で 14 日間保存しても、効力が大幅に低下することはありません。密閉して保管してください。よく振ってからご使用ください。未使用部分は 14 日後に廃棄してください。
供給方法
剤形と強度
SUPRAX は、次の剤形と強度で経口投与できます。
- フィルムコーティング錠は、三水和物として 400 mg のセフィキシムを提供します。これらは、白からオフホワイトのフィルムコーティングされたカプセル形状の錠剤で、エッジが面取りされ、両側に分割されたスコアラインがあります。タブレットの片面には「SUPRAX」、もう片面には「LUPIN」のデボス加工が施されています。
- カプセルは、三水和物として 400 mg のセフィキシムを提供します。これらは、ピンクの不透明なキャップとピンクの不透明なボディのサイズ「00EL」カプセルで、キャップに「LU」、ボディに黒インクで「U43」が付いています。カプセル内に白色~黄白色の粒状粉末が入っています。
- チュアブル錠は、三水和物として 100 mg または 150 mg または 200 mg のセフィキシムを提供します。 100mg錠はピンク色の丸い錠剤で、片面に「SUPRAX 100」、もう片面に「LUPIN」と刻印されています。 150 mg 錠はピンク色の丸い錠剤で、片面に「SUPRAX 150」、もう片面に「LUPIN」とデボス加工されています。 200mgの錠剤はピンク色の丸い錠剤で、片面に「SUPRAX 200」、反対面に「LUPIN」と刻印されています。
- 経口懸濁液用の粉末は、再構成すると、100 mg/5 mL または 200 mg/5 mL または 500 mg/5 mL のセフィキシムを三水和物として提供します。 100 mg/5 mL および 200 mg/5 mL の場合、粉末はオフホワイトから淡黄色で、ストロベリー風味です。 500 mg/5 mL の場合、粉末はオフホワイトからクリーム色で、ストロベリー風味です。
保管と取り扱い
SUPRAX® は、以下の表に記載されている次の剤形、強度、およびパッケージで経口投与できます。
製造元: Lupin Limited Mandideep 462 046 インド。改訂: 2018 年 3 月。
副作用
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
錠剤製剤の米国での試験で最も一般的に見られた副作用は消化器系のイベントであり、1 日 2 回または 1 日 1 回のレジメンで成人患者の 30% で報告されました。米国の臨床試験では、患者の 5% が薬物関連の副作用のために治療を中止しました。個々の副作用には、下痢 16%、軟便または頻便 6%、腹痛 3%、吐き気 7%、消化不良 3%、鼓腸 4% が含まれていました。懸濁液を投与された小児患者における下痢や軟便などの胃腸の有害反応の発生率は、錠剤を投与された成人患者に見られる発生率と同等でした。
市販後の経験
セフィキシムの承認後の使用により、次の副作用が報告されています。発生率は 50 人に 1 人未満 (2% 未満) でした。
胃腸
文書化された偽膜性大腸炎のいくつかの症例が臨床試験で確認されました。偽膜性大腸炎の症状の発症は、治療中または治療後に発生する可能性があります。
過敏反応
アナフィラキシー/アナフィラキシー様反応 (ショックおよび死亡を含む)、皮膚発疹、蕁麻疹、薬物熱、そう痒症、血管性浮腫、および顔面浮腫。多形紅斑、スティーブンス・ジョンソン症候群、および血清病様反応が報告されています。
肝臓
SGPT、SGOT、アルカリホスファターゼ、肝炎、黄疸の一時的な上昇。
腎臓
BUNまたはクレアチニンの一時的な上昇、急性腎不全。
中枢神経系
頭痛、めまい、発作。
血液とリンパ系
一過性血小板減少症、白血球減少症、好中球減少症、プロトロンビン時間の延長、LDH の上昇、汎血球減少症、無顆粒球症、および好酸球増加症。
異常な臨床検査
高ビリルビン血症。
その他の有害反応
性器そう痒症、膣炎、カンジダ症、中毒性表皮壊死症。
セファロスポリンクラスの薬剤について報告された有害反応
アレルギー反応、重複感染、腎機能障害、中毒性腎症、胆汁うっ滞を含む肝機能障害、再生不良性貧血、溶血性貧血、出血、および大腸炎。
いくつかのセファロスポリンは、特に投与量が減らされなかった場合に腎機能障害のある患者で発作を誘発することに関与している[ 投薬と管理 見る 過剰摂取 ]。薬物療法に関連する発作が発生した場合は、薬物を中止する必要があります。臨床的に必要な場合は、抗けいれん療法を行うことができます。
薬物相互作用
カルバマゼピン
セフィキシムを併用投与すると、市販後の経験でカルバマゼピンレベルの上昇が報告されています。薬物モニタリングは、カルバマゼピン血漿濃度の変化を検出するのに役立ちます。
ワルファリンと抗凝固薬
セフィキシムを併用すると、臨床的出血の有無にかかわらず、プロトロンビン時間の増加が報告されています。
薬物/実験室試験の相互作用
尿中のケトンの偽陽性反応は、ニトロプルシドを使用した検査で発生する可能性がありますが、ニトロフェリシアニドを使用した検査では発生しません.
セフィキシムの投与は、クリニテスト®、ベネディクト液、またはフェーリング液を使用した尿中のグルコースに対する偽陽性反応を引き起こす可能性があります。酵素的グルコースオキシダーゼ反応(Clinistix®やTesTape®など)に基づくグルコース検査を使用することをお勧めします。偽陽性の直接クームス試験は、他のセファロスポリンによる治療中に報告されています。したがって、陽性のクームス試験は薬物によるものである可能性があることを認識しておく必要があります。
警告
の一部として含まれています 予防 セクション。
予防
過敏反応
セフィキシムの使用により、アナフィラキシー/アナフィラキシー様反応 (ショックや死亡を含む) が報告されています。
SUPRAX による治療を開始する前に、患者が以前にセファロスポリン、ペニシリン、またはその他の薬剤に対して過敏反応を示したかどうかを慎重に調査する必要があります。この製品がペニシリンに敏感な患者に投与される場合は、ベータラクタム系抗菌薬間の交差過敏症が明確に文書化されており、ペニシリンアレルギーの既往のある患者の最大 10% で発生する可能性があるため、注意が必要です。 SUPRAX 100mg に対するアレルギー反応が生じた場合は、薬剤の使用を中止してください。
クロストリジウム・ディフィシル関連下痢症
クロストリジウム ディフィシル関連下痢症 (CDAD) は、SUPRAX 200mg を含むほぼすべての抗菌薬の使用で報告されており、軽度の下痢から致命的な大腸炎までの重症度に及ぶ可能性があります。抗菌剤による治療は、結腸の正常な細菌叢を変化させ、C. difficile の異常増殖を引き起こします。
C. difficile は、CDAD の発症に寄与する毒素 A および B を産生します。 C. difficile の高毒素産生分離株は、これらの感染症が抗菌療法に抵抗性である可能性があり、結腸切除が必要になる可能性があるため、罹患率と死亡率の増加を引き起こします。 CDAD は、抗菌薬の使用後に下痢を呈するすべての患者で考慮しなければなりません。 CDADは抗菌薬投与後2か月以上経過すると報告されているため、病歴には注意が必要です。
CDAD が疑われるか確認された場合、C. difficile に対するものではない継続的な抗菌薬の使用を中止する必要があるかもしれません。適切な体液と電解質の管理、タンパク質の補給、C. difficile の抗菌薬治療、および外科的評価を、臨床的に必要な場合に開始する必要があります。
腎障害における用量調整
SUPRAX 100mg の投与量は、腎機能障害のある患者、ならびに持続的外来腹膜透析 (CAPD) および血液透析 (HD) を受けている患者では調整する必要があります。透析患者は注意深く監視する必要があります[ 投薬と管理 ]。
凝固効果
SUPRAX 200mg を含むセファロスポリンは、プロトロンビン活性の低下と関連している可能性があります。危険にさらされている患者には、腎臓または肝臓の機能障害、または栄養状態の悪い患者、抗菌薬療法の長期コースを受けている患者、および以前に抗凝固療法で安定した患者が含まれます。リスクのある患者ではプロトロンビン時間を監視し、必要に応じて外因性ビタミン K を投与する必要があります。
薬剤耐性菌の発生
細菌感染が証明されていない、または強く疑われている場合に SUPRAX (セフィキシム) を処方しても、患者に利益がもたらされる可能性は低く、薬剤耐性菌が発生するリスクが高まります。
フェニルケトン尿症患者のリスク
フェニルアラニンは、フェニルケトン尿症 (PKU) の患者に有害な場合があります。 SUPRAX 200mg チュアブル錠には、フェニルアラニンの供給源であるアスパルテームが含まれています。 100 mg、150 mg、および 200 mg の各強度には、それぞれ 3.3 mg、5 mg、および 6.7 mg のフェニルアラニンが含まれています。 PKU 患者に SUPRAX チュアブル錠を処方する前に、SUPRAX 200mg チュアブル錠を含むすべての供給源からのフェニルアラニンの合計 1 日量を考慮してください。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん性を評価するための動物での生涯試験は実施されていません。セフィキシムは、in vitro で細菌または哺乳動物細胞に点突然変異、DNA 損傷、または染色体損傷を引き起こさず、in vivo マウス小核試験で染色体異常誘発能を示さなかった。ラットでは、成人の治療用量の最大 25 倍の用量のセフィキシムによって、受胎能および生殖能力は影響を受けませんでした。
特定の集団での使用
妊娠
妊娠カテゴリーB
ヒトの用量の 40 倍までの用量でマウスとラットで生殖研究が行われ、セフィキシムによる胎児への害の証拠は明らかにされていません。妊娠中の女性を対象とした、十分に管理された研究はありません。動物の繁殖研究は常に人間の反応を予測できるわけではないため、この薬は明らかに必要な場合にのみ妊娠中に使用する必要があります.
労働と配達
分娩中のセフィキシムの使用は研究されていません。明らかに必要な場合にのみ治療を行うべきです。
授乳中の母親
セフィキシムが母乳中に排泄されるかどうかは不明です。本剤投与中は、一時的に授乳を中止することを考慮すること。
小児用
生後 6 か月未満の小児におけるセフィキシムの安全性と有効性は確立されていません。懸濁液を投与された小児患者における下痢や軟便を含む胃腸の有害反応の発生率は、錠剤を投与された成人患者に見られる発生率と同等でした。
高齢者の使用
臨床研究では、65 歳以上の対象者が若い対象者と異なる反応を示すかどうかを判断するのに十分な数の対象者が含まれていませんでした。他の報告された臨床経験では、年配の患者と若い患者の間の反応の違いは確認されていません。高齢者の薬物動態研究では、薬物動態パラメーターの違いが検出されました [参照 臨床薬理学 ]。これらの差は小さく、高齢者における薬の用量調整の必要性を示すものではありません。
腎障害
セフィキシムの投与量は、腎機能障害のある患者、および持続的外来腹膜透析 (CAPD) および血液透析 (HD) を受けている患者で調整する必要があります。透析患者は注意深く監視する必要があります[ 投薬と管理 ]。
過剰摂取
胃洗浄が必要な場合があります。そうでなければ、特定の解毒剤は存在しません。セフィキシムは、血液透析または腹膜透析によって循環から大量に除去されることはありません。最大 2 g のセフィキシムを単回投与された少数の健康な成人ボランティアの有害反応は、推奨用量で治療された患者で見られたプロファイルと違いはありませんでした。
禁忌
Suprax(セフィキシム)は、セフィキシムまたは他のセファロスポリンに対する既知のアレルギーのある患者には禁忌です。
臨床薬理学
作用機序
セフィキシムは、半合成セファロスポリン抗菌薬です。 微生物学 ]。
薬物動態
SUPRAX 200mg チュアブル錠は経口懸濁液と生物学的に同等です。
SUPRAX 200mg の錠剤および懸濁液は、経口投与された場合、食物の有無にかかわらず、約 40% から 50% 吸収されます。ただし、食物と一緒に投与すると、最大吸収までの時間が約 0.8 時間長くなります。セフィキシムの 200 mg 錠剤 1 錠の平均ピーク血清濃度は約 2 mcg/mL (範囲 1 ~ 4 mcg/mL) です。単一の 400 mg 錠剤は、約 3.7 mcg/mL (範囲 1.3 ~ 7.7 mcg/mL) の平均ピーク濃度を生成します。経口懸濁液は、正常な成人ボランティアで試験した場合、錠剤よりも約 25% から 50% 高い平均ピーク濃度を生成します。経口懸濁液の 200 mg および 400 mg の用量は、正常な成人ボランティアで試験した場合、それぞれ 3 mcg/mL (範囲 1 ~ 4.5 mcg/mL) および 4.6 mcg/mL (範囲 1.9 ~ 7.7 mcg/mL) の平均ピーク濃度を生成します。 .時間対濃度曲線の下の面積 (AUC) は、正常な成人ボランティアで試験した場合、100 ~ 400 mg の用量で錠剤よりも経口懸濁液の方が約 10% ~ 25% 大きくなります。錠剤の代わりに経口懸濁液を使用する場合は、この吸収の増加を考慮する必要があります。生物学的同等性がないため、中耳炎の治療において錠剤を経口懸濁液の代わりに使用すべきではない[参照 投薬と管理 ]。錠剤と懸濁液のクロスオーバー研究は、小児では実施されていません。
400 mg カプセルは、絶食条件下で 400 mg 錠剤と生物学的に同等です。しかし、食物は、カプセル投与後の吸収を、AUCに基づいて約15%、Cmaxに基づいて約25%減少させます。
200 mg 錠剤 1 錠、400 mg 錠剤 1 錠、またはセフィキシム懸濁液 400 mg の経口投与後、2 時間から 6 時間の間に最高血清濃度が生じます。 200 mg の懸濁液を 1 回投与すると、2 時間から 5 時間後に血清中濃度がピークに達します。 400 mg カプセルを 1 回経口投与した後、3 時間から 8 時間後に血清中濃度がピークに達します。
分布
血清タンパク質の結合は濃度に依存せず、結合率は約 65% です。錠剤や懸濁液よりも生物学的利用能の低い研究用製剤で実施された複数回投与試験では、14 日間の投与後、血清または尿中に薬物の蓄積はほとんどありませんでした。セフィキシムの CSF レベルに関する適切なデータは入手できません。
代謝と排泄
インビボでのセフィキシムの代謝の証拠はない。吸収された量の約 50% が 24 時間で変化せずに尿中に排泄されます。動物実験では、セフィキシムも投与量の 10% を超えて胆汁中に排泄されることが注目されました。健康な被験者におけるセフィキシムの血清半減期は、剤形とは無関係であり、平均3〜4時間ですが、一部の正常なボランティアでは最大9時間の範囲になる場合があります.
特別な集団
老年医学
高齢患者の定常状態での平均 AUC は、他の健康な成人の平均 AUC よりも約 40% 高くなります。セフィキシム 400 mg を 1 日 1 回 5 日間投与された 12 人の若者と 12 人の高齢者の薬物動態パラメーターの違いは、次のように要約されます。
しかし、これらの増加は臨床的に有意ではありませんでした[ 投薬と管理 ]。
腎障害
中等度の腎機能障害 (クレアチニンクリアランスが 20 ~ 40 mL/分) の被験者では、セフィキシムの平均血清半減期は 6.4 時間に延長されます。重度の腎機能障害 (5 ~ 20 mL/分のクレアチニン クリアランス) では、半減期は平均 11.5 時間に増加しました。薬物は、血液透析または腹膜透析によって血液から有意に除去されません。しかし、ある研究では、400 mg の用量で、血液透析を受けている患者は、クレアチニン クリアランスが 21 ~ 60 mL/min の被験者と同様の血液プロファイルを示すことが示されました。
微生物学
作用機序
他のセファロスポリンと同様に、セフィキシムの殺菌作用は細胞壁合成の阻害に起因します。セフィキシムは、特定のベータラクタマーゼ酵素の存在下で安定しています。その結果、ベタラクタマーゼの存在によりペニシリンおよび一部のセファロスポリンに耐性のある特定の生物は、セフィキシムの影響を受けやすい可能性があります。
抵抗
インフルエンザ菌および淋菌の分離株におけるセフィキシムに対する耐性は、ほとんどの場合、ペニシリン結合タンパク質 (PBP) の変化に関連しています。セフィキシムは、拡張スペクトル ベータ-ラクタマーゼ (ESBL) を産生する腸内細菌科に対する活性が限られている可能性があります。 Pseudomonas 種、Enterococcus 種、グループ D 連鎖球菌の株、Listeria monocytogenes、ブドウ球菌のほとんどの株 (メチシリン耐性株を含む)、Enterobacter 種のほとんどの株、Bacteroides fragilis のほとんどの株、および Clostridium 種のほとんどの株は、セフィキシムに耐性があります。
抗菌活性
セフィキシムは、in vitro および臨床感染症の両方で、以下の微生物のほとんどの分離株に対して活性があることが示されています [参照 適応症 ]。
グラム陽性菌
肺炎連鎖球菌 化膿連鎖球菌
グラム陰性菌
大腸菌 インフルエンザ菌 モラクセラ・カタラーリス 淋菌 プロテウス・ミラビリス
以下の in vitro データが利用可能ですが、それらの臨床的意義は不明です。以下の細菌の少なくとも 90% は、同様の属または生物群の分離株に対するセフィキシムの感受性ブレークポイント以下の in vitro 最小発育阻止濃度 (MIC) を示します。ただし、これらの細菌によって引き起こされる臨床感染症の治療におけるセフィキシムの有効性は、十分に管理された適切な臨床試験では確立されていません。
グラム陽性菌
連鎖球菌アガラクティエ
グラム陰性菌
シトロバクター・アマロナティカス シトロバクター・ダイバースス ヘモフィルス・パラインフルエンザ クレブシエラ・オキシトカ クレブシエラ・ニューモニエ パスツレラ・マルトシダ プロテウス・ブルガリス プロビデンシア種 サルモネラ種 セラチア・マルセッセンス シゲラ種
感受性試験
感受性試験の解釈基準、関連する試験方法、およびこの薬剤について FDA によって認められた品質管理基準に関する具体的な情報については、https://www.fda.gov/STIC を参照してください。
臨床研究
中耳炎の比較臨床試験は、生後 6 か月から 10 歳までの約 400 人の子供を対象に実施されました。 Streptococcus pneumoniae は患者の 47% から、インフルエンザ菌は 34% から、Moraxella catarrhalis は 15% から、S. pyogenes は 4% から分離されました。
セフィキシムに対する Streptococcus pneumoniae の全体的な応答率は、セフィキシムに対するこれらの微生物の応答率よりも約 10% 低く、Haemophilus influenzae または Moraxella catarrhalis の応答率は約 7% 高かった (インフルエンザ菌の β-ラクタマーゼ陽性分離株が含まれる場合は 12%)。アクティブコントロール薬。
これらの研究では、患者は無作為に割り付けられ、セフィキシム 4 mg/kg 1 日 2 回または 8 mg/kg 1 日 1 回のいずれかで治療されました。治療後 2 ~ 4 週間の評価で、各群の患者の 69 ~ 70% で中耳炎の徴候と症状が解消されましたが、患者の 15% で持続性滲出液が見られました。治療終了時に評価した場合、セフィキシムを投与された患者の 17% と有効な比較薬を投与された患者の 14% (対照薬に耐性のインフルエンザ菌を有し、対照抗菌薬を投与された患者を含む 18%) が有効であると見なされました。治療失敗。 2 ~ 4 週間のフォローアップまでに、合計 30% ~ 31% の患者に治療の失敗または再発の証拠がありました。
反復中耳に基づく治療後 2 ~ 4 週間の中耳炎の細菌学的転帰
患者情報
セフィキシムを含む抗菌薬は、細菌感染症の治療にのみ使用するよう患者に助言してください。ウイルス感染症(風邪など)は治療しません。細菌感染症の治療にセフィキシムを処方する場合、治療の初期には気分が良くなるのが一般的ですが、指示どおりに薬を服用する必要があることを患者に伝えてください。投与をスキップしたり、治療の全コースを完了しないと、(1) 即時治療の有効性が低下し、(2) 細菌が耐性を獲得し、経口懸濁液用のセフィキシムやチュアブル錠などのセフィキシムで治療できなくなる可能性が高くなります。今後の抗菌薬。
フェニルケトン尿症の患者には、SUPRAX 200mg チュアブル タブレットにはフェニルアラニンの供給源であるアスパルテームが次のように含まれていることを伝えてください。各 SUPRAX チュアブル タブレットには、100 mg、150 mg、および 200 mg の強度あたり、それぞれ 3.3 mg、5 mg、および 6.7 mg のフェニルアラニンが含まれています。
下痢は抗菌薬によって引き起こされる一般的な問題であり、通常は抗菌薬の使用を中止すると終了することを患者にアドバイスします。抗菌薬による治療を開始した後、患者は、抗菌薬の最後の用量を服用してから2か月以上経っても、水様便や血便(胃痙攣や発熱の有無にかかわらず)を発症することがあります.これが発生した場合、患者はできるだけ早く医師に連絡する必要があります。
