感染症の治療: Bactrim 400/80mg, 800/160mg Trimethoprim 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
ブランド名: バクトリム
一般名:点滴静注用スルファメトキサゾール・トリメトプリム注射液
バクトリム800mgとは?
バクトリム (スルファメトキサゾールとトリメトプリム) DS は、尿路感染症、急性中耳炎、気管支炎、赤痢、ニューモシスチス肺炎、旅行者下痢症、メチシリン耐性黄色ブドウ球菌 (MRSA)、およびその他の細菌性感染症の治療に使用される 2 つの抗生物質の組み合わせです。この抗生物質に感受性のある感染症。
バクトリムの副作用は何ですか?
バクトリムの一般的な副作用は次のとおりです。
- 食欲減少、
- 吐き気、
- 嘔吐、
- 舌の痛みや腫れ、
- めまい、
- 回転する感覚、
- あなたの耳に鳴り響く、
- 疲労感や
- 睡眠の問題(不眠症)。
Bactrim 800mg の次のような重大な副作用が発生した場合は、医師に相談してください。
- あざや出血、
- 再生不良性貧血、
- 黄疸、
- 肝壊死、
- 口内炎、
- 関節痛、
- 重度の皮膚発疹、
- かゆみ、そして
- 喉の痛み。
説明
BACTRIM™ (トリメトプリムおよびスルファメトキサゾール) 注射は、静脈内注入専用の無菌溶液であり、スルファメトキサゾール (スルホンアミド系抗菌剤) とトリメトプリム (ジヒドロ葉酸レダクターゼ阻害剤抗菌剤) の組み合わせです。各 5 mL には、80 mg のトリメトプリム (16 mg/mL) と 400 mg のスルファメトキサゾール (80 mg/mL) が含まれており、40% のプロピレングリコール、10% のエチルアルコール、0.3% のジエタノールアミンが配合されています。 1% ベンジルアルコールおよび 0.1% メタ重亜硫酸ナトリウムを防腐剤として添加し、注射用水を加え、水酸化ナトリウムで pH を約 10 に調整しました。
トリメトプリムは、2,4-ジアミノ-5-(3,4,5-トリメトキシベンジル)ピリミジンです。これは、分子量が 290.3 で、次の構造式を持つ、白色から淡黄色、無臭、苦味のある化合物です。
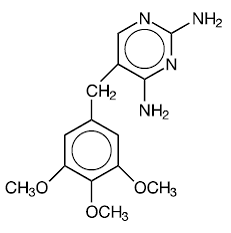
C14H18N4O3 分子量 290.3
スルファメトキサゾールは、N1-(5-メチル-3-イソキサゾリル)スルファニルアミドです。これは、分子量が 253.28 で、次の構造式を持つ、ほぼ白色、無臭、無味の化合物です。
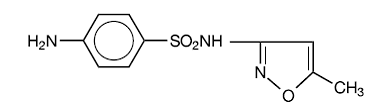
C10H11N3O3S 分子量 253.28
適応症
ニューモシスチス・ジロベチー肺炎
BACTRIM は、成人および生後 2 か月以上の小児患者のニューモシスチス イロベチ肺炎の治療に適応されます。
赤痢
BACTRIM 400mg は、成人および生後 2 か月以上の小児患者における、感受性のシゲラ フレクスナー菌株およびシゲラ ソンネイ菌によって引き起こされる腸炎の治療に適応されます。
尿路感染症
バクトリムは、経口投与時に大腸菌、クレブシエラ種、エンテロバクター種、モルガネラ・モルガニ、プロテウス・ミラビリス、プロテウス・ブルガリスの感受性株による生後2ヶ月以上の成人および小児患者の重度または複雑な尿路感染症の治療に適応されます。 BACTRIM は実行不可能であり、微生物が尿路で有効な単剤抗菌薬の影響を受けにくい場合。
使用法
薬剤耐性菌の発生を減らし、BACTRIM やその他の抗菌薬の有効性を維持するために、BACTRIM は、感受性のある細菌が原因であることが証明されている、または強く疑われる感染症の治療または予防にのみ使用する必要があります。培養および感受性の情報が利用可能である場合、それらは抗菌療法の選択または変更において考慮されるべきです。そのようなデータがない場合、地域の疫学および感受性パターンが治療の経験的選択に寄与する可能性があります。
適切な培養および感受性試験を実施する必要がありますが、これらの試験の結果を待っている間に治療を開始することもできます。
投薬と管理
成人および小児患者(生後2か月以上)の投与量
日最大推奨用量は、1 日 60 mL (トリメトプリム 960 mg) です。
腎機能障害患者における用量変更
腎機能が損なわれている場合は、表 2 に示すように用量を減らしてください。
重要な管理手順
溶液を 60 ~ 90 分間かけて静脈内注入して投与します。急速注入またはボーラス注射による投与は避けてください。 BACTRIM 400mg を筋肉内に投与しないでください。
溶液と容器が許す限り、投与前に粒子状物質や変色がないか非経口製剤を目視検査してください。
調製方法
単回および複数回投与バイアルの希釈
BACTRIM は希釈する必要があります。各 5 mL を 5% ブドウ糖水溶液 125 mL に追加する必要があります。 5% デキストロース水で希釈した後、溶液は冷蔵せず、6 時間以内に使用する必要があります。
5% デキストロース水 100 mL あたり 5 mL の希釈が必要な場合は、4 時間以内に使用する必要があります。水分制限が望ましい場合、各 5 mL を 5% デキストロース水溶液 75 mL に加えます。このような状況下では、溶液は使用直前に混合し、2 時間以内に投与する必要があります。
目視検査で、混合後に濁りや結晶化の形跡がある場合は、溶液を廃棄し、新しい溶液を調製する必要があります。
行う いいえ 同じ容器内でバクトリムを 5% デキストロース水溶液と薬物または溶液と混ぜます。
複数回投与バイアル (取り扱い)
バイアルに最初に入れた後、残りの内容物は 48 時間以内に使用する必要があります。
静脈内投与用の輸液システム
次の輸液システムがテストされ、満足のいくものであることが判明しました。単位用量のガラス容器。単位用量ポリ塩化ビニルおよびポリオレフィン容器。他のシステムはテストされていないため、他のシステムを推奨することはできません.
供給方法
剤形と強度
BACTRIM は、80 mg/mL のスルファメトキサゾールと 16 mg/mL のトリメトプリムを 10 mL の単回投与バイアルと 30 mL の複数回投与バイアルに含む注射剤として入手できます。
保管と取り扱い
BACTRIM™(スルファメトキサゾール・トリメトプリム)注射 次のように提供されます。
10mLバイアル 160 mg のトリメトプリム (16 mg/mL) と 800 mg のスルファメトキサゾール (80 mg/mL) を含む、5% デキストロース水溶液の注入用。
10 mL バイアル: NDC 49708-001-4210 mL バイアル (10 個入りボックス): NDC 49708-001-45
30 mL 複数回投与バイアル 、水に 5% ブドウ糖を注入するための 80 mg トリメトプリム (16 mg/mL) および 400 mg スルファメトキサゾール (80 mg/mL) を含む各 5 mL。
30 mL バイアル (1 箱): NDC 49708-002-47
室温 (15°C – 30°C または 59°F – 86°F) で保管してください。冷蔵しないでください。
参考文献
1. ウィンストン DJ、ラウ WK、ゲイル RP、ヤング LS。ニューモシスチス・カリニ肺炎の治療のためのトリメトプリム-スルファメトキサゾール。アンインターン医。 1980 年 6 月;92:762-769。
配布元: Sun Pharmaceutical Industries, Inc. Cranbury, NJ 08512. 改訂: 2020 年 7 月
副作用
次の重篤な副作用は、ラベルの別の場所に記載されています。
- 胚・胎児毒性 [参照 警告と注意事項 ]
- 過敏症およびその他の致命的な反応 [参照 警告と注意事項 ]
- 血小板減少症 [参照 警告と注意事項 ]
- Clostridioides difficile 関連の下痢 [参照 警告と注意事項 ]
- 亜硫酸塩感受性 [参照 警告と注意事項 ]
- ニューモシスチス・ジロベチー肺炎に対するロイコボリンの同時使用に伴うリスク[参照 警告と注意事項 ]
- プロピレングリコール毒性 [参照 警告と注意事項 、 有害反応 ]
- 注入反応 [参照 警告と注意事項 ]
- 低血糖 [参照 警告と注意事項 ]
- 電解質異常[参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
主な副作用として、胃腸障害(吐き気、嘔吐、食欲不振)やアレルギー性皮膚反応(発疹、蕁麻疹など)が挙げられます。
静脈内 (IV) 投与による局所反応、痛み、わずかな刺激はまれです。血栓性静脈炎が観察されています。
市販後の経験
BACTRIMの承認後の使用中に、次の副作用が確認されました。これらの反応は、不確かな規模の集団から自発的に報告されたため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることはできません。
- 血栓性血小板減少性紫斑病
- 特発性血小板減少性紫斑病
- 心室頻拍およびトルサード ド ポワントをもたらす QT 延長
- 代謝性アシドーシス
薬物相互作用
バクトリム 400mg が他の薬剤に影響を与える可能性
トリメトプリムは、CYP2C8 および OCT2 トランスポーターの阻害剤です。スルファメトキサゾールは CYP2C9 の阻害剤です。 BACTRIM 80mg と CYP2C8 および 2C9 または OCT2 の基質である薬物との併用は避けてください。
臨床検査または診断検査との相互作用
BACTRIM、特にトリメトプリム成分は、細菌のジヒドロ葉酸レダクターゼが結合タンパク質として使用される場合、競合結合タンパク質法 (CBPA) によって決定される血清メトトレキサートアッセイを妨害する可能性があります。ただし、メトトレキサートがラジオイムノアッセイ (RIA) によって測定される場合、干渉は発生しません。
BACTRIM の存在は、クレアチニンの Jaffe アルカリ ピクレート反応アッセイにも干渉し、正常値の範囲で約 10% の過大評価をもたらす可能性があります。
参考文献
2. Al-Khatib SM、LaPointe N、Kramer JM、Califf RM。 QT間隔について臨床医が知っておくべきこと。ジャム。 2003;289(16):2120-2127。
3. ボイヤー EW、コウノトリ C、王 RY。総説:ドフェチリドの薬理学と毒物学。 Int J Med Toxicol. 2001;4(2):16.
5. London NJ、Garg SJ、Moorthy RS、Cunningham ET。薬剤性ブドウ膜炎。 J 眼科炎症性感染症。 2013;3:43。
6.マリネッラMA。トリメトプリム誘発性高カリウム血症: 報告された症例の分析。ジェロントール。 1999;45:209-212。
7. Margassery S、Bastani B. トリメトプリムスルファメトキサゾール治療に続発する生命を脅かす高カリウム血症とアシドーシス。 J.Nephrol。 2001;14(5):410-414。
8. Moh Rら。コートジボワールで、コトリモキサゾールと組み合わせてジドブジンを含む HAART レジメンを受けている成人の血液学的変化。 Antivir Ther。 2005;10(5):615-24。
9. Kosoglou T、Rocci ML Jr、Vlasses PH.トリメトプリムは、プロカインアミドと N アセチルプロカインアミドの配置を変更します。 Clin Pharmacol Ther. 1988 年 10 月;44(4):467-77。
警告
の一部として含まれています 予防 セクション。
予防
胚・胎児毒性
いくつかの疫学的研究は、妊娠中の BACTRIM への曝露が、先天性奇形、特に神経管欠損症、心血管奇形、尿路欠損症、口裂、および内反足のリスク増加と関連している可能性があることを示唆しています。妊娠中に BACTRIM 400mg を使用する場合、または患者がこの薬を服用中に妊娠した場合、患者は胎児への潜在的な危険性について知らされるべきです [ 特定の集団での使用 ]。
過敏症およびその他の致命的な反応
スルホンアミドの投与に関連する死亡は、スティーブンス・ジョンソン症候群、中毒性表皮壊死融解症、劇症肝壊死、無顆粒球症、再生不良性貧血およびその他の血液疾患を含む重篤な反応により発生しています。
BACTRIM などのスルホンアミド含有製品を含むスルホンアミドは、皮膚発疹または有害反応の兆候が最初に現れた時点で中止する必要があります。発疹、のどの痛み、発熱、関節痛、咳、息切れ、蒼白、紫斑、黄疸などの臨床症状は、深刻な反応の初期兆候である可能性があります。発疹に続いて、スティーブンス・ジョンソン症候群、中毒性表皮壊死融解症、肝壊死、深刻な血液疾患などのより深刻な反応が起こることがあります。スルホンアミドを投与されている患者では、血算を頻繁に行う必要があります。咳、息切れ、および肺浸潤は、スルホンアミド治療に関連して報告されている気道の過敏反応です。
血小板減少症
BACTRIM による血小板減少症は、免疫介在性疾患である可能性があります。致命的または生命を脅かす血小板減少症の重症例が報告されています。患者の血液毒性を監視します。血小板減少症は通常、BACTRIM の中止後 1 週間以内に解消します。
レンサ球菌感染症とリウマチ熱
連鎖球菌性咽頭炎の治療に BACTRIM を使用しないでください。臨床研究では、グループ A β 溶血性連鎖球菌性扁桃咽頭炎の患者は、BACTRIM 800mg で治療した場合、ペニシリンで治療した患者よりも細菌学的失敗の発生率が高いことが報告されています。したがって、バクトリムはリウマチ熱などの後遺症を予防するものではありません。
Clostridioides Difficile関連下痢症
Clostridioides difficile 関連下痢症 (CDAD) は、BACTRIM 80mg を含むほぼすべての抗菌薬の使用で報告されており、重症度は軽度の下痢から致命的な大腸炎までさまざまです。抗菌剤による治療は、結腸の正常な細菌叢を変化させ、C. difficile の異常増殖を引き起こします。
C. difficile は、CDAD の発症に寄与する毒素 A および B を産生します。 C. difficile の高毒素産生株は、これらの感染症が抗菌療法に抵抗性である可能性があり、結腸切除術を必要とする可能性があるため、罹患率と死亡率の増加を引き起こします。抗菌薬の使用後に下痢を呈するすべての患者で CDAD を考慮する必要があります。 CDADは抗菌薬投与後2か月以上経過すると報告されているため、病歴には注意が必要です。
CDAD が疑われるか確認された場合、C. difficile に対するものではない継続的な抗菌薬の使用を中止する必要があるかもしれません。適切な水分と電解質の管理、タンパク質の補給、抗菌処理
C. difficile、および外科的評価は、臨床的に示されているように開始する必要があります。
亜硫酸塩感受性
バクトリム 400mg にはメタ重亜硫酸ナトリウムが含まれており、亜硫酸塩はアナフィラキシー症状や、特定の感受性のある人々の生命を脅かす、または軽度の喘息発作を含むアレルギー反応を引き起こす可能性があります。一般集団における亜硫酸過敏症の全体的な有病率は不明です。亜硫酸過敏症は、喘息でない人よりも喘息患者に多く見られます。
小児患者におけるベンジルアルコール中毒(「あえぎ症候群」)
BACTRIM 160mgには、防腐剤としてベンジルアルコールが含まれています。 BACTRIM を含む輸液中のベンジルアルコール保存製剤で治療された新生児および低出生体重児では、「あえぎ症候群」を含む重篤かつ致命的な副作用が発生する可能性があります。 「あえぎ症候群」は、中枢神経系の抑制、代謝性アシドーシス、あえぎ呼吸によって特徴付けられます。 BACTRIM 160mg は、生後 2 か月未満の小児患者には禁忌です [ 禁忌 ]。
小児患者 (生後 2 か月以上) に BACTRIM 400mg を処方する場合は、BACTRIM (1 mL あたり 10 mg のベンジル アルコールを含む) およびベンジル アルコールを含む他の薬剤を含むすべての供給源からのベンジル アルコールの合計 1 日あたりの代謝負荷を考慮してください。重篤な有害反応が起こる可能性のあるベンジルアルコールの最小量は知られていない[参照 特定の集団での使用 ]。
ニューモシスチス・ジロベチー肺炎に対するロイコボリンの同時使用に伴うリスク
無作為化プラセボ対照試験でニューモシスチス・イロベチ肺炎の HIV 陽性患者の治療に BACTRIM をロイコボリンと併用した場合、治療の失敗と過剰死亡率が観察されました。
プロピレングリコール毒性
BACTRIM には、溶媒としてプロピレングリコールが含まれています (40% v/v)。 P. jirovecii 肺炎の治療として高用量で投与され、プロピレングリコールを含む他の製品と同時に投与されると、乳酸アシドーシスを含むアニオンギャップ代謝性アシドーシスを伴う高浸透圧が発生する可能性があります。プロピレングリコールの毒性は、急性腎障害、CNS 毒性、および多臓器不全につながる可能性があります。すべての供給源からのプロピレングリコールの 1 日総摂取量と酸塩基障害を監視します。プロピレングリコールの毒性が疑われる場合は、BACTRIM 400mg を中止してください。 有害反応 ]。
葉酸欠乏症
腎機能または肝機能が低下している患者、葉酸欠乏の可能性がある患者(高齢者、慢性アルコール依存症患者、抗けいれん療法を受けている患者、吸収不良症候群の患者、栄養失調状態の患者など)および重度の患者では、バクトリム 160mg の使用を避けるアレルギーや気管支喘息。
葉酸欠乏症を示す血液学的変化は、高齢患者または既存の葉酸欠乏症または腎不全の患者で発生する可能性があります.これらの効果は、フォリン酸療法によって元に戻すことができます[参照 特定の集団での使用 ]。
溶血
グルコース-6-リン酸脱水素酵素欠損症の人では、溶血が起こることがあります。この反応はしばしば用量に関連しています。
注入反応
BACTRIM では、輸液の血管外浸潤による局所刺激および炎症が観察されています。これらが発生した場合、注入を中止し、別の部位で再開する必要があります。
低血糖症
BACTRIM 400mgで治療された非糖尿病患者の低血糖の症例が見られ、通常は治療の数日後に発生します.腎機能障害、肝疾患、栄養失調の患者、または高用量の BACTRIM 800mg を投与されている患者は、特に危険にさらされています。
フェニルアラニン代謝障害
BACTRIM の構成要素であるトリメトプリムは、フェニルアラニンの代謝を損なうことが指摘されていますが、これは、適切な食事制限を行っているフェニルケトン尿症患者では重要ではありません。
ポルフィリン症と甲状腺機能低下症
スルホンアミドを含む他の薬と同様に、BACTRIM はポルフィリン症の発症および甲状腺機能低下症を引き起こす可能性があります。ポルフィリン症または甲状腺機能障害のある患者への BACTRIM の使用は避けてください。
後天性免疫不全症候群(AIDS)患者におけるニューモシスティス・ジロベチー肺炎の治療における潜在的なリスク
AIDS 患者は、非 AIDS 患者と同じように BACTRIM に耐えられない、または反応しない場合があります。 Pneumocystis jirovecii 肺炎の治療を受けている AIDS 患者における BACTRIM 療法による有害反応、特に発疹、発熱、白血球減少症、およびアミノトランスフェラーゼ (トランスアミナーゼ) 値の上昇の発生率は、通常の治療に関連する発生率と比較して大幅に増加すると報告されています。非エイズ患者における BACTRIM 800mg の使用。患者が皮膚発疹または有害反応の徴候を発症した場合、BACTRIM による治療を再評価する [参照 警告と注意事項 ]。
ニューモシスチス・ジロベチー肺炎の治療中は、バクトリム 80mg とロイコボリンの併用を避ける。 警告と注意事項 ]。
電解質異常
P. jirovecii 肺炎の患者に使用されるトリメトプリムの高用量は、かなりの数の患者で血清カリウム濃度の進行性ではあるが可逆的な増加を誘発します。トリメトプリムがカリウム代謝の基礎疾患、腎不全のある患者に投与された場合、または高カリウム血症を誘発することが知られている薬物が同時に投与された場合、推奨用量での治療でも高カリウム血症を引き起こす可能性があります.これらの患者では、血清カリウムの綿密なモニタリングが必要です。
特に P. jirovecii 肺炎の治療のために BACTRIM 800mg を投与されている患者では、重度の症候性低ナトリウム血症が発生する可能性があります。生命を脅かす合併症を防ぐために、症状のある患者では低ナトリウム血症の評価と適切な矯正が必要です。
治療中は、結晶尿を防ぐために十分な水分摂取と尿量を確保してください。 「遅いアセチレーター」である患者は、スルホンアミドに対する特異な反応を起こしやすいかもしれません.
臨床検査のモニタリング
BACTRIM を投与されている患者では、血算を頻繁に行う必要があります。形成された血液成分の数が大幅に減少した場合は、BACTRIM 800mg の使用を中止してください。特に腎機能障害のある患者については、治療中に慎重な顕微鏡検査と腎機能検査を伴う尿検査を実施してください。
薬剤耐性菌の発生
証明された、または強く疑われる細菌感染がない場合、または予防適応がない場合に BACTRIM を処方すると、患者に利益がもたらされる可能性は低く、薬剤耐性菌が発生するリスクが高まります。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん
スルファメトキサゾールは、最大 400 mg/kg/日のスルファメトキサゾールの用量で 26 週間の発癌性マウス (Tg-rasH2) 試験で評価された場合、発がん性がありませんでした。ヒトの全身暴露の 2 倍に相当します (スルファメトキサゾール 800 mg の 1 日用量 (1 日 2 回))。
突然変異誘発
スルファメトキサゾールとトリメトプリムを併用した場合、標準プロトコールに従った in vitro 復帰突然変異細菌試験は実施されていません。スルファメトキサゾール/トリメトプリムによるヒトリンパ球の in vitro 染色体異常試験は陰性でした。動物種の in vitro および in vivo 試験では、スルファメトキサゾール/トリメトプリムは染色体を損傷しませんでした。スルファメトキサゾール/トリメトプリムの経口投与後の in vivo 小核アッセイは陽性でした。スルファメトキサゾールとトリメトプリムで治療された患者から得られた白血球の観察では、染色体異常は明らかになりませんでした。
スルファメトキサゾール単独は、in vitro 復帰突然変異細菌試験および培養ヒトリンパ球を用いた in vitro 小核試験で陽性でした。
トリメトプリム単独では、S9 活性化の有無にかかわらず、チャイニーズハムスターの卵巣または肺細胞を用いた in vitro 復帰突然変異細菌アッセイおよび in vitro 染色体異常アッセイで陰性でした。培養ヒトリンパ球を用いた in vitro コメット、小核および染色体損傷アッセイでは、トリメトプリムが陽性でした。トリメトプリムの経口投与後のマウスでは、肝臓、腎臓、肺、脾臓、または骨髄のコメットアッセイで DNA 損傷は記録されませんでした。
生殖能力の障害
350 mg/kg/日のスルファメトキサゾールと 70 mg/kg/日のトリメトプリムを経口投与したラットでは、生殖能力または一般的な生殖能力に悪影響は観察されませんでした。これは、体表面積ベースで推奨されるヒトの 1 日量の約 2 倍の用量です。 .
特定の集団での使用
妊娠
リスクの概要
BACTRIM を妊婦に投与すると、胎児に害を及ぼす可能性があります。いくつかの疫学的研究は、妊娠中の BACTRIM 400mg への暴露が、先天性奇形、特に神経管欠損症、心血管異常、尿路欠損症、口裂、および内反足のリスク増加と関連している可能性があることを示唆しています ( ヒューマンデータ )。
3 つのラット研究のうちの 1 つは、体表面積ベースでヒトの推奨用量の約 5 倍の用量で口蓋裂を示しました。他の 2 つの研究では、同様の用量で催奇形性は示されませんでした。妊娠中のウサギを対象とした研究では、体表面積ベースでヒトの用量の約 6 倍で胎児死亡率が増加することが示されました。 動物データ )。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2% ~ 4% および 15% ~ 20% です。妊娠中の女性には、バクトリム 400mg が胎児に害を及ぼす可能性があることを伝えてください ( 臨床上の考慮事項 )。
臨床上の考慮事項
病気に関連する母体および/または胚/胎児のリスク
妊娠中の尿路感染症は、早産、低出生体重、子癇前症などの周産期の有害転帰、および妊婦の死亡率の増加と関連しています。妊娠中の P. jirovecii 肺炎は、早産や妊婦の罹患率と死亡率の増加に関連しています。 BACTRIM は、潜在的な利益が胎児への潜在的なリスクを正当化する場合にのみ、妊娠中に使用する必要があります。
データ
ヒューマンデータ
妊娠中の女性とその乳児を対象とした大規模で前向きかつ十分に管理された研究はありませんが、いくつかのレトロスペクティブな疫学研究では、バクトリム 80 mg への妊娠初期の暴露と、先天性奇形、特に神経管欠損症、心血管異常、尿路異常のリスク増加との関連が示唆されています。管欠損症、口唇裂、および内反足。しかし、これらの研究は、暴露された症例の数が少なく、複数の統計的比較と交絡因子の調整が不足しているため、制限がありました。これらの研究は、想起、選択、および情報の偏り、およびそれらの調査結果の一般化の制限によってさらに制限されます。最後に、結果の測定値は研究間で異なり、研究間の比較が制限されていました。あるいは、他の疫学研究では、BACTRIM 160mg への曝露と特定の奇形との間に統計的に有意な関連性は検出されませんでした。 Brumfitt と Pursell は遡及的研究で 10、母親がプラセボまたは経口トリメトプリムとスルファメトキサゾールを投与された 186 の妊娠の結果を報告しました。先天性異常の発生率は、プラセボを投与された患者で 4.5% (66 人中 3 人)、トリメトプリムとスルファメトキサゾールを投与された患者で 3.3% (120 人中 4 人) でした。母親が妊娠初期に薬を投与された 10 人の子供に異常はありませんでした。別の調査で、Brumfitt と Pursell は、母親が受胎時またはその直後に経口トリメトプリムとスルファメトキサゾールを投与された 35 人の子供に先天異常がないことも発見しました。
動物データ
ラットでは、533 mg/kg のスルファメトキサゾールまたは 200 mg/kg のトリメトプリムのいずれかを経口投与すると、主に口蓋裂として現れる催奇形効果が生じました。これらの用量は、体表面積ベースで推奨されるヒトの 1 日総用量の約 5 倍および 6 倍です。ラットでの 2 つの研究では、512 mg/kg のスルファメトキサゾールを 128 mg/kg のトリメトプリムと組み合わせて使用した場合、催奇形性は観察されませんでした。いくつかのウサギの研究では、体表面積に基づくヒトの治療用量の 6 倍のトリメトプリムの用量と、胎児喪失 (死亡および再吸収された受胎産物) の全体的な増加が関連していました。
授乳
リスクの概要
母乳中の BACTRIM のレベルは、生後 2 か月以上の小児患者の推奨 1 日量の約 2 ~ 5% です。母乳で育てられた乳児に対する BACTRIM の影響または乳生産への影響に関する情報はありません。母乳で育てられた子供のビリルビン置換と核黄疸の潜在的なリスクのため[ 禁忌 ]、BACTRIM による治療中は授乳を避けるように女性に助言してください。
小児用
BACTRIM は、ビリルビン置換および核黄疸の潜在的なリスクがあるため、生後 2 か月未満の小児患者には禁忌です。 禁忌 ]。
致命的な反応や「あえぎ症候群」を含む深刻な副作用が、輸液の防腐剤としてベンジルアルコールを投与された新生児集中治療室の未熟児および低出生体重児に発生しました。これらのケースでは、99 ~ 234 mg/kg/日のベンジル アルコール投与量で、血中および尿中に高レベルのベンジル アルコールとその代謝物が生成されました (ベンジル アルコールの血中濃度は 0.61 ~ 1.378 mmol/L でした)。追加の副作用には、段階的な神経学的悪化、発作、頭蓋内出血、血液学的異常、皮膚の損傷、肝不全および腎不全、低血圧、徐脈、および心血管虚脱が含まれていました。早産の低体重児は、ベンジルアルコールを代謝する能力が低いため、これらの反応を発症する可能性が高くなります.
小児患者に BACTRIM 800mg を処方する場合は、BACTRIM (BACTRIM 160mg には 1 mL あたり 10 mg のベンジル アルコールが含まれています) およびその他のベンジル アルコールを含む薬剤を含むすべての供給源からのベンジル アルコールの 1 日あたりの代謝負荷の合計を考慮してください。重篤な有害反応が起こる可能性のあるベンジルアルコールの最小量は知られていない[参照 警告と注意事項 ]。
高齢者の使用
BACTRIM の臨床試験には、65 歳以上の被験者が十分に含まれておらず、若い被験者と反応が異なるかどうかを判断できませんでした。
高齢患者では、特に複雑な状態が存在する場合、例えば、腎機能や肝機能の障害、または他の薬物の併用など、重篤な副作用のリスクが高くなる可能性があります。重度の皮膚反応、全身の骨髄抑制 [参照 警告と注意事項 、 有害反応 ]、血小板の特定の減少(紫斑の有無にかかわらず)、および高カリウム血症は、高齢患者で最も頻繁に報告される重篤な副作用です。
特定の利尿剤、主にサイアザイドを同時に投与されている患者では、紫斑を伴う血小板減少症の発生率の増加が報告されています。 BACTRIM 80mg 療法を併用すると、特に高齢の患者でジゴキシンの血中濃度が上昇する可能性があります。血清ジゴキシンレベルを監視する必要があります[参照 薬物相互作用 ]。
高齢患者では、葉酸欠乏症を示す血液学的変化が起こる可能性があります。これらの効果は、フォリン酸療法によって元に戻すことができます。腎機能障害のある患者には適切な用量調整を行い、望ましくない反応のリスクを最小限に抑えるために、使用期間をできるだけ短くする必要があります。 投薬と管理 ]。
バクトリムのトリメトプリム成分は、カリウム代謝の基礎疾患を有する患者、腎不全を伴う患者に投与された場合、またはアンギオテンシン変換酵素阻害剤などの高カリウム血症を誘発することが知られている薬物と同時に投与された場合、高カリウム血症を引き起こす可能性があります。これらの患者では、血清カリウムの綿密なモニタリングが必要です。血清カリウム値を下げるために、BACTRIM 160mg の投与を中止することをお勧めします。
スルファメトキサゾールの薬物動態パラメーターは、高齢者の被験者と若年成人の被験者で同様でした。平均最大血清トリメトプリム濃度はより高く、トリメトプリムの平均腎クリアランスは、若い被験者と比較して高齢者の方が低かった[参照 臨床薬理学 ]。
参考文献
4. Safrin S、Lee BL、Sande MA。 AIDS患者のニューモシスチス・カリニ肺炎に対するトリメトプリム-スルファメトキサゾールとの補助的なフォリン酸は、治療の失敗と死亡のリスクの増加と関連しています. J Infect Dis。 1994 年 10 月;170(4):912-7。
10. Brumfitt W、Pursell R. 女性の細菌尿症の治療におけるトリメトプリム/スルファメトキサゾール。 J Infect Dis。 1973 年 11 月;128 (補足): S657-S663。
過剰摂取
急性
BACTRIM 160mg の 25 mL を超える単回投与(400 mg トリメトプリムおよび 2000 mg スルファメトキサゾール)をヒトで行った広範な経験がないため、ヒトの最大耐量は不明です。
スルホンアミドで報告されている過剰摂取の徴候と症状には、食欲不振、疝痛、吐き気、嘔吐、めまい、頭痛、眠気、意識消失などがあります。発熱、血尿、結晶尿が認められることがあります。血液障害および黄疸は、過剰摂取の潜在的な晩期症状です。
トリメトプリムの急性過剰摂取の兆候には、吐き気、嘔吐、めまい、頭痛、精神的抑うつ、錯乱、骨髄抑制などがあります。
治療の一般原則には、尿量が少なく、腎機能が正常である場合の静脈内輸液の投与が含まれます。尿が酸性化すると、トリメトプリムの腎排泄が増加します。患者は、血球数と電解質を含む適切な血液化学で監視する必要があります。重大な血液障害または黄疸が発生した場合は、これらの合併症に対して特定の治療を開始する必要があります。腹膜透析は効果がなく、血液透析はトリメトプリムとスルファメトキサゾールの除去に中程度の効果しかありません。
慢性
BACTRIM 800mg を高用量および/または長期間使用すると、血小板減少症、白血球減少症および/または巨赤芽球性貧血として現れる骨髄抑制を引き起こす可能性があります。骨髄抑制の徴候が発生した場合は、正常な造血が回復するまで、患者にロイコボリンを毎日 5 ~ 15 mg 投与する必要があります。
禁忌
BACTRIM は以下の場合禁忌です。
- -トリメトプリムまたはスルホンアミドに対する既知の過敏症[参照 警告と注意事項 ]
- -トリメトプリムおよび/またはスルホンアミドの使用による薬物誘発性免疫性血小板減少症の病歴[参照 警告と注意事項 ]
- 葉酸欠乏による巨赤芽球性貧血が記録されている患者[参照 警告と注意事項 ]
- 生後 2 か月未満の小児患者 [参照 特定の集団での使用 ]
- 著しい肝障害[参照 警告と注意事項 ]
- 腎機能の状態をモニタリングできない重度の腎不全[参照 警告と注意事項 ]
- ドフェチリドとの併用投与2,3 [参照 薬物相互作用 ]
参考文献
2. Al-Khatib SM、LaPointe N、Kramer JM、Califf RM。 QT間隔について臨床医が知っておくべきこと。ジャム。 2003;289(16):2120-2127。
3. ボイヤー EW、コウノトリ C、王 RY。総説:ドフェチリドの薬理学と毒物学。 Int J Med Toxicol. 2001;4(2):16.
臨床薬理学
作用機序
BACTRIM は抗菌薬です。 微生物学 ]。
薬物動態
体重が 105 ポンドから 165 ポンド (平均 143 ポンド) の範囲にある 11 人の患者に 160 mg のトリメトプリムと 800 mg のスルファメトキサゾールを 1 時間静脈内注入した後、トリメトプリムとスルファメトキサゾールのピーク血漿濃度は 3.4 ± 0.3 でした。それぞれ μg/mL および 46.3 ± 2.7 μg/mL。同じ用量を 8 時間間隔で繰り返し静脈内投与した後、定常状態での各注入の直前および直後の平均血漿濃度は、トリメトプリムで 5.6 ± 0.6 μg/mL および 8.8 ± 0.9 μg/mL、70.6 ± 7.3 μg でした。 /mL および 105.6 ± 10.9 μg/mL のスルファメトキサゾール。平均血漿半減期は、トリメトプリムで 11.3 ± 0.7 時間、スルファメトキサゾールで 12.8 ± 1.8 時間でした。これら 11 人の患者全員が正常な腎機能を有し、年齢は 17 歳から 78 歳 (中央値 60 歳) でした。
表 5.12 に示すように、小児および成人における薬物動態研究は、トリメトプリムの年齢依存的な半減期を示唆しています。
重度の腎機能障害のある患者では、両方の成分の半減期が長くなるため、投与計画の調整が必要です [ 投薬と管理 ]。
分布
トリメトプリムとスルファメトキサゾールはどちらも、非結合型、タンパク質結合型、および代謝型として血中に存在します。スルファメトキサゾールは、共役型としても存在します。
トリメトプリムの約 44% とスルファメトキサゾールの約 70% が血漿タンパク質に結合します。血漿中に 10 mg パーセントのスルファメトキサゾールが存在すると、トリメトプリムのタンパク質結合がわずかに減少します。トリメトプリムは、スルファメトキサゾールのタンパク質結合に影響を与えません。
トリメトプリムとスルファメトキサゾールの両方が、喀痰と膣液に分布します。トリメトプリムは気管支分泌物にも分布し、両方とも胎盤関門を通過して母乳に排泄されます。
排除
代謝
スルファメトキサゾールは、ヒトで少なくとも 5 つの代謝物に代謝されます。 N4-ヒドロキシ代謝産物の形成は、CYP2C9 を介して媒介されます。
トリメトプリムは in vitro で 11 の異なる代謝産物に代謝され、そのうち 5 つはグルタチオン付加物であり、6 つは酸化代謝産物であり、主な代謝産物である 1-および 3-オキシドと 3-および 4-ヒドロキシ誘導体が含まれます。
トリメトプリムおよびスルファメトキサゾールの遊離形態は、治療上有効な形態であると考えられています。 in vitro 研究では、トリメトプリムは P 糖タンパク質、OCT1 および OCT2 の基質であり、スルファメトキサゾールは P 糖タンパク質の基質ではないことが示唆されています。
排泄
トリメトプリムとスルファメトキサゾールの排泄は、糸球体濾過と尿細管分泌の両方を通じて、主に腎臓から行われます。トリメトプリムとスルファメトキサゾールの両方の尿中濃度は、血中濃度よりもかなり高くなっています。 1 日目に 240 mg のトリメトプリムと 1200 mg のスルファメトキサゾールを最初に静脈内投与した後、12 時間にわたって尿中に排泄された用量の割合は、遊離トリメトプリムとして 17% から 42.4% の範囲でした。遊離スルファメトキサゾールとして7%~12.7%;合計で 36.7% ~ 56% (遊離体と N4-アセチル化代謝物) のスルファメトキサゾール。 BACTRIM 400mg として一緒に投与すると、トリメトプリムもスルファメトキサゾールも、他方の尿中排泄パターンに影響を与えません。
特定の集団
高齢患者
スルファメトキサゾール 800 mg とトリメトプリム 160 mg の薬物動態が、6 人の高齢者 (平均年齢: 78.6 歳) と 6 人の若い健康な被験者 (平均年齢: 29.3 歳) で、米国で承認されていない製剤を使用して研究されました。高齢患者におけるスルファメトキサゾールの薬物動態値は、若年成人患者で観察されたものと類似していた。トリメトプリムの平均腎クリアランスは、若年成人被験者と比較して、高齢者被験者で有意に低かった (19 mL/h/kg 対 55 mL/h/kg)。しかし、体重で正規化した後、トリメトプリムの見かけの全身クリアランスは、若年成人の被験者と比較して、高齢者の被験者では平均で 19% 低くなりました。
微生物学
作用機序
スルファメトキサゾールは、パラアミノ安息香酸 (PABA) と競合することにより、ジヒドロ葉酸の細菌合成を阻害します。トリメトプリムは、必要な酵素であるジヒドロ葉酸レダクターゼに結合して可逆的に阻害することにより、ジヒドロ葉酸からのテトラヒドロ葉酸の生成をブロックします.したがって、スルファメトキサゾールとトリメトプリムは、多くの細菌に不可欠な核酸とタンパク質の生合成における 2 つの連続するステップをブロックします。
抵抗
in vitro 研究では、スルファメトキサゾールまたはトリメトプリムを単独で使用した場合よりも、スルファメトキサゾールとトリメトプリムを併用した場合の方が細菌耐性の発現が遅いことが示されています。
抗菌活性
BACTRIM は、in vitro および臨床感染の両方で、以下の微生物のほとんどの分離株に対して活性があることが示されています [参照 適応症と使用法 ]。
好気性グラム陰性菌
大腸菌Klebsiella種エンテロバクター種Morganella morganiiProteus mirabilisProteus vulgarisShigella flexneriShigella sonnei
その他の微生物
ニューモシスチス・ジロベチー
以下の in vitro データが利用可能ですが、それらの臨床的意義は不明です。以下の細菌の少なくとも 90% は、同様の属または生物群の分離株に対する BACTRIM 160mg の感受性ブレークポイント以下の in vitro 最小発育阻止濃度 (MIC) を示します。しかし、これらの細菌によって引き起こされる臨床感染症の治療における BACTRIM 400mg の有効性は、十分に管理された臨床試験では確立されていません。
好気性グラム陽性菌
肺炎連鎖球菌
好気性グラム陰性菌
インフルエンザ菌
感受性試験
感受性試験の解釈基準、関連する試験方法、およびこの薬剤について FDA によって認められた品質管理基準に関する具体的な情報については、https://www.fda.gov/STIC を参照してください。
参考文献
11.グロースWE、ボディGP、ルーTL。静脈内投与されたトリメトプリム-スルファメトキサゾールの臨床薬理学。抗菌剤ケモザー。 1979 年 3 月;15:447-451。
12. Siber GR、Gorham C、Durbin W、Lesko L、Levin MJ。小児および成人における静脈内トリメトプリム-スルファメトキサゾールの薬理学。現在の化学療法と感染症。米国微生物学会、ワシントン DC 1980。巻。 1、pp。691-692。
患者情報
胚胎児毒性
生殖能力のある女性患者には、BACTRIM が胎児に害を及ぼす可能性があること、および妊娠が判明している、または妊娠の疑いがあることを医療提供者に知らせるように助言する [参照 特定の集団での使用 ]。
授乳
授乳中の女性には、BACTRIM による治療中は授乳を避けるようアドバイスしてください。
抗菌耐性
BACTRIM を含む抗菌薬は細菌感染症の治療にのみ使用するよう患者に助言してください。ウイルス感染症(風邪など)は治療しません。
結晶尿や結石の形成を防ぐために、十分な水分摂取を維持するように患者に指示してください。
下痢
下痢は抗生物質によって引き起こされる一般的な問題であり、通常は抗生物質の使用を中止すると終了することを患者にアドバイスします。抗生物質による治療を開始した後、患者は、抗生物質の最後の用量を服用してから2か月以上経っても、水様便や血便(胃痙攣や発熱の有無にかかわらず)を発症することがあります.これが発生した場合、患者はできるだけ早く医師に連絡する必要があります。
