Zanaflex 2mg, 4mg Tizanidine 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Zanaflex 2mg とは何ですか? また、どのように使用されますか?
Zanaflex 2mg は、脳性麻痺やその他の神経障害などの状態に関連する筋肉のこわばり (痙性) の症状を治療するために使用される処方薬です。 Zanaflex 2mg は、単独で使用することも、他の薬と併用することもできます。
Zanaflex 2mg は、セントラル アルファ 2 アドレナリン アゴニストと呼ばれるクラスの薬に属しています。
ザナフレックスが子供に安全で効果的かどうかはわかっていません。
Zanaflex の考えられる副作用は何ですか?
Zanaflex 2mg は、次のような重大な副作用を引き起こす可能性があります。
- 低血圧、
- 異常な肝機能検査、
- 眠気、
- 幻覚、
- 過度の眠気、
- 心拍数が遅く、
- 口渇、
- 疲労感と
- 弱点
上記の症状がある場合は、すぐに医療機関を受診してください。
ザナフレックスの最も一般的な副作用は次のとおりです。
- 口渇、
- 疲れ、
- 弱点、
- 倦怠感、
- 疲れ、
- めまい、
- 尿路感染、
- 便秘、
- 異常な肝機能検査、
- 嘔吐、
- 言語障害、
- 怠惰な目(弱視)、
- 頻尿、
- インフルエンザの症状、
- 制御されていない筋肉の動き、
- 緊張感、
- 喉の痛み、そして
- 鼻水が出る
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Zanaflex の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
Zanaflex® (塩酸チザニジン) は、中枢性 α2 アドレナリン作動薬です。チザニジン HCl は白色からオフホワイトの微結晶性粉末で、無臭またはかすかな特有の臭気があります。チザニジンは水とメタノールにわずかに溶けます。 pHが上がると水への溶解度が低下します。その化学名は、5-クロロ-4-(2-イミダゾリン-2-イルアミノ)-2,1,3-ベンゾチアジアゾール一塩酸塩です。チザニジンの分子式は C9H8ClN5S-HCl、分子量は 290.2、構造式は次のとおりです。
Zanaflex 4mg Capsules® は、経口投与用の 2、4、および 6 mg カプセルとして提供されます。 Zanaflex Capsules® には、有効成分であるチザニジン塩酸塩 (2.29 mg はチザニジン塩基 2 mg に相当、4.58 mg はチザニジン塩基 4 mg に相当、6.87 mg はチザニジン塩基 6 mg に相当)、および不活性成分であるヒプロメロース、二酸化ケイ素、砂糖球、二酸化チタン、ゼラチン、着色料。
Zanaflex® 錠剤は、経口投与用の 4 mg 錠剤として提供されます。 Zanaflex® 錠剤には、有効成分である塩酸チザニジン (チザニジン塩基 4 mg に相当する 4.58 mg) と、不活性成分であるコロイド状二酸化ケイ素、ステアリン酸、微結晶性セルロース、および無水ラクトースが含まれています。
適応症
Zanaflex は、痙縮の管理に適応されます。治療効果が持続する期間が短いため、Zanaflex による治療は、日常の活動や痙縮の緩和が最も重要な時間に限定する必要があります。 投薬と管理 ]。
投薬と管理
投与情報
Zanaflex 2mg Capsules® または Zanaflex® 錠剤は、食事の有無にかかわらず処方される場合があります。製剤が選択され、食事の有無にかかわらず摂取する決定がなされたら、このレジメンを変更するべきではありません.
食物はチザニジンの薬物動態に複雑な影響を及ぼし、その影響は製剤によって異なります。ザナフレックス カプセルとザナフレックス タブレットは、絶食状態 (食後 3 時間以上) では互いに生物学的に同等ですが、摂食状態 (食後 30 分以内) では異なります。これらの薬物動態の違いは、錠剤とカプセルの投与を切り替える場合、および摂食状態と絶食状態の間で投与を切り替える場合に、臨床的に有意な違いをもたらす可能性があります。これらの変化は、切り替えの性質に応じて、有害事象の増加、または活性の開始の遅延または急速化をもたらす可能性があります。このため、処方者は、これらのさまざまな状態に関連する動態の変化を十分に理解している必要があります[参照 臨床薬理学 ]。
推奨される開始用量は 2 mg です。ザナフレックスの効果は、投与後約 1 ~ 2 時間でピークに達し、投与後 3 ~ 6 時間で消失するため、必要に応じて 6 ~ 8 時間間隔で、24 時間で最大 3 回の投与まで治療を繰り返すことができます。
投与量は、筋緊張の十分な低下が達成されるまで、投与量の増加の間隔を 1 ~ 4 日として、各投与量で 2 mg から 4 mg ずつ徐々に増加させることができます。 1日の総投与量は36mgを超えてはなりません。 16 mg を超える単回投与は研究されていません。
腎障害のある患者への投与
クリアランスが 50% 以上低下するため、ザナフレックスは腎不全 (クレアチニンクリアランス 警告と注意事項 ]。
肝障害のある患者への投与
Zanaflex 4mg は、肝障害のある患者には注意して使用する必要があります。これらの患者では、滴定中に個々の用量を減らす必要があります。より高い用量が必要な場合は、投与頻度ではなく、個々の用量を増やす必要があります。アミノトランスフェラーゼ レベルのモニタリングは、ベースライン時および最大用量に達してから 1 か月後、または肝障害が疑われる場合に推奨されます [参照 特定の集団での使用 ]。
投薬中止
治療を中止する必要がある場合、特に高用量 (1 日 20 mg から 36 mg) を長期間 (9 週間以上) 服用している患者、または麻薬との併用治療を受けている可能性のある患者では、用量をゆっくりと減らす必要があります (離脱およびリバウンド高血圧、頻脈、および筋緊張亢進のリスクを最小限に抑えるため、1 日あたり 2 ~ 4 mg 薬物乱用と依存 ]。
供給方法
剤形と強度
カプセル
2mg:水色不透明体で、キャップに「2MG」と印刷された水色不透明体 4mg:白色不透明体で、キャップに「4MG」と印刷された青色不透明体 6mg:青色不透明体で、キャップに「2MG」と印刷キャップに「6 MG」が印刷された白いストライプと青い不透明キャップ
錠剤
mg の白色のコーティングされていない錠剤で、片面に 4 分割のスコアがあり、もう片面に「A594」と刻印されています
保管と取り扱い
ザナフレックスカプセル®
Zanaflex Capsules®(塩酸チザニジン)カプセル 塩酸チザニジン 2.29 mg、4.58 mg、および 6.87 mg (チザニジン塩基 2 mg、4 mg、および 6 mg に相当) を含むツーピース ハード ゼラチン カプセルとして、3 つの強度で入手できます。
2 mg カプセルは、水色の不透明な本体と、キャップに「2 MG」と印刷された水色の不透明なキャップを備えています: 150 カプセルのボトル ( NDC 70515-602-15)
4 mg カプセルは白色の不透明な本体に青色の不透明なキャップがあり、キャップには「4 MG」と印刷されています: 150 カプセルのボトル ( NDC 70515-604-15)
mg カプセルは、白色のストライプが入った青色の不透明な本体と、カプセルに「6 MG」と印刷された青色の不透明なキャップを備えています。150 カプセルのボトル ( NDC 70515-606-15)
25°C (77°F) で保管してください。 15°C から 30°C (59°F から 86°F) まで許容されるエクスカーション [参照 USP制御の室温 ]。チャイルドレジスタントクロージャー付きの容器に分配してください。
ザナフレックス®錠
Zanaflex® (チザニジン塩酸塩) 錠剤は、チザニジン塩基 4 mg に相当するチザニジン塩酸塩 4.58 mg を含む 4 mg 白色のコーティングされていない錠剤として入手できます。タブレットの片面には 4 分割のスコアがあり、もう片面には「A594」の刻印があります。錠剤は次のように提供されます: 150 錠のボトル (NDC 70515-594-15)。
25°C (77°F) で保管してください。 15°C から 30°C (59°F から 86°F) まで許容されるエクスカーション [参照 USP制御の室温 ]。
チャイルドレジスタントクロージャー付きの容器に分配してください。
製造元: Covis Pharma Zug, 6300 Switzerland.改訂: 2020 年 12 月
副作用
以下の副作用は、処方情報の他のセクションに記載されています。
- 低血圧 [参照 警告と注意事項 ]
- 肝障害 [参照 警告と注意事項 ]
- 鎮静[参照 警告と注意事項 ]
- 幻覚/精神病様症状 [参照 警告と注意事項 ]
- 過敏反応 [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用の発生率を別の医薬品の臨床試験で観察された発生率と直接比較することはできず、臨床現場で観察された発生率を反映していない可能性があります。
痙性コントロールに対するチザニジンの効果を評価するために、3 つの二重盲検無作為化プラセボ対照臨床研究が実施されました。 2 つの研究は多発性硬化症の患者で実施され、1 つの研究は脊髄損傷の患者で実施されました。各研究には、13 週間の積極的治療期間があり、これには、3 回の分割用量で 36 mg/日までの最大耐用量までの 3 週間の漸増期、チザニジンの用量が一定に保たれる 9 週間のプラトー期、および1週間の減量。全体で、264 人の患者がチザニジンを投与され、261 人の患者がプラセボを投与されました。 3 つの研究全体で、患者の年齢は 15 ~ 69 歳で、51.4% が女性でした。プラトー期の用量の中央値は、20~28 mg/日の範囲でした。
264 名の痙性患者を対象とした複数回投与のプラセボ対照臨床試験で報告された最も頻繁な副作用は、口渇、傾眠/鎮静、無力症 (脱力感、疲労および/または疲労感) およびめまいでした。患者の 4 分の 3 がイベントを軽度から中等度と評価し、患者の 4 分の 1 がイベントを重度と評価しました。これらの事象は、用量に関連しているように見えました。
表1は、Zanaflex群の頻度がプラセボ群よりも高かった、3回の複数回投与のプラセボ対照試験でZanaflexを受けた患者の2%以上で報告された兆候と症状を示しています.比較の目的で、プラセボ治療を受けた患者の対応するイベントの頻度 (患者 100 人あたり) も提供されます。
単回投与では、多発性硬化症による痙縮患者 142 例を対象としたプラセボ対照試験 (試験 1) [参照 臨床研究 ]、患者は、口渇、傾眠(眠気)、無力症(衰弱、疲労および/または疲労)およびめまいの4つの最も一般的な副作用のいずれかを経験したかどうかを具体的に尋ねられました.さらに、低血圧および徐脈が観察された。これらの反応の発生を表 2 にまとめます。その他のイベントは、一般に 2% 以下の割合で報告されました。
市販後の経験
Zanaflex の承認後の使用中に、次の有害反応が確認されています。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
眠気、口渇、低血圧、血圧低下、徐脈、めまい、脱力感または無力症、筋けいれん、幻覚、疲労、肝機能検査異常および肝毒性などの特定の事象は、市販後および臨床試験で観察されており、議論されていますこのドキュメントの前のセクションで。
以下の有害反応は、Zanaflex の市販後の経験で発生していると確認されています。これらの反応に関して提供された情報に基づいて、ザナフレックスとの因果関係を完全に排除することはできません。イベントは、臨床的重要性の低い順にリストされています。市販後の設定での重症度は報告されていません。
- スティーブンス・ジョンソン症候群
- アナフィラキシー反応
- 剥脱性皮膚炎
- 心室頻拍
- 肝炎
- けいれん
- うつ
- 関節痛
- 感覚異常
- 発疹
- 身震い
薬物相互作用
フルボキサミン
フルボキサミンとザナフレックス4mgの併用は禁忌です。フルボキサミンと一緒に投与した場合のチザニジンの薬物動態の変化は、血圧の有意な低下、眠気の増加、および精神運動障害の増加をもたらしました[参照 禁忌 と 臨床薬理学 ]。
シプロフロキサシン
シプロフロキサシンとザナフレックスの併用は禁忌です。シプロフロキサシンと一緒に投与した場合のチザニジンの薬物動態の変化は、血圧の有意な低下、眠気の増加、および精神運動障害の増加をもたらした[参照 禁忌 と 臨床薬理学 ]。
フルボキサミンおよびシプロフロキサシン以外の CYP1A2 阻害剤
薬物相互作用の可能性があるため、ジロートン、強力な CYP1A2 阻害剤以外のフルオロキノロン(禁忌)、抗不整脈薬(アミオダロン、メキシレチン、プロパフェノン、ベラパミル)、シメチジン、ファモチジン、経口避妊薬などの他の CYP1A2 阻害剤と Zanaflex の併用。アシクロビル、およびチクロピジン) は避けるべきです。それらの使用が臨床的に必要な場合、治療は 2 mg の用量で開始し、治療に対する患者の反応に基づいて毎日 2 ~ 4 mg ずつ増量する必要があります。低血圧、徐脈、または過度の眠気などの有害反応が発生した場合は、Zanaflex 療法を減らすか中止してください [ 警告と注意事項 と 臨床薬理学 ]。
経口避妊薬
Zanaflex 2mg と経口避妊薬の併用は推奨されません。ただし、併用が臨床的に必要な場合は、Zanaflex 4mg を 2 mg の単回投与で開始し、治療に対する患者の反応に基づいて、毎日 2 ~ 4 mg ずつ増やしてください。低血圧、徐脈、または過度の眠気などの有害反応が発生した場合は、Zanaflex 療法を減らすか中止してください [ 臨床薬理学 ]。
アルコール
アルコールは、ザナフレックスの投与後に血流中の薬物の総量を増加させます.これは、ザナフレックスの副作用の増加と関連していました。 Zanaflex とアルコールの CNS 抑制効果は相加的です [参照 臨床薬理学 ]。
その他の中枢神経抑制剤
中枢神経系抑制薬(ベンゾジアゼピン、オピオイド、三環系抗うつ薬など)による Zanaflex の鎮静効果は相加的である可能性があります。 Zanaflex 2mg を別の中枢神経系抑制薬と一緒に服用している患者を監視して、過剰な鎮静の症状がないか [参照 臨床薬理学 ]。
α2アドレナリン作動薬
降圧効果は累積する可能性があるため、Zanaflex 4mg を他の α2 アドレナリン アゴニストと併用することは推奨されません。 警告と注意事項 ]。
薬物乱用と依存
乱用
乱用の可能性は、人間の研究では評価されていません。ラットは、トレーニング後、標準的な識別パラダイムで生理食塩水からチザニジンを区別することができましたが、モルヒネ、コカイン、ジアゼパム、またはフェノバルビタールの効果をチザニジンに一般化することはできませんでした.
依存
チザニジンはクロニジンと密接に関連しており、麻薬と組み合わせて乱用されることが多く、突然の離脱時にリバウンドの症状を引き起こすことが知られています.チザニジンの突然の離脱によるリバウンド症状の 3 例が報告されています。症例報告は、これらの患者も麻薬を乱用していたことを示唆しています。禁断症状には、高血圧、頻脈、筋緊張亢進、振戦、および不安が含まれていました。離脱症状は、高用量を使用した場合、特に長期間使用した場合、または麻薬を併用した場合に発生する可能性が高くなります.治療を中止する必要がある場合は、離脱症状のリスクを最小限に抑えるために、用量をゆっくりと減らす必要があります。 投薬と管理 ]。
サルは用量依存的にチザニジンを自己投与することが示されており、チザニジンの突然の中止は、mg/m²ベースでヒトの最大推奨用量の35倍を超える用量で一時的な離脱症状を引き起こしました.これらの一過性の禁断症状(移動の増加、体のひきつり、および観察者に対する嫌悪行動)は、ナロキソン投与によって逆転することはありませんでした。
警告
の一部として含まれています 予防 セクション。
予防
低血圧
チザニジンは、低血圧を引き起こす可能性のあるα2-アドレナリン作動薬です。市販後の設定で失神が報告されています。重大な低血圧の可能性は、投与量を漸増し、投与量を増やす前に低血圧の徴候と症状に注意を向けることによって最小限に抑えることができる.さらに、仰臥位から固定された直立位に移動する患者は、低血圧および起立性効果のリスクが高くなる可能性があります。
同時に降圧療法を受けている患者に Zanaflex を使用する場合は、低血圧を監視してください。 Zanaflex 2mg を他の α2 アドレナリン作動薬と一緒に使用することはお勧めしません。フルボキサミンまたはシプロフロキサシンのいずれかの同時投与および 4 mg の Zanaflex の単回投与により、臨床的に重大な低血圧 (収縮期および拡張期血圧の両方の低下) が報告されています。したがって、CYP1A2 の強力な阻害剤であるフルボキサミンまたはシプロフロキサシンとの Zanaflex の併用は禁忌です。 禁忌 と 薬物相互作用 ]。
肝障害のリスク
Zanaflex は、肝細胞性肝障害を引き起こす可能性があります。 Zanaflex 4mg は、肝障害のある患者には注意して使用する必要があります。アミノトランスフェラーゼ レベルのモニタリングは、ベースライン時および最大用量に達してから 1 か月後、または肝障害が疑われる場合に推奨されます [参照 投薬と管理 と 特定の集団での使用 ]。
鎮静
Zanaflex は鎮静作用を引き起こす可能性があり、日常生活に支障をきたす可能性があります。反復投与研究では、鎮静患者の有病率は滴定の最初の 1 週間後にピークに達し、その後は研究の維持期の間安定したままでした。 Zanaflex とアルコールおよび他の CNS 抑制剤 (例えば、ベンゾジアゼピン、オピオイド、三環系抗うつ剤) による CNS 抑制効果は相加的である可能性があります。 Zanaflex 4mg を別の中枢神経系抑制薬と一緒に服用している患者を監視して、過剰な鎮静の症状がないか [参照] 薬物相互作用 ]。

幻覚/精神病様症状
Zanaflex 4mg の使用は、幻覚と関連付けられています。形成された視覚的な幻覚または妄想は、2 つの北米の対照臨床研究で 170 人の患者のうち 5 人 (3%) で報告されています。ほとんどの患者は、その出来事が非現実的であることを認識していました。 1 人の患者は、幻覚に関連して精神病を発症しました。これらの 5 人のうちの 1 人の患者は、チザニジンの中止後、少なくとも 2 週間は問題を抱え続けました。幻覚を発症する患者では、ザナフレックスの中止を検討してください。
CYP1A2阻害剤との相互作用
薬物相互作用の可能性があるため、Zanaflex 4mg は、フルボキサミンやシプロフロキサシンなどの強力な CYP1A2 阻害剤を服用している患者には禁忌です。ザナフレックスをジロートン、シプロフロキサシン以外のフルオロキノロン(禁忌)、抗不整脈薬(アミオダロン、メキシレチン、プロパフェノン)、シメチジン、ファモチジン、経口避妊薬、アシクロビル、およびチクロピジン)。 Zanaflex 2mg 療法の必要性が臨床的に明らかでない限り、併用は避けるべきです。そのような場合は、慎重に使用してください[参照] 薬物相互作用 と 臨床薬理学 ]。
過敏反応
ザナフレックスはアナフィラキシーを引き起こす可能性があります。呼吸障害、蕁麻疹、喉や舌の血管性浮腫などの徴候や症状が報告されています。患者は、重度のアレルギー反応の徴候と症状について知らされ、Zanaflex を中止し、これらの徴候と症状が発生した場合は直ちに医療機関を受診するように指示されなければなりません [参照 禁忌 ]。
腎障害患者における有害反応のリスクの増加
クリアランスが 50% 以上低下するため、ザナフレックスは腎不全 (クレアチニンクリアランス 投薬と管理 と 特定の集団での使用 ]。
離脱の副作用
離脱副作用には、リバウンド性高血圧、頻脈、および筋緊張亢進が含まれます。これらの反応のリスクを最小限に抑えるには、特に高用量 (1 日 20 ~ 28 mg) を長期間 (9 週間以上) 服用している患者、または麻薬との併用治療を受けている可能性のある患者では、用量を減らす必要があります。ゆっくり(1日2~4mg) 投薬と管理 ]。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
発がん
チザニジンは、最大 16 mg/kg/日までの経口用量でマウスに 78 週間投与されました。これは、体表面積 (mg/m²) ベースで 36 mg/日の最大推奨ヒト用量 (MRHD) の 2 倍です。チザニジンはラットに 9 mg/kg/日までの経口用量で 104 週間投与されました。これは mg/m² ベースで MRHD の 2.5 倍です。どちらの種でも腫瘍の増加はありませんでした。
突然変異誘発
チザニジンは、in vitro(細菌復帰突然変異[Ames]、哺乳類遺伝子突然変異、および哺乳類細胞における染色体異常試験)およびin vivo(骨髄小核および細胞遺伝学)アッセイで陰性でした。
生殖能力の障害
チザニジンのラットへの交配前および交配中、ならびに妊娠初期のメスへの継続経口投与は、それぞれ 30 および 10 mg/kg/日の用量でオスおよびメスのラットの受胎能の低下をもたらしました。 10 (雄) および 3 (雌) mg/kg/日の用量では受胎能への影響は観察されず、これは mg/m² ベースでそれぞれ MRHD の約 3 倍であり、類似しています。
特定の集団での使用
妊娠
リスクの概要
妊娠中の女性におけるZanaflex 2mgの使用に関連する発達リスクに関する十分なデータはありません.動物研究では、妊娠中のチザニジンの投与は、母体毒性と関連していない臨床的に使用される用量よりも少ない用量で発生毒性(胚胎児および出生後の子孫の死亡率および成長障害)をもたらしました( 動物データ )。
米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2% ~ 4% および 15% ~ 20% です。示された集団の重大な先天性欠損症および流産の背景リスクは不明です。
データ
動物データ
妊娠中のラットに器官形成期にチザニジン (0.3 ~ 100 mg/kg/日) を経口投与すると、30 mg/kg/日以上の用量で胚胎児および出生後の子孫が死亡し、体重が減少した。試験した最高用量で母体毒性が観察された。ラットにおける胚胎児発生毒性の無影響用量 (3 mg/kg/日) は、体表面積 (mg/m²) ベースで 36 mg/日の最大推奨ヒト用量 (MRHD) に似ています。
器官形成期の妊娠ウサギへのチザニジン(1~100mg/kg/日)の経口投与は、すべての用量で胚胎児および出生後の子孫の死亡率をもたらした。試験した最高用量で母体毒性が観察された。妊娠の周産期 (出産の 2 ~ 6 日前) にチザニジン (10 および 30 mg/kg/日) を経口投与すると、両方の用量で出生後の子孫の死亡率が増加しました。ウサギにおける胚胎児発生毒性の無影響用量は特定されなかった。テストされた最低用量 (1 mg/kg/日) は、mg/m² ベースで MRHD よりも少ないです。
ラットの出生前および出生後の発生研究では、チザニジンの経口投与 (3 ~ 30 mg/kg/日) により、出生後の子孫の死亡率が増加しました。出生前および出生後の発生毒性に対する無影響用量は特定されなかった。テストされた最低用量 (3 mg/kg/日) は、それぞれ mg/m² ベースで MRHD に似ています。
授乳
リスクの概要
母乳中のチザニジンの存在、母乳育児への影響、または母乳生産への影響に関するデータはありません。動物実験では、授乳中の動物の乳中にチザニジンが存在することが報告されています。
母乳育児の発達上および健康上の利点は、ザナフレックス 4mg に対する母親の臨床的必要性、およびザナフレックスまたは基礎となる母体の状態から母乳で育てられた乳児への潜在的な悪影響とともに考慮されるべきです。
生殖能力のある雌と雄
女性または男性の生殖能力に対するZanaflex 4mgの効果に関する、適切で十分に管理されたヒトの研究はありません.オスとメスのラットへのチザニジンの経口投与は、生殖能力に悪影響を及ぼした[参照 非臨床毒性学 ]。
小児用
小児患者における安全性と有効性は確立されていません。
高齢者の使用
ザナフレックス 2mg は腎臓から実質的に排泄されることが知られており、腎機能障害のある患者では、この薬剤に対する副作用のリスクが高くなる可能性があります。高齢患者は腎機能が低下している可能性が高いため、投与量の選択には注意が必要であり、腎機能のモニタリングが役立つ場合があります。
Zanaflex 2mg の臨床研究には、65 歳以上の被験者が若い被験者と異なる反応を示すかどうかを判断するのに十分な数の被験者が含まれていませんでした。 6 mg Zanaflex 2 mg の単回投与後の薬物動態データの相互研究比較では、若い被験者は高齢の被験者よりも 4 倍速く薬物をクリアしたことが示されました。腎機能不全の高齢患者 (クレアチニンクリアランス
腎機能障害
ザナフレックスは腎臓から実質的に排泄されることが知られており、腎機能障害のある患者では、この薬剤に対する副作用のリスクが高くなる可能性があります。腎不全の患者 (クレアチニンクリアランス 投薬と管理 、 警告と注意事項 と 臨床薬理学 ]。
肝機能障害
チザニジンの薬物動態に対する肝障害の影響は評価されていません。チザニジンは肝臓で広範に代謝されるため、肝障害はチザニジンの薬物動態に重大な影響を与えると予想されます[ 投薬および投与 、 警告と注意事項 、 と 臨床薬理学 ]。
過剰摂取
安全監視データベースのレビューにより、意図的および偶発的なザナフレックスの過剰摂取の事例が明らかになりました.一部の症例は死亡に至り、意図的な過剰摂取の多くは、CNS 抑制剤を含む複数の薬物によるものでした。チザニジンの過剰摂取の臨床症状は、既知の薬理学と一致していました。ほとんどの場合、無気力、傾眠、錯乱、昏睡などの感覚神経の低下が観察されました。ほとんどの場合、徐脈および低血圧を含む心機能の低下も観察される。呼吸抑制は、チザニジンの過剰摂取のもう 1 つの一般的な特徴です。
過剰摂取が発生した場合は、気道の適切性を確保するための基本的な手順と、心血管系および呼吸器系のモニタリングを実施する必要があります。チザニジンは脂溶性薬物で、水とメタノールにわずかにしか溶けません。したがって、透析は体内から薬物を効率的に除去する方法ではない可能性があります。一般に、症状はチザニジンの中止と適切な治療の投与後 1 ~ 3 日以内に解決します。作用機序が似ているため、チザニジンの過剰摂取の症状と管理は、クロニジンの過剰摂取に続くものと似ています。過剰摂取の管理に関する最新情報については、毒物管理センターにお問い合わせください。
禁忌
Zanaflex は、フルボキサミンやシプロフロキサシンなどの CYP1A2 の強力な阻害剤を服用している患者には禁忌です。 薬物相互作用 ]。
臨床薬理学
作用機序
チザニジンは、中枢性α-2-アドレナリン受容体アゴニストであり、おそらく運動ニューロンのシナプス前抑制を増加させることによって痙縮を軽減します。チザニジンの効果は、多シナプス経路で最大です。これらの作用の全体的な効果は、脊髄運動ニューロンの促進を減少させると考えられています。
薬物動態
吸収と分配
経口投与後、チザニジンは本質的に完全に吸収されます。チザニジンの絶対的な経口バイオアベイラビリティは、広範な初回通過肝代謝により、約 40% (CV = 24%) です。チザニジンは、健康な成人志願者に静脈内投与した後、2.4 L/kg (CV = 21%) の平均定常状態分布体積で全身に広く分布しています。チザニジンは、約 30% が血漿タンパク質に結合しています。
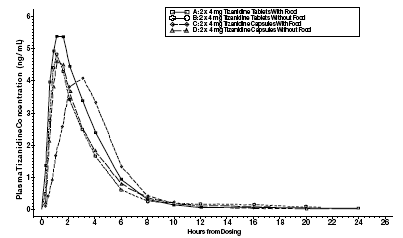
Zanaflex 4mg カプセル® と Zanaflex® 錠剤の違い
Zanaflex 2mg Capsules® と Zanaflex® 錠剤は、絶食条件下では互いに生物学的に同等ですが、摂食条件下ではそうではありません。 2 つの 4 mg 錠剤または 2 つの 4 mg カプセルのいずれかの単回投与が、非盲検、4 期間、無作為化クロスオーバー研究で、摂食および絶食条件下で 96 人のボランティアで投与され、そのうち 81 人が統計分析に適格でした。錠剤またはカプセルのいずれかを経口投与した後 (絶食状態)、チザニジンのピーク血漿濃度は投与後 1.0 時間で発生し、半減期は約 2 時間でした。 2 つの 4 mg 錠剤を食事とともに投与した場合、平均最大血漿濃度は約 30% 増加し、ピーク血漿濃度までの時間の中央値は 25 分増加して 1 時間 25 分になりました。対照的に、2 つの 4 mg カプセルを食事とともに投与した場合、平均最大血漿濃度は 20% 減少し、ピーク血漿濃度までの時間の中央値は 2 ~ 3 時間増加しました。その結果、食物とともに投与されたときのカプセルの平均 Cmax は、食物とともに投与されたときの錠剤の Cmax の約 66% です。食事も、錠剤とカプセルの両方の吸収の程度を増加させました。錠剤による増加 (~30%) は、カプセルによる増加 (~10%) よりも有意に大きかった。その結果、それぞれを食事とともに投与した場合、カプセルからの吸収量は錠剤からの吸収量の約 80% でした。アップルソースにまぶしたカプセル内容物の投与は、絶食条件下での無傷のカプセルの投与と生物学的に同等ではありませんでした。アップルソースにカプセルの内容物を投与すると、チザニジンの Cmax と AUC が 15% ~ 20% 増加し、空腹時の無傷のカプセルの投与と比較して、ラグタイムの中央値とピーク濃度までの時間が 15 分間減少しました。
図 1: Zanaflex 錠剤およびカプセル剤 (2 × 4 mg) の断食および摂食条件下での時間プロファイル対チザニジン濃度の平均
代謝と排泄
チザニジンは、臨床開発で研究された用量 (1 ~ 20 mg) にわたって線形の薬物動態を示します。チザニジンの半減期は約 2.5 時間です (CV=33%)。投与量の約 95% が代謝されます。チザニジン代謝に関与する主要なシトクロム P450 アイソザイムは CYP1A2 です。チザニジン代謝物が活性であることは知られていません。それらの半減期は 20 から 40 時間の範囲です。
14C-チザニジンの単回および複数回の経口投与後、総放射能の平均 60% および 20% がそれぞれ尿および糞から回収された。
特定の集団
年齢の影響
年齢の影響を調査するための特定の薬物動態研究は実施されていません。 6 mg Zanaflex 2 mg の単回投与後の薬物動態データのクロススタディ比較では、若い被験者は高齢の被験者よりも 4 倍速く薬物をクリアすることが示されました。 Zanaflex 4mg は小児では評価されていません [参照 特定の集団での使用 ]。
肝障害
チザニジンの薬物動態に対する肝障害の影響は評価されていません。チザニジンは肝臓で広範囲に代謝されるため、肝臓障害はチザニジンの薬物動態に重大な影響を与えると予想されます。 Zanaflex は、この患者集団には推奨されません [参照 特定の集団での使用 ]。
腎障害
チザニジンクリアランスは、健康な高齢者と比較して、腎不全の高齢患者 (クレアチニンクリアランス 警告と注意事項 と 特定の集団での使用 ]。
ジェンダーの影響
性別への影響を調査するための特定の薬物動態研究は実施されていません。しかし、4 mg Zanaflex 2 mg の単回および複数回投与後の薬物動態データのレトロスペクティブ分析では、性別はチザニジンの薬物動態に影響を与えないことが示されました。
種族効果
人種による薬物動態の違いは研究されていません。
薬物相互作用
CYP1A2阻害剤
Zanaflex とフルボキサミンまたはシプロフロキサシンのいずれかとの相互作用は、フルボキサミンまたはシプロフロキサシンによる CYP1A2 の阻害による可能性が最も高いです。 Zanaflex 4 mg 単回投与の薬物動態に対するフルボキサミンの効果は、10 人の健康な被験者で研究されました。チザニジンの Cmax、AUC、および半減期は、それぞれ 12 倍、33 倍、および 3 倍増加しました。 Zanaflex 4mgの単回4mg用量の薬物動態に対するシプロフロキサシンの効果は、10人の健康な被験者で研究されました.チザニジンの Cmax と AUC は、それぞれ 7 倍と 10 倍に増加しました [ 禁忌 ]。
チザニジンに対する他の CYP1A2 阻害剤の効果を評価した臨床研究はありませんが、ジロートン、他のフルオロキノロン、抗不整脈薬 (アミオダロン、メキシレチン、プロパフェノン、ベラパミル)、シメチジン、ファモチジン、経口避妊薬、アシクロビル、チクロピジンなどの他の CYP1A2 阻害剤、また、チザニジンの血中濃度が大幅に上昇する可能性があります [参照 警告と注意事項 ]。
ヒト肝ミクロソームを用いたシトクロム P450 アイソザイムの in vitro 研究では、チザニジンも主要代謝物も、シトクロム P450 アイソザイムによって代謝される他の薬物の代謝に影響を与える可能性は低いことが示されています。
経口避妊薬
経口避妊薬とザナフレックスの相互作用を調査するための特定の薬物動態研究は実施されていません。しかし、ザナフレックス 4 mg の単回および複数回投与後の集団薬物動態データのレトロスペクティブ分析では、経口避妊薬を同時に服用している女性は、経口避妊薬を服用していない女性と比較して、チザニジンのクリアランスが 50% 低いことが示されました。 警告と注意事項 ]。
アセトアミノフェン
チザニジンは、アセトアミノフェンの Tmax を 16 分遅らせました。アセトアミノフェンは、チザニジンの薬物動態に影響を与えませんでした。
アルコール
アルコールは、チザニジンの AUC を約 20% 増加させ、Cmax を約 15% 増加させました。これは、チザニジンの副作用の増加と関連していました。チザニジンとアルコールの CNS 抑制効果は相加的です。
臨床研究
痙性に関連する筋緊張の増加を抑えるチザニジンの能力は、多発性硬化症または脊髄損傷患者を対象とした 2 つの適切で十分に管理された研究で実証されました (研究 1 および 2)。
痙性を伴う多発性硬化症患者における単回投与試験
研究 1 では、多発性硬化症の患者を無作為に割り付けて、薬物またはプラセボを単回経口投与しました。患者と評価者は治療の割り当てを知らず、評価者が治療の割り当てを間接的に知る可能性を減らす努力がなされた(例えば、評価者は患者に直接ケアを提供せず、副作用について質問することを禁じられた)。全体で、140 人の患者がプラセボ、8 mg または 16 mg のザナフレックスを投与されました。
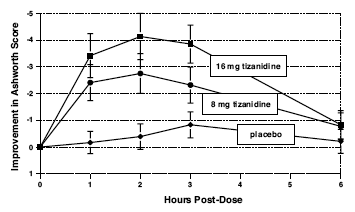
反応は身体検査によって評価されました。筋緊張は 5 点スケール (Ashworth スコア) で評価され、スコア 0 は正常な筋緊張を表すために使用されます。スコア 1 は軽度の痙性キャッチを示し、スコア 2 はより顕著な筋抵抗を示しました。スコア 3 は、トーンのかなりの増加を表すために使用され、受動的な動きが困難になりました。痙縮によって動かなくなった筋肉には 4 のスコアが付けられました。痙攣数も収集されました。
評価は、治療後 1、2、3、および 6 時間で行われました。プラセボと比較したザナフレックス 2mg のアッシュワース スコアの統計的に有意な減少が、治療後 1、2、3 時間で検出されました。下の図 2 は、アッシュワース スケールで測定した、ベースラインからの筋緊張の平均変化の比較を示しています。筋緊張の最大の低下は、治療後 1 ~ 2 時間でした。治療後 6 時間までに、8 および 16 mg のザナフレックス 2 mg 群の筋肉の緊張は、プラセボ治療を受けた患者の筋肉の緊張と区別がつかなくなりました。特定の患者内で、筋緊張の改善は血漿濃度と相関していました。血漿濃度は、所定の用量で患者ごとに変動した。 16 mg はより大きな効果をもたらしましたが、低血圧を含む有害事象は 8 mg 群よりも一般的で深刻でした.各グループで発生したけいれんの数に違いはありませんでした。
図 2: 単回投与研究 - アッシュワース スケール ± 95% 信頼区間で測定したベースラインからの筋緊張の平均変化 (負のアッシュワース スコアは、ベースラインからの筋緊張の改善を意味します)
痙性を伴う脊髄損傷患者における7週間の研究
週間の研究 (研究 2) では、脊髄損傷に続発する痙縮患者 118 人が、プラセボまたはザナフレックスのいずれかに無作為に割り付けられました。盲検化の完全性を確保するために、最初の研究で行われたものと同様の手順が採用されました。
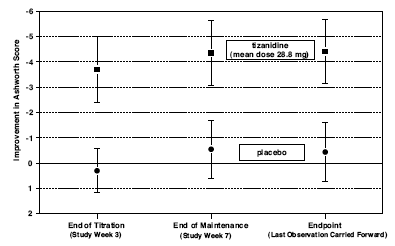
患者は 3 週間にわたって、最大耐用量または 36 mg を 3 回の不均等な用量で 1 日 36 mg まで用量設定されました (例: 朝と午後に 10 mg、夜に 16 mg を投与)。その後、患者はさらに 4 週間、最大耐用量で維持されました (すなわち、維持期)。維持期全体を通して、午前または午後の投与後 2.5 時間以内にアシュワース スケールで筋肉の緊張を評価しました。日中のけいれんの数は、患者によって毎日記録されました。
エンドポイント(結果評価のプロトコルで指定された時間)で、プラセボと比較して、ザナフレックス治療グループの筋肉緊張とけいれんの頻度が統計的に有意に減少しました.筋緊張の低下は、筋力の低下とは関連していませんでしたが(望ましい結果)、日常生活動作の測定において、ザナフレックス治療を受けた患者の一貫した利点にはつながりませんでした.下の図 3 は、アッシュワース スケールで測定した、ベースラインからの筋緊張の平均変化の比較を示しています。
図 3: 7 週間の研究 - アッシュワース スケール ± 95% 信頼区間で測定した投与後 0.5 ~ 2.5 時間の筋緊張の平均変化 (負のアッシュワース スコアは、ベースラインからの筋緊張の改善を意味します)
患者情報
深刻な薬物相互作用
フルボキサミンまたはシプロフロキサシンを服用している場合は、重度の血圧低下や鎮静などの重篤な副作用のリスクが高まるため、ザナフレックスを服用しないよう患者に助言してください。 Zanaflex と他の医薬品との相互作用に関連するリスクがあるため、薬の服用を開始または中止する場合は、医師または薬剤師に知らせるよう患者に指示してください。
ザナフレックス投与
患者には、Zanaflex 2mg を処方されたとおりに(食事の有無にかかわらず一貫して)服用し、錠剤とカプセルを切り替えないように伝えてください。 8 mg を超える単回投与または 36 mg を超える 1 日総投与量で有害事象のリスクがあるため、処方された量より多くの Zanaflex 2 mg を服用してはならないことを患者に伝えてください。反跳性高血圧および頻脈が起こる可能性があるため、Zanaflex 4mg を突然中止すべきではないことを患者に伝えてください。
ザナフレックスの効果
低血圧を経験する可能性があること、および横になっているまたは座っている状態から立っている状態に変更するときに注意するように患者に警告します。 Zanaflex によって鎮静状態や傾眠状態になる可能性があり、車両の運転や機械の操作など、注意力を必要とする活動を行うときは注意する必要があることを患者に伝えてください。 Zanaflex 4mg を薬物(バクロフェン、ベンゾジアゼピン)または中枢神経抑制剤として作用する物質(アルコールなど)と併用すると、鎮静作用が相加的になる可能性があることを患者に伝えてください。姿勢を維持し、移動中のバランスをとるために痙性に依存している場合、または機能を向上させるために痙性を利用している場合は常に、Zanaflex が痙性を軽減し、注意が必要であることを患者に思い出させてください。
