Elocon 5g Mometasone 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Elocon 5g とは何ですか? どのように使用されますか?
Elocon (モメタゾン フロエート) クリーム、0.1% は、2 歳以上の患者のコルチコステロイド反応性皮膚病の炎症性およびそう痒性の症状の軽減を目的とした、コルチコステロイドの局所クリーム、ローション、または軟膏です。
エロコン 5g の副作用は何ですか?
エロコンの一般的な副作用は次のとおりです。
- 皮膚発疹、
- かゆみ、
- 燃焼、
- 発赤、
- 乾燥、
- 肌が薄くなったり柔らかくなったり、
- 皮膚の発疹や口の周りの炎症、
- 腫れた毛包、
- 蜘蛛の巣、
- しびれやうずき、
- 治療した皮膚の色の変化、
- 水疱、
- にきび、
- 処理された皮膚のかさぶた、または
- ストレッチマーク。
説明
ELOCON (モメタゾン フロエート) クリームは、0.1% 局所用のモメタゾン フロエートを含んでいます。フランカルボン酸モメタゾンは、抗炎症作用を持つ合成コルチコステロイドです。
化学的に、フロ酸モメタゾンは 9α,21-ジクロロ-11β,17-ジヒドロキシ-16α-メチルプレグナ-1,4-ジエン3,20-ジオン 17-(2-フロ酸)であり、実験式は C27 H30CI2O6、分子量は 521.4 です。および次の構造式:
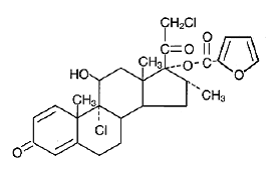
フランカルボン酸モメタゾンは、白色からオフホワイトの粉末で、水にほとんど溶けず、オクタノールにわずかに溶け、エチルアルコールに中程度に溶けます。
ELOCON 5g クリーム 0.1% の各グラムには、オクテニルコハク酸アルミニウム デンプン (ガンマ線照射済み)、ヘキシレン グリコール、水添大豆レシチン、リン酸、精製水、二酸化チタン、ホワイト ソフトの白からオフホワイトのクリーム ベースに 1 mg のフランカルボン酸モメタゾンが含まれています。パラフィン、ホワイトワックス。
適応症
ELOCON® Cream は、2 歳以上の患者のコルチコステロイド反応性皮膚疾患の炎症性およびそう痒症の症状の軽減を目的としたコルチコステロイドです。
投薬と管理
1 日 1 回、ELOCON Cream を患部に薄く塗ってください。 ELOCON Cream は、2 歳以上の小児患者に使用できます。 ELOCON Cream の安全性と有効性は、2 歳未満の小児患者では確立されていないため、この年齢層での使用は推奨されません [参照 警告と注意事項 と 特定の集団での使用 ]。
コントロールが達成されたら、治療を中止する必要があります。 2 週間以内に改善が見られない場合は、診断の再評価が必要になる場合があります。 3週間以上使用した小児患者におけるELOCON Creamの安全性と有効性は確立されていません.
ELOCON Cream は、医師の指示がない限り、閉塞包帯には使用しないでください。 ELOCON 5g クリームは、子供がまだおむつやプラスチック製のズボンを必要とする場合、これらの衣服は閉塞包帯を構成する可能性があるため、おむつエリアに塗布しないでください.
ELOCON Cream は局所使用専用です。経口、眼科、または膣内での使用はできません。
顔、鼠蹊部、または腋窩への使用は避けてください。
供給方法
剤形と強度
クリーム、0.1%。 ELOCON Cream の各グラムには、白からオフホワイトの滑らかで均一なクリームベースに 1 mg のフロ酸モメタゾンが含まれています。
保管と取り扱い
エロコンクリーム 色は白からオフホワイトで、15 グラム (NDC 0085-3149-01) および 50 グラム ( NDC 0085-3149-03) チューブ。
25°C (77°F) で保管してください。 15 ~ 30°C (59 ~ 86°F) まで許容されるエクスカーション [参照 USP制御の室温 ]。過度の熱を避けてください。
製造元: Merck & Co., Inc., Whitehouse Station, NJ 08889, USA の子会社である Merck Sharp & Dohme Corp.。製造元: Schering-Plough Labo NV Heist-op-den-Berg、ベルギー。改訂: 2013 年 4 月
副作用
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、臨床現場で観察された率を反映していない可能性があります。
319人の被験者が参加した対照臨床試験では、ELOCON 5gクリームの使用に関連する副作用の発生率は1.6%でした.報告された反応には、灼熱感、かゆみ、および皮膚萎縮が含まれていました。 ELOCON 5g クリームの使用に伴う酒さの報告も受けています。 2 歳から 12 歳までの小児被験者を対象とした対照臨床試験 (n=74) では、ELOCON 5g クリームの使用に関連する有害事象の発生率は約 7% でした。報告された反応には、刺痛、かゆみ、およびせつ症が含まれていました。
次の有害反応は、6 か月から 2 歳までの 182 人の小児被験者の 4% における臨床試験中に、ELOCON 5g クリームによる治療に関連している可能性がある、またはおそらく関連していると報告されています。感覚異常、2。毛包炎、1;モニリア症、1;細菌感染、1;皮膚の色素脱失 1. 臨床試験で ELOCON Cream を投与された 97 人の被験者の間で、以下の皮膚萎縮の徴候も観察されました。毛細血管拡張症、1;弾力性の喪失、4;正常な皮膚のマーキングの喪失、4;薄さ、1;およびあざ、1。
次の追加の局所副作用は、局所コルチコステロイドで報告されていますが、閉塞包帯を使用するとより頻繁に発生する可能性があります.これらの反応は、刺激、乾燥、毛包炎、多毛症、座瘡様発疹、低色素沈着、口周囲皮膚炎、アレルギー性接触皮膚炎、二次感染、線条、粟粒症です。
薬物相互作用
ELOCON Cream を使用した薬物相互作用試験は実施されていません。
警告
の一部として含まれています 予防 セクション。
予防
内分泌系への影響
局所コルチコステロイドの全身吸収は、可逆的な視床下部-下垂体-副腎 (HPA) 軸の抑制を引き起こし、グルココルチコステロイド不足の可能性があります。これは、治療中または治療中止後に発生する可能性があります。一部の患者では、治療中の局所コルチコステロイドの全身吸収によって、クッシング症候群、高血糖症、および糖尿病の症状が生じることもあります。局所コルチコステロイドを使用している患者が HPA 軸の抑制を受けやすくなる要因には、強力なステロイドの使用、広い治療面積、長期間の使用、閉塞性包帯の使用、皮膚バリアの変化、肝不全、若年などがあります。
全身吸収の可能性があるため、局所コルチコステロイドを使用するには、HPA 軸抑制について患者を定期的に評価する必要がある場合があります。これは、副腎皮質刺激ホルモン (ACTH) 刺激テストを使用して行うことができます。
HPA 軸に対するフランカルボン酸モメタゾン クリームの効果を評価する研究では、乾癬またはアトピー性皮膚炎の 6 人の成人被験者に 15 グラムを 1 日 2 回、7 日間適用しました。結果は、薬物が副腎コルチコステロイド分泌のわずかな低下を引き起こしたことを示しています.
HPA軸の抑制が認められた場合は、徐々に薬物を中止するか、適用頻度を減らすか、またはより効果の低いコルチコステロイドに置き換えることを試みる必要があります. HPA 軸機能の回復は、通常、局所コルチコステロイドの中止により迅速に行われます。まれに、グルココルチコステロイド不足の徴候や症状が発生し、全身性コルチコステロイドの補充が必要になることがあります。
小児患者は、皮膚表面と体重の比率が大きいため、同等の用量からの全身毒性の影響を受けやすい可能性があります[参照 特定の集団での使用 ]。
アレルギー性接触皮膚炎
刺激が生じた場合は、ELOCON Cream の使用を中止し、適切な治療を開始する必要があります。コルチコステロイドによるアレルギー性接触皮膚炎は、通常、コルチコステロイドを含まないほとんどの局所用製品のように臨床的増悪に注意するのではなく、治癒の失敗を観察することによって診断されます.このような観察結果は、適切な診断パッチ テストで裏付けられる必要があります。
付随する皮膚感染症
付随する皮膚感染症が存在するか発症した場合は、適切な抗真菌剤または抗菌剤を使用する必要があります。良好な反応がすぐに得られない場合は、感染が十分に制御されるまで、ELOCON 5g クリームの使用を中止する必要があります。

非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
ELOCON 5g クリームの発がん性を評価するための長期動物実験は実施されていません。フランカルボン酸モメタゾンの長期発がん性試験は、ラットとマウスで吸入経路により実施された。 Sprague Dawley ラットを用いた 2 年間の発がん性試験で、フランカルボン酸モメタゾンは最大 67 mcg/kg の吸入用量で腫瘍の統計的に有意な増加を示さなかった (mcg/m² ベースで ELOCON 5g クリームの推定最大臨床局所用量の約 0.04 倍) )。スイス CD-1 マウスでの 19 か月の発がん性研究では、フランカルボン酸モメタゾンは、最大 160 mcg/kg の吸入用量で統計的に有意な腫瘍発生率の増加を示さなかった (ELOCON Cream の推定最大臨床局所用量の約 0.05 倍)。 mcg/㎡ベース)。
モメタゾンフロエートは、in vitro チャイニーズハムスター卵巣細胞アッセイで染色体異常を増加させたが、in vitro チャイニーズハムスター肺細胞アッセイでは染色体異常を増加させなかった。モメタゾンフロエートは、Ames 試験またはマウスリンパ腫試験で変異原性を示さず、in vivo マウス小核試験、ラット骨髄染色体異常試験、またはマウス雄生殖細胞染色体異常試験で染色体異常誘発性を示さなかった。フランカルボン酸モメタゾンはまた、ラット肝細胞において in vivo で予定外の DNA 合成を誘発しなかった。
ラットの生殖研究では、15 mcg/kg (mcg/m² ベースで、ELOCON 5g クリームの推定最大臨床局所投与量の約 0.01 倍) までの皮下投与量によって、雄または雌のラットで受胎能の障害は生じませんでした。
特定の集団での使用
妊娠
催奇形作用 - 妊娠カテゴリー C
妊娠中の女性を対象とした、十分に管理された研究はありません。したがって、潜在的な利点が胎児への潜在的なリスクを正当化する場合にのみ、ELOCON 5g クリームを妊娠中に使用する必要があります。
コルチコステロイドは、比較的低用量レベルで全身投与された場合、実験動物で催奇形性があることが示されています。コルチコステロイドの中には、実験動物に皮膚に塗布した後に催奇形性があることが示されているものがあります。
妊娠中のラット、ウサギ、およびマウスに投与すると、フランカルボン酸モメタゾンは胎児の奇形を増加させました。胎児の体重の低下および/または骨化の遅延によって測定されるように、奇形を生じた用量は胎児の成長も低下させた。また、フロ酸モメタゾンは、妊娠後期にラットに投与した場合、難産および関連する合併症を引き起こしました。
マウスでは、フランカルボン酸モメタゾンは 60 mcg/kg 以上の皮下投与で口蓋裂を引き起こしました。胎児の生存率は 180 mcg/kg で減少しました。 20 mcg/kg では毒性は観察されませんでした。 (マウスの 20、60、および 180 mcg/kg の用量は、mcg/m² に基づく ELOCON クリームの推定最大臨床局所用量の約 0.01、0.02、および 0.05 倍です。)
ラットでは、フランカルボン酸モメタゾンは 600 mcg/kg 以上の局所用量で臍ヘルニアを引き起こしました。 300 mcg/kg の用量では、骨化の遅延が生じましたが、奇形はありませんでした。 (ラットにおける 300 および 600 mcg/kg の用量は、mcg/m² に基づく ELOCON 5g クリームの推定最大臨床局所用量の約 0.2 および 0.4 倍です。)
ウサギでは、フランカルボン酸モメタゾンは、150 mcg/kg 以上の局所用量 (1 μg/kg の ELOCON クリームの推定最大臨床局所用量の約 0.2 倍) で複数の奇形 (例、前足の屈曲、胆嚢無形成、臍ヘルニア、水頭症) を引き起こしました。 ㎡ベース)。経口研究では、フランカルボン酸モメタゾンは再吸収を増加させ、700 mcg/kg で口蓋裂および/または頭部奇形 (水頭症およびドーム型頭部) を引き起こしました。 2800 mcg/kg では、ほとんどの同腹児が流産または吸収されました。 140 mcg/kg では毒性は観察されませんでした。 (ウサギにおける 140、700、および 2800 mcg/kg の用量は、mcg/m² ベースで ELOCON 5g クリームから推定される最大臨床局所用量の約 0.2、0.9、および 3.6 倍です。)
ラットが妊娠中または妊娠後期にフランカルボン酸モメタゾンの皮下投与を受けた場合、15 mcg/kg は長時間の困難な分娩を引き起こし、出生数、出生体重、および初期の子犬の生存率を低下させました。同様の効果は、7.5 mcg/kg では観察されませんでした。 (ラットにおける 7.5 および 15 mcg/kg の用量は、mcg/m² に基づく ELOCON クリームの推定最大臨床局所用量の約 0.005 および 0.01 倍です。)
授乳中の母親
全身投与されたコルチコステロイドは母乳に含まれており、成長を抑制したり、内因性のコルチコステロイド産生を妨害したり、その他の有害な影響を引き起こす可能性があります.コルチコステロイドの局所投与が、母乳で検出可能な量を生成するのに十分な全身吸収をもたらすかどうかは不明です.多くの薬物は母乳中に排泄されるため、エロコン 5g クリームを授乳中の女性に投与する場合は注意が必要です。
小児用
ELOCON Cream は、2 歳以上の小児患者には注意して使用できますが、3 週間を超える薬物使用の安全性と有効性は確立されていません。 ELOCON 5g クリームの安全性と有効性は、2 歳未満の小児患者では確立されていないため、この年齢層での使用は推奨されません。
小児科の試験では、アトピー性皮膚炎患者 24 人 (うち 19 人は 2 歳から 12 歳) が ELOCON Cream で 1 日 1 回治療を受けました。 ELOCON 5g クリームは、治療開始前に Cortrosyn テストで正常な副腎機能を示し、約 3 週間にわたって治療された 6 ~ 23 か月の小児被験者の約 16% で、ELOCON 5g クリームによって HPA 軸抑制を引き起こしました。 41% の平均体表面積 (範囲 15%-94%)。抑制の基準は、コルチゾールの基礎レベルが 5 mcg/dL 以下、刺激後 30 分間のレベルが 18 mcg/dL 以下、または 7 mcg/dL 未満の増加でした。治験終了後 2 ~ 4 週間のフォローアップ試験では、被験者のうち 5 人が利用でき、同じ基準を使用して 1 人の被験者で HPA 軸機能の抑制が実証されました。局所コルチコステロイドの長期使用は、この集団では研究されていない[参照 臨床薬理学 ]。
体重に対する皮膚表面積の比率が高いため、小児患者は、局所コルチコステロイドで治療されている場合、成人よりも HPA 軸抑制およびクッシング症候群のリスクが高くなります。したがって、彼らはまた、治療の中止中および/または中止後に副腎機能不全のリスクが高くなります。小児患者は、局所コルチコステロイドで治療されている場合、成人よりも線条を含む皮膚萎縮の影響を受けやすい可能性があります。局所コルチコステロイドを体表面の 20% 以上に適用している小児患者は、HPA 軸抑制のリスクが高くなります。
HPA 軸抑制、クッシング症候群、線形成長遅延、体重増加の遅延、および頭蓋内圧亢進が、局所コルチコステロイドを受けている小児患者で報告されています。小児における副腎抑制の徴候には、血漿コルチゾール値の低下と ACTH 刺激に対する反応の欠如が含まれます。頭蓋内圧亢進症の症状には、泉門の隆起、頭痛、および両側性乳頭浮腫が含まれます。
ELOCON Cream はおむつ皮膚炎の治療には使用しないでください。
高齢者の使用
エロコン 5g クリームの臨床試験には、65 歳以上の 190 人の被験者と 75 歳以上の 39 人の被験者が含まれていました。これらの被験者と若い被験者の間で安全性または有効性の全体的な違いは観察されず、他の報告された臨床経験では、高齢者と若い患者の間の反応の違いは確認されていません.ただし、一部の高齢者の感度が高いことは否定できません。
過剰摂取
局所的に適用された ELOCON クリームは、全身効果を生み出すのに十分な量で吸収されます [参照 警告と注意事項 ]。
禁忌
なし。
臨床薬理学
作用機序
他の局所コルチコステロイドと同様に、フランカルボン酸モメタゾンには、抗炎症、鎮痒、および血管収縮の特性があります。一般に、局所ステロイドの抗炎症活性の機序は不明である。しかし、コルチコステロイドは、総称してリポコルチンと呼ばれるホスホリパーゼ A2 阻害タンパク質の誘導によって作用すると考えられています。これらのタンパク質は、共通の前駆体であるアラキドン酸の放出を阻害することにより、プロスタグランジンやロイコトリエンなどの炎症の強力なメディエーターの生合成を制御すると考えられています。アラキドン酸は、ホスホリパーゼ A2 によって膜リン脂質から放出されます。
薬力学
ELOCON 5g クリームで実施された研究では、他の局所コルチコステロイドと比較して中程度の効力であることが示されています。
HPA 軸に対するフランカルボン酸モメタゾン クリームの効果を評価する研究では、乾癬またはアトピー性皮膚炎の 6 人の成人被験者に 15 グラムを 1 日 2 回、7 日間適用しました。クリームは、体表面の少なくとも 30% に閉塞することなく適用されました。結果は、薬剤が副腎コルチコステロイド分泌のわずかな低下を引き起こすことを示した[参照 警告と注意事項 ]。
アトピー性皮膚炎の生後 6 ~ 23 か月の 97 人の小児被験者が、非盲検の HPA 軸安全性研究に登録されました。 ELOCON Cream を 1 日 1 回、約 3 週間、平均体表面積 41% (範囲 15% ~ 94%) に塗布しました。治療開始前にコルトロシン試験で正常な副腎機能を示した被験者の約16%で、ELOCON 5gクリームの治療終了時に副腎抑制が観察されました。抑制の基準は、コルチゾールの基礎レベルが 5 mcg/dL 以下、刺激後 30 分間のレベルが 18 mcg/dL 以下、または 7 mcg/dL 未満の増加でした。治療中止後 2 ~ 4 週間のフォローアップ試験では、被験者のうち 5 人が利用でき、これらと同じ基準を使用して、1 人の被験者で HPA 軸機能の抑制が実証された [参照 特定の集団での使用 ]。
薬物動態
局所コルチコステロイドの経皮吸収の程度は、ビヒクルや表皮バリアの完全性など、多くの要因によって決まります。ヒトでの研究によると、ELOCON 5g クリームの適用量の約 0.4% が、閉塞のない正常な皮膚に 8 時間接触した後、循環に入ります。皮膚の炎症および/またはその他の疾患プロセスにより、経皮吸収が増加する場合があります。
臨床研究
コルチコステロイド反応性皮膚疾患の治療のための ELOCON 5g クリームの安全性と有効性は、乾癬とアトピー性皮膚炎の 2 つの無作為二重盲検ビヒクル対照臨床試験で評価されました。これらの試験では、合計 366 人の被験者 (12 ~ 81 歳) が評価され、そのうち 177 人が ELOCON Cream を受け取り、181 人が車両用クリームを受け取りました。 ELOCON クリームまたはビークル クリームを 1 日 1 回、21 日間塗布しました。
2 つの試験では、ELOCON 5g クリームが乾癬およびアトピー性皮膚炎の治療に有効であることが示されました。
患者情報
患者に次のことを知らせます。
- 医師の指示に従って、ELOCON 5g クリームを使用してください。外用のみです。
- 目に入らないようにしてください。
- 医師の指示がない限り、ELOCON Cream を顔、脇の下、または鼠蹊部に使用しないでください。
- ELOCON 5g Cream は、処方された疾患以外には使用しないでください。
- 治療部位は、医師の指示がない限り、閉塞するように包帯を巻いたり、覆ったり、包んだりしないでください。
- 局所的な有害反応の兆候があれば医師に報告してください。
- おむつ皮膚炎の治療に ELOCON 5g クリームを使用しないように患者に助言してください。おむつやプラスチック製のズボンは閉塞性包帯となる可能性があるため、おむつの領域に ELOCON Cream を塗布しないでください。
- コントロールが達成されたら、治療を中止します。 2週間以内に改善が見られない場合は、医師に連絡してください。
- 最初に医師に相談することなく、他のコルチコステロイド含有製品を ELOCON Cream と一緒に使用しないでください。
