Dostinex 0.25mg, 0.5mg Cabergoline 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Dostinex 0.25mg とは何ですか?
Dostinex (カベルゴリン) は、血中のプロラクチンが多すぎる (高プロラクチン血症とも呼ばれる) ホルモンの不均衡を治療するために使用されるドーパミン受容体拮抗薬です。
ドスティネックスの副作用は?
Dostinex 0.25mg の一般的な副作用は次のとおりです。
- 吐き気、
- 嘔吐、
- 胃のむかつきや痛み、
- 消化不良、
- 便秘、
- ガス、
- めまい、
- 回転する感覚、
- 立ちくらみ、
- 眠気、
- 緊張感、
- 疲れ、
- 頭痛、
- 憂鬱な気分、
- ほてり、
- しびれやチクチク感、または
- 口渇。
ドスティネックスの次のようなまれではあるが深刻な副作用が発生した場合は、医師に相談してください。
- 呼吸困難、
- しつこい咳、
- 足首や足のむくみ、
- 異常な疲労感
- 精神的/気分の変化(緊張など)、
- 異常に強い衝動(ギャンブルの増加、性的衝動の増加など)、
- 視界の変化、
- 月経痛や
- 胸の痛み。
説明
ドスティネックス錠には、ドーパミン受容体作動薬であるカベルゴリンが含まれています。カベルゴリンの化学名は、1-[(6-アリルレルゴリン-8β-イル)-カルボニル]-1-[3-(ジメチルアミノ)プロピル]-3-エチル尿素です。実験式は C26H37N5O2 で、分子量は 451.62 です。構造式は次のとおりです。
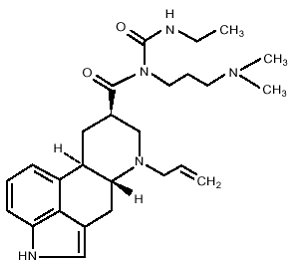
カベルゴリンは、エチル アルコール、クロロホルム、N, N-ジメチルホルムアミド (DMF) に溶ける白色の粉末です。 0.1N 塩酸にわずかに溶ける。 n-ヘキサンに非常に溶けにくい。そして水に不溶。
DOSTINEX 0.25mg 錠剤は、経口投与用で、0.5mg のカベルゴリンを含みます。不活性成分は、ロイシン、USP、およびラクトース、NFで構成されています。
適応症
DOSTINEX 0.5mg 錠剤は、特発性または下垂体腺腫による高プロラクチン血症障害の治療に適応されます。
投薬と管理
治療開始時のドスティネックス 0.25mg 錠の推奨用量は、週 2 回 0.25mg です。患者の血清プロラクチン値に応じて、1mg/週2回まで0.25mg/週2回ずつ増量されます。治療を開始する前に、心臓血管の評価を実施し、弁膜症を評価するために心エコー検査を検討する必要があります。
用量の増加は、医師が各用量レベルに対する患者の反応を評価できるように、4 週間ごとよりも急速に行うべきではありません。患者が十分に反応せず、より高い用量で追加の利益が観察されない場合は、最大の反応を達成した最低用量を使用し、他の治療アプローチを検討する必要があります. DOSTINEX 0.25mg による長期治療を受けている患者は、心臓の状態を定期的に評価し、心エコー検査を考慮する必要があります。
正常な血清プロラクチン レベルが 6 か月間維持された後、DOSTINEX 0.5mg の投与を中止し、血清プロラクチン レベルを定期的にモニタリングして、DOSTINEX による治療を再開するかどうか、またはいつ再開するかを決定します。 DOSTINEX による治療の 24 か月を超える効果の持続性は確立されていません。
供給方法
ドスティネックス錠は、0.5 mg のカベルゴリンを含む、白い、刻み目のあるカプセル型の錠剤です。各タブレットは片側にスコアが付けられ、ブレークラインの両側に文字 P と文字 U があります。銘板の反対側には700の数字が刻印されています。
ドスティネックス 次のように使用できます。
8錠入りボトル NDC 0013-7001-12
保管所
20°~25°C (68°~77°F) に制御された室温で保管してください [参照 USP ]。
この商品のラベルは更新されている可能性があります。現在の完全な処方情報については、www.pfizer.com をご覧ください。
配布元: Pharmacia & Upjohn Company Division of Pfizer Inc., NY, NY 10017. 改訂: 2014 年 9 月
副作用
DOSTINEX 0.25mg 錠の安全性は、900 人以上の高プロラクチン血症性障害患者で評価されています。ほとんどの有害事象は、重症度が軽度または中等度でした。
週間の二重盲検プラセボ対照試験では、週 2 回 0.125、0.5、0.75、または 1.0 mg の固定用量でプラセボまたはカベルゴリンで治療が行われました。投与量は、最初の 1 週間で半分になりました。用量に関連した影響の可能性が吐き気に対してのみ観察されたため、4 つのカベルゴリン治療グループが組み合わされました。プラセボ対照試験中の最も一般的な有害事象の発生率を次の表に示します。
4 週間の二重盲検プラセボ対照試験中に報告された有害事象の発生率
ブロモクリプチンとの比較試験の 8 週間の二重盲検期間で、ドスチネックス (週 2 回 0.5 mg の用量で) は、221 人の患者のうち 4 人 (2%) で有害事象が発生したため中止されましたが、ブロモクリプチン (1 回の用量で2.5 mg を 1 日 2 回)は、231 人の患者のうち 14 人(6%)で中止されました。 DOSTINEX の中止の最も一般的な理由は、頭痛、吐き気、嘔吐でした (それぞれ 3、2、2 人の患者)。ブロモクリプチンを中止する最も一般的な理由は、吐き気、嘔吐、頭痛、およびめまいまたはめまいでした (それぞれ 10、3、3、および 3 人の患者)。ブロモクリプチンとの比較試験の二重盲検部分における最も一般的な有害事象の発生率を次の表に示します。
ブロモクリプチンとの比較試験の8週間の二重盲検期間中に報告された有害事象の発生率
全体的な臨床試験で 1.0% 未満の発生率で報告されたその他の有害事象は次のとおりです。
全身: 顔面浮腫、インフルエンザ様症状、倦怠感
心臓血管系: 低血圧、失神、動悸
消化器系: 口渇、鼓腸、下痢、食欲不振
代謝および栄養システム: 体重減少、体重増加
神経系: 傾眠、神経過敏、感覚異常、不眠、不安
呼吸器系: 鼻づまり、鼻づまり
皮膚と付属物: にきび、かゆみ
特別な感覚: 異常な視力
泌尿生殖器系: 月経困難症、性欲亢進
カベルゴリンの安全性は、高プロラクチン血症障害に対するカベルゴリンの最大推奨用量を大幅に超える1日あたり最大11.5 mgの用量で、対照および非対照研究で約1,200人のパーキンソン病患者で評価されています.高プロラクチン血症性疾患の患者で発生した有害事象に加えて、パーキンソン病患者で最も一般的な有害事象は、ジスキネジア、幻覚、錯乱、および末梢性浮腫でした。心不全、胸水、肺線維症、および胃潰瘍または十二指腸潰瘍はめったに発生しませんでした。収縮性心膜炎の 1 例が報告されています。
市販後調査データ
DOSTINEX に関連して、次の事象が報告されています。 警告 、 心臓弁膜症および心外線維症反応 )。
カベルゴリンに関連して他の事象が報告されています:性欲亢進、性欲亢進、病的ギャンブル 予防 、 精神的 )。さらに、DOSTINEX を服用している患者では、脱毛症、攻撃性、精神病性障害の症例が報告されています。これらの報告のいくつかは、ドーパミン アゴニスト製品に対して以前に副作用があった患者でのものです。
薬物相互作用
DOSTINEX 0.5mg は、フェノチアジン、ブチロフェノン、チオキサンテン、メトクロプラミドなどの D 拮抗薬と同時に投与しないでください。
警告
妊娠
一般に、ドーパミン作動薬は、潜在的な利益が潜在的なリスクを上回ると判断されない限り、妊娠誘発性高血圧症、例えば子癇前症、子癇、産後高血圧の患者には使用すべきではありません。
線維性合併症
心臓弁膜症
すべての患者は、弁膜症の潜在的な存在を評価するために、心エコー図を含む心血管の評価を受ける必要があります。弁膜症が検出された場合、患者は DOSTINEX で治療されるべきではありません。 (見る 禁忌 DOSTINEX を投与された患者では、市販後に心臓弁膜症の症例が報告されています。これらの症例は、パーキンソン病の治療のための高用量のドスチネックス(> 2mg/日)の投与中に一般的に発生しています。高プロラクチン血症性障害の治療のために低用量のドスチネックスを投与された患者でも、心臓弁膜症の症例が報告されています。
パーキンソン病および高プロラクチン血症に対するカベルゴリン (n = 27,812) を含むドーパミン作動薬の新規使用と心臓病との関連性を評価するために、英国、イタリア、およびオランダの一般診療記録および記録リンケージ システムを使用した多国レトロスペクティブ コホート研究が実施されました。弁逆流(CVR)、その他の線維症、およびその他の心肺イベントを、最大 12 年間の追跡調査で確認しました。この研究では、パーキンソン病患者におけるカベルゴリンの使用は、非麦角由来のドーパミン アゴニスト (DA) およびレボドパと比較した場合、CVR のリスク増加と関連していた [10,000 人年あたりの発生率 (IR) 68.1 (95 % 信頼区間 (CI): 37.2–115.3) カベルゴリン vs. 非麦角 DA では 10.0 (95% CI: 5.2–19.4)、レボドパでは 11.3 (95% CI: 7.2 –17.0)]。ドーパミン アゴニストで治療された高プロラクチン血症の人 (n=8,386) に限定された研究分析では、カベルゴリンを使用しなかった人 (n=15,147) と比較して、CVR のリスクは高くありませんでした。パーキンソン病患者(リスク増加)および高プロラクチン血症患者(リスク増加なし)のカベルゴリン治療に関連する CVR のリスクに関する調査結果は、他の公開された研究の調査結果と一致しています。
医師は、高プロラクチン血症性障害の治療に有効な最低用量の DOSTINEX を使用し、DOSTINEX による治療を継続する必要性を定期的に再評価する必要があります。治療開始後、心臓弁膜症のリスクを評価するために、臨床的および診断的モニタリング(胸部X線、CTスキャン、心エコー図など)を実施する必要があります。定期的な心エコーモニタリングの推奨頻度は、6 ~ 12 か月ごと、または浮腫、新たな心雑音、呼吸困難、またはうっ血性心不全などの徴候および症状の存在により臨床的に示される場合です。
心エコー検査で新たな弁逆流、弁制限、または弁葉の肥厚が明らかになった場合、DOSTINEX は中止する必要があります。
DOSTINEX は、弁膜症に関連する他の薬にさらされている患者には注意して使用する必要があります。

心外線維症反応
DOSTINEXの投与後に、胸膜、心膜、および後腹膜線維症の市販後の症例が報告されています。いくつかの報告は、以前に他のエルゴチン性ドーパミン作動薬で治療された患者でのものでした。 DOSTINEX は、心臓または心臓外の線維性疾患の既往歴のある患者には使用しないでください。
線維性障害は潜行性に発症する可能性があり、患者は進行性線維症の徴候を監視する必要があります。したがって、治療中は、次の徴候と症状に注意を払う必要があります。
- 呼吸困難、息切れ、しつこい咳、胸痛などの胸膜肺疾患。
- 腎機能不全または尿管/腹部の血管閉塞は、腰部/脇腹の痛みおよび下肢の浮腫、ならびに後腹膜線維症を示す可能性のある腹部の腫瘤または圧痛を伴って発生する可能性があります。
- 心不全: 弁膜および心膜線維症の症例は、しばしば心不全として現れます。したがって、そのような症状が発生した場合は、弁線維症 (および収縮性心膜炎) を除外する必要があります。
赤血球沈降速度、胸部 X 線、血清クレアチニン測定、およびその他の調査などの臨床的および診断的モニタリングは、患者が DOSTINEX で治療されている間、ベースライン時および必要に応じて考慮する必要があります。
胸水または肺線維症の診断に続いて、DOSTINEX の中止により徴候および症状の改善が報告されました。
予防
全般的
1.0 mg を超える初期用量は、起立性低血圧を引き起こす可能性があります。血圧を下げることが知られている他の薬と一緒に DOSTINEX を投与する場合は、注意が必要です。
分娩後の授乳の抑制または抑制
DOSTINEX 0.25mg は、生理的授乳の抑制または抑制には適応されていません。この目的のための別のドーパミン アゴニストであるブロモクリプチンの使用は、高血圧、脳卒中、および発作の症例と関連しています。
肝障害
カベルゴリンは肝臓で広範囲に代謝されるため、肝機能障害のある患者にドスチネックス 0.5mg を投与する際には注意が必要であり、注意深いモニタリングが必要です。
精神的
カベルゴリンを含むドーパミンアゴニストで治療された患者では、病的なギャンブル、性欲の増加、および性欲亢進が報告されています。これは、通常、用量を減らすか治療を中止すると元に戻ります( 市販後調査データ )。
発がん、突然変異誘発、生殖能力の障害
発がん性試験は、カベルゴリンをそれぞれ 0.98 mg/kg/日および 0.32 mg/kg/日までの用量で強制経口投与したマウスおよびラットで実施されました。これらの用量は、げっ歯類では合計 mg/m /週、50 kg のヒトでは mg/m /週を使用して体表面積に基づいて計算された、ヒトの最大推奨用量の 7 倍および 4 倍です。
マウスでは、子宮頸部および子宮平滑筋腫と子宮平滑筋肉腫の発生率がわずかに増加しました。ラットでは、子宮頸部と子宮の悪性腫瘍と間質細胞腺腫がわずかに増加しました。齧歯動物では黄体の維持にプロラクチンが必要であるため、メスの齧歯動物における腫瘍の発生は、プロラクチン分泌の長期にわたる抑制に関連している可能性があります。プロラクチンが不足すると、エストロゲン/プロゲステロン比が増加し、子宮腫瘍のリスクが高まります。雄のげっ歯類では、血清プロラクチンレベルの低下は、精巣ステロイド合成を維持するための代償効果であると考えられている血清黄体形成ホルモンの増加と関連していました.これらのホルモンのメカニズムは種特異的であると考えられているため、これらの腫瘍とヒトとの関連性は不明です。
カベルゴリンの変異原性が評価され、一連の in vitro 試験で陰性であることが判明しました。これらの試験には、ネズミチフス菌を用いた細菌変異 (Ames) 試験、Schizosaccharomyces pombe P1 および V79 チャイニーズハムスター細胞を用いた遺伝子変異試験、Saccharomyces cerevisiae D4 における DNA 損傷および修復、およびヒトリンパ球における染色体異常が含まれていました。カベルゴリンは、マウスの骨髄小核試験でも陰性でした。
雌ラットでは、交配前の 2 週間から交配期間全体にわたって 0.003 mg/kg の 1 日用量で受胎が抑制されました。この用量は、ラットの総 mg/m /週および 50 kg のヒトの mg/m /週を使用して体表面積に基づいて計算されたヒトの最大推奨用量の約 1/28 に相当します。
妊娠
催奇形作用 - カテゴリー B
カベルゴリンを強制経口投与したマウス、ラット、およびウサギの生殖研究が行われています。 (このセクションの最大推奨ヒト用量の倍数は、動物の総 mg/m /週および 50 kg のヒトの mg/m /週を使用して、体表面積に基づいて計算されます。)
器官形成期にカベルゴリンを 8 mg/kg/日 (ヒトの最大推奨用量の約 55 倍) まで投与したマウスでは、母体毒性はありましたが、催奇形性はありませんでした。
ラットの器官形成期に 0.012 mg/kg/日 (ヒトの最大推奨用量の約 1/7) を投与すると、着床後の胚胎児喪失が増加した。これらの損失は、ラットにおけるカベルゴリンのプロラクチン阻害特性による可能性があります。ウサギの器官形成期に 0.5 mg/kg/日 (ヒトの最大推奨用量の約 19 倍) の 1 日用量で、カベルゴリンは、体重の減少と摂餌量の減少を特徴とする母体毒性を引き起こしました。ウサギの器官形成期に 4 mg/kg/日 (ヒトの最大推奨用量の約 150 倍) を投与すると、さまざまな奇形の発生が増加しました。しかし、ウサギを対象とした別の研究では、最大 8 mg/kg/日 (ヒトの最大推奨用量の約 300 倍) までの用量で、治療に関連した奇形や胚胎児毒性は観察されませんでした。
ラットでは、0.003 mg/kg/日 (ヒトの最大推奨用量の約 1/28) を超える用量を、分娩の 6 日前から授乳期間全体にわたって投与すると、乳汁分泌の減少により、子の成長が阻害され、死に至ります。
しかし、妊娠中の女性を対象とした十分に管理された研究はありません。動物の繁殖研究は常に人間の反応を予測できるわけではないため、この薬は明らかに必要な場合にのみ妊娠中に使用する必要があります.
授乳中の母親
この薬が母乳中に排泄されるかどうかは不明です。多くの薬物が母乳中に排泄され、カベルゴリンによる授乳中の乳児に深刻な副作用が生じる可能性があるため、母親にとっての薬物の重要性を考慮して、授乳を中止するか、薬物を中止するかを決定する必要があります。生理的授乳の抑制または抑制のために DOSTINEX を使用することは推奨されません。 予防 セクション)。
カベルゴリンのプロラクチン低下作用は、授乳を妨げることを示唆しています.この授乳の妨害のため、ドスチネックス 0.5mg は、授乳中または授乳を計画している分娩後の女性には投与しないでください。
小児用
小児患者における DOSTINEX 0.5mg の安全性と有効性は確立されていません。
高齢者の使用
DOSTINEX 0.5mg の臨床試験には、65 歳以上の被験者が十分に含まれておらず、若い患者と反応が異なるかどうかを判断できませんでした。他の報告された臨床経験では、年配の患者と若い患者の間の反応の違いは確認されていません。一般に、高齢患者の用量選択は慎重に行う必要があり、通常は用量範囲の下限から開始します。これは、肝臓、腎臓、または心機能の低下、および付随する疾患または他の薬物療法の頻度が高いことを反映しています。
過剰摂取
過剰摂取は、鼻づまり、失神、または幻覚を引き起こすと予想される場合があります。必要に応じて、血圧をサポートするための措置を講じる必要があります。
禁忌
ドスティネックス錠は、以下の患者には禁忌です:
- 制御されていない高血圧または麦角誘導体に対する既知の過敏症。
- -心臓弁膜症の病歴、弁葉の肥厚、弁制限、または混合弁制限-狭窄の心エコー検査によるデモンストレーションを含む治療前の評価によって決定される、弁の弁障害の解剖学的証拠によって示唆される。 (見る 警告 )
- -肺、心膜、または後腹膜の線維性障害の病歴。 (見る 警告 )
臨床薬理学
作用機序
下垂体前葉によるプロラクチンの分泌は、主に視床下部の抑制制御下にあり、結節漏斗ニューロンによるドーパミンの放出によって発揮される可能性が高い.カベルゴリンは、D2 受容体に高い親和性を持つ長時間作用型のドーパミン受容体アゴニストです。インビトロ研究の結果は、カベルゴリンがラット下垂体ラクトトロフによるプロラクチンの分泌に対して直接的な阻害効果を発揮することを示しています。カベルゴリンは、再セルピン化ラットの血清プロラクチンレベルを低下させました。受容体結合研究は、カベルゴリンがドーパミン D1、α1-および α2-アドレナリン受容体、および 5-HT1-および 5-HT2-セロトニン受容体に対する親和性が低いことを示しています。
臨床研究
DOSTINEX 0.25mg のプロラクチン低下効果は、2 つの無作為化二重盲検比較試験 (1 つはプラセボ、もう 1 つはブロモクリプチン) で、高プロラクチン血症の女性で実証されました。プラセボ対照研究 (プラセボ n=20; カベルゴリン n=168) では、DOSTINEX 0.5mg は、29%、76%、74%、および 95% で 4 週間の治療後に正常化された血清プロラクチン レベルの用量依存的な減少をもたらしました。 0.125、0.5、0.75、および 1.0 mg をそれぞれ週 2 回投与された患者の %。
ブロモクリプチン(カベルゴリン n=223; 治療目的分析ではブロモクリプチン n=236)による 8 週間の二重盲検比較試験では、0.5 mg の DOSTINEX で治療された患者の 77% でプロラクチンが正常化されました。 2.5 mg のブロモクリプチンを 1 日 2 回投与された患者の 59% と比較して、週 2 回月経の回復は、ブロモクリプチンで治療された女性の 70% と比較して、DOSTINEX で治療された女性の 77% で発生しました。乳汁漏出患者の中で、この症状は、ブロモクリプチンで治療された患者の 56% と比較して、DOSTINEX で治療された患者の 73% で消失しました。
薬物動態
吸収
12 人の健康な成人ボランティアに 0.5 mg から 1.5 mg の単回経口投与を行ったところ、2 時間から 3 時間以内に 30 から 70 ピコグラム (pg)/mL のカベルゴリンの平均ピーク血漿レベルが観察されました。 0.5 から 7 mg の用量範囲で、12 人の健康な成人ボランティアと 9 人の成人パーキンソン病患者において、カベルゴリンの血漿レベルは用量に比例するように見えました。 12 人の健康なボランティアを対象とした反復投与研究では、週 1 回の投与スケジュールに従った定常状態レベルは、単回投与後の 2 倍から 3 倍高くなると予想されることが示唆されています。カベルゴリンの絶対的なバイオアベイラビリティは不明です。投与量のかなりの部分が初回通過効果を受ける。 12人の健康な被験者の尿データから推定されたカベルゴリンの排出半減期は、63時間から69時間の範囲でした.カベルゴリンの長期にわたるプロラクチン低下効果は、その遅い排出と長い半減期に関連している可能性があります.
分布
動物では、総放射能に基づいて、カベルゴリン (および/またはその代謝産物) が広範な組織分布を示しています。下垂体の放射能は血漿中の放射能の 100 倍を超え、約 60 時間の半減期で消失した。この発見は、この薬の持続的なプロラクチン低下効果と一致しています。妊娠ラットの全身オートラジオグラフィー研究では、胎児への取り込みは見られませんでしたが、子宮壁に高レベルが見られました。授乳中のラットのミルクで検出された有意な放射能 (親と代謝物) は、授乳中の乳児への曝露の可能性を示唆しています。薬は全身に広く分布しています。カベルゴリンは、濃度に依存しない方法でヒト血漿タンパク質に適度に結合します (40% から 42%)。高度にタンパク質結合した薬物の同時投与は、その性質に影響を与える可能性は低い.
代謝
動物とヒトの両方で、カベルゴリンは主にアシル尿素結合または尿素部分の加水分解を介して広範囲に代謝されます。シトクロム P-450 を介した代謝は最小限のようです。カベルゴリンは、ラットで酵素の誘導および/または阻害を引き起こしません。アシル尿素または尿素部分の加水分解は、カベルゴリンのプロラクチン低下効果を無効にし、これまでに確認された主要な代謝産物は治療効果に寄与しません。
排泄
放射性カベルゴリンを 5 人の健康なボランティアに経口投与した後、投与量の約 22% と 60% がそれぞれ 20 日以内に尿と糞に排泄されました。投与量の 4% 未満が未変化のまま尿中に排泄されました。カベルゴリンの非腎クリアランスと腎クリアランスは、それぞれ約 3.2 L/分と 0.08 L/分です。高プロラクチン血症患者の尿中排泄は同様でした。
特別な集団
腎不全
カベルゴリンの薬物動態は、クレアチニンクリアランスによって評価された中等度から重度の腎機能不全の患者 12 人で変化がありませんでした。
肝不全
軽度から中等度の肝機能障害 (Child-Pugh スコア ≤ 10) を有する 12 人の患者では、平均カベルゴリン Cmax または血漿濃度曲線下面積 (AUC) への影響は観察されませんでした。ただし、重度の機能不全 (Child-Pugh スコア > 10) の患者は、平均カベルゴリン Cmax および AUC が大幅に増加するため、注意が必要です。
お年寄り
カベルゴリンの薬物動態に対する年齢の影響は研究されていません。
食物と薬物の相互作用
12人の健康な成人ボランティアでは、食物はカベルゴリンの動態を変えませんでした.
薬力学
健康なボランティア (0.05 ~ 1.5 mg) および高プロラクチン血症の患者 (0.3 ~ 1 mg) にカベルゴリンを単回投与した後、血漿プロラクチンの阻害、最大効果の開始、および効果の持続を伴う用量反応が記録されています。志願者では、プロラクチン阻害は 0.2 mg 以上の用量で明らかでしたが、0.5 mg 以上の用量ではほとんどの被験者で最大の抑制が起こりました。より高い用量は、より多くの割合の被験者でプロラクチン抑制を引き起こし、作用の開始が早く、作用の持続時間が長くなります。 12 人の健康なボランティアでは、0.5、1、および 1.5 mg の用量でプロラクチンが完全に阻害され、1 および 1.5 mg の用量では 92% から 100% の被験者で 3 時間以内に最大の効果が得られましたが、0.5 mg の用量では 50% の被験者でした。 mg用量。
高プロラクチン血症患者 (N=51) では、0.6 mg のカベルゴリン単回投与後の最大プロラクチン減少は、2.5 mg ブロモクリプチンに匹敵しました。ただし、効果の持続時間は著しく長かった (14 日対 24 時間)。最大効果までの時間は、カベルゴリンよりもブロモクリプチンの方が短かった (6 時間対 48 時間)。
72人の健康なボランティアにおいて、カベルゴリンの単回または複数回の投与(最大2mg)は、プロラクチンの選択的阻害をもたらし、他の下垂体前葉ホルモン(GH、FSH、LH、ACTH、およびTSH)またはコルチゾールへの明らかな影響はありませんでした.
患者情報
治療中に妊娠の疑いがある場合、妊娠している場合、または妊娠する予定がある場合は、医師に通知するよう患者に指示する必要があります。妊娠の疑いがある場合は妊娠検査を行い、治療の継続について医師と話し合う必要があります。
患者は、息切れ、持続する咳、横になっているときの呼吸困難、または四肢の腫れを発症した場合、医師に通知する必要があります.
