Zofran 4mg, 8mg Ondansetron 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
ゾフランとは何ですか?
ゾフラン 4mg は、予防として、また特定の薬による、または術後の吐き気や嘔吐の症状を治療するために使用される処方薬です。ゾフラン 8mg は、単独で使用することも、他の薬と併用することもできます。
ゾフランは制吐剤、選択的 5-HT3 アンタゴニストと呼ばれる薬物のクラスに属します。
ゾフラン 4mg が生後 1 か月未満の子供に安全で効果的かどうかは不明です。
ゾフランの可能性のある副作用は何ですか?
ゾフランは、次のような深刻な副作用を引き起こす可能性があります。
- 重度の便秘、
- 胃痛、
- 膨満感、
- 胸の痛みと激しいめまいを伴う頭痛、
- 失神、
- 心臓の鼓動が速くなったり、ドキドキしたり、
- 皮膚や目の黄変(黄疸)
- ぼやけた視界、
- 一時的な視力喪失、
- 攪拌、
- 幻覚、
- 熱、
- 速い心拍数、
- 過剰反射、
- 吐き気、
- 嘔吐、
- 下痢、
- 調整の喪失、および
- 失神
上記の症状がある場合は、すぐに医療機関を受診してください。
ゾフランの最も一般的な副作用は次のとおりです。
- 下痢、
- 便秘、
- 眠気、および
- 疲労感
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、ゾフランの副作用のすべてではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
ゾフラン 4mg 錠剤およびゾフラン経口液剤の有効成分は、二水和物としてのオンダンセトロン塩酸塩であり、オンダンセトロンのラセミ体であり、セロトニン 5-HT3 受容体型の選択的遮断剤です。化学的には (±) 1, 2, 3, 9-テトラヒドロ-9-メチル-3-[(2-メチル-1H-イミダゾール-1-イル)メチル]-4H-カルバゾール-4-オン、一塩酸塩、二水和物.次の構造式があります。
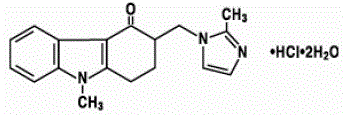
実験式は C18H19N3O・HCl・2H2O で、分子量は 365.9 です。
オンダンセトロン塩酸塩二水和物は、水と生理食塩水に溶ける白色からオフホワイトの粉末です。
ゾフラン 4mg ODT 口腔内崩壊錠の有効成分は、オンダンセトロン塩基、オンダンセトロンのラセミ体、およびセロトニン 5-HT3 受容体タイプの選択的遮断剤です。化学的には、(±) 1, 2, 3, 9 テトラヒドロ-9-メチル-3-[(2-メチル-1H-イミダゾール-1-イル)メチル]-4H-カルバゾール-4-オンです。次の構造式があります。
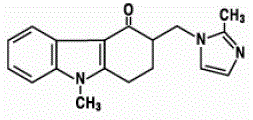
実験式は C18H19N3O で、分子量は 293.4 です。
経口投与用の 4 mg ゾフラン 8 mg 錠には、オンダンセトロン 4 mg に相当する塩酸オンダンセトロン二水和物が含まれています。経口投与用の 8 mg ゾフラン 8 mg 錠には、オンダンセトロン 8 mg に相当する塩酸オンダンセトロン二水和物が含まれています。各錠剤には、不活性成分のヒプロメロース、黄色酸化鉄 (8 mg 錠剤のみ)、乳糖、ステアリン酸マグネシウム、微結晶性セルロース、アルファ化デンプン、トリアセチン、および二酸化チタンも含まれています。
経口投与用の 4 mg ZOFRAN 8 mg ODT 口腔内崩壊錠には、4 mg のオンダンセトロン塩基が含まれています。経口投与用の各 8 mg ZOFRAN 4 mg ODT 口腔内崩壊錠には、8 mg のオンダンセトロン塩基が含まれています。各ゾフラン ODT タブレットには、不活性成分のアスパルテーム、ゼラチン、マンニトール、メチルパラベン ナトリウム、プロピルパラベン ナトリウム、ストロベリー フレーバーも含まれています。ゾフラン ODT 錠剤は、オンダンセトロンの凍結乾燥経口投与製剤であり、舌の上で崩壊し、溶解または嚥下を助けるために水を必要としません。
ゾフラン内服液 5 mL には、オンダンセトロン 4 mg に相当する塩酸オンダンセトロン二水和物 5 mg が含まれています。ゾフラン 8mg 内服液には、不活性成分無水クエン酸、精製水、安息香酸ナトリウム、クエン酸ナトリウム、ソルビトール、ストロベリーフレーバーが含まれています。
適応症
ZOFRAN は、以下に関連する吐き気と嘔吐の予防に適応されます。
- 50mg/m²以上のシスプラチンを含む催吐性の高いがん化学療法
- 催吐性が中等度の癌化学療法の初期および反復コース
- 全身照射、腹部への単一の高線量分割、または腹部への毎日の分割のいずれかを受ける患者における放射線療法
ZOFRAN は、術後の悪心および/または嘔吐の予防にも適応されます。
投薬と管理
投与量
成人患者および小児患者に対する推奨用量は、それぞれ表 1 および表 2 に記載されています。ゾフラン錠剤、ゾフラン ODT® 口腔内崩壊錠、およびゾフラン経口溶液の対応する用量は、互換的に使用することができます。
肝障害における投与量
重度の肝機能障害 (Child-Pugh スコアが 10 以上) の患者では、1 日合計 8 mg を超えないようにしてください [ 特定の集団での使用 、 臨床薬理学 ]。
ゾフランODT口腔内崩壊錠の服用方法
ZOFRAN ODT 口腔内崩壊錠をホイルの裏材から押し出そうとしないでください。乾いた手でブリスター 1 個の裏紙をはがし、錠剤をそっと取り出します。すぐにゾフラン 4mg ODT 口腔内崩壊錠を舌の上に置き、数秒で溶け、唾液とともに飲み込みます。液体による投与は必要ありません。
供給方法
剤形と強度
ゾフラン錠 楕円形のフィルムコーティング錠で、片面に「Zofran」と刻印されており、次の強度で利用できます。
- 4 mg - 反対側に「4」が刻印された白色の錠剤。
- 8 mg - 反対側に「8」が刻印された黄色の錠剤。
ゾフランODT 口腔内崩壊錠は、白色、丸型、および平凸型の錠剤で、次の強度で利用できます。
- 4 mg - 片面に「Z4」の型押し。
- 8 mg - 片面に「Z8」の型押し。
ゾフラン 4mg 内服液 、4 mg/5 mL は、無色透明から淡黄色の液体で、特徴的なイチゴの香りがあり、50 mL のボトルで入手できます。
保管と取り扱い
ゾフラン錠
mg (オンダンセトロン 4 mg に相当するオンダンセトロン塩酸塩二水和物) は、白い楕円形のフィルムコーティング錠で、片面に「Zofran」、もう片面に「4」と刻印され、30 錠入りのボトルに入っています (NDC 0078-0675-15 )。
2°C から 30°C (36°F から 86°F) で保管してください。光から保護します。 USP で定義されているように、タイトで耐光性のある容器に分注してください。
8 mg (オンダンセトロン 8 mg に相当するオンダンセトロン塩酸塩二水和物) は、黄色の楕円形のフィルムコーティング錠で、片面に「Zofran」、もう片面に「8」と刻印され、30 錠入りのボトルに入っています (NDC 0078-0676-15 )。
2°C から 30°C (36°F から 86°F) で保管してください。光から保護します。 USP で定義されているように、タイトで耐光性のある容器に分注してください。
ゾフラン口腔内崩壊錠8mg ODT
4 mg (4 mg オンダンセトロン基剤として) は、30 錠の単位用量パック (NDC 0078-0679-19) で、片面に「Z4」とデボス加工された白色の丸い平凸錠です。
mg (オンダンセトロン 8 mg ベースとして) は、30 錠の単位用量パック (NDC 0078-0680-19).
2°C から 30°C (36°F から 86°F) で保管してください。
ゾフラン 4mg 内用液
無色透明から淡黄色の液体で、特徴的なイチゴの香りがあり、チャイルド レジスタント クロージャー付きの 50 mL の琥珀色のガラス瓶に、5 mL あたり 4 mg のオンダンセトロンに相当する 5 mg のオンダンセトロン塩酸塩二水和物が含まれています (NDC 0078-0677-22)。 .
15°C から 30°C (59°F から 86°F) で直立して保管してください。光から保護します。ボトルはカートンに立てて保管してください。
販売元: Novartis Pharmaceuticals Corporation East Hanover, New Jersey 07936. 改訂: 2021 年 4 月
副作用
以下の臨床的に重大な副作用は、ラベルの別の場所に記載されています。
- 過敏反応 [参照 警告と注意事項 ]
- QT延長[参照 警告と注意事項 ]
- セロトニン症候群 [参照 警告と注意事項 ]
- 進行性イレウスおよび胃膨満のマスキング [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用の発生率を別の医薬品の臨床試験で観察された発生率と直接比較することはできず、実際に観察された発生率を反映していない可能性があります。
ゾフランの有効成分であるオンダンセトロンの臨床試験において、以下の副作用が報告されています。 ZOFRAN による治療との因果関係は、多くの場合不明でした。
化学療法による吐き気と嘔吐の予防
催吐性の高い化学療法(50mg以上のシスプラチン)に伴う吐き気と嘔吐の予防を目的とした2件の試験で、ゾフラン4mgの単回24mgの経口投与を受けた300人の成人の4%以上で報告された最も一般的な副作用/m²) は、頭痛 (11%) と下痢 (4%) でした。
催吐性が中等度の化学療法(主にシクロホスファミドベースのレジメン)に伴う吐き気と嘔吐の予防について、成人を対象とした 4 つの試験で報告された最も一般的な副作用を表 3 に示します。
あまり一般的でない有害反応
中枢神経系
錐体外路反応 (患者の 1% 未満)。
肝臓
アスパラギン酸トランスアミナーゼ (AST) および/またはアラニントランスアミナーゼ (ALT) の値は、米国の臨床試験でゾフラン 8 mg とシクロホスファミドベースの化学療法を受けた 723 人の患者の約 1% から 2% で正常上限の 2 倍を超えました。増加は一時的なものであり、投与量や治療期間に関連しているようには見えませんでした。反復暴露では、トランスアミナーゼ値の同様の一過性上昇が一部のコースで発生しましたが、症候性肝疾患は発生しませんでした。これらの生化学的変化におけるがん化学療法の役割は不明です。
肝毒性の可能性がある細胞傷害性化学療法や抗生物質などの同時投薬を受けているがん患者では、肝不全と死亡が報告されています。肝不全の病因は不明である。
外皮
発疹 (患者の約 1%)。
その他(2%未満)
アナフィラキシー、気管支痙攣、頻脈、狭心症、低カリウム血症、心電図変化、血管閉塞事象、および大発作。気管支痙攣とアナフィラキシーを除いて、ゾフラン 4mg との関係は不明です。
放射線による吐き気と嘔吐の予防
ZOFRAN と同時放射線療法を受けた患者で報告された最も一般的な副作用 (2% 以上) は、ZOFRAN と同時化学療法を受けた患者で報告されたものと同様で、頭痛、便秘、下痢でした。
術後の吐き気と嘔吐の予防
術後の吐き気と嘔吐の予防に関する試験で成人で報告された最も一般的な副作用を表 4 に示します。
25 人の被験者を対象としたクロスオーバー研究では、水を含まないゾフラン 8mg ODT 口腔内崩壊錠を投与された 2 人の被験者 (8%) と比較して、水と共にゾフラン 8mg ODT 口腔内崩壊錠を投与された 6 人の被験者 (24%) で頭痛が報告されました。
市販後の経験
オンダンセトロンの承認後の使用中に、次の副作用が確認されています。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
心臓血管
不整脈(心室性および上室性頻脈、早期心室収縮、心房細動など)、徐脈、心電図変化(第2度心ブロック、QT/QTc間隔延長、ST低下など)、動悸、失神。オンダンセトロンの静脈内投与では、QT 間隔の延長を含む一過性の ECG 変化がまれに報告されています。
全般的
フラッシング
まれに重度の過敏反応(アナフィラキシー反応、血管浮腫、気管支痙攣、息切れ、低血圧、喉頭浮腫、喘鳴など)も報告されています。喉頭痙攣、ショック、および心肺停止は、注射可能なオンダンセトロンを受けている患者のアレルギー反応中に発生しました。
肝胆道
肝酵素異常。
下気道
しゃっくり。
神経学
眼科学的危機、単独で、および他のジストニア反応とともに現れる。
肌
蕁麻疹、スティーブンス・ジョンソン症候群、中毒性表皮壊死症。
眼疾患
主に静脈内投与中の一過性失明の症例が報告されています。これらの一過性失明の症例は、数分から 48 時間以内に回復すると報告されています。
薬物相互作用
セロトニン薬
セロトニン症候群 (精神状態の変化、自律神経の不安定性、神経筋症状を含む) は、5-HT3 受容体拮抗薬や、SSRI や SNRI などの他のセロトニン作動薬の併用によって報告されています。セロトニン症候群の出現を監視します。症状が現れた場合は、ゾフラン 4mg を中止し、支持療法を開始する [参照 警告と注意事項 ]。
シトクロム P-450 酵素に作用する薬剤
オンダンセトロン自体は、肝臓のシトクロム P-450 薬物代謝酵素系を誘導または阻害するようには見えません [ 臨床薬理学 ]。オンダンセトロンは肝臓のシトクロム P450 薬物代謝酵素 (CYP3A4、CYP2D6、CYP1A2) によって代謝されるため、これらの酵素の誘導物質または阻害物質はクリアランスを変化させ、オンダンセトロンの半減期を変化させる可能性があります。 CYP3A4 の強力な誘導物質 (すなわち、フェニトイン、カルバマゼピン、およびリファンピン) で治療された患者では、オンダンセトロンのクリアランスが有意に増加し、オンダンセトロンの血中濃度が減少しました。しかし、入手可能なデータに基づくと、ゾフラン 8mg の投与量調整は、これらの薬剤を服用している患者には推奨されない [参照 臨床薬理学 ]。
トラマドール
オンダンセトロンとトラマドールの間の薬物動態学的薬物相互作用は観察されていませんが、2 つの小規模試験のデータは、一緒に使用すると、ゾフラン 8mg がトラマドールの患者管理投与を増加させる可能性があることを示しています。オンダンセトロンをトラマドールと一緒に投与する場合は、患者をモニタリングして適切な疼痛管理を確保してください。
化学療法
カルムスチン、エトポシド、およびシスプラチンは、オンダンセトロンの薬物動態に影響を与えません。
小児患者 76 人を対象としたクロスオーバー試験では、オンダンセトロンの静脈内投与によって高用量メトトレキサートの全身濃度が上昇することはありませんでした。
アルフェンタニルとアトラクリウム
ゾフラン 4 mg は、アルフェンタニルによって生成される呼吸抑制効果またはアトラクリウムによって生成される神経筋遮断の程度を変更しません。全身麻酔薬または局所麻酔薬との相互作用は研究されていません。
薬物乱用と依存
動物研究は、オンダンセトロンがベンゾジアゼピンとして差別されておらず、直接中毒研究でベンゾジアゼピンの代わりにならないことを示しています.
警告
の一部として含まれています 予防 セクション。
予防
過敏反応
アナフィラキシーや気管支痙攣を含む過敏反応は、他の選択的 5-HT3 受容体拮抗薬に対して過敏症を示した患者で報告されています。過敏反応が起きた場合は、ゾフランの使用を中止してください。標準治療に従って迅速に治療し、徴候や症状が解消するまで監視する [参照 禁忌 ]。
QT延長
オンダンセトロンを投与されている患者では、QT 間隔の延長を含む心電図 (ECG) の変化が見られます。さらに、ZOFRAN を使用している患者で Torsade de Pointes の市販後の症例が報告されています。先天性 QT 延長症候群の患者では、ゾフラン 8mg を避けてください。 ECGモニタリングは、電解質異常(例、低カリウム血症または低マグネシウム血症)、うっ血性心不全、徐脈性不整脈のある患者、またはQT延長につながる他の医薬品を服用している患者に推奨されます[ 臨床薬理学 ]。
セロトニン症候群
セロトニン症候群の発症は、5-HT3 受容体拮抗薬のみで報告されています。ほとんどの報告は、セロトニン作動薬(選択的セロトニン再取り込み阻害薬(SSRI)、セロトニンおよびノルエピネフリン再取り込み阻害薬(SNRI)、モノアミンオキシダーゼ阻害薬、ミルタザピン、フェンタニル、リチウム、トラマドール、静脈内メチレンブルーなど)の併用に関連しています。報告された症例のいくつかは致命的でした。ゾフラン4mg単独の過剰摂取で起こるセロトニン症候群も報告されています。 5-HT3受容体拮抗薬の使用に関連するセロトニン症候群の報告の大部分は、麻酔後のケアユニットまたは輸液センターで発生しました.
セロトニン症候群に関連する症状には、以下の徴候と症状の組み合わせが含まれる場合があります:精神状態の変化(例:激越、幻覚、せん妄、および昏睡)、自律神経の不安定性(例:頻脈、不安定な血圧、めまい、発汗、潮紅、高体温) 、神経筋症状(例、振戦、硬直、ミオクローヌス、反射亢進、協調運動障害)、発作、胃腸症状(例、吐き気、嘔吐、下痢)の有無にかかわらず。患者は、特に ZOFRAN 4mg と他のセロトニン作動薬の併用により、セロトニン症候群の出現を監視する必要があります。セロトニン症候群の症状が発生した場合は、ゾフランを中止し、支持療法を開始してください。特に ZOFRAN が他のセロトニン作動薬と併用されている場合は、セロトニン症候群のリスクが高いことを患者に知らせる必要があります。 薬物相互作用 、 過剰摂取 ]。
進行性イレウスと胃膨満のマスキング
腹部手術後の患者、または化学療法による吐き気と嘔吐を伴う患者に ZOFRAN を使用すると、進行性イレウスおよび/または胃膨満が隠れる可能性があります。特に消化管閉塞の危険因子がある患者では、腸の活動の低下を監視します。
ゾフラン 8mg は、胃や腸の蠕動運動を刺激する薬ではありません。経鼻胃吸引の代わりに使用しないでください。
フェニルケトン尿症
フェニルケトン尿症の患者には、ゾフラン ODT 口腔内崩壊錠にフェニルアラニン (アスパルテームの成分) が含まれていることを知らせる必要があります。各 4 mg および 8 mg の口腔内崩壊錠には、0.03 mg 未満のフェニルアラニンが含まれています。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
オンダンセトロンの経口投与量がそれぞれ 1 日あたり 10 mg/kg および 30 mg/kg までのラットおよびマウスでの 2 年間の研究では、発がん性の影響は見られませんでした (ヒトの最大推奨経口投与量 24 mg の約 4 倍および 6 倍)。 1日あたり、体表面積に基づく)。
オンダンセトロンは、標準的な変異原性試験で変異原性を示さなかった。
オンダンセトロンを 1 日あたり 15 mg/kg まで経口投与した場合 (体表面積に基づいて、1 日あたりの最大推奨経口用量 24 mg の約 6 倍)、雌雄ラットの受胎能または一般的な生殖能力に影響はありませんでした。
特定の集団での使用
妊娠
リスクの概要
オンダンセトロンの使用と主要な先天性欠損症との関連について発表された疫学研究では、一貫性のない結果が報告されており、妊娠中のオンダンセトロンの使用の安全性に関する結論を排除する重要な方法論的限界があります (以下を参照)。 データ )。入手可能な市販後データでは、薬物に関連した流産や母体への有害転帰のリスクは確認されていません。ラットとウサギの生殖研究では、体表面積に基づいて、オンダンセトロンを器官形成期にヒトの最大推奨経口用量 24 mg/日の約 6 倍と 24 倍で投与した場合、胎児への害の証拠は示されませんでした。 データ )。
示された集団の重大な先天性欠損症および流産の背景リスクは不明です。すべての妊娠には、先天異常、流産、またはその他の有害な転帰の背景リスクがあります。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2% ~ 4% および 15% ~ 20% です。
データ
ヒューマンデータ
いくつかの発表された疫学的研究からの妊婦のオンダンセトロン使用に関する入手可能なデータは、処方箋を記入した女性が実際に薬を服用したかどうかの不確実性、同時使用、他の薬や治療法、想起バイアス、およびその他の未調整の交絡要因。
子宮内でのオンダンセトロンへの暴露は、全体的な分析では、主要な先天性奇形とは関連していません。ある大規模なレトロスペクティブ コホート研究では、妊娠中にオンダンセトロンの処方を受けた 1970 年の女性が調査され、オンダンセトロンへの曝露と主要な先天性奇形、流産、死産、早産、低出生体重の乳児、または在胎期間に比べて小さい乳児との間に関連はないと報告されました。
2 つの大規模なレトロスペクティブ コホート研究と 1 つの症例対照研究では、妊娠初期のオンダンセトロン曝露と心血管障害のリスクが評価されており、所見には一貫性がありません。相対リスク (RR) は、0.97 (95% CI 0.86 ~ 1.10) から 1.62 (95% CI 1.04、2.54) の範囲でした。コホート研究の 1 つにおけるサブセット分析では、オンダンセトロンが心臓中隔欠損症と特異的に関連していることが観察されました (RR 2.05、95% CI 1.19、3.28)。ただし、この関連性は他の研究では確認されていません。
オンダンセトロンと口腔裂のリスクを評価したいくつかの研究では、結果に一貫性がありません。米国メディケイド データベースの 180 万人の妊娠を対象としたレトロスペクティブ コホート研究では、妊娠第 1 期に経口オンダンセトロンが処方された 88,467 人の妊娠で口唇裂のリスクが高いことが示されましたが (RR 1.24、95% CI 1.03、1.48)、そのような関連性はありませんでした。 23,866 人の妊娠でオンダンセトロンの静脈内投与が報告されています (RR 0.95、95% CI 0.63、1.43)。両方の投与形態を受けた女性のサブグループでは、RR は 1.07 (95% CI 0.59, 1.93) でした。先天異常サーベイランス プログラムのデータを使用した 2 件の症例対照研究では、母親によるオンダンセトロンの使用と孤立した口蓋裂との間に相反する関連性が報告されました (OR 1.6 [95% CI 1.1, 2.3] および 0.5 [95% CI 0.3, 1.0])。口蓋裂の場合の子宮内でのオンダンセトロン暴露が、口蓋形成の時期 (妊娠 6 週から 9 週の間に形成される) に発生したかどうかは不明です。
動物データ
ラットとウサギの胚・胎児発生研究では、妊娠中の動物は、器官形成期にそれぞれ最大 15 mg/kg/日と 30 mg/kg/日までのオンダンセトロンの経口投与を受けました。ウサギの母体の体重増加がわずかに減少したことを除いて、母体の動物または子孫の発育に対するオンダンセトロンの有意な影響はありませんでした。ラットで 15 mg/kg/日、ウサギで 30 mg/kg/日の用量で、母体の曝露マージンは、体表面積に基づいて、ヒトの最大推奨経口用量である 24 mg/日のそれぞれ約 6 倍および 24 倍であった。 .
出生前および出生後の発生毒性試験で、妊娠ラットは、妊娠 17 日目から産卵 21 日目まで、最大 15 mg/kg/日のオンダンセトロンを経口投与されました。交配した F1 世代の生殖能力を含め、妊娠中のラットとその子孫の出生前および出生後の発育に影響はありません。ラットの 15 mg/kg/日の用量では、母体の曝露マージンは、体表面積に基づいて、ヒトの最大推奨経口用量 24 mg/日の約 6 倍でした。
授乳
リスクの概要
オンダンセトロンが母乳に存在するかどうかは不明です。母乳で育てられた乳児に対するゾフラン 8mg の影響または乳生産への影響に関するデータはありません。しかし、オンダンセトロンがラットのミルクに存在することが実証されています。薬物が動物の乳に存在する場合、その薬物は母乳にも存在する可能性があります。
母乳育児の発達上および健康上の利点は、ゾフラン 4mg に対する母親の臨床的必要性、およびゾフランまたは基礎となる母体の状態から母乳で育てられた乳児への潜在的な悪影響とともに考慮されるべきです。
小児用
経口投与された ZOFRAN の安全性と有効性は、4 歳以上の小児患者において、催吐性が中等度のがん化学療法に伴う吐き気と嘔吐の予防について確立されています。これらの年齢層における ZOFRAN 4mg の使用は、4 歳から 18 歳までの 182 歳の小児がん患者を対象とした 3 つの非盲検非対照非米国試験からの追加データとともに、成人における ZOFRAN の適切かつ十分に管理された研究から得られた証拠によって裏付けられています。さまざまなシスプラチンまたは非シスプラチンレジメンを投与された患者 [参照 投薬と管理 、 臨床研究 ]。
小児患者におけるオンダンセトロンの使用に関する追加情報は、ゾフラン注射の処方情報に記載されています。
経口投与されたゾフラン 4mg の安全性と有効性は、以下の小児患者では確立されていません。
- 催吐性の高いがん化学療法に伴う吐き気と嘔吐の予防
- 放射線治療に伴う吐き気と嘔吐の予防
- 術後の悪心および/または嘔吐の予防
高齢者の使用
サブグループ分析が行われた米国および外国の対照臨床試験で、癌化学療法誘発性および術後の吐き気と嘔吐に登録された被験者の総数のうち、938人(19%)が65歳以上でした。
65 歳以上の対象者とそれ以上の年齢の対象者の間で、安全性または有効性の全体的な違いは観察されませんでした。クリアランスの減少と排泄半減期の増加は、若い被験者と比較して 75 歳以上の患者で見られました [ 臨床薬理学 ]。臨床試験で 75 歳以上の患者数が不十分であったため、この年齢層での安全性または有効性の結論が得られませんでした。他の報告された臨床経験では、高齢患者と若年患者の反応の違いは確認されていませんが、一部の高齢者の感度が高いことは除外できません.高齢患者では用量調整は必要ありません。
肝障害
軽度または中等度の肝障害のある患者では、用量調整は必要ありません。
重度の肝障害のある患者では、クリアランスが減少し、見かけの分布容積が増加するため、オンダンセトロンの半減期が大幅に増加します。したがって、重度の肝障害(Child-Pugh スコアが 10 以上)の患者では、1 日総投与量 8 mg を超えないようにしてください。 投薬と管理 、 臨床薬理学 ]。
腎障害
腎障害の程度(軽度、中等度、または重度)を問わず、患者には投与量の調整は推奨されません。オンダンセトロンの初日投与以上の経験はない[参照 臨床薬理学 ]。
過剰摂取
オンダンセトロンの過剰摂取に対する特効薬はありません。患者は適切な支持療法で管理されるべきです。
上記の有害反応に加えて、以下の有害反応がオンダンセトロンの過剰摂取の状況で報告されています: 72 mg を投与された 1 人の患者に、2 ~ 3 分の持続時間と重度の便秘の「突然の失明」 (黒内障) が発生しました。単回投与としてオンダンセトロンの静脈内投与。低血圧(および失神)は、48 mgのゾフラン錠を服用した患者に発生しました.わずか 4 分間で 32 mg を注入した後、一過性の第 2 度心ブロックを伴う血管迷走神経エピソードが観察されました。すべての場合において、副作用は完全に解消されました。
幼児におけるオンダンセトロンの不注意な経口過量投与 (kg あたり 5 mg の推定摂取量を超える) の後に、セロトニン症候群と一致する小児例が報告されています。報告された症状には、傾眠、激越、頻脈、頻呼吸、高血圧、紅潮、散瞳、発汗、ミオクロニー運動、水平眼振、反射亢進、および発作が含まれます。患者は、場合によっては挿管を含む支持療法を必要とし、1 ~ 2 日以内に後遺症なく完全に回復しました。
禁忌
ZOFRAN は以下の患者には禁忌です:
- オンダンセトロンまたは製剤のいずれかの成分に対して過敏症(アナフィラキシーなど)があることが知られている[参照 有害反応 ]
- 重度の低血圧と意識喪失のリスクがあるため、アポモルヒネを併用している
臨床薬理学
作用機序
オンダンセトロンは、選択的な 5-HT3 受容体拮抗薬です。その作用機序は完全には解明されていませんが、オンダンセトロンはドーパミン受容体拮抗薬ではありません。 5-HT3 タイプのセロトニン受容体は、末梢の迷走神経終末と中央の脳後部領域の化学受容体トリガー ゾーンの両方に存在します。オンダンセトロンの制吐作用が中枢性、末梢性、または両方の部位で媒介されるかどうかは定かではありません.しかし、細胞傷害性化学療法は、小腸の腸クロム親和性細胞からのセロトニンの放出と関連しているようです。ヒトでは、シスプラチン投与後、嘔吐の発症と並行して、尿中の 5-ヒドロキシインドール酢酸 (5-HIAA) 排泄が増加します。放出されたセロトニンは、5-HT3 受容体を介して迷走神経求心性神経を刺激し、嘔吐反射を開始する可能性があります。
薬力学
健康な被験者では、オンダンセトロン 0.15 mg/kg の単回静脈内投与は、食道の運動性、胃の運動性、食道括約筋の圧力低下、または小腸通過時間に影響を与えませんでした。オンダンセトロンを数日間投与すると、健康な被験者の結腸通過が遅くなることが示されています。オンダンセトロンは、血漿プロラクチン濃度に影響を与えません。
心臓電気生理学
QTc間隔の延長は、58人の健康な被験者を対象に、二重盲検、単回静脈内投与、プラセボおよびポジティブコントロールのクロスオーバー試験で研究されました.ベースライン補正後のプラセボとの QTcF の最大平均 (95% 上限信頼限界) 差は、オンダンセトロン 32 mg および 8 mg の 15 分間の静脈内注入後、それぞれ 19.5 (21.8) ミリ秒および 5.6 (7.4) ミリ秒でした。オンダンセトロン濃度と ΔΔQTcF の間に有意な暴露反応関係が確認されました。確立された暴露反応関係を使用して、15 分間にわたって静脈内注入された 24 mg は、14.0 (16.3) ミリ秒の平均予測 (95% 上限予測間隔) ΔΔQTcF を有していました。対照的に、同じモデルを使用して 15 分間にわたって静脈内注入された 16 mg は、9.1 (11.2) ミリ秒の平均予測 (95% 上限予測間隔) ΔΔQTcF を有していました。この研究では、15分間にわたって注入された8mgの用量は、臨床的に関連する程度までQT間隔を延長しませんでした.
薬物動態
吸収
オンダンセトロンは消化管から吸収され、初回通過代謝を受けます。単一の 8 mg 錠剤の投与後の健康な被験者の平均バイオアベイラビリティは、約 56% です。
オンダンセトロンの全身暴露は、用量に比例して増加しません。 16 mg 錠剤の曲線下面積 (AUC) は、8 mg 錠剤の用量から予測されるよりも 24% 大きかった。これは、より高い経口用量で初回通過代謝がいくらか減少したことを反映している可能性があります。
食事の影響
バイオアベイラビリティは、食物の存在によってもわずかに強化されます。
分布
インビトロで測定されたオンダンセトロンの血漿タンパク質結合は、10~500 ng/mLの濃度範囲にわたって70%~76%であった。循環する薬物は赤血球にも分配されます。
排除
代謝と排泄
オンダンセトロンはヒトで広範囲に代謝され、放射性標識された用量の約 5% が尿から親化合物として回収されます。代謝物は尿中に観察されます。主な代謝経路は、インドール環のヒドロキシル化とそれに続くグルクロニドまたは硫酸抱合です。
in vitro 代謝研究では、オンダンセトロンが CYP1A2、CYP2D6、および CYP3A4 を含むヒト肝シトクロム P-450 酵素の基質であることが示されています。全体的なオンダンセトロンのターンオーバーに関しては、CYP3A4 が優勢な役割を果たしました。オンダンセトロンを代謝できる代謝酵素は多数あるため、1 つの酵素の阻害または喪失 (例えば、CYP2D6 遺伝子欠乏症) が他の酵素によって補われる可能性が高く、オンダンセトロン除去の全体的な速度はほとんど変化しない可能性があります。
一部の非抱合代謝物には薬理活性がありますが、これらはオンダンセトロンの生物学的活性に大きく寄与する可能性が高い濃度では血漿中に見られません。
特定の集団
年齢: 高齢者人口
クリアランスの減少と排泄半減期の増加は、若い被験者と比較して 75 歳以上の患者で見られます [ 特定の集団での使用 ]。
セックス
単回投与されたオンダンセトロンの体内動態には性差が見られた。吸収の程度と速度は、男性より女性の方が大きい。女性ではクリアランスが遅く、見かけの分布容積が小さく(体重調整済み)、絶対バイオアベイラビリティが高いほど、血漿オンダンセトロン濃度が高くなりました。これらのより高い血漿濃度は、男性と女性の体重の違いによって部分的に説明されるかもしれません.これらの性差が臨床的に重要であったかどうかは不明です。より詳細な薬物動態情報は、表 5 および 6 に含まれています。
腎障害
腎障害は、オンダンセトロンの総クリアランスに有意な影響を与えるとは予想されません。しかし、オンダンセトロンの平均血漿クリアランスは、重度の腎機能障害 (クレアチニンクリアランスが 30 mL/分未満) の患者では約 50% 減少しました。クリアランスの減少は可変的であり、半減期の増加と一致しませんでした [ 特定の集団での使用 ]。
肝障害
軽度から中等度の肝機能障害の患者では、クリアランスは 2 倍に減少し、平均半減期は健常者の 5.7 時間と比較して 11.6 時間に増加します。重度の肝機能障害 (Child-Pugh スコアが 10 以上) の患者では、クリアランスが 2 倍から 3 倍に減少し、見かけの分布容積が増加し、結果として半減期が 20 時間に増加します [参照 投薬と管理 、 特定の集団での使用 ]。
薬物相互作用研究
CYP 3A4 インデューサー
オンダンセトロン除去は、シトクロム P-450 インデューサーの影響を受ける可能性があります。 CYP3A4 誘導剤、カルバマゼピン、またはフェニトインで慢性的に維持された 16 人のてんかん患者の薬物動態試験では、オンダンセトロンの AUC、Cmax、および t½ の減少が観察されました。これにより、オンダンセトロンのクリアランスが大幅に増加しました。ただし、この増加は臨床的に関連しているとは考えられていません [ 薬物相互作用 ]。
化学療法剤
カルムスチン、エトポシド、およびシスプラチンは、オンダンセトロンの薬物動態に影響を与えません。 薬物相互作用 ]。
制酸剤
制酸剤の同時投与は、オンダンセトロンの吸収を変化させません。
臨床研究
化学療法による吐き気と嘔吐の予防
高度催吐性化学療法
つの無作為二重盲検単剤療法試験で、ゾフラン 24 mg の単回経口投与は、50 以上のシスプラチンを含む催吐性の高いがん化学療法に伴う吐き気と嘔吐の予防において、関連する過去のプラセボ対照よりも優れていました。 mg/㎡。ステロイド投与は、これらの臨床試験から除外されました。ヒストリカル プラセボ コンパレータで 50 mg/m² 以上のシスプラチンを投与された患者の 90% 以上が、制吐療法を受けていない状態で嘔吐を経験しました。
最初の試験では、50 mg/m² 以上のシスプラチンを含む化学療法レジメンを受けている成人がん患者 357 人を対象に、オンダンセトロン 24 mg を単回投与、8 時間ごとに 8 mg を 2 回経口投与、32 mg を単回投与で比較しました。 .初回または単回投与は、化学療法の 30 分前に行われました。オンダンセトロン 24mg 1 日 1 回投与群で合計 66%、オンダンセトロン 8mg 1 日 2 回投与群で 55%、オンダンセトロン 32mg 1 日 1 回投与群で 55% の患者が完了有効性の主要エンドポイントである、嘔吐エピソードが 0 でレスキュー制吐薬がない 24 時間の試験期間。 3 つの治療グループのそれぞれが、過去のプラセボ コントロールよりも統計的に有意に優れていることが示されました。
同じ試験で、オンダンセトロン 8mg を 1 日 2 回経口投与した患者の 36% と比較して、オンダンセトロン 24mg を 1 回経口投与した患者の 56% が 24 時間の試験期間中に吐き気を経験しませんでした ( P = 0.001)、経口オンダンセトロン 32 mg 1 日 1 回投与群では 50%。ゾフラン 8 mg を 1 日 2 回、32 mg を 1 日 1 回投与する投与レジメンは、催吐性の高い化学療法に伴う吐き気と嘔吐の予防には推奨されない [参照 投薬と管理 ]。
番目の試験では、50 mg/m² 以上のシスプラチンを含む催吐性の高いがん化学療法に伴う吐き気と嘔吐の予防に対する、ゾフラン 4 mg の 24 mg 経口単回投与の有効性が確認されました。
催吐性が中等度の化学療法
米国では、ドキソルビシンを含むシクロホスファミドベースの化学療法レジメンを受けている 67 人の患者を対象に、無作為化プラセボ対照二重盲検試験が実施されました。ゾフラン 8mg の最初の 8mg 用量は、化学療法開始の 30 分前に投与され、次の用量は最初の投与の 8 時間後に投与され、その後、ゾフラン 8mg 8mg が 1 日 2 回、化学療法の完了後 2 日間投与されました。嘔吐の予防において、プラセボよりも有意に効果的でした。治療反応は、3 日間の試験期間中の嘔吐エピソードの総数に基づいていました。この試行の結果を表 7 にまとめます。
メトトレキサートまたはドキソルビシンのいずれかを含むシクロホスファミドベースの化学療法レジメンを受けている 336 人の患者を対象とした米国の二重盲検試験では、ゾフラン 8 mg を 1 日 2 回投与した場合、ゾフラン 8 mg を 1 日 3 回投与した場合と同程度に吐き気と嘔吐の予防効果がありました。 ZOFRAN 8 mg を 1 日 3 回投与することは、催吐性が中等度の化学療法の治療に推奨されるレジメンではありません。 投薬と管理 ]。
治療反応は、3 日間の試験期間中の嘔吐エピソードの総数に基づいていました。研究された投与計画の詳細およびこの試験の結果については、表 8 を参照してください。
再治療
単群試験では、シクロホスファミドベースの化学療法を受けている 148 人の患者が、その後の化学療法中に 1 日 3 回ゾフラン 8 mg で再治療され、合計 396 の再治療コースが行われました。再治療コースの 314 (79%) では嘔吐エピソードは発生せず、再治療コースの 43 (11%) では 1 ~ 2 回の嘔吐エピソードしか発生しませんでした。
小児科の治験
さまざまなシスプラチンまたは非シスプラチンレジメンを投与された 4 ~ 18 歳の小児がん患者 182 人を対象に、3 つの非盲検単群非米国試験が実施されました。ゾフラン 4mg 注射の初回投与量は、1 kg あたり 0.04 ~ 0.87 mg (総投与量 2.16 mg ~ 12 mg) の範囲で、その後 3 日間、毎日 4 ~ 24 mg の範囲のゾフラン 4 mg の経口投与が行われました。これらの試験では、評価可能な 170 人の患者の 58% が 1 日目に完全な反応 (嘔吐エピソードなし) を示しました。 12 歳から 18 歳の患者では 1 日 3 回 mg。これらの小児患者における嘔吐の予防は、基本的に成人の場合と同じでした。
放射線による吐き気と嘔吐
全身照射
20 人の患者を対象とした無作為化プラセボ対照二重盲検試験では、4 日間の放射線療法の各分割の 1.5 時間前に投与された 8 mg のゾフランは、全身照射によって誘発される嘔吐の予防においてプラセボよりも有意に効果的でした。全身照射は、合計 1,320 cGy の 4 日間にわたる 11 分割 (分割ごとに 120 cGy) で構成されていました。患者は 3 日間 3 分割、4 日目に 2 分割を受けました。
単一高線量放射線治療
腹部に対して 80 cm² 以上の前方または後方照射野サイズで単回高線量放射線療法 (800 ~ 1,000 cGy) を受けた 105 人の患者を対象とした実薬対照二重盲検試験では、ZOFRAN 4mg が有意に効果的でした。嘔吐の完全な制御に関してメトクロプラミドよりも優れています(嘔吐エピソード0)。患者は、放射線療法の 1 ~ 2 時間前にゾフラン (8 mg) またはメトクロプラミド (10 mg) の初回投与を受けました。午前中に放射線療法が行われた場合、8 mg のゾフラン 8 mg または 10 mg のメトクロプラミドが午後遅くに投与され、就寝前にもう一度繰り返されました。放射線療法が午後に行われた場合、患者は就寝前に 1 回だけゾフラン 4mg またはメトクロプラミド 10mg を 8mg 服用しました。患者は経口薬の投与を 1 日 3 回、3 日間続けました。
毎日の分割放射線療法
135 人の患者を対象とした実薬対照二重盲検試験では、腹部まで 100 cm² 以上の照射野で 1 ~ 4 週間の分割放射線療法 (線量 180 cGy) を実施したところ、ZOFRAN 4mg は有意に嘔吐の完全な制御に関してプロクロルペラジンよりも効果的です(嘔吐エピソード0).患者は、最初の毎日の放射線療法の 1 ~ 2 時間前にゾフラン(8 mg)またはプロクロルペラジン(10 mg)の初回投与を受け、その後、放射線療法の各日に約 8 時間ごとに 8 mg の投与を受けました。
術後の吐き気と嘔吐
入院手術を受ける女性865人を対象とした2件のプラセボ対照二重盲検試験(1件は米国で実施され、もう1件は米国外で実施された)では、ゾフラン16mgの単回投与またはプラセボが、全身バランスの導入の1時間前に投与された。麻酔(バルビツレート、オピオイド、亜酸化窒素、神経筋遮断、および補助的なイソフルランまたはエンフルラン)を使用した場合、ゾフラン錠は術後の吐き気と嘔吐の予防においてプラセボよりも有意に効果的でした.
男性での試験は実施されていません。
患者情報
QT延長
ZOFRAN が QT 延長などの深刻な心不整脈を引き起こす可能性があることを患者に知らせてください。患者に、心拍数の変化を感じた場合、立ちくらみを感じた場合、または失神エピソードがある場合は、すぐに医療提供者に伝えるように指示します[参照 警告と注意事項 ]。
過敏反応
ZOFRAN 4mgが過敏反応を引き起こす可能性があり、アナフィラキシーや気管支痙攣と同じくらい深刻な場合があることを患者に知らせてください.発熱、悪寒、発疹、または呼吸の問題を含む過敏反応の徴候や症状があれば、すぐに医療提供者に報告するように患者に指示します [参照 警告と注意事項 ]。
進行性イレウスと胃膨満のマスキング
腹部手術後の患者、または化学療法による吐き気と嘔吐のある患者には、ゾフラン 4mg が腸閉塞の徴候と症状を覆い隠す可能性があることを知らせてください。潜在的な腸閉塞と一致する徴候や症状があれば、すぐに医療提供者に報告するように患者に指示します [参照 警告と注意事項 ]。
薬物相互作用
- すべての薬、特にアポモルヒネの使用を医療提供者に報告するよう患者に指示します。アポモルヒネとゾフランを併用すると、血圧が著しく低下し、意識を失うことがあります。
- ゾフラン 8mg と、うつ病や片頭痛の治療薬など、別のセロトニン作動薬の併用によるセロトニン症候群の可能性について、患者に助言してください。次の症状が現れた場合は、直ちに医師の診察を受けるよう患者に助言する:精神状態の変化、自律神経の不安定、胃腸症状を伴うまたは伴わない神経筋症状[ 警告と注意事項 ]。
ゾフラン4mg ODT口腔内崩壊錠の投与
ゾフラン 4mg ODT 口腔内崩壊錠は、投与直前までブリスターから取り出さないように患者に指示してください。
- ZOFRAN 8mg ODT 口腔内崩壊錠をホイルの裏材から押し出そうとしないでください。
- 乾いた手でブリスター 1 個の裏紙をはがし、錠剤をそっと取り出します。
- すぐにゾフラン ODT 口腔内崩壊錠を舌の上に置き、数秒で溶け、唾液とともに飲み込みます。
- 液体による投与は必要ありません。
- 製品の適切な使用と取り扱いを保証するために、剥離可能なイラストのステッカーが処方箋とともに提供される製品カートンに貼られています。
