Xeloda 500mg Capecitabine 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Xeloda 500mg とは何ですか?
ゼローダは、結腸がん、結腸直腸がん、乳がんなどのがんの症状を治療するために使用される処方薬です。 Xeloda は、単独で使用することも、他の薬と併用することもできます。
ゼローダは、抗新生物薬、代謝拮抗薬と呼ばれる薬のクラスに属しています。
Xeloda 500mgが子供に安全で効果的かどうかは不明です.
ゼローダ500mgで起こりうる副作用は?
Xeloda は、次のような重大な副作用を引き起こす可能性があります。
- 100.5度以上の発熱、
- 吐き気、
- 食欲減少、
- いつもよりかなり食べる量が少なく、
- 嘔吐(24時間に1回以上)、
- 重度の下痢 (1 日に 4 回以上、または夜間)、
- 口の中の水ぶくれや潰瘍、
- 歯ぐきが赤くなったり、腫れたり、
- 嚥下障害、
- 手や足の痛み、圧痛、赤み、腫れ、水ぶくれ、皮膚の剥離、
- のどが渇いたり、熱くなったり、
- 排尿できなくなり、
- 激しい発汗、
- 暑くて乾燥した肌、
- 胸の痛みや圧迫感、
- 不規則な心拍、
- 呼吸困難、
- むくみや急激な体重増加、
- 痛みや排尿困難、
- 足や足首のむくみ、
- 疲労感、
- 呼吸困難、
- 暗い尿、
- 粘土色の便、
- 皮膚や目の黄変(黄疸)、
- 発熱またはその他のインフルエンザの症状、
- 咳、
- 皮膚のただれ、
- 薄い肌、
- あざができやすい、
- 不正出血、
- 立ちくらみを感じ、
- 速い心拍数、
- 喉の痛み、
- 顔や舌の腫れ、
- あなたの目に燃えている、そして
- 赤または紫の発疹(特に顔または上半身)が続き、水ぶくれや剥離を引き起こす皮膚の痛み
上記の症状がある場合は、すぐに医療機関を受診してください。
Xeloda 500mgの最も一般的な副作用は次のとおりです。
- 胃痛、
- 便秘、
- 胃の不調、
- 疲労感、
- 軽度の皮膚発疹、および
- 手や足のしびれやうずき
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Xeloda の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
ゼローダとワーファリンの相互作用
XELODA 500mg ワルファリン 相互作用: カペシタビンと経口クマリン誘導体抗凝固療法を併用している患者は、抗凝固剤の用量を適宜調整するために、抗凝固反応 (INR またはプロトロンビン時間) を頻繁に監視する必要があります。臨床的に重要なゼローダとワルファリンの薬物相互作用が、臨床薬理試験で実証されました [参照 警告と注意事項 および薬物相互作用]。ワルファリンやフェンプロクモンなどのクマリン誘導体抗凝固剤と併用して XELODA 500mg を服用している患者では、凝固パラメーターの変化および/または死亡を含む出血が報告されています。市販後の報告では、XELODA 500mg が導入された時点で抗凝固薬で安定していた患者のプロトロンビン時間 (PT) と INR が臨床的に有意に増加したことが示されています。これらの事象は、ゼローダ 500mg の治療を開始してから数日から数か月以内に発生し、いくつかのケースでは、ゼローダを中止してから 1 か月以内に発生しました。これらのイベントは、肝転移のある患者とない患者で発生しました。 60 歳以上でがんの診断を受けた患者は、独立して凝固障害のリスクが高くなります。
説明
XELODA (カペシタビン) は、抗腫瘍活性を持つフルオロピリミジンカルバメートです。これは、5-フルオロウラシルに変換される 5'-デオキシ-5-フルオロウリジン (5'-DFUR) の経口投与全身プロドラッグです。
カペシタビンの化学名は 5'-デオキシ-5-フルオロ-N-[(ペンチルオキシ)カルボニル]-シチジンで、分子量は 359.35 です。カペシタビンの構造式は次のとおりです。
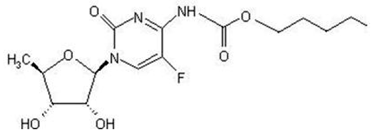
カペシタビンは白色からオフホワイトの結晶性粉末で、水溶解度は 20°C で 26 mg/mL です。
XELODA は、経口投与用の両凸の長方形のフィルムコーティング錠として提供されます。薄い桃色の錠剤にはカペシタビンが 150 mg 含まれており、桃色の錠剤にはカペシタビンが 500 mg 含まれています。 XELODA の不活性成分には、無水ラクトース、クロスカルメロース ナトリウム、ヒドロキシプロピル メチルセルロース、微結晶性セルロース、ステアリン酸マグネシウム、および精製水が含まれます。ピーチまたはライトピーチ フィルム コーティングには、ヒドロキシプロピル メチルセルロース、タルク、二酸化チタン、および合成の黄酸化鉄と赤酸化鉄が含まれています。
適応症
大腸がん
- XELODA は、フルオロピリミジン療法単独による治療が望ましい場合、原発腫瘍の完全切除を受けたデュークス C 型結腸癌患者の補助療法の単剤療法として適応されます。ゼローダ 500mg は、無病生存期間 (DFS) について、5 フルオロウラシルおよびロイコボリン (5-FU/LV) に劣っていませんでした。医師は、デュークス C 型結腸癌の補助療法として XELODA 500mg 単剤を処方する際、DFS と OS の改善を示した多剤併用化学療法試験の結果を考慮する必要があります。
- XELODA 500mg は、フルオロピリミジン療法単独による治療が望ましい場合、転移性結腸直腸癌患者の第一選択治療として適応されます。併用化学療法は、5-FU/LV 単独と比較して生存率の向上を示しています。ゼローダ 500mg 単剤療法では、5-FU/LV を超える延命効果は実証されていません。 5FU/LV の代わりに XELODA を組み合わせて使用することは、安全性や生存率の維持を保証するために十分に研究されていません。
乳がん
- XELODA とドセタキセルの併用は、以前のアントラサイクリンを含む化学療法が失敗した後の転移性乳癌患者の治療に適応されます。
- XELODA 500mgの単剤療法は、パクリタキセルとアントラサイクリンを含む化学療法レジメンの両方に耐性がある、またはパクリタキセルに耐性があり、さらなるアントラサイクリン療法が適応とされていない転移性乳がん患者の治療にも適応されます(例:累積投与量400mgの患者) mg/m2 のドキソルビシンまたはドキソルビシン同等物)。耐性は、治療中の進行性疾患、初期反応の有無にかかわらず、またはアントラサイクリンを含むアジュバント療法による治療完了から 6 か月以内の再発と定義されます。
投薬と管理
重要な管理手順
ゼローダ錠は、食後30分以内に水と一緒に飲み込んでください。ゼローダ 500mg は細胞毒性薬です。該当する特別な取り扱いおよび廃棄手順に従ってください。1 XELODA 500mg 錠剤を切断または粉砕する必要がある場合は、適切な機器と安全手順を使用して、細胞毒性薬の安全な取り扱いについて訓練を受けた専門家が行う必要があります。ゼローダの投与量は、体表面積に応じて計算されます。
標準開始用量
単剤療法(転移性結腸直腸癌、アジュバント結腸直腸癌、転移性乳癌)
ゼローダの推奨用量は、1250 mg/m2 を 1 日 2 回(朝晩、1 日総量 2500 mg/m2 に相当)、2 週間経口投与した後、1 週間の休薬期間を 3 週間サイクルとして投与することです( を参照)。
デュークス C 結腸がん患者の補助療法は、合計 6 か月間推奨されます [つまり、XELODA 1250 mg/m2 を 1 日 2 回、2 週間経口投与した後、1 週間の休薬期間を 3 週間サイクルとして、合計 3 週間のサイクルとして投与します。の 8 サイクル (24 週間)]。
ドセタキセルとの併用(転移性乳がん)
ドセタキセルと併用する場合、XELODA の推奨用量は、1250 mg/m2 を 1 日 2 回 2 週間投与した後、1 週間の休薬期間を置き、ドセタキセル 75 mg/m2 を 3 週間ごとに 1 時間点滴静注することです。 XELODA とドセタキセルの併用療法を受けている患者には、ドセタキセルのラベル表示に従って、ドセタキセル投与前に前投薬を開始する必要があります。体表面積ごとのゼローダの1日の総服用量と1回の服用量を表示します。
線量管理ガイドライン
全般的
XELODA の投与量は、患者管理を最適化するために個別化する必要がある場合があります。患者の毒性を注意深く監視し、必要に応じて XELODA 500 mg の用量を変更して、個々の患者の治療耐性に対応する必要があります [参照 臨床研究 ]。ゼローダ 500mg 投与による毒性は、対症療法、投与中断、およびゼローダ投与量の調整によって管理される場合があります。一度減量した後は増量してはいけません。毒性のために省略された XELODA 500mg の用量は、置き換えられたり復元されたりしません。代わりに、患者は計画された治療サイクルを再開する必要があります。
フェニトインの投与量とクマリン誘導体抗凝固薬の投与量は、いずれかの薬剤が XELODA と同時に投与される場合、減量する必要があるかもしれません。 薬物相互作用 ]。
単剤療法(転移性結腸直腸癌、アジュバント結腸直腸癌、転移性乳癌)
副作用の管理には、下記の XELODA 用量変更スキーム( を参照)が推奨されます。
ドセタキセルとの併用(転移性乳がん)
ゼローダ500mgの毒性による用量調節は、上記のゼローダに準じて行ってください。治療サイクルの開始時に、ゼローダ 500mg またはドセタキセルのいずれかで治療の遅延が示されている場合、両方の薬剤の再開の要件が満たされるまで、両方の薬剤の投与を遅らせる必要があります。
転移性乳癌の治療のために XELODA と併用した場合のドセタキセルの減量スケジュールを表 3 に示します。
特別な集団における開始用量の調整
腎障害
軽度の腎機能障害(クレアチニンクリアランス = 51 ~ 80 mL/分 [Cockroft and Gault、以下に示すように])の患者には、XELODA 500mg の開始用量を調整しないことをお勧めします。中等度の腎機能障害 (ベースラインのクレアチニンクリアランス = 30 ~ 50 mL/分) の患者では、単剤療法またはドセタキセルとの併用 (1250 mg/m2 から 950 mg/m2 1 日 2 回)が推奨されます [参照 特定の集団での使用 と 臨床薬理学 ]。患者がグレード 2 から 4 の有害事象を発症した場合は、および (レジメンに応じて) で概説されているように、その後の用量調整が推奨される [ 警告と注意事項 ]。中等度の腎機能障害を有する患者に対する開始用量調整の推奨事項は、XELODA 500mg 単剤療法および XELODA 500mg とドセタキセルの併用療法の両方に適用されます。
Cockroft と Gault の式:
老年医学
医師は、高齢者におけるゼローダ 500mg の効果を監視する際に注意を払う必要があります。推奨用量を提供するにはデータが不十分です。
供給方法
剤形 強み
XELODA は、経口投与用の両凸の長方形のフィルムコーティング錠として提供されます。薄桃色の錠剤には 150 mg のカペシタビンが含まれており、桃色の錠剤には 500 mg のカペシタビンが含まれています。
150mg
色:ライトピーチ 刻印:片面ゼローダ、片面150粒 150mg錠60粒入り( NDC 0004-1100-20)、カートンに個別包装されています。
500mg
色:ピーチ 刻印:片面ゼローダ500mg、片面500粒 500mg錠120粒入り( NDC 0004-1101-50)、カートンに個別包装されています。
保管と取り扱い
25°C (77°F) で保管してください。 15° から 30°C (59° から 86°F) まで許容されるエクスカーション。 [USP 制御室温を参照]。しっかり閉めてください。
ゼローダは細胞毒性薬です。該当する特別な取り扱いおよび廃棄手順に従ってください。1 未使用の製品は、地域の要件または薬物回収プログラムに従って廃棄する必要があります。
参考文献
1. 「OSHA 有害薬物」。 OSHA。 http://www.osha.gov/SLTC/hazardousdrugs/index.html。
配布元: Genentech USA, Inc. Roche Group のメンバー、1 DNA Way、South San Francisco、CA 94080-4990。改訂: 2021 年 5 月
副作用
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
補助結腸がん
治験薬を少なくとも 1 回投与され、少なくとも 1 回の安全性評価を受けたデュークス C 型結腸癌患者を対象とした 1 つの第 3 相試験で、患者の 5% 以上に発生した有害反応を示しています。合計 995 人の患者に 1,250mg/m2 の XELODA 500mg を 1 日 2 回 2 週間投与し、その後 1 週間休薬し、974 人の患者に 5-FU とロイコボリン (20mg/m2 のロイコボリン IV、その後425 mg/m2 IV ボーラス 5FU を 1~5 日目に 28 日ごとに)。治療期間の中央値は、カペシタビン治療患者で 164 日、5-FU/LV 治療患者で 145 日でした。合計 112 人 (11%) と 73 人 (7%) のカペシタビンおよび 5-FU/LV 治療を受けた患者が、副作用のために治療を中止しました。すべての原因による合計 18 人の死亡が、試験中または治験薬の投与後 28 日以内に発生しました。8 人 (0.8%) の患者は XELODA 500mg に無作為に割り付けられ、10 人 (1.0%) は 5-FU/LV に無作為に割り付けられました。
治験薬を少なくとも 1 回投与され、少なくとも 1 回の安全性評価を受けたデュークス C 型結腸癌患者を対象とした 1 つの第 3 相試験で、患者の 1% 以上にグレード 3/4 の臨床検査値異常が発生したことを示しています。
転移性結腸直腸がん
単剤療法
第一選択の転移性結腸直腸癌における 2 つの第 3 相試験をプールして、患者の 5% 以上で発生した有害反応を示しています。合計 596 人の転移性結腸直腸癌患者が 1,250 mg/m2 の XELODA を 1 日 2 回 2 週間投与され、その後 1 週間の休薬期間が設けられ、593 人の患者が Mayo レジメンで 5-FU とロイコボリンを投与されました (20 mg/m2 ロイコボリン IV、続いて 425 mg/m2 IV ボーラス 5-FU、1~5 日目、28 日ごと)。プールされた結腸直腸データベースでは、治療期間の中央値は、カペシタビン治療患者で 139 日、5-FU/LV 治療患者で 140 日でした。カペシタビンと 5-FU/LV で治療された患者のそれぞれ合計 78 人 (13%) と 63 人 (11%) が、副作用/合併症のために治療を中止しました。すべての原因による合計 82 人の死亡が、試験中または治験薬の投与後 28 日以内に発生しました。50 人 (8.4%) の患者が XELODA 500mg に無作為に割り付けられ、32 人 (5.4%) が 5-FU/LV に無作為に割り付けられました。
乳がん
ドセタキセルとの併用
以下のデータは、 および の転移性乳癌患者における XELODA 500mg とドセタキセルの併用試験について示されています。ゼローダとドセタキセルの併用群では、XELODA 1,250 mg/m2 を 1 日 2 回、間欠療法 (2 週間の治療と 1 週間の治療なし) として少なくとも 6 週間経口投与し、ドセタキセルを 1 時間の静脈内注入として投与しました。少なくとも 6 週間、各 3 週間サイクルの初日に 75 mg/m2 の用量。単剤療法群では、ドセタキセルは、少なくとも 6 週間、各 3 週間サイクルの初日に 100 mg/m2 の用量で 1 時間の静脈内注入として投与されました。平均治療期間は、併用群で 129 日、単剤療法群で 98 日でした。併用療法群で合計 66 人の患者 (26%)、単剤療法群で合計 49 人 (19%) の患者が、副作用のために試験から脱落しました。副作用のために減量を必要とする患者の割合は、併用群で 65%、単剤療法群で 36% でした。併用療法群で副作用のために治療の中断を必要とした患者の割合は 79% でした。治療の中断は、併用療法群の用量変更スキームの一部でしたが、ドセタキセル単独療法で治療された患者ではそうではありませんでした。
単剤療法
以下のデータは、1250 mg/m2 の用量を 1 日 2 回、2 週間投与された後、1 週間の休薬期間を受けた、ステージ IV の乳癌患者における研究について示されています。平均治療期間は114日でした。 162 人の患者のうち合計 13 人 (8%) が副作用/合併症のために治療を中止しました。
5%未満の患者における臨床的に関連のある有害事象
ゼローダを単剤療法またはドセタキセルとの併用療法で治療した患者の 5% 未満で報告された臨床的に重要な有害事象のうち、少なくとも治療に関連していると考えられるものを以下に示します。グレード 3 および 4 の各有害事象の発生数は括弧内に示されています。
単剤療法(転移性結腸直腸癌、アジュバント結腸直腸癌、転移性乳癌)
胃腸: 腹部膨満、嚥下障害、肛門痛、腹水 (0.1%)、胃潰瘍 (0.1%)、イレウス (0.3%)、腸の中毒性拡張、胃腸炎 (0.1%)
肌と皮下組織: 爪障害 (0.1%)、発汗増加 (0.1%)、光線過敏反応 (0.1%)、皮膚潰瘍、そう痒症、放射線想起症候群 (0.2%)
全般的: 胸痛 (0.2%), インフルエンザ様疾患, ほてり, 痛み (0.1%), 嗄声, 神経過敏, 歩行困難, 喉の渇き, 胸部腫瘤, 虚脱, 線維症 (0.1%), 出血, 浮腫, 鎮静
神経学的: 不眠症、運動失調 (0.5%)、振戦、失語症、脳症 (0.1%)、協調異常、構音障害、意識喪失 (0.2%)、バランス障害
代謝: 体重増加、悪液質 (0.4%)、高トリグリセリド血症 (0.1%)、低カリウム血症、低マグネシウム血症
目: 結膜炎
呼吸器: 咳 (0.1%)、鼻出血 (0.1%)、喘息 (0.2%)、喀血、呼吸困難 (0.1%)、呼吸困難
心臓: 頻脈 (0.1%)、徐脈、心房細動、心室性期外収縮、期外収縮、心筋炎 (0.1%)、心嚢液貯留
感染症: 喉頭炎 (1.0%)、気管支炎 (0.2%)、肺炎 (0.2%)、気管支肺炎 (0.2%)、角結膜炎、敗血症 (0.3%)、真菌感染症 (カンジダ症を含む) (0.2%)
筋骨格: 筋肉痛、骨の痛み (0.1%)、関節炎 (0.1%)、筋力低下
血液とリンパ: 白血球減少症 (0.2%)、凝固障害 (0.1%)、骨髄抑制 (0.1%)、特発性血小板減少性紫斑病 (1.0%)、汎血球減少症 (0.1%)
血管: 低血圧 (0.2%)、高血圧 (0.1%)、リンパ浮腫 (0.1%)、肺塞栓症 (0.2%)、脳血管障害 (0.1%)
精神的: うつ病、混乱 (0.1%)
腎臓: 腎障害 (0.6%)
耳: めまい
肝胆道: 肝線維症(0.1%)、肝炎(0.1%)、胆汁うっ滞性肝炎(0.1%)、肝機能検査異常
免疫系: 薬物過敏症 (0.1%)
XELODA 500mg とドセタキセルの併用 (転移性乳がん)
胃腸: イレウス (0.4%)、壊死性腸炎 (0.4%)、食道潰瘍 (0.4%)、出血性下痢 (0.8%)
神経学的: 運動失調 (0.4%)、失神 (1.2%)、味覚障害 (0.8%)、多発神経障害 (0.4%)、片頭痛 (0.4%)
心臓: 上室性頻脈 (0.4%)
感染: 好中球減少性敗血症 (2.4%)、敗血症 (0.4%)、気管支肺炎 (0.4%)
リンパ: 無顆粒球症 (0.4%)、プロトロンビン減少 (0.4%)
血管: 低血圧 (1.2%)、静脈性静脈炎および血栓性静脈炎 (0.4%)、体位性低血圧 (0.8%)
腎臓: 腎不全 (0.4%)
肝胆道: 黄疸(0.4%)、肝機能検査異常(0.4%)、肝不全(0.4%)、肝性昏睡(0.4%)、肝毒性(0.4%)
免疫系: 過敏症 (1.2%)
市販後の経験
市販後の設定で、次の有害反応が観察されています:血管浮腫、肝不全、涙管狭窄、致命的な結果を含む脱水に続発する急性腎不全[ 警告と注意事項 ]、皮膚エリテマトーデス、角膜炎を含む角膜障害、中毒性白質脳症、スティーブンス・ジョンソン症候群や中毒性表皮壊死症(TEN)などの重度の皮膚反応[参照 警告と注意事項 ]、永続的または重度の手足症候群は、最終的に指紋の喪失につながる可能性があります[参照 警告と注意事項 ]
砕いたゼローダ 500mg 錠にさらされた場合、次の副作用が報告されています: 目の刺激と腫れ、皮膚の発疹、下痢、感覚異常、頭痛、胃の刺激、嘔吐、吐き気。
薬物相互作用
薬物間相互作用
抗凝固剤
ワルファリンやフェンプロクモンなどのクマリン誘導体抗凝固剤と併用して XELODA 500mg を服用している患者では、凝固パラメーターの変化および/または出血が報告されています [ ボックス警告 ]。これらの事象は、ゼローダ 500mg の治療を開始してから数日から数か月以内に発生し、いくつかのケースでは、ゼローダを中止してから 1 か月以内に発生しました。これらのイベントは、肝転移のある患者とない患者で発生しました。単回投与ワルファリン投与による薬物相互作用研究では、S-ワルファリンの平均 AUC に有意な増加が見られました [参照 臨床薬理学 ]。観測された最大 INR 値は 91% 増加しました。この相互作用は、おそらくカペシタビンおよび/またはその代謝産物によるシトクロム P450 2C9 の阻害によるものです。
フェニトイン
XELODA 500mgを服用している患者では、フェニトインのレベルを注意深く監視する必要があり、フェニトインの用量を減らす必要がある場合があります[ 投薬と管理 ]。市販後の報告によると、ゼローダ 500mg とフェニトインを投与された一部の患者は、フェニトイン レベルの上昇に伴う毒性を示しました。フェニトインとの正式な薬物間相互作用研究は実施されていませんが、相互作用のメカニズムは、カペシタビンおよび/またはその代謝産物による CYP2C9 イソ酵素の阻害であると推定されています。
ロイコボリン
5-フルオロウラシルの濃度が上昇し、その毒性がロイコボリンによって増強される可能性があります。毎週ロイコボリンとフルオロウラシルを投与されている高齢患者では、重度の腸炎、下痢、および脱水による死亡が報告されています。
CYP2C9 基質
ワルファリン以外に、XELODA と他の CYP2C9 基質との間の正式な薬物間相互作用研究は実施されていません。 XELODA を CYP2C9 基質と併用する場合は注意が必要です。
アロプリノール
アロプリノールとの併用は、カペシタビンの活性代謝物の濃度を低下させる可能性があります [参照 臨床薬理学 ]、ゼローダの有効性が低下する可能性があります。ゼローダによる治療中は、アロプリノールの使用を避けてください。
薬と食物の相互作用
食物は、カペシタビンの吸収率と吸収度の両方を低下させることが示された [参照 臨床薬理学 ]。すべての臨床試験において、患者は食後 30 分以内に XELODA 500mg を投与するように指示されました。ゼローダは食事と一緒に投与することをお勧めします。 投薬と管理 ]。
警告
の一部として含まれています "予防" セクション
予防
凝固障害
カペシタビンと経口クマリン誘導体抗凝固療法を併用している患者は、抗凝固反応(INRまたはプロトロンビン時間)を非常に頻繁に注意深く監視し、それに応じて抗凝固薬の用量を調整する必要があります。 ボックス警告 と 薬物相互作用 ]。
下痢
ゼローダ 500mg は下痢を誘発することがあります。重度の下痢の患者は注意深く監視し、脱水状態になった場合は水分と電解質を補充する必要があります。 XELODA単独療法を受けた転移性乳癌または結腸直腸癌の患者875人において、グレード2~4の下痢が最初に発生するまでの期間の中央値は34日(範囲は1~369日)でした。グレード 3 から 4 の下痢の期間の中央値は 5 日でした。カナダ国立癌研究所 (NCIC) は、グレード 2 の下痢を 1 日あたり 4 ~ 6 回の便または夜間便の増加と定義し、グレード 3 の下痢を 1 日あたり 7 ~ 9 回の便の増加または失禁および吸収不良と定義し、グレード 4 の下痢を次のように定義しています。 1日あたり10回以上の便の増加、またはひどい血性下痢、または非経口サポートの必要性。グレード 2、3、または 4 の下痢が発生した場合は、下痢が治まるか、グレード 1 まで強度が低下するまで、XELODA の投与を直ちに中断する必要があります。 投薬と管理 ]。標準的な止瀉薬(ロペラミドなど)が推奨されます。
壊死性腸炎(チフス炎)が報告されています。
心毒性
ゼローダ 500mg で認められた心毒性には、心筋梗塞・虚血、狭心症、不整脈、心停止、心不全、突然死、心電図変化、心筋症などがあります。これらの有害反応は、冠動脈疾患の既往歴のある患者でより一般的である可能性があります。
ジヒドロピリミジン脱水素酵素欠損症
市販後の報告に基づくと、DPD 遺伝子に特定のホモ接合性または特定の複合ヘテロ接合性変異があり、DPD 活性が完全またはほぼ完全に欠如している患者は、毒性の急性早期発症および重度、生命を脅かす、または致命的な有害事象のリスクが高くなります。 XELODA による反応(例、粘膜炎、下痢、好中球減少症、神経毒性)。部分的な DPD 活動を有する患者は、XELODA によって引き起こされる重篤な、生命を脅かす、または致命的な副作用のリスクも高くなる可能性があります。
DPD 活性がほぼ完全にまたは完全に欠如している可能性がある急性早期発症または異常に重度の毒性の証拠がある患者で観察された毒性の発症、期間、および重症度の臨床的評価に基づいて、XELODA 500mg を差し控えるか、永久に中止します。 DPD 活性が完全に欠如している患者に対して安全であると証明された XELODA の用量はありません。特定の検査で測定された部分的な DPD 活性を有する患者に特定の用量を推奨するには、データが不十分です。
脱水症と腎不全
脱水症が観察されており、致命的な急性腎不全を引き起こす可能性があります。既存の腎機能が低下している患者、または既知の腎毒性物質を併用する XELODA を投与されている患者は、リスクが高くなります。食欲不振、無力症、吐き気、嘔吐、または下痢のある患者は、急速に脱水状態になることがあります。ゼローダ 500mg を投与するときは、患者をモニタリングして、発症時の脱水症状を予防および是正します。グレード 2 (またはそれ以上) の脱水が発生した場合は、XELODA 治療を直ちに中断し、脱水を修正する必要があります。治療は、患者が水分補給され、原因が修正または制御されるまで再開しないでください。必要に応じて、有害事象を誘発するために用量変更を適用する必要があります[参照 投薬と管理 ]。
ベースラインで中等度の腎機能障害がある患者には、用量の減量が必要です [参照 投薬と管理 ]。ベースラインで軽度および中等度の腎障害を有する患者は、有害反応について注意深く監視する必要があります。 [参照 投薬と管理 、 特定の集団での使用 、 と 臨床薬理学 ]。
胚・胎児毒性
動物の繁殖研究から得られた知見とその作用機序に基づいて、XELODA は妊婦に投与すると胎児に害を及ぼす可能性があります [参照 臨床薬理学 ]。限られた入手可能なデータは、妊娠中の女性における XELODA 500mg の使用を知らせるのに十分ではありません.動物の繁殖研究では、妊娠中の動物に器官形成期にカペシタビンを投与すると、推奨用量を投与された患者の暴露量 (AUC) の 0.2 倍および 0.6 倍で、マウスでは胚致死および催奇形性が、サルでは胚致死がそれぞれ引き起こされた [参照 特定の集団での使用 ]。妊娠中の女性には、胎児への潜在的なリスクを知らせてください。治療中および XELODA の最終投与後 6 か月間は、生殖能力のある女性に効果的な避妊法を使用するようにアドバイスします。 特定の集団での使用 ]。
皮膚粘膜および皮膚毒性
スティーブンス・ジョンソン症候群や中毒性表皮壊死症(TEN)などの致命的な結果を伴う重度の皮膚粘膜反応は、ゼローダで治療された患者に発生する可能性があります。 有害反応 ]。ゼローダ治療に起因すると考えられる重度の皮膚粘膜反応を経験した患者では、ゼローダ 500mg を永久に中止する必要があります。
手足症候群 (手掌足底発赤知覚不全または化学療法誘発先端部紅斑) は、皮膚毒性です。発症までの期間の中央値は79日(11日から360日の範囲)で、転移性設定でXELODA 500mgの単剤療法を受けた患者の重症度範囲はグレード1から3でした。グレード 1 は、次のいずれかによって特徴付けられます: しびれ、感覚異常/感覚異常、ヒリヒリ感、痛みのない手および/または足の腫れまたは紅斑、および/または通常の活動を妨げない不快感。グレード 2 の手足症候群は、手や足の痛みを伴う紅斑や腫れ、および/または患者の日常生活に影響を与える不快感として定義されます。グレード 3 の手足症候群は、湿性落屑、潰瘍、水ぶくれ、または手や足の重度の痛み、および/または患者が仕事や日常生活の活動を行うことができなくなる重度の不快感として定義されます。持続性または重度の手足症候群 (グレード 2 以上) は、最終的に指紋の喪失につながり、患者の識別に影響を与える可能性があります。グレード 2 または 3 の手足症候群が発生した場合、事象が解消するか、グレード 1 に強度が低下するまで、ゼローダの投与を中断する必要があります。見る 投薬と管理 ]。
高ビリルビン血症
転移性乳癌または結腸直腸癌の患者 875 例で、XELODA 1250 mg/m2 を 1 日 2 回、単剤療法として 2 週間以上投与された後、1 週間の休薬期間が設けられ、グレード 3 (1.5-3 x ULN) の高ビリルビン血症が発生しました。患者の 15.2% (n=133) とグレード 4 (>3 x ULN) の高ビリルビン血症が患者の 3.9% (n=34) で発生しました。ベースラインで肝転移があった 566 人の患者とベースラインで肝転移がなかった 309 人の患者のうち、グレード 3 または 4 の高ビリルビン血症がそれぞれ 22.8% と 12.3% で発生しました。グレード 3 または 4 の高ビリルビン血症の 167 人の患者のうち、18.6% (n=31) はアルカリホスファターゼのベースライン後の上昇 (グレード 1 から 4、ベースラインでの上昇なし) もあり、27.5% (n=46) はベースライン後のトランスアミナーゼの上昇がありました。いつでも(必ずしも同時である必要はありません)。これらの患者の大部分である 64.5% (n=20) と 71.7% (n=33) は、ベースラインで肝転移を持っていました。さらに、167 人の患者の 57.5% (n=96) および 35.3% (n=59) が、ベースライン前およびベースライン後の両方で、それぞれアルカリホスファターゼまたはトランスアミナーゼの上昇 (グレード 1 ~ 4) を示しました。 7.8% (n=13) と 3.0% (n=5) のみが、アルカリホスファターゼまたはトランスアミナーゼのグレード 3 または 4 の上昇を示しました。
転移性結腸直腸癌の第一選択療法としてゼローダ 500mg で治療された 596 人の患者において、グレード 3 または 4 の高ビリルビン血症の発生率は、ゼローダ 500mg 単剤療法の全体的な臨床試験安全性データベースと同様でした。結腸直腸がん集団におけるグレード 3 または 4 の高ビリルビン血症の発症までの時間の中央値は 64 日で、総ビリルビンの中央値はベースラインの 8 μm/L から XELODA による治療中に 13 μm/L に増加しました。グレード 3 または 4 の高ビリルビン血症を有する 136 人の結腸直腸癌患者のうち、49 人の患者は最後の測定値としてグレード 3 または 4 の高ビリルビン血症を有し、そのうち 46 人はベースラインで肝転移を有していました。
XELODA 500mg とドセタキセルの併用療法を受けた転移性乳がん患者 251 人では、グレード 3 (1.5 ~ 3 x ULN) の高ビリルビン血症が 7% (n=17) で発生し、グレード 4 (>3 x ULN) の高ビリルビン血症が 2% で発生しました。 (n=5)。
薬物関連のビリルビンのグレード 3 ~ 4 の上昇が発生した場合、高ビリルビン血症が 3.0 X ULN 以下に低下するまで、XELODA 500mg の投与を直ちに中断する必要があります [以下の推奨される用量変更を参照してください。 投薬と管理 ]。
血液学
転移性乳癌または結腸直腸癌の患者 875 人で、単剤療法として 1250 mg/m2 の用量を 1 日 2 回、2 週間投与した後、1 週間の休薬期間を設けたところ、患者の 3.2%、1.7%、および 2.4% がグレード 3 でした。または 4 好中球減少症、血小板減少症またはヘモグロビンの減少。 XELODA とドセタキセルの併用投与を受けた転移性乳癌患者 251 人では、68% がグレード 3 または 4 の好中球減少症、2.8% がグレード 3 または 4 の血小板減少症、9.6% がグレード 3 または 4 の貧血でした。
ベースラインの好中球数が 1.5 x 109/L 未満および/または血小板数が 100 x 109/L 未満の患者は、ゼローダで治療すべきではありません。治療サイクル中の予定外の臨床検査でグレード 3 または 4 の血液毒性が示された場合、XELODA による治療を中断する必要があります。
高齢患者
80 歳以上の患者は、グレード 3 または 4 の副作用の発生率が高くなる可能性があります。ゼローダ 500mg の単剤療法を受けた転移性乳癌または結腸直腸癌の患者 875 人において、ゼローダ 500mg で治療された 80 歳以上の 21 人の患者の 62% が治療に関連したグレード 3 または 4 の有害事象を経験しました。 、吐き気3人(14.3%)、手足症候群3人(14.3%)、嘔吐2人(9.5%)。ゼローダ 500mg とドセタキセルの併用療法を受けた 70 歳以上の 10 人の患者 (80 歳以上の患者はいなかった) のうち、30% (10 人中 3 人) の患者がグレード 3 または 4 の下痢と口内炎を経験し、40 人が% (10 人中 4 人) がグレード 3 の手足症候群を経験しました。
ゼローダとドセタキセルの併用療法を受けている 60 歳以上の患者 67 例のうち、グレード 3 または 4 の治療関連副作用、治療関連の重篤な副作用、副作用による中止、副作用による治療中止および治療の発生率最初の 2 回の治療サイクルでの中止は、60 歳未満の患者グループよりも高かった。
原発腫瘍の切除後にデュークス C 結腸癌の補助療法として XELODA を投与された 995 人の患者では、XELODA で治療された 65 歳以上の 398 人の患者の 41% が治療に関連したグレード 3 または 4 の有害事象を経験しました。 - 足症候群 75 例 (18.8%)、下痢 52 例 (13.1%)、口内炎 12 例 (3.0%)、好中球減少症/顆粒球減少症 11 例 (2.8%)、嘔吐 6 例 (1.5%)、吐き気 5 例 (1.3%) %) 忍耐。原発腫瘍の切除後にデュークス C 結腸癌の治療を受けた 65 歳以上の患者(すべて無作為化集団;カペシタビン 188 例、5-FU/LV 208 例)では、無病生存率と全生存率のハザード比XELODA は 5-FU/LV と比較して、それぞれ 1.01 (95% CI 0.80 – 1.27) および 1.04 (95% CI 0.79 – 1.37) でした。
肝不全
肝転移による軽度から中等度の肝機能障害のある患者は、XELODA を投与する際に注意深く監視する必要があります。重度の肝機能障害がゼローダの性質に及ぼす影響は知られていない[参照 特定の集団での使用 と 臨床薬理学 ]。
他の薬との併用
XELODA とイリノテカンの併用については十分に検討されていません。
患者相談情報
患者に、FDA 承認の患者ラベル ( 患者情報 )。
下痢
グレード 2 の下痢 (1 日あたり 4 ~ 6 回の便または夜間の便の増加) またはそれ以上の下痢を経験している患者、または激しい腹痛と発熱を伴う重度の血性下痢を経験している患者には、XELODA の使用を中止するように伝えてください。下痢を管理するための止瀉薬(ロペラミドなど)の使用について患者に助言する[ 警告と注意事項 ]。
心毒性
患者に心毒性のリスクがあることを伝え、胸の痛み、息切れ、めまい、立ちくらみが新たに発生した場合は、すぐに医療提供者に連絡するか、緊急治療室に行くようにアドバイスします [参照 警告と注意事項 ]。
ジヒドロピリミジン脱水素酵素欠損症
既知のDPD欠乏症がある場合は、医療提供者に通知するよう患者にアドバイスしてください。 DPD 活性が完全またはほぼ完全に欠如している場合は、XELODA による毒性の急性早期発症および重篤、生命を脅かす、または致命的な有害反応(例、粘膜炎、下痢、好中球減少症、および神経毒性) [参照 警告と注意事項 ]。
脱水症と腎不全
グレード 2 以上の脱水症状(24 時間未満の輸液が必要)の患者には、ゼローダ 500mg の服用を直ちに中止し、医療提供者に連絡して脱水症状を改善するように指示してください。患者には、水分を補給し、原因が改善または制御されるまで、ゼローダ 500mg を再開しないようにアドバイスしてください。 警告と注意事項 ]。
重要な管理手順
ゼローダ 500mg 錠は、食事後 30 分以内に水と一緒に飲み込むように患者に助言してください。ゼローダ錠をつぶしたり切ったりしないように、患者と介護者に助言してください。ゼローダ錠を丸ごと飲み込めない場合は、医療提供者に知らせるように患者に助言する [参照 投薬と管理 ]。
過敏症と血管性浮腫
XELODA が重度の過敏反応および血管性浮腫を引き起こす可能性があることを患者に助言してください。カペシタビンまたは 5-フルオロウラシルに対する過敏症があることがわかっている患者には、担当の医療提供者に知らせるようにアドバイスします [参照 禁忌 ]。過敏症反応または粘膜皮膚症状(蕁麻疹、発疹、紅斑、かゆみ、顔面、唇、舌または喉の腫れにより、飲み込みや呼吸が困難になるなど)を発症した患者には、ゼローダの使用を中止し、直ちに医療提供者に連絡するよう指示してください。または緊急治療室に行きます。 [見る 有害反応 ]。
吐き気
グレード 2 の吐き気(食物摂取量が大幅に減少したが、断続的に食べることができる)以上の患者には、ゼローダ 500mg の服用を直ちに中止し、吐き気の管理について医療提供者に連絡するように指示します。 有害反応 ]。

嘔吐
グレード 2 (24 時間に 2 ~ 5 回) 以上の嘔吐を経験している患者には、ゼローダの服用を直ちに中止し、嘔吐の管理について医療提供者に連絡するように指示します。 有害反応 ]。
手足症候群
グレード2の手足症候群(手や足の痛みを伴う紅斑と腫れ、および/または患者の日常生活に影響を与える不快感)以上の患者には、ゼローダ500mgの服用を直ちに中止し、医療提供者に連絡するように指示してください。 .対症療法の開始が推奨されること、および手足症候群は個人識別に影響を与える可能性のある指紋の喪失につながる可能性があることを患者に知らせます[ 有害反応 ]。
口内炎
グレード 2 の口内炎(口または舌の痛みを伴う紅斑、浮腫または潰瘍であるが、食べることはできる)またはそれ以上の患者には、ゼローダの服用を直ちに中止し、担当の医療提供者に連絡するように伝えてください。 有害反応 ]。
発熱と好中球減少症
100.5°F 以上の発熱、または感染の可能性があるその他の兆候が見られた患者には、医療提供者に連絡するよう伝えます [参照 有害反応 ]。
胚・胎児毒性
妊娠の可能性がある女性には、胎児への潜在的なリスクについて説明し、ゼローダ 500mg の投与中および最終投与後 6 か月間は効果的な避妊法を使用するようにアドバイスしてください。妊娠が判明している、または妊娠の疑いがあることを医療提供者に知らせるように女性に助言する[参照 警告と注意事項 、 特定の集団での使用 ]。
生殖能力のある女性パートナーを持つ男性患者には、XELODA 500mg による治療中および最終投与後 3 か月間は効果的な避妊法を使用するようにアドバイスしてください。 特定の集団での使用 ]。
授乳
ゼローダ 500mg の投与中および最終投与後 2 週間は、授乳しないよう女性に助言する [ 特定の集団での使用 ]。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
カペシタビンの発がん性を調査する適切な研究は実施されていません。カペシタビンは、in vitro で細菌 (Ames 試験) または哺乳動物細胞 (チャイニーズハムスター V79/HPRT 遺伝子変異アッセイ) に対して変異原性を示さなかった。カペシタビンは、in vitro でヒト末梢血リンパ球に対して染色体異常誘発性でしたが、in vivo でマウス骨髄に対して染色体異常誘発性ではありませんでした (小核試験)。フルオロウラシルは細菌や酵母に突然変異を引き起こします。フルオロウラシルは、in vivo でのマウス小核試験でも染色体異常を引き起こします。
雌マウスの受胎能および一般的な生殖能力に関する研究では、760 mg/kg/日 (約 2300 mg/m2/日) の経口カペシタビン投与で発情が妨げられ、その結果、受胎能が低下しました。妊娠したマウスでは、この用量で生き残った胎児はいませんでした。発情の乱れは可逆的であった。男性では、この用量は、精母細胞および精子細胞の数の減少を含む、精巣の変性変化を引き起こしました。別の薬物動態研究では、マウスにおけるこの用量は、推奨される 1 日用量を投与された患者の対応する値の約 0.7 倍の 5'-DFUR AUC 値をもたらしました。
特定の集団での使用
妊娠
リスクの概要
動物の繁殖研究の結果とその作用機序に基づいて、XELODA 500mg は妊婦に投与すると胎児に害を及ぼす可能性があります [参照 臨床薬理学 ]。限られた利用可能な人間のデータは、妊娠中の薬物関連のリスクを知らせるのに十分ではありません.動物の繁殖研究では、器官形成期の妊娠中の動物にカペシタビンを投与すると、マウスでは胚致死性と催奇形性が、サルでは推奨用量を投与された患者の暴露量 (AUC) の 0.2 倍と 0.6 倍で胚致死性がそれぞれ引き起こされた [参照 データ ]。妊娠中の女性には、胎児への潜在的なリスクを知らせてください。
示された集団の主要な先天性欠損症および流産の推定背景リスクは不明です。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2 ~ 4% および 15 ~ 20% です。
データ
動物データ
器官形成期の妊娠中のマウスに 198 mg/kg/日の用量でカペシタビンを経口投与すると、奇形と胚致死が引き起こされました。別の薬物動態研究では、マウスでのこの用量は、推奨される 1 日用量を投与された患者の AUC 値の約 0.2 倍の 5'-DFUR AUC 値を示しました。マウスの奇形には、口蓋裂、無眼球症、小眼球症、乏指症、多指症、合指症、ねじれた尾、および脳室の拡張が含まれていました。器官形成期の妊娠中のサルに 90 mg/kg/日の用量でカペシタビンを経口投与すると、胎児が死亡した。この用量は、推奨される 1 日用量を投与された患者の AUC 値の約 0.6 倍の 5'-DFUR AUC 値をもたらしました。
授乳
リスクの概要
母乳中のカペシタビンの存在、または母乳生産または母乳で育てられた乳児への影響に関する情報はありません。カペシタビンの代謝産物は、授乳中のマウスの乳汁中に存在していた [参照 データ ]。母乳育児中の乳児がカペシタビンに曝露すると深刻な副作用が生じる可能性があるため、ゼローダ 500mg の投与中および最終投与後 2 週間は授乳しないよう女性に助言してください。
データ
カペシタビンを単回経口投与された授乳中のマウスは、かなりの量のカペシタビン代謝産物を乳汁中に排泄しました。
生殖能力のある雌と雄
妊娠検査
XELODA を開始する前に、生殖能力のある女性には妊娠検査が推奨されます。
避妊
女性
ゼローダ 500mg を妊婦に投与すると、胎児に害を及ぼす可能性があります。 妊娠 ]。生殖能力のある女性には、治療中および XELODA の最終投与後 6 か月間は効果的な避妊法を使用するようにアドバイスしてください。
男性
遺伝毒性の所見に基づいて、生殖能力のある女性パートナーを持つ男性患者には、治療中および XELODA の最終投与後 3 か月間は効果的な避妊法を使用するようにアドバイスします [ 非臨床毒性学 ]。
不妊
動物実験に基づくと、XELODA は生殖能力のある雌雄の生殖能力を損なう可能性があります。 非臨床毒性学 ]。
小児用
小児患者におけるゼローダの安全性と有効性は確立されていません。新たに診断された脳幹神経膠腫および高悪性度神経膠腫の小児患者を対象とした 2 つの単群試験では、臨床的利益は示されませんでした。両方の試験で、小児患者は、放射線療法(180 cGy 分割で 5580 cGy の総線量)と同時に、および放射線療法の完了後にカペシタビンの治験用小児製剤を投与されました。ゼローダ 500 mg に対する治験薬の相対的バイオアベイラビリティは同様でした。
最初の試験は、新たに診断された非播種性内因性びまん性脳幹神経膠腫および高悪性度神経膠腫を有する 22 人の小児患者 (年齢中央値 8 歳、範囲 5 ~ 17 歳) で実施されました。試験の用量設定部分では、患者はカペシタビンと放射線療法を併用し、12 時間ごとに 500 mg/m2 から 850 mg/m2 の範囲の用量で最大 9 週間投与されました。 2 週間の休憩の後、患者は 21 日サイクルの 1 日目から 14 日目に 12 時間ごとに 1250 mg/m2 のカペシタビンを 3 サイクルまで投与されました。放射線療法と同時に投与されたカペシタビンの最大耐量 (MTD) は、12 時間ごとに 650 mg/m2 でした。主な用量制限毒性は、手掌足底発赤知覚不全およびアラニンアミノトランスフェラーゼ (ALT) 上昇でした。
番目の試験は、新たに診断された非播種性内在性びまん性脳幹グリオーマ (年齢の中央値 7 歳、範囲 3 ~ 16 歳) を有する 34 人の追加の小児患者と、用量設定試験でカペシタビンの MTD を受け、条件を満たした 10 人の小児患者で実施されました。この試験の適格基準。すべての患者は、12 時間ごとに 650 mg/m2 のカペシタビンと、最大 9 週間の放射線療法を受けました。 2 週間の休憩の後、患者は 21 日サイクルの 1 日目から 14 日目に 12 時間ごとに 1250 mg/m2 のカペシタビンを 3 サイクルまで投与されました。
他の臨床試験に参加した同様の小児患者集団と比較して、カペシタビンを投与された内因性脳幹グリオーマと新たに診断された小児患者の 1 年無増悪生存率および 1 年全生存率に改善はありませんでした。
カペシタビンの有害反応プロファイルは、小児患者でより一般的に発生する臨床検査値異常を除いて、成人における既知の有害反応プロファイルと一致していました。最も頻繁に報告された臨床検査値異常 (患者あたりの発生率 ≥40%) は、ALT の増加 (75%)、リンパ球減少症 (73%)、白血球減少症 (73%)、低カリウム血症 (68%)、血小板減少症 (57%)、低アルブミン血症 (55%) でした。 %)、好中球減少症 (50%)、低ヘマトクリット (50%)、低カルシウム血症 (48%)、低リン血症 (45%)、低ナトリウム血症 (45%)。
高齢者の使用
医師は、高齢者におけるゼローダ 500mg の副作用の監視に特に注意を払う必要があります。 警告と注意事項 ]。
肝不全
肝転移による軽度から中等度の肝機能障害のある患者が XELODA で治療される場合は注意が必要です。ゼローダに対する重度の肝機能障害の影響は知られていない[参照 警告と注意事項 と 臨床薬理学 ]。
腎不全
中等度 (クレアチニン クリアランス = 30 ~ 50 mL/分) および重度 (クレアチニン クリアランス 禁忌 、 警告と注意事項 、 投薬と管理 、 と 臨床薬理学 ]。
過剰摂取
急性過剰摂取の症状には、吐き気、嘔吐、下痢、胃腸の刺激と出血、および骨髄抑制が含まれます.過剰摂取の医学的管理には、現在の臨床症状を是正することを目的とした慣習的な支持的医学的介入を含める必要があります。ゼローダ 500mg の過剰摂取の治療として透析を使用した臨床経験は報告されていませんが、透析は、親化合物の低分子量代謝産物である 5'-DFUR の循環濃度を低下させるのに役立つ可能性があります。
ゼローダ 500mg の単回投与は、最大 2000mg/kg の用量でマウス、ラット、およびサルに対して致死的ではありませんでした (mg/m2 ベースで推奨されるヒトの 1 日用量の 2.4、4.8、および 9.6 倍)。
禁忌
重度の腎障害
XELODA は、重度の腎機能障害 (クレアチニンクリアランスが 30 mL/分未満 [Cockroft and Gault]) の患者には禁忌です [参照 特定の集団での使用 と 臨床薬理学 ]。
過敏症
XELODA 500mg は、カペシタビンまたはその成分に対する過敏症が知られている患者には禁忌です。 XELODA は、5 フルオロウラシルに対する既知の過敏症を有する患者には禁忌です。
臨床薬理学
作用機序
酵素は、生体内でカペシタビンを 5-フルオロウラシル (5-FU) に変換します。正常細胞と腫瘍細胞の両方が、5-FU を 5-フルオロ-2'-デオキシウリジン一リン酸 (FdUMP) と 5-フルオロウリジン三リン酸 (FUTP) に代謝します。これらの代謝物は、2 つの異なるメカニズムによって細胞傷害を引き起こします。まず、FdUMP と葉酸補助因子である N5-10-メチレンテトラヒドロ葉酸がチミジル酸シンターゼ (TS) に結合して、共有結合した三元複合体を形成します。この結合は、2'-デオキシウリジル酸からのチミジル酸の形成を阻害します。チミジル酸は、DNA の合成に不可欠なチミジン三リン酸の必須前駆体であるため、この化合物が欠乏すると細胞分裂が阻害される可能性があります。第二に、核転写酵素は、RNA の合成中にウリジン三リン酸 (UTP) の代わりに FUTP を誤って組み込む可能性があります。この代謝エラーは、RNA プロセッシングとタンパク質合成を妨げる可能性があります。
薬物動態
吸収
がん患者に 1255 mg/m2 BID を経口投与した後、カペシタビンは約 1.5 時間 (Tmax) で血中濃度のピークに達し、5-FU 濃度のピークはわずか 2 時間後でした。食物はカペシタビンの吸収速度と吸収範囲の両方を減少させ、平均 Cmax と AUC0-∞ はそれぞれ 60% と 35% 減少しました。 5-FU の Cmax と AUC0-∞ も、食事によってそれぞれ 43% と 21% 減少しました。食物は、親と 5-FU の両方の Tmax を 1.5 時間遅らせた [参照 警告と注意事項 、 投薬と管理 、 と 薬と食物の相互作用 ]。
ゼローダ 500mg とその代謝物の薬物動態は、約 200 人の癌患者で 500 ~ 3500 mg/m2/日の用量範囲で評価されています。この範囲で、XELODA とその代謝物である 5'-DFCR の薬物動態は用量に比例し、経時的に変化しませんでした。しかし、5'-DFUR と 5-FU の AUC の増加は、用量の増加に比例するよりも大きく、5-FU の AUC は 14 日目で 1 日目よりも 34% 高かった。 5-FU の Cmax と AUC は 85% を超えていました。
分布
カペシタビンとその代謝物の血漿タンパク質結合は 60% 未満であり、濃度依存性ではありません。カペシタビンは、主にヒトアルブミンに結合していました (約 35%)。 XELODA 500mg は、血漿タンパク質結合に関連する薬物動態学的相互作用の可能性が低いです。
生物活性化と代謝
カペシタビンは、酵素によって 5-FU に広範囲に代謝されます。肝臓では、60 kDa のカルボキシルエステラーゼが化合物の多くを 5'-デオキシ-5-フルオロシチジン (5'-DFCR) に加水分解します。腫瘍を含むほとんどの組織に見られる酵素であるシチジンデアミナーゼは、続いて 5'-DFCR を 5'-DFUR に変換します。酵素、チミジン ホスホリラーゼ (dThdPase) は、5'DFUR を活性薬物 5-FU に加水分解します。全身の多くの組織がチミジンホスホリラーゼを発現しています。一部のヒト癌腫は、この酵素を周囲の正常組織よりも高濃度で発現します。結腸直腸癌患者の手術の 7 日前に XELODA を経口投与した後、結腸直腸腫瘍と隣接組織の 5-FU 濃度の比率の中央値は 2.9 (0.9 から 8.0 の範囲) でした。これらの比率は、乳がん患者で評価されておらず、5-FU 注入と比較されていません。
カペシタビンから 5-FU への代謝経路
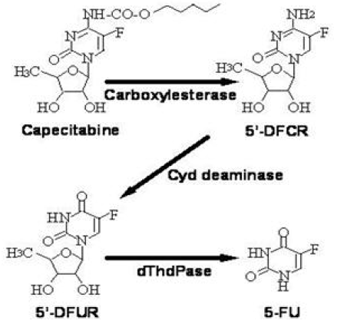
酵素ジヒドロピリミジン脱水素酵素は、カペシタビン代謝の産物である 5-FU を、はるかに毒性の低い 5-フルオロ-5, 6-ジヒドロ-フルオロウラシル (FUH2) に水素化します。ジヒドロピリミジナーゼはピリミジン環を切断して、5-フルオロ-ウレイド-プロピオン酸 (FUPA) を生成します。最後に、β-ウレイド-プロピオナーゼが FUPA を切断してα-フルオロ-β-アラニン (FBAL) にし、尿中に排出されます。
ヒト肝ミクロソームを用いた in vitro 酵素研究では、カペシタビンとその代謝産物 (5'-DFUR、5'-DFCR、5-FU、および FBAL) は、シトクロム P450 アイソザイム 1A2、2A6、3A4 による試験基質の代謝を阻害しないことが示されました。 2C19、2D6、および 2E1。
排泄
カペシタビンとその代謝物は主に尿中に排泄されます。投与されたカペシタビン用量の 95.5% が尿中に回収されます。糞便排泄は最小限です (2.6%)。尿中に排泄される主な代謝物は FBAL で、これは投与量の 57% に相当します。投与量の約3%が未変化体として尿中に排泄されます。親カペシタビンと 5-FU の両方の消失半減期は約 0.75 時間でした。
カペシタビンの薬物動態に対する年齢、性別、人種の影響
ゼローダ 500mg を 1,250mg/m2 で 1 日 2 回投与された転移性結腸直腸癌患者 (n=505) を対象とした 2 つの大規模な対照研究からプールされたデータの母集団分析では、性別 (女性 202 人、男性 303 人) および人種 (455 人) が示されました。白人/白人患者、22 人の黒人患者、および 28 人の他の人種の患者) は、5'DFUR、5-FU、および FBAL の薬物動態に影響を与えません。年齢は、27 ~ 86 歳の範囲で 5'-DFUR および 5-FU の薬物動態に大きな影響を与えません。年齢が 20% 増加すると、FBAL の AUC が 15% 増加します [ 警告と注意事項 と 投薬と管理 ]。
825 mg/m2 のカペシタビンを 1 日 2 回 14 日間経口投与した後、日本人患者 (n=18) は白人患者 (n=22) よりもカペシタビンの Cmax が約 36% 低く、AUC が 24% 低かった。また、日本人患者は、白人患者よりも FBAL の Cmax が約 25% 低く、AUC が 34% 低かった。これらの違いの臨床的意義は不明です。他の代謝物 (5'-DFCR、5'-DFUR、および 5FU) への暴露に有意差は発生しませんでした。
肝不全の影響
XELODA は、1255 mg/m2 の XELODA を単回投与した後、ビリルビン、AST/ALT、およびアルカリホスファターゼを含む複合スコアによって定義される肝転移による軽度から中等度の肝機能障害を有する 13 人の患者で評価されています。カペシタビンの AUC0-∞ と Cmax の両方が、肝機能が正常な患者と比較して、肝機能障害のある患者で 60% 増加しました (n=14)。 5-FU の AUC0-∞ および Cmax は影響を受けませんでした。肝転移による軽度から中等度の肝機能障害のある患者へのゼローダ500mgの投与には注意が必要です。重度の肝機能障害がゼローダ 500mg に及ぼす影響は不明です [ 警告と注意事項 と 特別な集団での使用 ]。
腎不全の影響
腎機能障害の程度がさまざまながん患者に 1250 mg/m2 のカペシタビンを 1 日 2 回経口投与した後、中等度 (クレアチニン クリアランス = 30 ~ 50 mL/分) および重度 (クレアチニン クリアランス 80mL/分)。 5'-DFUR への全身曝露は、正常な患者よりも中等度および重度の腎障害患者で、それぞれ 42% および 71% 大きかった。カペシタビンへの全身曝露は、中等度および重度の腎障害患者の両方で約 25% 多かった [参照 投薬と管理 、 禁忌 、 警告と注意事項 、 と 特別な集団での使用 ]。
ワルファリンの薬物動態に対するカペシタビンの効果
がん患者 4 人において、ワルファリン 20 mg 単回投与によるカペシタビン (1,250 mg/m2 入札) の慢性投与により、S-ワルファリンの平均 AUC が 57% 増加し、クリアランスが 37% 減少しました。これら 4 人の患者の INR のベースライン補正 AUC は 2.8 倍増加し、観察された最大平均 INR 値は 91% 増加しました [参照 ボックス警告 と 薬物相互作用 ]。
カペシタビンの薬物動態に対する制酸剤の効果
水酸化アルミニウムと水酸化マグネシウムを含む制酸剤であるマーロックス® (20 mL) を XELODA (1250 mg/m2、n=12 がん患者) の直後に投与すると、AUC と Cmax はそれぞれ 16% と 35% 増加しました。カペシタビンでは、5'-DFCR ではそれぞれ 18% と 22% です。 XELODA の他の 3 つの主要な代謝物 (5'-DFUR、5-FU、FBAL) には影響は見られませんでした。
カペシタビンに対するアロプリノールの効果
公開された文献では、アロプリノールとの併用により、カペシタビンから活性代謝物である FdUMP および FUTP への変換が減少する可能性があることが報告されています。ただし、臨床的意義は完全には特徴付けられていませんでした。
ドセタキセルの薬物動態に対するカペシタビンの効果とその逆
第 1 相研究では、ドセタキセル (Taxotere®) の薬物動態に対する XELODA の効果が評価され、XELODA の薬物動態に対するドセタキセルの効果は、26 人の固形腫瘍患者で実施されました。 XELODA はドセタキセルの薬物動態 (Cmax および AUC) に影響を与えず、ドセタキセルはカペシタビンおよび 5-FU 前駆体 5'-DFUR の薬物動態に影響を与えません。
臨床研究
補助結腸がん
デュークス C 結腸癌(X-ACT)患者を対象とした多施設無作為対照第 3 相臨床試験では、結腸癌患者の補助療法における XELODA の使用に関するデータが提供されました。この研究の主な目的は、XELODA を投与された患者と IV 5-FU/LV のみを投与された患者の無病生存期間 (DFS) を比較することでした。この試験では、1987 人の患者が XELODA 1250 mg/m2 の経口投与を 1 日 2 回、2 週間行った後、1 週間の休薬期間を 3 週間のサイクルとして合計 8 サイクル (24 週間) 投与するか、IV 投与するかのいずれかに無作為に割り付けられました。ボーラス 5-FU 425 mg/m2 および 20 mg/m2 ロイコボリンを 1 ~ 5 日目に静注、4 週間サイクルで合計 6 サイクル (24 週間)。この研究の患者は、18歳から75歳までで、組織学的に確認されたデュークス病期Cの結腸癌で、少なくとも1つのリンパ節陽性であり、(無作為化前の8週間以内に)原発腫瘍の完全切除を受けている必要がありました。残存腫瘍の肉眼的または顕微鏡的証拠がない。患者はまた、以前に細胞傷害性化学療法または免疫療法(ステロイドを除く)を受けておらず、ECOGパフォーマンスステータスが0または1(KPS≧70%)、ANC≧1.5x109 / L、血小板≧100x109 / L、血清クレアチニン≦である必要がありました。 -1.5 ULN、総ビリルビン≤1.5 ULN、AST/ALT ≤ 2.5 ULN、および無作為化時の正常範囲内の CEA。
XELODA および 5-FU/LV 患者のベースラインの人口統計を表 10 に示します。ベースラインの特性は、アーム間でバランスが取れていました。
正常な腎機能または軽度の腎機能障害を持つすべての患者は、1250 mg/m2 の完全な開始用量で 1 日 2 回経口で治療を開始しました。ベースラインで中等度の腎機能障害 (計算されたクレアチニンクリアランス 30 ~ 50 mL/分) を有する患者では、開始用量が減量された [ 投薬と管理 ]。その後、すべての患者について、毒性に応じて必要に応じて用量が調整されました。 XELODA 500mg の用量管理には、用量の減少、サイクルの遅延、および治療の中断が含まれていました (表 11 を参照)。
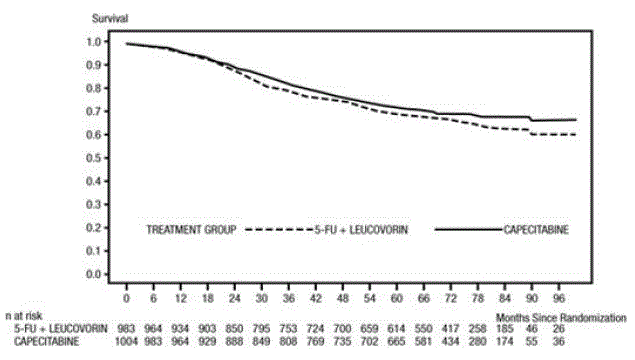
分析時の追跡期間の中央値は 83 か月 (6.9 年) でした。 5-FU/LV と比較した XELODA 500mg の DFS のハザード比は 0.88 (95% CI 0.77 – 1.01) でした (および 図1 )。ハザード比の両側 95% 信頼限界の上限が 1.20 未満であるため、XELODA は 5-FU/LV に対して非劣性でした。 1.20 という非劣性マージンの選択は、DFS に対する 5-FU/LV 効果の約 75% の保持に相当します。全生存率に関して、5-FU/LV と比較した XELODA のハザード比は 0.86 (95% CI 0.74 – 1.01) でした。 5 年全生存率はゼローダで 71.4%、5-FU/LV で 68.4% でした (図 2 参照)。
図 1 無病生存率の Kaplan-Meier 推定値 (すべて無作為化された集団)a
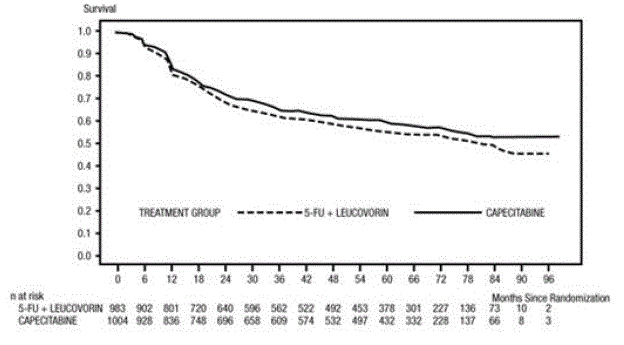
図 2 全生存率のカプラン・マイヤー推定 (すべて無作為化された母集団)
転移性結腸直腸がん
全般的
ゼローダ 500mg の推奨用量は、カペシタビンの継続投与 (1,331 mg/m2/日、2 回の分割投与、n=39)、カペシタビンの間欠投与 ( 2510 mg/m2/日を 2 回に分けて投与、n=34)、経口ロイコボリン (LV) と組み合わせたカペシタビンによる断続的治療 (カペシタビン 1,657 mg/m2/日を 2 回に分けて投与、n=35; ロイコボリン 60 mg/日)日) 第一選択の転移設定における進行および/または転移性結腸直腸癌の患者。 XELODA にロイコボリンを追加しても奏効率に明らかな利点はありませんでした。ただし、毒性が増加しました。 XELODA 1250 mg/m2 を 1 日 2 回 14 日間投与し、その後 1 週間休薬することは、研究された 3 つのスケジュールの全体的な安全性と有効性プロファイルに基づいて、さらなる臨床開発のために選択されました。
単剤療法
1,207 人の患者を対象とした 2 つの非盲検多施設無作為化比較臨床試験のデータは、転移性結腸直腸癌患者の第一選択治療における XELODA の使用を支持しています。 2 つの臨床研究はデザインが同一で、異なる国の 120 のセンターで実施されました。研究 1 は、米国、カナダ、メキシコ、およびブラジルで実施されました。研究 2 は、ヨーロッパ、イスラエル、オーストラリア、ニュージーランド、および台湾で実施されました。全体として、両方の試験で、603 人の患者が無作為に 1250 mg/m2 の用量で XELODA 500 mg を 1 日 2 回 2 週間投与され、その後 1 週間の休薬期間が設けられ、3 週間のサイクルで投与されました。 604 人の患者が無作為に 5-FU とロイコボリン (20 mg/m2 ロイコボリン IV に続いて 425 mg/m2 IV ボーラス 5-FU、1 日目から 5 日目、28 日ごと) による治療に割り付けられました。
両方の試験で、全生存期間、進行までの時間、奏効率(完全奏効と部分奏効)が評価されました。回答は世界保健機関の基準によって定義され、盲検化された独立審査委員会 (IRC) に提出されました。治験責任医師と IRC の間の評価の違いは、指定されたアルゴリズムに従って、治験依頼者が治療群を知らずに調整しました。生存率は、非劣性分析に基づいて評価されました。
XELODA および 5-FU/LV 患者のベースライン人口統計を表 13 に示します。
2 つの第 3 相試験の有効性エンドポイントを および に示します。
図 3 プールされたデータの全生存率のカプラン・マイヤー曲線 (研究 1 および 2)
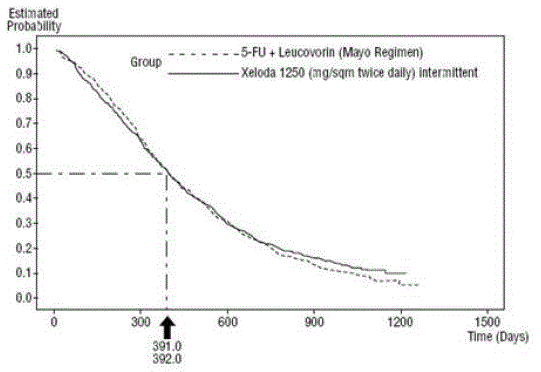
XELODA は、研究 1 および研究 2 の客観的奏効率において 5-FU/LV よりも優れていました。これらの研究における XELODA 500mg と 5-FU/LV の類似性は、2 つの治療間の潜在的な違いを調べることによって評価されました。ゼローダ 500mg が臨床的に意味のある生存効果を有することを保証するために、ゼローダによって保持された 5-FU/LV の生存効果の割合を決定するために統計分析が行われました。 5-FU/LV の生存効果の推定値は、これらの研究で使用された対照群と同様の 5-FU/LV のレジメンと 5-FU を比較した、公開された文献からの 10 の無作為化研究のメタ分析から導き出されました。 1 と 2. 治療を比較する方法は、5-FU/LV と XELODA 500mg の差について最悪のケース (95% 信頼上限) を調べ、5-FU/LV の 50% 以上の損失を示すことでした。 FU/LV 生存効果は除外されました。維持された 5-FU/LV の生存効果のパーセントは、研究 2 で少なくとも 61%、研究 1 で 10% であることが実証されました。プールされた結果は、5 の効果の少なくとも 50% の保持と一致しています。 -FU/LV.保存された効果のこれらの値は、5-FU/LV と XELODA 500mg の差の上限に基づいていることに注意してください。これらの結果は、ゼローダ 500mg が 5-FU/LV と真に同等である可能性を排除するものではありません (および 図 3 )。
乳がん
XELODA は、ドセタキセル (Taxotere®) との併用および単剤療法としての臨床試験で評価されています。
ドセタキセルとの併用
第 3 相臨床試験でドセタキセルと併用して使用された XELODA の用量は、第 1 相試験の結果に基づいており、XELODA の間欠的レジメン (14 日間投与後、7 日間の休薬期間)を評価した。併用投与レジメンは、ドセタキセルの 3 週間サイクルで投与される 75 mg/m2 と、3 週間サイクルで投与されるゼローダ 500 mg の 14 日間、1 日 2 回 1250 mg/m2 の忍容性プロファイルに基づいて選択されました。 3 週間サイクルで投与される 100 mg/m2 のドセタキセルの承認用量は、第 3 相試験の対照群でした。
XELODA とドセタキセルの併用は、ヨーロッパ、北米、南米、アジア、オーストラリアの 75 の施設で実施された非盲検多施設ランダム化試験で評価されました。アントラサイクリンを含む治療に抵抗性があるか、治療中または治療後に再発した、またはアントラサイクリンを含む補助治療中に再発したか、完了後 2 年以内に再発した、合計 511 人の転移性乳癌患者が登録されました。 255 人の患者を無作為に割り付け、XELODA 1250 mg/m2 を 1 日 2 回 14 日間投与し、その後 1 週間は治療を行わず、ドセタキセル 75 mg/m2 を 1 時間の静脈内注入として 3 週間サイクルで投与しました。単剤療法群では、256 人の患者がドセタキセル 100 mg/m2 を 1 時間の静脈内注入として 3 週間のサイクルで投与されました。患者の人口統計を表 16 に示します。
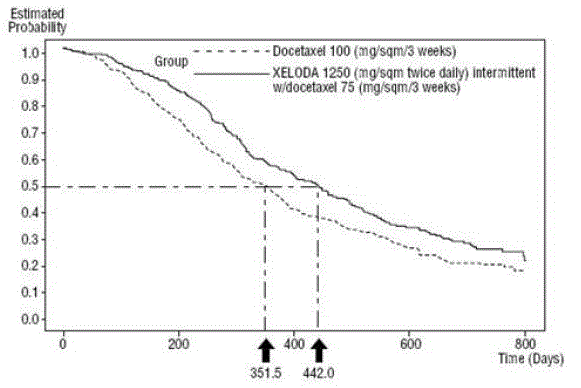
XELODA とドセタキセルの併用は、ドセタキセルによる単剤療法と比較して、疾患進行までの時間、全生存期間、および客観的奏効率において統計的に有意な改善をもたらしました。 図 5 .
図 4 XELODA およびドセタキセル対ドセタキセルの疾患進行までの時間のカプラン・マイヤー推定値
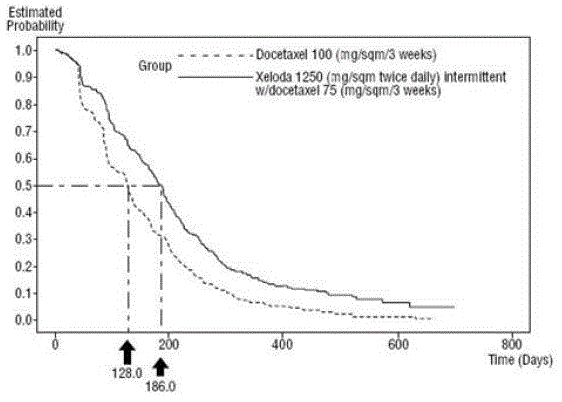
図 5 生存 XELODA およびドセタキセル対ドセタキセルのカプラン・マイヤー推定
単剤療法
単剤療法としての XELODA の抗腫瘍活性は、米国とカナダの 24 施設で実施された非盲検単群試験で評価されました。ステージ IV の乳癌の合計 162 人の患者が登録されました。主要評価項目は、測定可能な疾患を有する患者の腫瘍奏効率であり、応答は、二次元的に測定可能な疾患の垂直直径の積の合計が少なくとも 1 か月間 50% 以上減少することとして定義されました。 XELODA は 1255 mg/m2 の用量で 1 日 2 回 2 週間投与され、その後 1 週間の休薬期間があり、3 週間のサイクルで投与されました。すべての患者 (n=162) および測定可能な疾患を有する患者 (n=135) のベースラインの人口統計および臨床的特徴を図 1 に示します。耐性は、治療中の進行性疾患、初期反応の有無にかかわらず、またはアントラサイクリンを含む補助化学療法レジメンによる治療完了から 6 か月以内の再発として定義されました。
パクリタキセルとアントラサイクリンの両方に耐性のある疾患を持つ患者に対する抗腫瘍反応は、
二重耐性を示した 43 人の患者のサブグループでは、進行までの時間の中央値は 102 日で、生存期間の中央値は 255 日でした。この母集団における客観的奏効率は、化学療法に対する抵抗性が低かった、測定可能な疾患を有する 135 人の患者の全体集団における 18.5% の奏効率 (1 CR、24 PR) によって裏付けられました (参照)。進行までの期間の中央値は 90 日で、生存期間の中央値は 306 日でした。
患者情報
ゼローダ® (zeh-LOE-duh) (カペシタビン) 錠
ゼローダ 500mg について知っておくべき最も重要な情報は何ですか?
ゼローダ 500mg は、次のような重大な副作用を引き起こす可能性があります。
- XELODA は、ワルファリン (COUMADIN®) などの血液希釈剤と相互作用する可能性があります。これらの薬と一緒にゼローダ 500mg を服用すると、血液凝固の速度が変化し、死に至る出血を引き起こす可能性があります。これは、ゼローダ 500mg の服用を開始してから数日後、または治療中に発生する可能性があり、ゼローダの服用を中止してから 1 か月以内に発生する可能性もあります。がんにかかっている場合や 60 歳以上の場合は、リスクが高くなる可能性があります。
- XELODA を服用する前に、ワルファリン (COUMADIN) または別の血液希釈剤を服用しているかどうかを医療提供者に伝えてください。
- XELODA による治療中にワルファリン (COUMADIN) またはワルファリン (COUMADIN) のような別の血液希釈剤を服用している場合、担当の医療提供者は頻繁に血液検査を行い、XELODA による治療中および中止後に血液が凝固する速度を確認する必要があります。必要に応じて、医療提供者が血液希釈剤の用量を変更することがあります。
見る 「ゼローダ500mgで起こりうる副作用は?」 副作用の詳細については。
ゼローダとは?
XELODA は、次のような人々の治療に使用される処方薬です。
- 結腸に近い領域のリンパ節に転移した結腸がん (Dukes' C 期)、手術後。
- 結腸または直腸 (結腸直腸) のがんが体の他の部分に拡がっている (転移性)、この段階でのがんの最初の治療として。
- 他の特定の抗がん剤で治療した後、ドセタキセルと呼ばれる別の薬と一緒に体の他の部分に広がった(転移性)乳がん.
- 体の他の部分に転移し、パクリタキセルやその他の特定の抗がん剤による治療後に改善しない乳がん、または特定の抗がん剤による治療をこれ以上受けることができない乳がん。
ゼローダ 500mg が子供に安全で効果的かどうかは不明です。
次の場合は、ゼローダを服用しないでください。
- 重度の腎臓の問題がある
- カペシタビン、5-フルオロウラシル、またはゼローダに含まれるその成分にアレルギーのある方。ゼローダの全成分リストについては、このリーフレットの最後をご覧ください。
上記の状態のいずれかを持っているかどうかわからない場合は、XELODA を服用する前に医療提供者に相談してください。
XELODA を服用する前に、次の場合を含め、すべての病状について医療提供者に伝えてください。
見る 「ゼローダについて知っておくべき最も重要な情報は何ですか?」
- 心臓に問題があった
- 腎臓または肝臓に問題がある
- DPD(ジヒドロピリミジン脱水素酵素)という酵素が不足していると言われています。
- 妊娠している、または妊娠する予定がある。ゼローダ 500mg は胎児に害を及ぼす可能性があります。 XELODA による治療を開始する前に、医療提供者は妊娠検査を行う必要があります。 XELODA の治療中に妊娠した場合、または妊娠の可能性があると思われる場合は、すぐに医療提供者に伝えてください。
- 女性 妊娠できる人は、治療中および最終投与後 6 か月間は効果的な避妊を行う必要があります。 XELODA による治療中のあなたに適した避妊法については、かかりつけの医療提供者に相談してください。
- 男性 妊娠可能な女性パートナーがいる場合は、治療中および最終投与後 3 か月間は効果的な避妊を行う必要があります。
- 授乳中または授乳を計画している。 XELODA が母乳に移行するかどうかは不明です。ゼローダ500mg投与中および最終投与後2週間は授乳を避けてください。
処方薬、市販薬、ビタミン、ハーブのサプリメントなど、服用しているすべての薬について医療提供者に伝えてください。ゼローダは他の薬の働きに影響を与える可能性があり、他の薬はゼローダの働きに影響を与える可能性があります。
服用している薬を知る。それらのリストを保管して、新しい薬を入手したときに医療提供者や薬剤師に見せてください.
ゼローダ 500mg の服用方法を教えてください。
- XELODA は、担当の医療提供者が指示したとおりに服用してください。
- かかりつけの医療提供者がゼローダの服用量と服用時期を教えてくれます。
- ゼローダは朝晩1回、1日2回服用してください。
- 食後30分以内にゼローダ500mgを服用してください。
- ゼローダ 500mg 錠を水で丸ごと飲み込んでください。 しない ゼローダ 500mg 錠を砕くか切る。ゼローダ錠を丸ごと飲み込めない場合は、医療機関に相談してください。
- 副作用が発生した場合、医療提供者はゼローダ 500mg の投与量を変更したり、一時的に中止したり、永久に中止したりすることがあります。
- ゼローダの服用量が多すぎる場合は、すぐに医療提供者に連絡するか、最寄りの病院の緊急治療室に行ってください。
ゼローダの副作用は?
XELODA は、次のような重大な副作用を引き起こす可能性があります。
吐き気、嘔吐はゼローダによく見られます。食欲不振、脱力感、吐き気、嘔吐、下痢があると、すぐに脱水症状になります。
次の場合は、ゼローダの服用を中止し、すぐに医療提供者に連絡してください。
白血球数が非常に少ない場合、感染のリスクが高くなります。華氏 100.5 度以上の発熱がある場合、または他の感染症の徴候や症状がある場合は、すぐに医療提供者に連絡してください。
- 見る 「ゼローダについて知っておくべき最も重要な情報は何ですか?」
- 下痢。 XELODA では下痢がよくみられ、時には重度になることもあります。ゼローダの服用を中止し、1 日の排便回数が通常の排便回数または夜間の排便回数よりも 4 回以上増加した場合は、すぐに医療提供者に連絡してください。下痢を治療するために服用できる薬については、かかりつけの医療提供者に尋ねてください。重度の腹痛と発熱を伴う重度の血性下痢がある場合は、ゼローダ 500mg の服用を中止し、医療提供者に連絡するか、すぐに最寄りの病院の緊急治療室に行ってください。
- 心の問題。 XELODA は、心臓発作や心臓への血流の減少、胸痛、不規則な心拍、心電図 (ECG) で見られる心臓の電気的活動の変化、心筋の問題、心不全、突然の心臓の問題など、心臓の問題を引き起こす可能性があります。死。 XELODA 500mg の服用を中止し、次のような心臓の問題の新たな症状が現れた場合は、すぐに医療提供者に連絡するか、最寄りの病院の緊急治療室に行きます。
- 胸痛
- めまい
- 呼吸困難
- 立ちくらみ
- 体液の過剰な喪失(脱水)および腎不全。 ゼローダ 500mg を服用すると脱水症状が起こり、突然の腎不全を引き起こし、死に至る場合があります。 XELODA 500mgを服用する前に腎臓に問題があり、腎臓の問題を引き起こす可能性のある他の薬を服用している場合、リスクが高くなります.
- 1日に2回以上吐く。
- 時々食べたり飲んだりすることが少ししかできない、または吐き気のためにまったく飲めない。
- 下痢があります。上記の「下痢」を参照してください。
- 重度の皮膚と口の反応。
- ゼローダ 500mg は、死に至る可能性のある重度の皮膚反応を引き起こす可能性があります。皮膚の発疹、水疱、皮膚の剥離が発生した場合は、すぐに医療提供者に伝えてください。重度の皮膚反応がある場合、担当の医療提供者は XELODA の使用を中止するように指示する場合があります。この場合、ゼローダ 500mg を再度服用しないでください。
- ゼローダ 500mg は、「手足症候群」を引き起こす可能性もあります。手足症候群は、ゼローダ 500mg によく見られ、手足のしびれや感覚の変化、または手足の発赤、痛み、腫れを引き起こす可能性があります。これらの症状のいずれかがあり、通常の活動ができない場合は、ゼローダの服用を中止し、すぐに医療提供者に連絡してください。
- 手足症候群は、指紋の喪失につながる可能性があり、識別に影響を与える可能性があります。
- ゼローダを服用すると、口や舌に痛みが生じることがあります。口や舌に痛みを伴う発赤、腫れ、または潰瘍が生じた場合、または食事に問題がある場合は、ゼローダ 500mg の服用を中止し、医療提供者に連絡してください。
- 血液中のビリルビンレベルの上昇と肝臓の問題。 血液中のビリルビンの増加は、XELODA 500mg で一般的であり、時には重篤になることもあります。かかりつけの医療提供者は、ゼローダでの治療中にこれらの問題についてチェックします。
- 白血球、血小板、赤血球数の減少。 担当の医療提供者は、ゼローダによる治療中に血液検査を行い、血球数を確認します。
80 歳以上の人は、XELODA で重度または重篤な副作用を発症する可能性が高くなります。
ゼローダ 500mg の最も一般的な副作用は次のとおりです。
- 下痢
- 胃部(腹部)の痛み
- 手足症候群
- 衰弱と疲労
- 吐き気
- 吐いた
- 赤血球分解生成物(血液中のビリルビン)の量の増加
ゼローダで重度のアレルギー反応が起こる可能性があります。 カペシタビンまたは 5-フルオロウラシルに対してアレルギー反応を起こしたことがある場合は、医療提供者に伝えてください。見る 「次の場合はゼローダを服用しないでください:」.次の重度のアレルギー反応の症状がある場合は、ゼローダ 500mg の服用を中止し、すぐに医療提供者に連絡するか、緊急治療室に行ってください。
- かゆみを伴う赤みが皮膚にできます (蕁麻疹)
- 肌の赤み
- 顔、唇、舌、喉の腫れ
- 発疹
- かゆみ
- 飲み込みや呼吸の困難
ゼローダ 500mg は、女性と男性の生殖能力の問題を引き起こす可能性があります。これは、子供を持つ能力に影響を与える可能性があります。不妊症について懸念がある場合は、医療提供者に相談してください。
これらはゼローダの副作用のすべてではありません。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
ゼローダの保管方法は?
- ゼローダ 500mg は、室温 68°F ~ 77°F (20°C ~ 25°C) で保管してください。
- ゼローダ 500mg は密閉容器に保管してください。
- 未使用のゼローダを安全に廃棄する方法については、かかりつけの医療提供者または薬剤師に相談してください。
ゼローダとすべての医薬品は、子供の手の届かないところに保管してください。
ゼローダの安全で効果的な使用に関する一般的な情報。
医薬品は、患者情報リーフレットに記載されている以外の目的で処方されることがあります。ゼローダが処方されていない状態には使用しないでください。ゼローダ 500mg は、たとえ同じ症状の人がいたとしても、与えないでください。それらに害を及ぼす可能性があります。医療専門家向けに書かれた XELODA 500mg に関する情報については、薬剤師または医療提供者にお尋ねください。
ゼローダ500mgの成分は?
有効成分: カペシタビン
不活性成分: 無水ラクトース、クロスカルメロースナトリウム、ヒドロキシプロピルメチルセルロース、微結晶性セルロース、ステアリン酸マグネシウムおよび精製水。ピーチまたはライトピーチ フィルム コーティングには、ヒドロキシプロピル メチルセルロース、タルク、二酸化チタン、および合成の黄酸化鉄と赤酸化鉄が含まれています。
詳細については、http://www.gene.com/patients/medicines/xeloda 500mg にアクセスするか、1-877-436-3683 に電話してください。
この患者情報は、米国食品医薬品局によって承認されています。
