Propecia 1mg, 5mg Finasteride 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
プロペシア1mgとは?
プロペシアは、良性前立腺肥大症(BPH)、男性型脱毛症(アンドロゲン性脱毛症)の症状を治療するために使用される処方薬です。プロペシアは、単独で使用することも、他の薬と併用することもできます。
プロペシア 1mg は、5-アルファ還元酵素阻害剤と呼ばれる種類の薬に属しています。
プロペシア 1mg が子供に安全で効果があるかどうかはわかっていません。
プロペシア5mgの副作用は?
プロペシア 1mg は、次のような重大な副作用を引き起こす可能性があります。
- 胸のしこり、
- 乳房の痛みや圧痛、
- 乳頭分泌物、および
- その他の乳房の変化
上記の症状がある場合は、すぐに医療機関を受診してください。
プロペシア5mgの最も一般的な副作用は次のとおりです。
- セックスへの興味の喪失、
- インポテンツ、
- オーガズムを持つのに問題があり、
- 異常射精
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらはプロペシアの副作用のすべてではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
プロペシア(フィナステリド)錠には有効成分としてフィナステリドが含まれています。合成 4-アザステロイド化合物であるフィナステリドは、アンドロゲン テストステロンを 5α-ジヒドロテストステロン (DHT) に変換する細胞内酵素であるステロイド II 型 5α-レダクターゼの特異的阻害剤です。
フィナステリドの化学名は、N-tert-ブチル-3-オキソ-4-アザ-5α-アンドロスト-1-エン-17β-カルボキサミドです。フィナステリドの実験式は C23H36N2O2 で、分子量は 372.55 です。その構造式は次のとおりです。
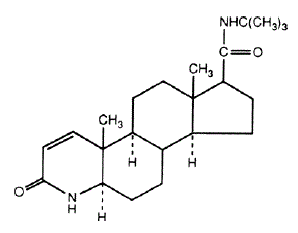
フィナステリドは白色の結晶性粉末で、融点は 250°C 近くです。クロロホルムおよび低級アルコール溶媒に溶けやすいが、水にはほとんど溶けない。
プロペシア(フィナステリド)錠は、経口投与用のフィルムコーティング錠です。各錠剤にはフィナステリド 1 mg と次の不活性成分が含まれています: ラクトース一水和物、微結晶性セルロース、アルファ化デンプン、デンプン グリコール酸ナトリウム、ヒドロキシプロピル メチルセルロース、ヒドロキシプロピル セルロース、二酸化チタン、ステアリン酸マグネシウム、タルク、ドキュセート ナトリウム、黄色三二酸化鉄、赤色第二鉄酸化物。
適応症
PROPECIA® は、男性専用の男性型脱毛症 (男性型脱毛症) の治療に使用されます。
両耳性不況における有効性は確立されていません。
プロペシアは女性には使用できません。
投薬と管理
プロペシアは、食事の有無にかかわらず投与できます。
プロペシアの推奨用量は、1日1回1錠(1mg)です。
一般に、効果が観察されるまでには、3 か月以上の毎日の使用が必要です。定期的に再評価する必要がある利点を維持するために、継続的な使用が推奨されます。治療を中止すると、12 か月以内に効果が元に戻ります。
供給方法
剤形と強度
プロペシア 5mg 錠剤 (1mg) は、黄褐色の八角形のフィルムコーティングされた凸型錠剤で、片面に「様式化された P」のロゴ、もう片面にプロペシア 5mg があります。
プロペシア 錠剤 1 mg は、黄褐色の八角形のフィルム コーティングされた凸型錠剤で、片面に「様式化された P」のロゴ、もう片面に PROPECIA のロゴが付いています。それらは次のように提供されます。
NDC 78206-152-01 30本入(乾燥剤付) NDC 78206-152-02 90 ® の PROPAK ボトル (乾燥剤付き)。
保管と取り扱い
室温、15~30°C (59~86°F) で保管してください。容器は密閉し、湿気から保護してください。
フィナステリドの吸収の可能性とその後の男性胎児への潜在的なリスクのため、妊娠中または妊娠の可能性のある女性は、砕いたり壊れたプロペシアの錠剤を取り扱ってはいけません。プロペシア 5mg 錠剤はコーティングされており、錠剤が壊れたりつぶれたりしない限り、通常の取り扱い中に有効成分との接触を防ぎます。 警告と注意事項 、 特定の集団での使用 と 患者相談情報 ]。
距離提供者: 米国 NJ 07302、ジャージーシティ、ORGANON & Co. の子会社である Organon LLC。改訂: 2021 年 6 月
副作用
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、臨床現場で観察された率を反映していない可能性があります。
男性型脱毛症の治療におけるプロペシア (フィナステリド 1 mg) の臨床研究
プロペシア 5mg の 12 か月間の 3 つの対照臨床試験では、プロペシアを服用している患者の 1.4% (n=945) が、おそらく、おそらく、または確実に薬物に関連していると考えられる有害な経験のために中止されました (プラセボでは 1.6%、プラセボでは 1.6%; n=934)。
PROPECIA またはプラセボで治療された患者の 1% 以上で、薬物関連の可能性がある、おそらくまたは確実に報告された臨床的有害事象を表 1 に示します。
表 1: 1 年目のプロペシア (フィナステリド 1 mg) の薬物関連の有害事象 (%) 男性型脱毛症
臨床的有害事象の統合分析では、プロペシア 1mg による治療中に、945 人の男性のうち 36 人 (3.8%) がこれらの有害な経験を 1 つ以上報告したのに対し、プラセボで治療を受けた 934 人の男性のうち 20 人 (2.1%) が報告したことが示されました (p=0.04)。 .これらの副作用のためにプロペシアによる治療を中止した男性と、治療を継続したほとんどの男性で解消が見られました。上記の各有害事象の発生率は、プロペシアによる治療の 5 年目までに 0.3% 以下に減少しました。
健康な男性にフィナステリドを 1 日 1 mg 投与した研究では、48 週間の治療後にプラセボの 0.2 mL (-8%) と比較して、射精量の中央値で 0.3 mL (-11%) の減少が観察されました。他の 2 つの研究では、プロペシアの 5 倍の投与量 (1 日 5 mg) のフィナステリドが、プラセボと比較して約 0.5 mL (-25%) の有意な中央値の減少をもたらしたことが示されましたが、これは治療の中止後に元に戻りました.
プロペシアの臨床試験では、フィナステリド治療患者の乳房の圧痛と肥大、過敏反応、精巣痛の発生率は、プラセボ治療患者と差がありませんでした.
良性前立腺肥大症の治療における PROSCAR® (フィナステリド 5 mg) および AVODART (デュタステリド) の対照臨床試験および長期開放延長研究
PROSCAR 長期有効性および安全性研究 (PLESS) は、4 年間の対照臨床研究であり、症候性 BPH および前立腺肥大を有する 45 歳から 78 歳までの 3040 人の患者を 4 年間にわたって安全性について評価しました (1524 PROSCAR 5 mg/日およびプラセボで 1516)。プロスカー 5 mg で 3.7% (57 例)、プラセボで 2.1% (32 例) が性機能に関連する副作用の報告が最も多く、治療を中止しました。
表 2 は、4 年間の研究で PROSCAR の発生率が 1% 以上であり、プラセボよりも高かった、治験責任医師が薬物に関連している可能性がある、おそらく、または確実に考えている唯一の臨床的副作用を示しています。試験の 2~4 年目では、インポテンス、性欲減退、射精障害の発生率に治療群間に有意差はありませんでした。
表 2: PROSCAR (フィナステリド 5 mg) の薬物関連有害事象 良性前立腺肥大症
年間のプラセボ対照第 III 相 BPH 試験と、PROSCAR 5 mg および PLESS による 5 年間のオープン延長試験における有害な経験のプロファイルは類似していました。
PROSCAR 5 mg による治療期間の延長に伴い、性的有害事象が増加したという証拠はありません。薬物関連の性的な有害体験に関する新しい報告は、治療期間とともに減少しました。
3,047 人の男性を登録した 4 ~ 6 年間のプラセボおよび比較対照の前立腺症状の医学療法 (MTOPS) 研究では、PROSCAR で治療された男性で 4 例の乳がんが発生しましたが、PROSCAR で治療されていない男性では 1 例もありませんでした。 3,040 人の男性を登録した 4 年間のプラセボ対照 PLESS 研究では、プラセボ治療を受けた男性で 2 例の乳がんが発生しましたが、PROSCAR で治療された男性では症例は報告されませんでした。
18,882 人の男性を登録した 7 年間のプラセボ対照前立腺がん予防試験 (PCPT) では、PROSCAR で治療された男性で 1 例の乳がんが、プラセボで治療された男性で 1 例の乳がんが発生しました。フィナステリドの長期使用と男性の乳房腫瘍との関係は現在不明です。
PCPT 試験は、直腸指診が正常で PSA が 3.0 ng/mL 以下の 55 歳以上の健康な男性 18,882 人を登録した 7 年間のランダム化二重盲検プラセボ対照試験でした。男性は、PROSCAR (フィナステリド 5 mg) またはプラセボのいずれかを毎日投与されました。患者は PSA と直腸指診で毎年評価されました。 PSA の上昇、異常な直腸指診、または研究の終了のために生検が行われました。グリーソン スコア 8-10 の前立腺がんの発生率は、フィナステリドで治療された男性 (1.8%) で、プラセボで治療された男性 (1.1%) よりも高かった。別の 5α-レダクターゼ阻害剤 [AVODART (デュタステリド)] を使用した 4 年間のプラセボ対照臨床試験では、グリーソン スコア 8-10 の前立腺癌で同様の結果が観察されました (デュタステリド 1% vs プラセボ 0.5%)。男性によるプロペシアの使用に関するこれらの所見の臨床的意義は不明です。
PROSCAR で治療された前立腺癌患者では、臨床的利益は証明されていません。 PROSCAR は、前立腺がんの発症リスクを軽減することは承認されていません。
市販後の経験
プロペシアの承認後の使用中に、次の副作用が確認されています。これらの反応は不確実な規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることが常に可能であるとは限りません。
過敏反応: 発疹、かゆみ、蕁麻疹、血管性浮腫などの過敏反応(唇、舌、のど、顔の腫れを含む);
生殖器系: 勃起不全、性欲障害、射精障害、オルガスム障害など、治療の中止後も続く性機能障害;男性の不妊症および/または精液の質の低下(フィナステリドの中止後に精液の質の正常化または改善が報告されています);精巣痛;血精液症。
新生物: 男性の乳がん;
乳房障害: 乳房の圧痛と拡大;
神経系/精神医学: うつ
薬物相互作用
シトクロム P450 結合型薬物代謝酵素システム
臨床的に重要な薬物相互作用は確認されていません。フィナステリドは、シトクロム P450 に関連する薬物代謝酵素系に影響を与えないようです。人間でテストされた化合物には、アンチピリン、ジゴキシン、プロプラノロール、テオフィリン、およびワルファリンが含まれますが、臨床的に意味のある相互作用は見つかりませんでした.
その他の併用療法
特定の相互作用研究は実施されていませんが、アセトアミノフェン、アセチルサリチル酸、α遮断薬、鎮痛薬、アンギオテンシン変換酵素(ACE)阻害薬、抗けいれん薬、ベンゾジアゼピン、ベータ遮断薬、カルシウムを用いた臨床試験では、1mg以上のフィナステリド用量が併用されました。チャネル遮断薬、心臓硝酸塩、利尿薬、H2 アンタゴニスト、HMG-CoA レダクターゼ阻害薬、プロスタグランジン合成酵素阻害薬 (NSAID とも呼ばれる)、およびキノロン系抗感染薬は、臨床的に重大な有害な相互作用の証拠はありません。
警告
の一部として含まれています 予防 セクション。
予防
女性の暴露 - 男性胎児へのリスク
プロペシアは女性には使用できません。フィナステリドの吸収の可能性とその後の男性胎児への潜在的なリスクのため、妊娠中または妊娠の可能性のある女性は、砕いたり壊れたプロペシアの錠剤を取り扱ってはいけません。プロペシアの錠剤はコーティングされており、錠剤が壊れたりつぶれたりしていない限り、通常の取り扱い中に有効成分との接触を防ぎます。 [見る 適応症と使用法 、 禁忌 、 特定の集団での使用 、 供給方法 / 保管と取り扱い と 患者相談情報 ]
前立腺特異抗原 (PSA) への影響
プロペシア(フィナステリド、1 mg)を使用した 18 ~ 41 歳の男性の臨床試験では、血清前立腺特異抗原(PSA)の平均値がベースラインの 0.7 ng/mL から 12 か月目には 0.5 ng/mL に減少しました。良性前立腺肥大症(BPH)の高齢男性にPROSCAR(フィナステリド、5 mg)を使用した臨床研究では、PSAレベルが約50%低下しました。 PROSCAR を使用した他の研究では、前立腺癌の存在下で血清 PSA の低下を引き起こす可能性があることも示されました。フィナステリドで治療された男性を評価する際に、血清 PSA を適切に解釈するために、これらの所見を考慮に入れる必要があります。 PROPECIA の服用中に最低 PSA 値からの増加が確認された場合は、前立腺がんの存在を示す可能性があるため、5α-レダクターゼ阻害剤を服用していない男性の PSA 値がまだ正常範囲内にある場合でも、評価する必要があります。プロペシア 5mg による治療を遵守しない場合も、PSA 検査の結果に影響を与える可能性があります。
5α-レダクターゼ阻害剤による高悪性度前立腺がんのリスク増加
7年間の前立腺がん予防試験(PCPT)でフィナステリド5mg/日(プロペシアの5倍量)を服用している55歳以上の男性で、直腸指診が正常でベースライン時のPSAが3.0ng/mL以下の場合、リスクが増加したグリーソン スコア 8-10 の前立腺癌 (フィナステリド 1.8% 対 プラセボ 1.1%)。 [見る 有害反応 同様の結果が、別の 5α-レダクターゼ阻害剤(デュタステリド、AVODART)を用いた 4 年間のプラセボ対照臨床試験で観察されました(デュタステリド 1% 対 0.5% プラセボ)。 5α-レダクターゼ阻害剤は、高悪性度前立腺がんの発症リスクを高める可能性があります。 5α-レダクターゼ阻害剤が前立腺の体積を減少させる効果、または研究関連の要因がこれらの研究の結果に影響を与えたかどうかは確立されていません.
小児患者
プロペシアは、小児患者への使用は適応されていません [参照 特定の集団での使用 ]。
患者相談情報
患者に、FDA 承認の患者ラベル ( 患者情報 )。
女性の暴露 - 男性胎児へのリスク
医師は、フィナステリドが吸収される可能性があり、その後の男性胎児へのリスクの可能性があるため、妊娠中または妊娠している可能性のある女性は、粉砕または破損したプロペシア錠を扱わないように患者に通知する必要があります。プロペシア 5mg 錠剤はコーティングされており、錠剤が壊れたりつぶれたりしていない限り、通常の取り扱い中に有効成分との接触を防ぎます。妊娠中または妊娠している可能性のある女性が、つぶれたり壊れたりしたプロペシア 1mg 錠に接触した場合は、接触した部分を石鹸と水ですぐに洗い流してください。 禁忌 、 警告と注意事項 、 特定の集団での使用 Âと 供給方法 / 保管と取り扱い ]。
高悪性度前立腺がんのリスク増加
患者は、前立腺がんを予防するためのこれらの薬剤の使用を調べた研究で、プラセボで治療された男性と比較して、BPH治療に適応された5α-レダクターゼ阻害剤で治療された男性で高悪性度前立腺がんの増加があったことを知らされるべきである[ 警告と注意事項 と 有害反応 ]。
追加の指示
医師は、しこり、痛み、乳頭分泌物などの乳房の変化を速やかに報告するよう患者に指示する必要があります。乳房の肥大、圧痛および新生物を含む乳房の変化が報告されている[参照 有害反応 ]。
医師は、プロペシアの治療を開始する前に患者の添付文書を読み、処方箋が更新されるたびにもう一度読むように患者に指示して、プロペシアに関する患者の最新情報を認識できるようにする必要があります。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
Sprague-Dawley ラットに雄で 160 mg/kg/日、雌で 320 mg/kg/日までのフィナステリドを投与した 24 か月の研究では、腫瘍形成効果の証拠は観察されませんでした。これらの用量は、1 mg/日の推奨ヒト用量を投与されたヒトで観察されたものの 888 倍および 2192 倍のラットにおけるそれぞれの全身曝露をもたらしました。すべての曝露計算は、動物について計算された AUC(0-24hr) およびヒトについての平均 AUC(0-24hr) (0.05 μg•hr/mL) に基づいていました。
CD-1 マウスでの 19 か月の発がん性試験では、統計的に有意な (p≤0.05) 精巣ライディッヒ細胞腺腫の発生率の増加が、ヒト暴露 (250 mg/kg/日) の 1824 倍で観察されました。マウスでは推定ヒトの 184 倍(25 mg/kg/日)、ラットではヒトの 312 倍(≧40 mg/kg/日)でライディッヒ細胞過形成の発生率の増加が観察された。ライディッヒ細胞の増殖性変化と血清 LH レベルの上昇 (コントロールの 2 ~ 3 倍) との間の正の相関関係は、高用量のフィナステリドで処理された両方のげっ歯類種で実証されています。フィナステリドを 1 年間 240 回および 2800 回 (それぞれ 20 mg/kg/日および 45 mg/kg/日) 投与したラットまたはイヌ、または 19 か月間投与したマウスでは、薬物に関連したライディッヒ細胞の変化は見られませんでした。ヒトの推定暴露量の 18.4 倍 (2.5 mg/kg/日)。
変異原性の証拠は、in vitro 細菌変異誘発試験、哺乳類細胞変異誘発試験、または in vitro アルカリ溶出試験で観察されませんでした。チャイニーズハムスター卵巣細胞を用いた in vitro 染色体異常アッセイでは、染色体異常がわずかに増加しました。マウスの in vivo 染色体異常試験では、発がん性試験で決定された最大耐用量 250 mg/kg/日 (ヒト曝露の 1824 倍) のフィナステリドでは、治療に関連した染色体異常の増加は観察されませんでした。
性的に成熟したオスのウサギにフィナステリドを人間の 4344 倍の量 (80 mg/kg/日) で最長 12 週間投与したところ、生殖能力、精子数、射精量に影響は見られませんでした。ヒトの 488 倍の暴露量 (80 mg/kg/日) で処理された性的に成熟した雄ラットでは、6 週間または 12 週間の処理後に生殖能力に有意な影響はありませんでした。しかし、治療を最大 24 週間または 30 週間続けた場合、生殖能力、繁殖力が明らかに低下し、それに伴い精嚢と前立腺の重量が大幅に減少しました。これらの影響はすべて、治療中止後 6 週間以内に元に戻りました。ラットまたはウサギでは、精巣または交配成績に対する薬物関連の影響は見られません。フィナステリド投与ラットの生殖能力のこの低下は、副性器 (前立腺および精嚢) への影響の二次的なものであり、結果として精栓が形成されなくなります。精栓は、ラットの正常な生殖能力に不可欠ですが、人間には関係ありません。
特定の集団での使用
妊娠
妊娠カテゴリーX [参照 禁忌 ]。プロペシア 5mg は、妊娠中または妊娠している可能性のある女性への使用は禁忌です。プロペシア 5mg は、男性生殖器の正常な発達に必要なホルモンであるテストステロンから 5α-ジヒドロテストステロン (DHT) への変換を妨げる II 型 5α-レダクターゼ阻害剤です。動物実験では、フィナステリドは男性胎児の外性器の異常な発達を引き起こしました.妊娠中にこの薬を使用する場合、またはこの薬を服用中に患者が妊娠した場合は、男性胎児への潜在的な危険性について患者に通知する必要があります。
テストステロンから 5α-ジヒドロテストステロン (DHT) への変換が 5α-レダクターゼ阻害剤によって阻害されると、異常な男性生殖器の発生が予想されます。これらの転帰は、遺伝的5α-レダクターゼ欠損症の男児で報告されているものと同様です。女性は、粉砕または破損したプロペシア 5mg 錠剤、またはプロペシアを服用している男性パートナーからの精液との接触により、フィナステリドにさらされる可能性があります。フィナステリドの皮膚からの曝露に関しては、プロペシアの錠剤はコーティングされており、錠剤がつぶれたり壊れたりしていなければ、通常の取り扱い中にフィナステリドが皮膚に触れないようになっています。妊娠中または妊娠の可能性のある女性は、男性胎児に暴露する可能性があるため、粉砕または破損したプロペシア 5mg 錠剤を取り扱ってはなりません。妊娠中の女性がプロペシア 1mg のつぶれた錠剤や壊れた錠剤に触れた場合は、接触した部分を直ちに石鹸と水で洗い流してください。精液を介したフィナステリド曝露の可能性に関しては、精液中のフィナステリド濃度を測定するプロペシア 1 mg/日を服用している男性を対象とした研究が実施されています。 臨床薬理学 ]。
胚・胎児発生研究では、妊娠したラットは、主要な器官形成の期間(妊娠 6 ~ 17 日)にフィナステリドを投与されました。経口フィナステリドの母親への経口投与量(RHD)1mg/日(0.1~100mg/kg/日の動物用量でのAUCに基づく)の約1~684倍で、尿道下裂が用量依存的に増加した.オスの子孫の 3.6 ~ 100%。妊娠していないラットのデータを使用して、暴露倍数を推定した。妊娠 16 ~ 17 日は、雄胎児ラットの外性器の分化にとって重要な時期です。 RHD の約 0.2 倍の経口母体用量 (0.03 mg/kg/日の動物用量での AUC に基づく) で、雄の子孫は前立腺および精嚢重量の減少、包皮分離の遅延、および一時的な乳首の発達を示した。 RHD の約 0.02 倍 (0.003 mg/kg/日の動物用量での AUC に基づく) を投与された妊娠ラットの雄の子孫では、肛門性器間距離の減少が発生しました。子宮内でフィナステリドを投与されたメスの子孫に異常は見られませんでした。
RHD の約 488 倍(80 mg/kg/日の動物用量での AUC に基づく)を受けたフィナステリド処置雄ラットと交配させた未処置雌の子孫には、発達異常は観察されなかった。妊娠後期および授乳期の雌ラットに RHD の約 20 倍 (3 mg/kg/日の動物用量での AUC に基づく) を投与した後、雄の子孫で受胎能のわずかな低下が観察された。これらの条件下では、雌の子孫に生殖能力への影響は見られませんでした。
主要器官形成期 (妊娠 6 ~ 18 日) に 100 mg/kg/日までの母体用量でフィナステリドに暴露されたウサギの胎児では、雄の外性器の奇形やその他の異常の証拠は観察されませんでした (フィナステリド暴露レベルは 1 日あたり測定されていません)。ウサギ)。ただし、この研究には、ウサギの雄の外性器の発達に対するフィナステリドの効果の臨界期が含まれていなかった可能性があります。
胚および胎児の発育期間中の母親のフィナステリド曝露の胎児への影響は、ラットおよびウサギでの研究よりもヒトでの特定の影響を予測する種および発育期間のアカゲザル(妊娠 20 ~ 100 日)で評価されました。妊娠中のサルにフィナステリドを 800 ng/日の高用量で静脈内投与した結果 (推定最大血中濃度は 1.86 ng/mL、または 1 mg/日を服用している男性の精液からのフィナステリドへの妊婦の推定最大暴露量の約 930 倍)、結果が得られました。男性胎児に異常なし。ヒト胎児の発育に対するアカゲザルモデルの関連性を確認するために、フィナステリドの用量(2 mg/kg/日、または 1 mg/日を服用している男性の精液から推定されるフィナステリドの最高血中レベルの約 120,000 倍)を経口投与して、妊娠中のサルは、雄の胎児に外性器の異常をもたらしました。雄胎児には他の異常は観察されず、いずれの用量でも雌胎児にはフィナステリド関連の異常は観察されませんでした。
授乳中の母親
プロペシアは女性には使用できません。
フィナステリドが母乳中に排泄されるかどうかは不明です。
小児用
プロペシア 1mg は、小児患者への使用は適応されていません。
小児患者における安全性と有効性は確立されていません。
高齢者の使用
プロペシアの臨床効果試験には、65 歳以上の被験者は含まれていません。フィナステリド 5 mg の薬物動態に基づくと、高齢者におけるプロペシアの用量調整は必要ありません。 臨床薬理学 ]。ただし、高齢者におけるプロペシア 1mg の有効性は確立されていません。
肝障害
フィナステリドは肝臓で広範囲に代謝されるため、肝機能に異常のある患者へのプロペシア 5mg の投与には注意が必要です。 臨床薬理学 ]。
腎障害
腎障害のある患者では投与量の調整は必要ありません [参照 臨床薬理学 ]。
過剰摂取
臨床研究では、フィナステリドを 400 mg までの単回投与と 80 mg/日までのフィナステリドを 3 か月間複数回投与しても、副作用は発生しませんでした。さらなる経験が得られるまで、フィナステリドの過剰摂取に対する特定の治療法は推奨できません.
1500 mg/m² (500 mg/kg) の単回経口投与で雄と雌のマウスに、2360 mg/m² (400 mg/kg) と 5900 mg/m2 の単回経口投与で雌と雄のラットに有意な致死率が観察されました。 (1000 mg/kg)、それぞれ。
禁忌
プロペシア 5mg は以下の場合禁忌です。
- 妊娠。フィナステリドの使用は、妊娠中または妊娠している可能性のある女性には禁忌です。タイプ II 5α-レダクターゼ阻害剤には、テストステロンから 5α-ジヒドロテストステロン (DHT) への変換を阻害する能力があるため、フィナステリドは、フィナステリドを投与された妊婦の男性胎児の外性器に異常を引き起こす可能性があります。妊娠中にこの薬を使用する場合、またはこの薬を服用中に妊娠した場合は、妊娠中の女性に男性胎児への潜在的な危険性を知らせる必要があります。 [見る 警告と注意事項 、 特定の集団での使用 、 供給方法 / 保管と取り扱い と 患者相談情報 メスのラットでは、妊娠中に投与された低用量のフィナステリドにより、オスの子の外性器に異常が生じました。
- この薬の成分に対する過敏症。
臨床薬理学
作用機序
フィナステリドは、アンドロゲン テストステロンを DHT に変換する細胞内酵素である II 型 5α-レダクターゼの競合的かつ特異的な阻害剤です。マウス、ラット、サル、およびヒトには、I 型と II 型の 2 つの異なるアイソザイムが見られます。これらのアイソザイムのそれぞれは、組織および発達段階で異なって発現されます。ヒトでは、I 型 5α-レダクターゼは、頭皮および肝臓を含む皮膚のほとんどの領域の皮脂腺で優勢です。タイプ I 5α-レダクターゼは、循環する DHT の約 3 分の 1 を担っています。タイプ II 5α-レダクターゼ アイソザイムは、主に前立腺、精嚢、精巣上体、毛包、および肝臓に見られ、循環する DHT の 3 分の 2 を担っています。
ヒトにおけるフィナステリドの作用機序は、タイプ II アイソザイムの優先的な阻害に基づいています。天然組織(頭皮および前立腺)を使用して、いずれかのアイソザイムを阻害するフィナステリドの可能性を調べる in vitro 結合研究では、I 型アイソザイムよりもヒト II 型 5α-レダクターゼに対して 100 倍の選択性があることが明らかになりました(IC50 = 500 および I 型では 4.2 nM)および II)。両方のアイソザイムについて、フィナステリドによる阻害は、阻害剤のジヒドロフィナステリドへの還元およびNADP+との付加物形成を伴う。酵素複合体の代謝回転は遅い (t 1/2 は、II 型酵素複合体で約 30 日、I 型複合体で約 14 日)。タイプ II 5α-レダクターゼの阻害は、テストステロンから DHT への末梢の変換をブロックし、血清および組織の DHT 濃度を大幅に低下させます。
男性型脱毛症(アンドロゲン性脱毛症)の男性では、脱毛した頭皮には毛包が小型化されており、毛深い頭皮と比較してDHTの量が増加しています.フィナステリドの投与は、これらの男性の頭皮と血清の DHT 濃度を低下させます。フィナステリドの治療効果に対するこれらの減少の相対的な寄与は定義されていません。このメカニズムにより、フィナステリドは、遺伝的に素因のある患者の男性型脱毛症の発症における重要な要因を遮断するようです.
薬力学
フィナステリドは血清 DHT 濃度を急速に低下させ、1 mg 錠剤を経口投与してから 24 時間以内に 65% の抑制に達します。テストステロンとエストラジオールの平均循環レベルは、ベースラインと比較して約 15% 増加しましたが、これらは生理的範囲内にとどまりました。
フィナステリドはアンドロゲン受容体に親和性がなく、アンドロゲン、抗アンドロゲン、エストロゲン、抗エストロゲン、またはプロゲステロン効果はありません。フィナステリドを使用した研究では、黄体形成ホルモン (LH)、卵胞刺激ホルモン (FSH)、またはプロラクチンに臨床的に意味のある変化は検出されませんでした。健康なボランティアでは、フィナステリドによる治療は、ゴナドトロピン放出ホルモンに対する LH および FSH の応答を変化させず、視床下部-下垂体-精巣軸が影響を受けなかったことを示しています。
フィナステリドは、コルチゾール、甲状腺刺激ホルモン、またはチロキシンの循環レベルに影響を与えず、血漿脂質プロファイル(総コレステロール、低密度リポタンパク質、高密度リポタンパク質およびトリグリセリドなど)または骨ミネラル密度にも影響しませんでした.
薬物動態
吸収
15 人の健康な若い男性被験者を対象とした研究では、フィナステリド 1 mg 錠剤の平均バイオアベイラビリティは、静脈内 (IV) 参照に対する曲線下面積 (AUC) の比率に基づいて 65% (範囲 26-170%) でした。用量。 1 mg/日 (n=12) の投与後の定常状態では、フィナステリドの最大血漿濃度は平均 9.2 ng/mL (範囲、4.9 ~ 13.7 ng/mL) で、投与後 1 ~ 2 時間で到達しました。 AUC は 53 ng•hr/mL (範囲、20 ~ 154 ng•hr/mL) でした。フィナステリドのバイオアベイラビリティは、食物の影響を受けませんでした。
分布
平均定常状態の分布量は 76 リットル (範囲、44 ~ 96 リットル、n=15) でした。循環フィナステリドの約 90% は血漿タンパク質に結合しています。フィナステリドを複数回服用すると、ゆっくりと蓄積する段階があります。
フィナステリドは血液脳関門を通過することがわかっています。
フィナステリド 1 mg/日を 6 週間服用している 35 人の男性の精液レベルが測定されました。サンプルの 60% (35 個中 21 個) で、フィナステリドのレベルは検出されませんでした ( 特定の集団での使用 ]
代謝
フィナステリドは、主にシトクロム P450 3A4 酵素サブファミリーを介して、肝臓で広範囲に代謝されます。フィナステリドの 5α-レダクターゼ阻害活性の 20% 以下の 2 つの代謝物、t-ブチル側鎖モノヒドロキシル化代謝物およびモノカルボン酸代謝物が特定されています。
排泄
健康な若い被験者 (n=15) の静脈内注入後、フィナステリドの平均血漿クリアランスは 165 mL/分 (範囲、70-279 mL/分) でした。血漿中の平均終末半減期は 4.5 時間でした (範囲、3.3 ~ 13.4 時間; n=12)。男性(n=6)に 14C-フィナステリドを経口投与した後、投与量の平均 39%(範囲、32~46%)が代謝物の形で尿中に排泄されました。 57% (範囲、51-64%) が糞便中に排泄されました。
平均終末半減期は、18~60 歳の男性で約 5~6 時間、70 歳以上の男性で約 8 時間です。
表 3: 健康な男性 (18 ~ 26 歳) の平均 (SD) 薬物動態パラメータ
表 4: 健康な男性 (19 ~ 42 歳) における 1 mg/日を複数回投与した後の平均 (SD) 非コンパートメント薬物動態パラメータ
腎障害
腎障害のある患者では用量調整は必要ありません。クレアチニン クリアランスが 9.0 ~ 55 mL/min の慢性腎障害患者では、14C-フィナステリドの単回投与後の AUC、最大血漿濃度、半減期、およびタンパク質結合は、健康なボランティアで得られたものと同様でした。代謝物の尿中排泄は、腎障害のある患者で減少しました。この減少は、代謝産物の糞便排泄の増加と関連していました。代謝産物の血漿中濃度は、腎機能障害のある患者で有意に高かった (総放射能 AUC の 60% 増加に基づく)。しかし、フィナステリドは、腎機能が正常な男性で 12 週間にわたって 1 日 80 mg まで摂取しても許容されており、これらの患者が代謝物にさらされる可能性がはるかに高いと考えられます。
肝障害
フィナステリドの薬物動態に対する肝障害の影響は研究されていません。フィナステリドは肝臓で広範囲に代謝されるため、肝機能に異常のある患者へのプロペシア 1mg の投与には注意が必要です。
臨床研究
男性の研究
プロペシア 1mg の有効性は、18 歳から 41 歳までの軽度から中等度のアンドロゲン性脱毛症 (男性型脱毛症) の男性 (88% 白人) で実証されました。これらの研究で発毛の評価を混乱させる可能性のある脂漏性皮膚炎を防ぐために、すべての男性は、フィナステリドまたはプラセボで治療されているかどうかにかかわらず、特定の薬用タールベースのシャンプー(Neutrogena T / Gel®シャンプー)を使用するように指示されました。研究の最初の2年間。
12 か月間の二重盲検無作為化プラセボ対照試験が 3 件ありました。 2 つの主要なエンドポイントは、毛髪の数と患者の自己評価でした。 2 つの副次評価項目は、研究者の評価と写真の評価でした。さらに、性機能(自己記入アンケートに基づく)および頭皮以外の体毛の成長に関する情報が収集されました。 3つの研究は、軽度から中等度の脱毛であるが完全ではない1879人の男性で実施されました.そのうちの 2 件の研究では、主に軽度から中等度の頭頂部脱毛を有する男性 (n=1553) が登録されました。 3番目に登録された男性は、頭頂部の脱毛の有無にかかわらず、頭皮前部の中間領域に軽度から中程度の脱毛があります(n = 326)。
頭頂部脱毛症の男性における研究
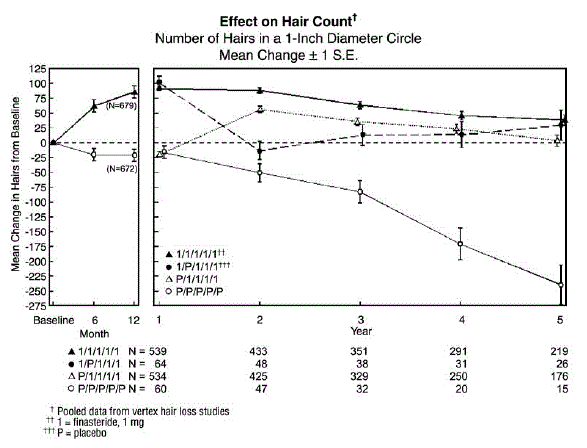
つの頂点脱毛試験の最初の 12 か月を完了した男性のうち、1,215 人が、二重盲検、プラセボ対照、12 か月の延長研究を続けることを選択しました。 547 人の男性が初期試験と最初の延長期間 (最大 2 年間の治療) でプロペシア 5mg を投与され、60 人の男性が同じ期間でプラセボを投与されました。延長試験はさらに 3 年間継続され、323 人の男性がプロペシア 5 mg を、23 人の男性がプラセボを服用して 5 年目の試験に入りました。
治療中止の効果を評価するために、65 人の男性が最初の 12 か月間プロペシア 5 mg を投与され、その後最初の 12 か月の延長期間にプラセボが投与されました。これらの男性の何人かは追加の延長研究を続け、プロペシア 5mg による治療に戻され、32 人の男性が研究の 5 年目に入った.最後に、最初の 12 か月間プラセボを投与され、その後最初の 12 か月の延長期間にプロペシアを投与された男性は 543 人でした。これらの男性の何人かは、プロペシア 5mg を投与された追加の延長研究を継続し、290 人の男性が研究の 5 年目に突入しました (下の図 1 を参照)。
毛髪の数は、活動的な脱毛の代表的な領域の写真の拡大によって評価されました。頭頂部脱毛症の男性を対象としたこれら 2 つの研究では、プロペシア 5 mg を投与した男性では 6 か月目と 12 か月目に毛髪数の有意な増加が示されましたが、プラセボを投与した男性ではベースラインからの大幅な脱毛が示されました。 12 か月の時点で、直径 1 インチの円 (5.1 cm²) 内で、プラセボとの差は 107 本でした (p
プラセボからプロペシアに切り替えた患者 (n=425) は、最初の 12 か月のプラセボ期間の終わりに毛髪数が減少し、プロペシアでの 1 年間の治療後に毛髪数が増加しました。この毛髪数の増加 (元のベースラインを 56 本上回る) は、最初にプロペシアに無作為に割り付けられた男性で 1 年間の治療後に観察された増加 (元のベースラインを上回る 91 本の毛髪) よりも少なかった.治療開始時と比較した毛髪数の増加は、これら 2 つのグループ間で同等でしたが、最初の研究でプロペシアによる治療を開始した患者では、より高い絶対毛髪数が達成されました。この利点は、残りの 3 年間の研究を通じて維持されました。最初の 12 か月の終わりにプロペシア 5mg からプラセボ (n=48) に治療を変更すると、12 か月後の 24 か月で毛髪数の増加が逆転しました (下の図 1 を参照)。
12 か月の時点で、プラセボ群の男性の 58% は、プロペシアで治療された男性の 14% と比較して、さらなる脱毛 (ベースラインからの毛髪数の減少として定義) を経験しました。最長 2 年間治療を受けた男性では、プロペシアで治療された男性の 17% と比較して、プラセボ群の男性の 72% が脱毛を示しました。 5 年後、プラセボ群の男性の 100% が脱毛を示したのに対し、プロペシアで治療された男性の 35% が脱毛を示しました。
図1
患者の自己評価は、診療所を訪れるたびに、発毛、脱毛、および外見の認識に関する質問を含む自己記入式アンケートから得られました。この自己評価は、プロペシアで治療された男性の髪の量の増加、脱毛の減少、および外観の改善を示しました.プラセボと比較した全体的な改善は、早ければ 3 か月で見られ (p
治験責任医師の評価は、各患者の来院時に頭髪の増加または減少を評価する 7 段階評価に基づいていました。この評価では、プロペシアで治療された男性は、プラセボと比較して、早ければ 3 か月で発毛が大幅に増加したことが示されました (p
独立したパネルが、研究者の評価と同じ 7 段階のスケールを使用して、頭皮の毛髪の増減に基づいて盲検法で標準化された頭の写真を評価しました。 12 か月の時点で、プロペシアで治療された男性の 48% は、プラセボで治療された男性の 7% と比較して増加しました。 2 年後、プロペシア 5 mg を投与した男性の 66% で発毛の増加が見られましたが、プラセボを投与した男性の 7% が増加しました。 5 年後、プロペシア 5mg で治療された男性の 48% が発毛の増加を示し、42% は変化がないと評価され (ベースラインからの脱毛の進行が見られない)、10% は脱毛したと評価されました。ベースライン。対照的に、プラセボで治療された男性の 6% は発毛の増加を示し、19% は変化がないと評価され、75% はベースラインと比較して脱毛したと評価されました.
48 週間のプラセボ対照試験では、男性型脱毛症の男性 212 人が登録され、頭頂部脱毛症の頭髪全体および活発に成長する (成長期) 頭髪に対する PROPECIA の効果をフォトトリコグラムで評価するように設計されました。ベースライン時と 48 週目に、頭皮の 1 cm² の対象領域で総毛髪数と成長期毛髪数を取得しました。プロペシアで治療された男性は、総毛髪数と成長期の毛髪数がベースラインからそれぞれ 7 本と 18 本の増加を示したのに対し、プラセボで治療された男性はそれぞれ 10 本と 9 本の毛髪の減少を示しました。これらの毛髪数の変化により、総毛髪数で 17 本 (p
頂点脱毛研究におけるその他の結果
性機能アンケートは、性機能のより微妙な変化を検出するために、2 つの頂点脱毛試験に参加している患者によって自己管理されました。 12 か月目に、プラセボを支持する統計的に有意な差が 4 つのドメイン (性的関心、勃起、性的問題の認識) のうち 3 つに見られました。しかし、性生活の全体的な満足度に関する質問には有意差は見られませんでした。
2 つの頂点脱毛研究の 1 つで、患者は頭皮以外の体毛の成長について質問されました。プロペシアは、頭皮以外の体毛には影響を与えないようでした.
頭皮前部中部に脱毛がある男性での研究
プロペシア 5mg の有効性を評価するためにデザインされた 12 か月間の研究では、頭皮前部の脱毛が見られる男性においても、プラセボと比較して毛髪数が大幅に増加することが示されました。毛髪数の増加は、患者の自己評価、研究者の評価、および標準化された写真に基づく評価の改善を伴いました。髪の数は頭皮の前部で得られ、両耳側後退の領域または前髪の生え際は含まれませんでした。
男性における臨床研究のまとめ
軽度から中等度のアンドロゲン性脱毛症の 18 歳から 41 歳の男性を対象に、臨床研究が実施されました。プロペシア 5mg またはプラセボで治療されたすべての男性は、研究の最初の 2 年間、タールベースのシャンプー (ニュートロジーナ T/ジェル® シャンプー) を受けました。プロペシア 5mg で治療された患者では、早ければ 3 か月で臨床的改善が見られ、頭皮の毛髪数と毛髪の再成長が正味増加しました。最長 5 年間の臨床研究では、プロペシア 5mg による治療は、プラセボ群で観察された脱毛のさらなる進行を遅らせました。一般に、治療グループ間の差は、5 年間の研究を通じて増加し続けました。
男性からの臨床データの民族分析
頭頂部脱毛症に関する 2 つの研究を組み合わせた分析では、ベースラインからの平均毛髪数の変化は、白人 (n=1185) では 91 対 -19 毛 (プロペシア 5mg 対 プラセボ)、黒人 (n=84) では 49 対 -27 毛でした。 、アジア人では 53 対 -38 毛髪 (n=17)、ヒスパニック系では 67 対 5 毛髪 (n=45)、その他の民族グループでは 67 対 -15 毛髪 (n=20)。患者の自己評価では、プロペシア治療により人種グループ全体で改善が見られましたが、全体的に満足していた黒人男性の前頭の生え際と頂点の満足度は例外でした.
女性の研究
プロペシア (n=67) またはプラセボ (n=70) で 12 か月間治療された 137 人の男性型脱毛症の閉経後の女性を対象とした研究では、有効性は示されませんでした。プラセボ群と比較した場合、プロペシアで治療された女性の毛髪数、患者の自己評価、研究者の評価、または標準化された写真の評価に改善はありませんでした[参照 適応症と使用法 ]。
患者情報
プロペシア (プロピーシャ)(フィナステリド)錠
PROPECIA® は男性専用です。女性や子供は使用しないでください。
プロペシア 5mg の服用を開始する前、およびリフィルを入手するたびに、この患者情報をお読みください。新しい情報があるかもしれません。この情報は、あなたの病状や治療について医療提供者と話すことに代わるものではありません.
プロペシア5mgとは?
プロペシア5mgは、男性型脱毛症(男性型脱毛症)の治療に用いられる処方薬です。
プロペシア 5mg が、額の両側と上 (側頭領域) の生え際の後退に効果があるかどうかは不明です。
プロペシア 5mg は、女性や子供には使用できません。
プロペシア 5mg を服用してはいけない人
次の場合は、プロペシア 1mg を服用しないでください。
- 妊娠している、または妊娠する可能性がある。プロペシアは胎児に害を及ぼす可能性があります。
- プロペシア 1mg 錠はコーティングされており、錠剤が壊れたりつぶれたりしない限り、取り扱い中に薬との接触を防ぎます。妊娠中または妊娠の可能性がある女性は、壊れた、または砕けたプロペシアの錠剤に触れないでください。妊娠中の女性がプロペシア 5mg のつぶれた錠剤や壊れた錠剤に触れた場合は、直ちに石鹸と水でその部分を洗い流してください。妊娠中の女性がプロペシア 5mg の有効成分に接触した場合は、医療提供者に相談してください。
- 男性の赤ちゃんを妊娠している女性がプロペシアの薬を飲み込んだり接触したりすると、男性の赤ちゃんが正常でない性器を持って生まれてくる可能性があります。
- プロペシアの成分にアレルギーのある方。プロペシアの全成分リストについては、このリーフレットの最後をご覧ください。
プロペシア 5mg を服用する前に医療従事者に何を伝えるべきですか?
プロペシア5mgを服用する前に、 次の場合は、医療提供者に伝えてください。
- 前立腺や肝臓の問題など、他の病状がある
あなたが服用しているすべての薬について、医療提供者に伝えてください。 処方薬および非処方薬、ビタミン、ハーブサプリメントを含みます。
服用している薬を知る。それらのリストを保管して、新しい薬を入手したときに医療提供者や薬剤師に見せてください.
プロペシア 5mg の服用方法は?
- プロペシア 5mg は、担当の医療提供者が指示するとおりに服用してください。
- プロペシア 5mg は食事の有無にかかわらず服用できます。
- プロペシア 1mg を飲み忘れた場合は、1 錠余分に服用しないでください。次の錠剤はいつものように服用してください。
プロペシアは、1 日に 1 回以上服用しても、効果が速くなったり、良くなったりすることはありません。
プロペシアの副作用の可能性は?
- 血液中の前立腺特異抗原 (PSA) レベルの低下。 プロペシアは、前立腺がんのスクリーニングのための PSA (前立腺特異抗原) と呼ばれる血液検査に影響を与える可能性があります。プロペシア 1mg は PSA レベルを低下させるため、PSA 検査を受けた場合は、プロペシアを服用していることを医療提供者に伝えてください。 PSA レベルの変化は、医療提供者によって評価される必要があります。プロペシアを服用していない男性の検査結果が正常範囲内であっても、フォローアップ PSA 値が最低点から上昇した場合、前立腺がんの存在を示す可能性があるため、評価する必要があります。また、プロペシア 1mg を処方どおりに服用していない場合は、PSA 検査の結果に影響を与える可能性があるため、医療提供者にその旨を伝えてください。詳細については、医療提供者に相談してください。
- プロペシアの5倍のフィナステリドを服用している男性では、より深刻な前立腺がんのリスクが高まる可能性があります.
プロペシアの最も一般的な副作用は次のとおりです。
- 性欲の低下
- 勃起を得たり維持したりするのに問題がある
- 精液の量の減少
プロペシアの一般的な使用において、以下が報告されています。
- 乳房の圧痛と拡大。乳房にしこり、痛み、乳頭分泌物などの変化があれば、医療提供者に伝えてください。
- うつ;
- 薬を止めた後も続いた性欲の減少;
- 発疹、かゆみ、蕁麻疹、唇、舌、のど、顔の腫れなどのアレルギー反応;
- 投薬を中止した後も続く射精の問題;
- 精巣痛;
- 精液中の血;
- 投薬を中止した後も持続する勃起を達成することの難しさ;
- 男性不妊および/または精液の質の低下。
- まれに、男性の乳がん。
気になる副作用や治らない副作用がある場合は、医療提供者に伝えてください。
これらは、プロペシアの副作用のすべてではありません。詳細については、医療提供者または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
プロペシア 1mg の保管方法を教えてください。
- プロペシア 5mg は 59°F ~ 86°F (15°C ~ 30°C) の室温で保管してください。
- プロペシアを密閉容器に保管し、プロペシア 5mg 錠を乾燥させて保管してください (湿気から保護してください)。
プロペシアとすべての医薬品は子供の手の届かないところに保管してください。
プロペシアの安全で効果的な使用に関する一般的な情報。
医薬品は、この患者情報リーフレットに記載されている以外の目的で処方されることがあります。プロペシア 5mg は、処方されていない状態には使用しないでください。他の人があなたと同じ症状であっても、プロペシアを与えないでください。それらに害を及ぼす可能性があります。
この患者情報リーフレットには、プロペシアに関する最も重要な情報がまとめられています。さらに詳しい情報が必要な場合は、医療提供者に相談してください。医療専門家向けに書かれたプロペシアに関する情報については、薬剤師または医療提供者にお尋ねください。詳細については、1-844-674-3200 までお電話ください。
プロペシア1mgの成分は?
有効成分:フィナステリド。
不活性成分:ラクトース一水和物、微結晶性セルロース、アルファ化デンプン、デンプングリコール酸ナトリウム、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルセルロース、二酸化チタン、ステアリン酸マグネシウム、タルク、ドキュセートナトリウム、黄色三二酸化鉄、赤色三二酸化鉄。
この患者情報は、米国食品医薬品局によって承認されています。
