癌治療: Nolvadex 10mg, 20mg Tamoxifen 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
ノルバデックスとは何ですか?どのように使用されますか?
ノルバデックス 10mg は、乳がんの症状を治療するために使用される処方薬です。ノルバデックスは、単独で使用することも、他の薬と併用することもできます。
ノルバデックス 20mg は、抗腫瘍薬、エストロゲン受容体拮抗薬と呼ばれる薬のクラスに属しています。
ノルバデックス 20mg が子供に安全で効果的かどうかはわかっていません。
ノルバデックス 20mg の副作用の可能性は何ですか?
ノルバデックスは、次のような重大な副作用を引き起こす可能性があります。
- 視界の変化、
- 眼の痛み、
- あざや出血しやすい、
- 気分の変化、
- 足首や足のむくみ、および
- 異常な疲労
上記の症状がある場合は、すぐに医療機関を受診してください。
ノルバデックスの最も一般的な副作用は次のとおりです。
- ほてり、
- フラッシング、
- 月経周期の変化、
- 吐き気、
- 足のけいれん、
- 腹部のけいれん、
- 骨の痛み、
- 筋肉痛、
- 咳、
- 腫れ、
- 倦怠感、
- 薄毛、
- 頭痛、
- うつ病、および
- 性的能力/興味の喪失(男性)
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、ノルバデックスの考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
警告
非浸潤性乳管がん(DCIS)の女性および乳がんのリスクが高い女性の場合: リスク低減環境(がんのリスクが高い女性および DCIS の女性)におけるノルバデックス(クエン酸タモキシフェン)に関連する重篤で生命を脅かす事象には、子宮悪性腫瘍、脳卒中および肺塞栓症が含まれます。これらのイベントの発生率は、NSABP P-1 試験から推定されました (参照 臨床薬理学 - 臨床試験 - ハイリスク女性における乳がん発生率の低下 )。子宮悪性腫瘍は、子宮内膜腺癌(ノルバデックス(クエン酸タモキシフェン)の女性1,000人当たりの発生率2.20対プラセボの0.71)および子宮肉腫(女性1,000人当たりの発生率/ノルバデックス(クエン酸タモキシフェン)の0.17対0.4)の両方からなる。プラセボ)*。脳卒中の場合、女性年 1,000 人あたりの発生率は、ノルバデックス(クエン酸タモキシフェン)で 1.43、プラセボで 1.00 でした**。肺塞栓症の場合、1,000 人の女性年当たりの発生率は、NOLVADEX (クエン酸タモキシフェン) で 0.75、プラセボで 0.25 でした**。
脳卒中、肺塞栓、子宮悪性腫瘍の一部は致命的でした。
医療従事者は、乳がんのリスクが高い女性や、乳がんの発症リスクを減らすためにノルバデックス(クエン酸タモキシフェン)を検討している DCIS の女性と、これらの重大な事象の潜在的な利益と潜在的なリスクについて話し合う必要があります。
NOLVADEX (クエン酸タモキシフェン) の利点は、すでに乳がんと診断された女性のリスクを上回ります。
参考文献
*NSABP P-1 研究からの長期追跡データ (追跡期間の中央値は 6.9 年) が更新されました。見る 警告: 子宮内膜がんおよび子宮肉腫への影響 .
**以下の表 3 を参照 臨床薬理学 - 臨床研究 .
説明
NOLVADEX® (クエン酸タモキシフェン) 錠剤は、非ステロイド性抗エストロゲン剤で、経口投与用です。 NOLVADEX (クエン酸タモキシフェン) 錠剤は、次のように入手できます。
10mg錠
各錠剤には、タモキシフェン 10 mg に相当する 15.2 mg のクエン酸タモキシフェンが含まれています。
20mg錠
各錠剤には、タモキシフェン 20 mg に相当する 30.4 mg のクエン酸タモキシフェンが含まれています。
不活性成分:カルボキシメチルセルロースカルシウム、ステアリン酸マグネシウム、マンニトール、デンプン。
化学的には、NOLVADEX (クエン酸タモキシフェン) はトリフェニルエチレン誘導体のトランス異性体です。化学名は (Z)2-[4-(1,2-ジフェニル-1-ブテニル) フェノキシ]-N, N-ジメチルエタンアミン 2 ヒドロキシ-1,2,3-プロパントリカルボキシレート (1:1) です。構造式と実験式は次のとおりです。
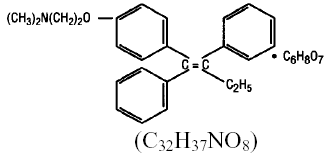
クエン酸タモキシフェンの分子量は 563.62、pKa'は 8.85 であり、37°C での水への平衡溶解度は 0.5 mg/mL であり、37°C での 0.02 N HCl への平衡溶解度は 0.2 mg/mL です。
適応症
転移性乳がん
ノルバデックス(クエン酸タモキシフェン)は、女性および男性の転移性乳がんの治療に有効です。転移性乳癌の閉経前の女性では、NOLVADEX (クエン酸タモキシフェン) は、卵巣摘出術または卵巣照射に代わるものです。利用可能な証拠は、腫瘍がエストロゲン受容体陽性である患者は、NOLVADEX (クエン酸タモキシフェン) 療法の恩恵を受ける可能性が高いことを示しています。
乳がんの補助療法
ノルバデックス(クエン酸タモキシフェン)は、乳房全切除術または乳房部分切除術、腋窩郭清、および乳房照射後の女性のリンパ節陽性乳癌の治療に適応されます。ノルバデックス(クエン酸タモキシフェン)のいくつかのアジュバント研究では、今日までの利益のほとんどは、陽性の腋窩リンパ節が 4 つ以上あるサブグループで得られました。
ノルバデックス(クエン酸タモキシフェン)は、全乳房切除術または乳房部分切除術、腋窩郭清、および乳房放射線照射後の女性における腋窩リンパ節転移陰性乳癌の治療に適応されます。
エストロゲンおよびプロゲステロン受容体の値は、アジュバント NOLVADEX (クエン酸タモキシフェン) 療法が有益である可能性が高いかどうかを予測するのに役立つ可能性があります。
ノルバデックス(クエン酸タモキシフェン)は、乳がんの補助療法としてノルバデックス(クエン酸タモキシフェン)療法を受けている患者の対側乳がんの発生を減少させます。
上皮内乳管がん(DCIS)
DCIS の女性では、乳房手術と放射線療法の後に、ノルバデックス (クエン酸タモキシフェン) が浸潤性乳がんのリスクを軽減するために適応となります (以下を参照)。 囲み警告 ラベルの先頭にあります)。乳癌の発生率を低下させるためのノルバデックス (クエン酸タモキシフェン) による治療に関する決定は、ノルバデックス (クエン酸タモキシフェン) 療法の利点とリスクに関する個々の評価に基づいて行う必要があります。
臨床試験からの現在のデータは、乳癌患者に対する 5 年間のアジュバント NOLVADEX (クエン酸タモキシフェン) 療法を支持しています。
ハイリスク女性における乳がん発生率の低下
ノルバデックス(クエン酸タモキシフェン)は、乳がんのリスクが高い女性の乳がんの発生率を低下させることが示されています。この効果は、追跡期間の中央値が 4.2 年で計画期間が 5 年の研究で示されました。参加者の 25% が 5 年間薬を服用しました。長期的な影響は不明です。この研究では、タモキシフェンが全死亡率または乳がん関連死亡率に影響を与えることはありませんでした( 囲み警告 ラベルの先頭にあります)。
ノルバデックス(クエン酸タモキシフェン)は、リスクの高い女性にのみ適応されます。 「高リスク」とは、ゲイル モデルで計算した 5 年間の乳がん予測リスクが 1.67% 以上の 35 歳以上の女性と定義されています。
5 年リスク ≥ 1.67% を予測する要因の組み合わせの例は次のとおりです。
35 歳以上で、以下の要因の組み合わせのいずれか:
- 乳癌の病歴、2つ以上の良性生検、および非定型過形成を示す乳房生検の病歴を持つ1人の第一度近親者;また
- 乳がんの病歴があり、少なくとも 1 回の乳房生検の個人歴がある、少なくとも 2 人の第一度近親者;また
- LCIS
40 歳以上で、次のいずれかの要因の組み合わせ:
- 乳癌の病歴があり、良性生検が2回以上あり、初産年齢が25歳以上で、初経年齢が11歳以下の第1度近親者;また
- 乳がんの病歴があり、初産時の年齢が 19 歳以下である、少なくとも 2 人の第一度近親者;また
- 乳癌の既往のある第一度近親者が 1 人おり、非定型過形成を示す乳房生検の個人歴があります。
45 歳以上で、以下の要因の組み合わせのいずれか:
- 乳癌の病歴があり、最初の生児出生時の年齢が24歳以下である、少なくとも2人の第一度近親者;また
- 乳癌の病歴があり、良性乳房生検の個人歴があり、初経年齢が11歳以下で、初産年齢が20歳以上の第一度近親者が1人。
50 歳以上で、次のいずれかの要因の組み合わせ:
- 乳癌の既往のある一親等の近親者が少なくとも 2 人いる。また
- -非定型過形成を示す1回の乳房生検の病歴、および初産年齢が30歳以上で初経年齢が11歳以下;また
- -非定型過形成の病歴を伴う少なくとも2回の乳房生検の病歴、および初産時の年齢が30歳以上。
55 歳以上で、以下の要因の組み合わせのいずれか:
- 乳癌の病歴があり、良性の乳房生検の個人歴があり、初経年齢が11歳以下の第一度近親者;また
- -非定型過形成の病歴を伴う少なくとも2回の乳房生検の病歴、および初産時の年齢が20歳以上。
60 歳以上で、
- ゲイルモデルで計算された、乳がんの5年予測リスク≧1.67%。
危険因子が上記の例に記載されていない女性の場合、乳がんの絶対リスクを推定するにはゲイル モデルが必要です。医療専門家は、1-800-544-2007 にダイヤルすることで、ゲイル モデル リスク評価ツールを入手できます。
遺伝性変異 (BRCA1、BRCA2) を持つ女性の乳癌発生率に対する NOLVADEX (クエン酸タモキシフェン) の効果に関して入手可能なデータは不十分であり、これらの患者における NOLVADEX (クエン酸タモキシフェン) の有効性について具体的な推奨を行うことができます。
乳がん発症のリスクを評価した後、NOLVADEX(クエン酸タモキシフェン)療法の利点とリスクを個別に評価して、NOLVADEX(クエン酸タモキシフェン)による乳がん発生率の低減に関する治療を決定する必要があります。 NSABP P-1 試験では、NOLVADEX (クエン酸タモキシフェン) 治療により、試験の追跡期間中に乳癌を発症するリスクが低下しましたが、乳癌リスクは排除されませんでした (表 3 を参照)。 臨床薬理学 )。
投薬と管理
乳がん患者の場合、1 日あたりの推奨用量は 20 ~ 40 mg です。 1 日 20 mg を超える用量は、朝と夜に分けて投与する必要があります。
女性を対象とした 3 つの単剤アジュバント研究では、10 mg のノルバデックス (クエン酸タモキシフェン) 錠剤 1 錠が 1 日 2 回 (ECOG および NATO) または 3 回 (トロント) に 2 年間投与されました。リンパ節転移陰性乳癌の女性を対象とした NSABP B-14 アジュバント研究では、10 mg NOLVADEX (クエン酸タモキシフェン) 錠剤 1 錠を 1 日 2 回、少なくとも 5 年間投与しました。 B-14 研究の結果は、5 年を超えて治療を継続しても追加の利益が得られないことを示唆しています ( 臨床薬理学 )。 EBCTCG 1995 の概要では、タモキシフェンを約 5 年間使用した研究では、タモキシフェンをより短期間使用した研究よりも再発と死亡率の減少が大きかった. 1 日あたり 20 mg を超える用量がより効果的であるという兆候はありませんでした。臨床試験からの現在のデータは、乳癌患者に対する 5 年間のアジュバント NOLVADEX (クエン酸タモキシフェン) 療法を支持しています。
上皮内乳管がん(DCIS)
推奨用量は、NOLVADEX (クエン酸タモキシフェン) 20 mg を 5 年間毎日服用することです。
ハイリスク女性における乳がん発生率の低下
推奨用量は、NOLVADEX (クエン酸タモキシフェン) 20 mg を 5 年間毎日服用することです。 NOLVADEX (クエン酸タモキシフェン) の 5 年間以外の使用を裏付けるデータはありません ( 臨床薬理学 - 臨床試験 - ハイリスク女性における乳がん発生率の低下 )。
供給方法
10mg錠 タモキシフェン 10 mg に相当する量のクエン酸塩としてタモキシフェンを含む (丸型、両凸、コーティングなし、白色の錠剤で、NOLVADEX (クエン酸タモキシフェン) 600 で識別され、片面にデボス加工が施され、反対側にカメオ加工が施されている) は、60 個入りのボトルで供給されます。錠剤。 NDC 0310-0600-60。
20mg錠 タモキシフェン 20 mg に相当する量のクエン酸塩としてタモキシフェンを含む (丸型、両凸、コーティングなし、白色の錠剤で、NOLVADEX (クエン酸タモキシフェン) 604 で識別され、片面にデボス加工が施され、もう一方の面にカメオ模様がデボス加工されている) は、30 個入りのボトルで供給されます。錠剤。 NDC 0310-0604-30。
制御された室温、20 ~ 25°C (68 ~ 77°F) [USP を参照] で保管してください。十分に密閉された耐光性容器に分注してください。
※Coumadin®はブリストル・マイヤーズ スクイブ社の登録商標です。その他すべての商標は、AstraZeneca グループ (AstraZeneca Pharmaceuticals LP Wilmington, Delaware 19850-5437) の所有物です。 Rev 09-27-05。 FDA 改訂日: 2006 年 3 月 9 日
副作用
ノルバデックス(クエン酸タモキシフェン)の副作用は比較的軽度で、乳癌患者の治療を中止する必要があるほど深刻になることはめったにありません。
継続的な臨床研究により、プラセボと比較して NOLVADEX (クエン酸タモキシフェン) の副作用の発生率をより適切に示すさらなる情報が得られました。
転移性乳がん
骨や腫瘍の痛みが増し、また局所的な疾患の再燃が起こっています。骨の痛みが増した患者は、追加の鎮痛剤が必要になる場合があります。軟部組織疾患の患者は、既存の病変のサイズが急激に増加することがあり、病変の内部および周囲に著しい紅斑および/または新しい病変が発生することがあります。それらが発生すると、ノルバデックス(クエン酸タモキシフェン)を開始した直後に骨の痛みまたは疾患の再燃が見られ、通常は急速に治まります.
転移性乳癌に対してノルバデックス(クエン酸タモキシフェン)で治療されている患者において、ノルバデックス(クエン酸タモキシフェン)に対する最も頻繁な副作用はのぼせです。
まれに見られる他の有害反応は、高カルシウム血症、末梢性浮腫、食物に対する嫌悪感、外陰部のかゆみ、うつ病、めまい、ふらつき、頭痛、薄毛および/または部分的な脱毛、および膣の乾燥です.
閉経前の女性
次の表は、転移性乳癌の閉経前患者における NOLVADEX (クエン酸タモキシフェン) 療法と卵巣切除を比較した臨床試験 (Ingle、Pritchard、Buchanan) から報告された 2% 以上の頻度で報告された有害反応の発生率をまとめたものです。
男性乳がん
ノルバデックス(クエン酸タモキシフェン)は、乳がんの男性によく耐えられます。文献および症例報告からの報告は、男性におけるノルバデックス(クエン酸タモキシフェン)の安全性プロファイルが女性に見られるものと類似していることを示唆しています。性欲減退とインポテンスにより、男性患者のタモキシフェン療法が中止されました。また、タモキシフェンで治療された乏精子症の男性では、LH、FSH、テストステロン、およびエストロゲンのレベルが上昇しました。重大な臨床的変化は報告されていません。
アジュバント乳がん
NSABP B-14 研究では、腋窩リンパ節転移陰性の乳がんの女性が、一次手術後に 5 年間のノルバデックス(クエン酸タモキシフェン)20 mg/日またはプラセボに無作為に割り付けられました。報告された副作用を以下に表に示します(平均追跡期間は約 6.8 年)。プラセボよりもノルバデックス(クエン酸タモキシフェン)でより一般的な有害事象が示されています。ほてり(64% 対 48%)、膣分泌物(30% 対 15%)、および月経不順(25% 対 19%)の発生率は、プラセボと比較してノルバデックス(クエン酸タモキシフェン)で高かった。血栓性イベントを除いて、他のすべての有害作用は2つの治療群で同様の頻度で発生しました。 NOLVADEX (クエン酸タモキシフェン) で治療された患者では、より高い発生率が見られました (5 年間で、1.7% 対 0.4%)。ノルバデックス(クエン酸タモキシフェン)で治療された患者のうち、血栓症を起こした患者のうち 2 人が死亡しました。
東部共同腫瘍学グループ (ECOG) の乳がん補助療法試験では、NOLVADEX (クエン酸タモキシフェン) またはプラセボが、乳房切除後の女性に 2 年間投与されました。プラセボと比較した場合、ノルバデックス(クエン酸タモキシフェン)はほてりの発生率が有意に高いことを示しました(19%対プラセボの8%)。他のすべての有害反応の発生率は、NOLVADEX (クエン酸タモキシフェン) の発生率が 10% 対プラセボの 3% であった血小板減少症を除いて、2 つの治療群で同様であり、境界統計的有意性が観察されました。
トロントおよび NOLVADEX (クエン酸タモキシフェン) Adjuvant Trial Organization (NATO) の他のアジュバント研究では、女性は NOLVADEX (クエン酸タモキシフェン) を受けるか、治療を受けなかった。トロントの研究では、NOLVADEX (クエン酸タモキシフェン) の患者の 29% でほてりが観察されたのに対し、未治療群では 1% でした。 NATO 試験では、のぼせと膣出血は、ノルバデックス(クエン酸タモキシフェン)の女性でそれぞれ 2.8% と 2.0% で報告されたのに対し、未治療群ではそれぞれ 0.2% でした。
アナストロゾール アジュバント試験 - 早期乳癌のアジュバント治療におけるアナストロゾールとノルバデックス(クエン酸タモキシフェン)の比較研究 (見る 臨床薬理学 - 臨床研究)。
追跡期間の中央値 33 か月で、アナストロゾールとノルバデックス (クエン酸タモキシフェン) の併用療法は、すべての患者およびホルモン受容体陽性の亜集団において、ノルバデックス (クエン酸タモキシフェン) 単独療法と比較して、有効性の利点を示しませんでした。この治療群は試験から中止されました。安全性評価のための補助療法期間の中央値は、アナストロゾール 1 mg およびノルバデックス (クエン酸タモキシフェン) 20 mg を投与された患者で、それぞれ 59.8 か月および 59.6 か月でした。
治療中または治療終了後 14 日以内にいずれかの治療群で少なくとも 5% の発生率で発生した有害事象を次の表に示します。
-治療中、または治療終了後14日以内にいずれかの治療群で少なくとも5%の発生率で発生した有害事象
特定の有害事象および有害事象の組み合わせは、2 つの薬剤の既知の薬理学的特性および副作用プロファイルに基づいて、分析のために前向きに特定されました (次の表を参照)。
アナストロゾールアジュバント試験で事前に特定された有害事象を有する患者の数 (%)1
アナストロゾールを投与された患者は、ノルバデックス(クエン酸タモキシフェン)を投与された患者と比較して、関節障害(関節炎、関節症、関節痛を含む)が増加しました。アナストロゾールを投与された患者は、ノルバデックス(クエン酸タモキシフェン)を投与された患者 [209 (7%)] と比較して、すべての骨折 (具体的には脊椎、股関節、および手首の骨折) [315 (10%)] の発生率が増加しました。アナストロゾールを投与された患者は、ノルバデックス(クエン酸タモキシフェン)を投与された患者と比較して、ほてり、膣出血、膣分泌物、子宮内膜がん、静脈血栓塞栓症および虚血性脳血管イベントが減少しました。
ノルバデックス(クエン酸タモキシフェン)を投与された患者は、アナストロゾールを投与された患者(278 [9%])と比較して、高コレステロール血症が減少しました(108 [3.5%])。狭心症は、アナストロゾール群で 71 例 [2.3%] の患者、ノルバデックス (クエン酸タモキシフェン) 群で 51 例 [1.6%] の患者で報告されました。心筋梗塞は、アナストロゾール群の 37 例 [1.2%] の患者と NOLVADEX (クエン酸タモキシフェン) 群の 34 例 [1.1%] の患者で報告されました。
アジュバント試験の骨サブスタディの結果は、12 か月および 24 か月で、アナストロゾールを投与された患者は、ベースラインと比較して、腰椎と総股関節骨密度 (BMD) の両方が平均的に減少したことを示しました。ノルバデックス(クエン酸タモキシフェン)を投与された患者は、ベースラインと比較して、腰椎と総股関節骨密度の両方が平均的に増加しました。
上皮内乳管がん(DCIS)
NSABP B-24 試験での有害事象の種類と頻度は、NOLVADEX (クエン酸タモキシフェン) を使用して実施された他の補助試験で観察されたものと一致していました。
ハイリスク女性における乳がん発生率の低下
NSABP P-1 試験では、ノルバデックス(クエン酸タモキシフェン)群で 5 つの重篤な副作用が増加しました。肺塞栓症(ノルバデックス(クエン酸タモキシフェン)群で18例、プラセボ群で6例)。深部静脈血栓症(NOLVADEX(クエン酸タモキシフェン)群で 30 例、プラセボ群で 19 例)。脳卒中(NOLVADEX(クエン酸タモキシフェン)群の 34 例 vs. プラセボ群の 24 例);白内障形成(NOLVADEX(クエン酸タモキシフェン)群 540 例 vs プラセボ群 483 例)および白内障手術(NOLVADEX(クエン酸タモキシフェン)群 101 例 vs プラセボ群 63 例)( 警告 表 3 臨床薬理学 )。
次の表は、治療群ごとに NSABP P-1 で観察された有害事象を示しています。プラセボよりもノルバデックス(クエン酸タモキシフェン)でより一般的な有害事象のみが示されています.
NSABP P-1 試験では、NOLVADEX (クエン酸タモキシフェン) とプラセボ療法を受けた参加者のそれぞれ 15.0% と 9.7% が、医学的な理由で試験から離脱しました。 NOLVADEX (クエン酸タモキシフェン) とプラセボ療法からそれぞれ離脱する医学的理由は次のとおりです: ほてり (3.1% 対 1.5%) および膣分泌物 (0.5% 対 0.1%)。
NSABP P-1 試験では、NOLVADEX (クエン酸タモキシフェン) とプラセボ療法を受けた参加者のそれぞれ 8.7% と 9.6% が非医学的理由で離脱しました。
NSABP P-1 試験では、プラセボ群の女性の 68% に、ノルバデックス (クエン酸タモキシフェン) 群の女性の 80% に、あらゆる重症度のほてりが発生しました。重度のほてりは、プラセボ群の女性の 28%、ノルバデックス (クエン酸タモキシフェン) 群の女性の 45% で発生しました。膣分泌物は、プラセボと NOLVADEX (クエン酸タモキシフェン) の女性のそれぞれ 35% と 55% で発生しました。そして、それぞれ4.5%と12.3%で深刻でした。治療群間で性器出血の発生率に差はありませんでした。
小児患者 - マッキューン・オルブライト症候群
平均子宮容積は、6 か月の治療後に増加し、1 年間の研究の終わりには 2 倍になりました。因果関係は確立されていません。しかし、ノルバデックスで治療された成人では、子宮内膜腺癌および子宮肉腫の発生率の増加が認められているため( 囲み警告 )、NOLVADEX(クエン酸タモキシフェン)で治療されたMcCune-Albright患者の長期的な影響を継続的に監視することが推奨されます. マキューン・オルブライト症候群および思春期早発症の 2 歳から 10 歳の女児に対するノルバデックス (クエン酸タモキシフェン) の安全性と有効性は、治療開始から 1 年を超えて研究されていません。 NOLVADEX (クエン酸タモキシフェン) 療法の女児における長期的な効果は確立されていません。
市販後の経験
あまり報告されていない副作用として、性器出血、おりもの、月経不順、発疹、頭痛などが報告されています。通常、これらは投与量の減量や治療の中止を必要とするほど深刻ではありません。ノルバデックス(クエン酸タモキシフェン)療法では、多形紅斑、スティーブンス・ジョンソン症候群、水疱性類天疱瘡、間質性肺炎、および血管性浮腫を含む過敏反応のまれな報告が報告されています。これらのケースのいくつかでは、発症までの時間が 1 年以上でした。まれに、血清トリグリセリドレベルの上昇が、場合によっては膵炎で、ノルバデックス(クエン酸タモキシフェン)の使用に関連している可能性があります( 注意事項 - 薬物/実験室試験の相互作用 セクション)。
薬物相互作用
ノルバデックス(クエン酸タモキシフェン)をクマリン系抗凝固剤と併用すると、抗凝固効果が著しく高まることがあります。そのような同時投与が存在する場合、患者のプロトロンビン時間を注意深く監視することが推奨されます。
NSABP P-1 試験では、何らかの理由でクマリン系抗凝固剤を必要とする女性は、試験への参加資格がありませんでした ( 禁忌 )。
細胞毒性薬をノルバデックス(クエン酸タモキシフェン)と組み合わせて使用すると、血栓塞栓症が発生するリスクが高くなります。
タモキシフェンは、レトロゾールの血漿濃度を 37% 低下させました。タモキシフェンがシクロホスファミドや活性化に混合機能オキシダーゼを必要とする他の抗腫瘍薬などの代謝および排泄に及ぼす影響は不明です。リファンピンまたはアミノグルテチミドと同時投与すると、タモキシフェンおよび N-デスメチル タモキシフェンの血漿濃度が低下することが示されています。 CYP3A4 を介した代謝の誘導は、これらの減少が起こるメカニズムであると考えられています。他の CYP3A4 誘導剤は、この効果を確認するために研究されていません。
NOLVADEX (クエン酸タモキシフェン) とフェノバルビタールを併用投与された 1 人の患者は、他の患者で観察された値よりも低い定常状態のタモキシフェンの血清レベルを示しました (すなわち、26 ng/mL 対平均値 122 ng/mL)。ただし、この所見の臨床的意義は不明です。リファンピンはタモキシフェンの代謝を誘導し、10 人の患者でタモキシフェンの血漿濃度を有意に低下させました。アミノグルテチミドは、タモキシフェンと N-デスメチル タモキシフェンの血漿濃度を低下させます。メドロキシプロゲステロンは、N-デスメチルの血漿濃度を低下させますが、タモキシフェンは低下させません。
併用ブロモクリプチン療法は、血清タモキシフェンおよび N-デスメチル タモキシフェンを上昇させることが示されています。
アナストロゾール補助療法試験の臨床的および薬物動態学的結果に基づいて、NOLVADEX (クエン酸タモキシフェン) はアナストロゾールと一緒に投与すべきではありません (以下を参照)。 臨床薬理学 - 薬物間相互作用 セクション)。
薬物/実験室試験の相互作用
市販後の調査中に、少数の閉経後の患者で T4 の上昇が報告されましたが、これは甲状腺結合グロブリンの増加によって説明できる可能性があります。これらの上昇は、臨床的甲状腺機能亢進症を伴うものではありませんでした。
NOLVADEX (クエン酸タモキシフェン) を投与された閉経後の患者では、膣塗抹標本の核濃縮指数の変動およびパップスミア標本に対するさまざまな程度のエストロゲン効果がめったに見られません。
ノルバデックス(クエン酸タモキシフェン)の市販後の経験では、まれに高脂血症の症例が報告されています。血漿トリグリセリドとコレステロールの定期的なモニタリングは、既存の高脂血症の患者に適応となる場合があります。 有害反応 - 市販後の経験 セクション)。
警告
転移性乳がん患者における効果
他の追加ホルモン療法(エストロゲンおよびアンドロゲン)と同様に、ノルバデックス(クエン酸タモキシフェン)による治療を開始してから数週間以内に、骨転移のある一部の乳がん患者で高カルシウム血症が報告されています。高カルシウム血症が発生した場合は、適切な措置を講じる必要があり、重度の場合は NOLVADEX (クエン酸タモキシフェン) を中止する必要があります。
子宮内膜がんおよび子宮肉腫に対する効果
NOLVADEX(クエン酸タモキシフェン)治療に関連して、子宮悪性腫瘍の発生率が増加することが報告されています。根本的なメカニズムは不明ですが、NOLVADEX (クエン酸タモキシフェン) のエストロゲン様効果に関連している可能性があります。ノルバデックス(クエン酸タモキシフェン)に関連して見られるほとんどの子宮悪性腫瘍は、子宮内膜の腺癌として分類されます。ただし、悪性ミュラー管混合腫瘍 (MMMT) を含むまれな子宮肉腫も報告されています。子宮肉腫は、一般に、診断時の FIGO 病期 (III/IV) が高く、予後が悪く、生存期間が短いことと関連しています。ノルバデックス(クエン酸タモキシフェン)の長期使用者(2年以上)では、非使用者よりも子宮肉腫がより頻繁に発生することが報告されています。子宮の悪性腫瘍 (子宮内膜癌または子宮肉腫) の中には致命的なものもあります。
NSABP P-1 試験では、ノルバデックス (クエン酸タモキシフェン) に無作為に割り付けられた参加者の間で、子宮内膜がんの発生率が統計的に有意に増加しました (プラセボに無作為に割り付けられた参加者の 14 症例と比較して、33 症例の浸潤性子宮内膜がん (RR = 2.48) , 95% CI: 1.27-4.92). NOLVADEX (クエン酸タモキシフェン) を投与された参加者の 33 例は FIGO ステージ I であり、そのうち 20 例が IA、12 例が IB、1 例が IC 子宮内膜腺癌でした. プラセボに無作為に割り付けられた参加者では、13 例が FIGO ステージ I でした. (8 IA および 5 IB) で、1 人は FIGO ステージ IV でした. NOLVADEX (クエン酸タモキシフェン) を服用している 5 人の女性とプラセボを服用している 1 人の女性が、手術に加えて術後放射線療法を受けました. この増加は主に、少なくとも 50 歳以上の女性で観察されました(浸潤性子宮内膜がんの 26 例、プラセボに無作為に割り付けられた参加者の 6 例と比較して (RR = 4.50、95% CI: 1.78-13.16)。無作為化の時点で年齢が 49 歳以下の女性では 7 例でした。私の浸潤性子宮内膜がん、プラセボに無作為に割り付けられた参加者の 8 例と比較して (RR=0.94、95% CI: 0.28-2.89)。診断時の年齢を考慮すると、ノルバデックス(クエン酸タモキシフェン)に無作為に割り付けられた 49 人以下の参加者では子宮内膜がんの症例が 4 例であったのに対し、プラセボに無作為に割り付けられた参加者では 2 例でした(RR = 2.21、95% CI: 0.4-12.0)。診断時に 50 歳以上の女性の場合、NOLVADEX (クエン酸タモキシフェン) に無作為に割り付けられた参加者は 29 例、プラセボ群の女性は 12 例でした (RR = 2.5、95% CI: 1.3-4.9)。リスク比は 2 つのグループで類似していましたが、若い女性ではより少ないイベントが発生しました。ノルバデックス(クエン酸タモキシフェン)群の 33 例中 5 例は無症候性の女性で発生したが、ほとんど(NOLVADEX(クエン酸タモキシフェン)群の 33 例中 29 例)の子宮内膜がんは症状のある女性で診断された。 NOLVADEX (クエン酸タモキシフェン) を投与された女性では、治療開始から 1 ~ 61 か月 (平均 = 32 か月) の間にイベントが現れました。
NSABP P-1 リスク低減試験で無作為化された無傷の子宮を持つ 8,306 人の女性に関する長期データの更新されたレビュー (全追跡期間の中央値は盲検追跡調査を含めて 6.9 年) では、両方の発生率がノルバデックス(クエン酸タモキシフェン)を服用している女性では、腺癌とまれな子宮肉腫が増加しました。盲検追跡調査中に、NOLVADEX(クエン酸タモキシフェン)を投与された女性で 36 例の FIGO ステージ I 子宮内膜腺癌(FIGO ステージ IA で 22 例、IB で 13 例、IC で 1 例)、プラセボを投与された女性で 15 例 [14 例が FIGO ステージであった] I (9 IA および 5 IB) であり、1 例は FIGO Stage IV であった]。ノルバデックス(クエン酸タモキシフェン)を投与され、子宮内膜がんを発症した患者のうち、1 人はステージ IA で、4 人はステージ IB のがんで放射線療法を受けました。プラセボ群では、FIGO ステージ 1B のがん患者 1 人が放射線療法を受け、FIGO ステージ IVB がんの患者 1 人が化学療法とホルモン療法を受けました。全体のフォローアップ中に、ノルバデックス(クエン酸タモキシフェン)に無作為に割り付けられた 53 人の女性で子宮内膜腺癌が報告されました(FIGO ステージ IA の 30 症例、ステージ IB の 20 人、ステージ IC の 1 人、ステージ IIIC の 2 人)。プラセボ (9 例が FIGO ステージ IA、6 例がステージ IB、1 例がステージ IIIC、1 例がステージ IVB) (1,000 女性年あたりの発生率はそれぞれ 2.20 および 0.71)。一部の患者は、手術に加えて術後放射線療法を受けました。 NOLVADEX (クエン酸タモキシフェン) に無作為に割り付けられた 4 人の女性 (1 人は FIGO IA、1 人は FIGO IB、1 人は FIGO IIA、1 人は FIGO IIIC) で子宮肉腫が報告され、1 人の患者は無作為にプラセボに割り付けられた (FIGO 1A)。女性 1,000 人当たりの発生率は、それぞれ 0.17 および 0.04 です。 NOLVADEX (クエン酸タモキシフェン) に無作為に割り付けられた患者のうち、FIGO IA および IB の症例は、それぞれ MMMT および肉腫でした。 FIGO II は MMMT でした。 FIGO IIIは肉腫でした。プラセボに無作為に割り付けられた 1 人の患者は MMMT でした。他の 5 つの NSABP 臨床試験で、ノルバデックス(クエン酸タモキシフェン)を投与された女性の間で、子宮内膜腺癌および子宮肉腫の同様の発生率の増加が観察されました。
ノルバデックス(クエン酸タモキシフェン)を服用している、または以前に服用したことがあり、異常な膣出血を報告している患者は、速やかに評価する必要があります。ノルバデックス(クエン酸タモキシフェン)を服用している、または以前に服用していた患者は、毎年婦人科検査を受ける必要があり、月経不順、異常な膣出血、膣分泌物の変化、または骨盤痛などの異常な婦人科症状を経験した場合は、速やかに医師に連絡する必要があります。プレッシャー。
P-1 試験では、子宮内膜のサンプリングは、子宮内膜のサンプリングを受けなかった女性と比較して、子宮が無傷の女性の子宮内膜がんの検出率を変化させませんでした (サンプリングありで 0.6%、サンプリングなしで 0.5%)。ノルバデックス(クエン酸タモキシフェン)を服用している無症候性の女性が定期的に子宮内膜を採取して乳がんの発生率を下げることが有益であることを示唆するデータはありません。
子宮への非悪性効果
NOLVADEX(クエン酸タモキシフェン)治療に関連して、過形成やポリープを含む子宮内膜の変化の発生率の増加が報告されています。この増加の発生率とパターンは、根本的なメカニズムが NOLVADEX (クエン酸タモキシフェン) のエストロゲン特性に関連していることを示唆しています。
ノルバデックス(クエン酸タモキシフェン)を服用している女性に子宮内膜症と子宮筋腫の報告がいくつかあります。根底にある機序は、NOLVADEX (クエン酸タモキシフェン) の部分的なエストロゲン様効果による可能性があります。卵巣嚢腫は、NOLVADEX (クエン酸タモキシフェン) で治療された少数の進行乳癌の閉経前患者にも観察されています。
ノルバデックス(クエン酸タモキシフェン)は、月経不順や無月経を引き起こすことが報告されています。
ノルバデックス(クエン酸タモキシフェン)の血栓塞栓効果
ノルバデックス(クエン酸タモキシフェン)療法中に、深部静脈血栓症や肺塞栓症などの血栓塞栓症の発生率が増加するという証拠があります。ノルバデックス(クエン酸タモキシフェン)を化学療法と併用すると、血栓塞栓症の発生率がさらに高まる可能性があります。乳がんの治療では、血栓塞栓症の既往歴のある女性では、ノルバデックス(クエン酸タモキシフェン)のリスクと利点を慎重に検討する必要があります。 NSABP P-1 試験の小規模なサブスタディ (N=81) では、ノルバデックス (タモキシフェン) の適切な候補ではない可能性のある女性を特定する手段として、第 V 因子ライデンおよびプロトロンビン変異 G20210A について女性をスクリーニングすることには利点がないように思われました。クエン酸)療法。
NSABP P-1 試験のデータは、肺塞栓 (PE) の病歴のないノルバデックス (クエン酸タモキシフェン) を投与された参加者は、肺塞栓が統計的に有意に増加したことを示しています (18-ノルバデックス (クエン酸タモキシフェン) 、6-プラセボ、RR = 3.01 、95% CI: 1.15-9.27)。 NOLVADEX (クエン酸タモキシフェン) 群の 3 つの肺塞栓は致命的でした。肺塞栓症の症例の 87% は、無作為化時に 50 歳以上の女性で発生しました。 NOLVADEX (クエン酸タモキシフェン) を投与された女性では、治療開始から 2 ~ 60 か月 (平均 = 27 か月) の間にイベントが現れました。
この同じ集団で、深部静脈血栓症 (DVT) の非統計的に有意な増加が NOLVADEX (クエン酸タモキシフェン) グループで見られました (30-NOLVADEX (クエン酸タモキシフェン)、19-プラセボ; RR = 1.59、95% CI: 0.86 -2.98)。 49 歳以下の女性と 50 歳以上の女性でも同様の相対リスクの増加が見られましたが、より若い女性ではより少ないイベントが発生しました。血栓塞栓症のイベントを起こした女性は、2 番目の関連イベントのリスクがあり (プラセボの女性 25 人中 7 人、ノルバデックス (クエン酸タモキシフェン) の女性 48 人中 5 人)、イベントとその治療の合併症のリスクがありました (0/25プラセボ、ノルバデックス(クエン酸タモキシフェン)で4/48)。ノルバデックス (クエン酸タモキシフェン) を投与された女性では、治療開始から 2 ~ 57 か月 (平均 = 19 か月) の間に深部静脈血栓症が発生しました。
ノルバデックス (クエン酸タモキシフェン) に無作為に割り付けられた患者では、統計的に有意ではない脳卒中の増加がありました (24-プラセボ; 34-ノルバデックス (クエン酸タモキシフェン) ; RR = 1.42; 95% CI 0.82-2.51)。プラセボ群の脳卒中24例のうち6例は出血性と考えられ、ノルバデックス(クエン酸タモキシフェン)群の脳卒中34例中10例は出血性に分類されました。ノルバデックス(クエン酸タモキシフェン)群の 34 例の脳卒中のうち 17 例は閉塞性であると考えられ、7 例は病因が不明であると考えられていました。プラセボ群の 24 の脳卒中のうち 14 は閉塞性であり、4 つは原因不明であると報告されました。これらの脳卒中のうち、プラセボ群の 3 脳卒中とノルバデックス (クエン酸タモキシフェン) 群の 4 脳卒中は致命的でした。脳卒中の 88% は、無作為化の時点で 50 歳以上の女性で発生しました。 NOLVADEX (クエン酸タモキシフェン) を投与された女性では、治療開始から 1 ~ 63 か月 (平均 = 30 か月) の間にイベントが発生しました。
肝臓への影響:肝臓がん
ノルバデックス(クエン酸タモキシフェン)40 mg/日を 2~5 年間使用したスウェーデンの試験では、ノルバデックス(クエン酸タモキシフェン)投与群で 3 例、観察群で 1 例の肝臓がんが報告されています( 注意事項 - 発がん )。ノルバデックス(クエン酸タモキシフェン)を評価する他の臨床試験では、これまでに肝臓がんの症例は報告されていません。
NOLVADEX (クエン酸タモキシフェン) に無作為に割り付けられた参加者の NSABP P-1 で、肝臓がんの 1 例が報告されました。
肝臓への影響: 非悪性への影響
ノルバデックス(クエン酸タモキシフェン)は、肝臓の酵素レベルの変化に関連しており、まれに、脂肪肝、胆汁うっ滞、肝炎、肝壊死などのより深刻な肝臓の異常のスペクトルに関連しています.これらの深刻なケースのいくつかには、死亡者が含まれていました。報告されたほとんどの症例で、ノルバデックス(クエン酸タモキシフェン)との関係は不明です。ただし、いくつかの肯定的な再チャレンジとデチャレンジが報告されています。
NSABP P-1 試験では、肝機能 (SGOT、SGPT、ビリルビン、アルカリホスファターゼ) のグレード 3 ~ 4 の変化はほとんど観察されませんでした (プラセボで 10、NOLVADEX (クエン酸タモキシフェン) で 6)。血清脂質は体系的に収集されませんでした。
その他のがん
子宮内膜以外の部位に発生する多くの二次原発腫瘍が、臨床試験で NOLVADEX (クエン酸タモキシフェン) による乳がんの治療後に報告されています。 NSABP B-14 および P-1 研究のデータは、ノルバデックス (クエン酸タモキシフェン) を投与されている患者の間で、他の (子宮以外の) がんの増加がないことを示しています。他の(子宮以外の)がんのリスク増加が NOLVADEX(クエン酸タモキシフェン)に関連しているかどうかはまだ不明であり、引き続き評価されています。
目への影響
ノルバデックス(クエン酸タモキシフェン)を投与されている患者では、角膜の変化、色覚知覚の低下、網膜静脈血栓症、網膜症などの眼障害が報告されています。ノルバデックス(クエン酸タモキシフェン)を投与されている患者では、白内障の発生率の増加と白内障手術の必要性が報告されています。
NSABP P-1 試験では、ベースラインで白内障のない女性の間で白内障を発症する重大な境界リスクが増加しました (540-NOLVADEX (クエン酸タモキシフェン) ; 483-プラセボ; RR=1.13、95% CI: 1.00-1.28)。観察した。これらの同じ女性の中で、ノルバデックス(クエン酸タモキシフェン)は白内障手術を受けるリスクの増加と関連していました(101-ノルバデックス(クエン酸タモキシフェン); 63-プラセボ; RR = 1.62、95% CI 1.18-2.22)。 臨床薬理学 )。試験に参加したすべての女性(ベースラインで白内障の有無にかかわらず)の中で、NOLVADEX(クエン酸タモキシフェン)は白内障手術を受けるリスクの増加と関連していました(201-NOLVADEX(クエン酸タモキシフェン); 129-プラセボ; RR = 1.58、95% CI 1.26-1.97)。研究中、目の検査は必要ありませんでした。白内障以外の眼科的事象に関しては、これ以上の結論を下すことはできません。
妊娠カテゴリーD
NOLVADEX (クエン酸タモキシフェン) は、妊婦に投与すると胎児に害を及ぼす可能性があります。ノルバデックス(クエン酸タモキシフェン)を服用している間、またはノルバデックス(クエン酸タモキシフェン)を中止してから 2 か月以内に妊娠しないように女性にアドバイスする必要があります。タモキシフェンは、月経不順があっても不妊症を引き起こしません。薬剤の抗エストロゲン作用から生殖機能への効果が期待されます。ヒト用量以下の用量レベルでのラットの生殖試験では、非催奇形性の発達骨格変化が見られ、可逆的であることが判明した.さらに、ラットの受胎能研究およびヒトで使用される用量以下の用量を使用したウサギの奇形学研究では、胚着床の発生率が低く、胎児の死亡または子宮発育の遅延の発生率が高いことが観察されました。ヒストリカルコントロールと比較した場合、いくつかのラットの子。数匹の妊娠マーモセットに、器官形成中または妊娠後半に 10 mg/kg/日 (mg/m² に基づいて人間の 1 日最大推奨用量の約 2 倍) を投与しました。変形は見られず、用量は一部の動物で妊娠を終わらせるのに十分高かったが、妊娠を維持した動物は催奇形性奇形の証拠を示さなかった.
胎児の生殖器官の発育に関するげっ歯類モデルでは、タモキシフェン (mg/m² に基づいて人間の 1 日最大推奨用量の 0.002 から 2.4 倍の用量) は、エストラジオール、エチニルエストラジオール、およびジエチルスチルベストロールによって引き起こされるものと同様の変化を男女に引き起こしました。これらの変化の臨床的関連性は不明ですが、これらの変化の一部、特に膣腺腫は、子宮内でジエチルスチルベストロールに曝露され、1000 分の 1 のリスクで子宮頸部の明細胞腺癌を発症する若い女性に見られるものと類似しています。膣または子宮頸部。今日まで、タモキシフェンへの子宮内曝露が、若い女性の膣腺腫、または膣または子宮頸部の明細胞腺癌を引き起こすことは示されていません。しかし、子宮内でタモキシフェンに曝露された若い女性はごく少数であり、この曝露の結果として膣または子宮頸部の腫瘍が発生する可能性があるかどうかを判断するのに十分な期間 (15 歳から 20 歳まで) 追跡された女性は少数です。
妊娠中の女性を対象としたタモキシフェンの十分に管理された試験はありません。妊娠中の女性の性器出血、自然流産、先天性欠損症、および胎児死亡の少数の報告があります。妊娠中にこの薬を使用する場合、または患者がこの薬を服用している間、または治療を中止してから約 2 か月以内に妊娠した場合、DES-の潜在的な長期リスクを含む、胎児への潜在的なリスクについて患者に通知する必要があります。みたいな症候群。
ハイリスク女性における乳がん発生率の低下 - 妊娠カテゴリーD
出産の可能性のある性的に活発な女性の場合、月経中にNOLVADEX(クエン酸タモキシフェン)療法を開始する必要があります。月経不順のある女性では、治療開始直前の B-HCG が陰性であれば十分です( 注意事項 - 患者のための情報 - ハイリスク女性における乳がん発生率の低下 )。
予防
全般的
乳癌のために NOLVADEX (クエン酸タモキシフェン) を服用している患者では、血小板数の減少 (通常は 50,000 ~ 100,000/mm3 で、まれに低い) が時折報告されています。重大な血小板減少症の患者では、まれに出血エピソードが発生していますが、これらのエピソードがノルバデックス(クエン酸タモキシフェン)療法によるものかどうかは不明です。白血球減少症が観察されており、時には貧血および/または血小板減少症に関連しています。ノルバデックス(クエン酸タモキシフェン)を投与された患者で好中球減少症と汎血球減少症がまれに報告されています。これは深刻な場合があります。
NSABP P-1 試験では、NOLVADEX (クエン酸タモキシフェン) を服用している 6 人の女性とプラセボを服用している 2 人の女性が、血小板数のグレード 3~4 の低下 (≤ 50,000/mm³) を経験しました。
患者様向け情報
患者は、以下を読むように指示されるべきです。 投薬ガイド ノルバデックス 10mg の調剤時に法律で義務付けられているとおりに供給されます。の全文 投薬ガイド このドキュメントの最後に転載されています。
DCIS の女性における浸潤性乳癌および DCIS の減少
NOLVADEX(クエン酸タモキシフェン)による治療により浸潤性乳房の発生率が低下したため、腫瘍摘出術と放射線療法で治療された DCIS の女性で、NOLVADEX(クエン酸タモキシフェン)を使用して 2 番目の乳がんイベントの発生率を低下させることを検討している場合は、治療のリスクと利点を評価する必要があります。しかし、生存率に影響を与えることは示されていません (表 1 を参照してください。 臨床薬理学 )。
ハイリスク女性における乳がん発生率の低下
乳がんのリスクが高い女性は、乳がんの発生率を下げるために NOLVADEX (クエン酸タモキシフェン) 療法を受けることを検討できます。治療の利益がリスクを上回ると見なされるかどうかは、女性の個人的な健康歴と、利益とリスクをどのように比較検討するかによって異なります。したがって、乳がんの発生率を低下させる NOLVADEX (クエン酸タモキシフェン) 療法は、乳がんのリスクが高いすべての女性に適しているとは限りません。ノルバデックス(クエン酸タモキシフェン)療法を検討している女性は、乳がんの発生率を下げるための治療を開始する前に、潜在的な利益とリスクの評価について医療専門家に相談する必要があります(表3を参照) 臨床薬理学 )。女性は、ノルバデックス(クエン酸タモキシフェン)が乳がんの発生率を低下させることを理解する必要がありますが、リスクを排除することはできません.ノルバデックス(クエン酸タモキシフェン)は、小さなエストロゲン受容体陽性腫瘍の発生率を低下させましたが、エストロゲン受容体陰性腫瘍またはより大きな腫瘍の発生率を変化させませんでした.二次乳癌を発症するリスクが高い乳癌の女性では、ノルバデックス(クエン酸タモキシフェン)を約 5 年間使用した治療により、二次乳癌の年間発生率が約 50% 減少しました。
妊娠中または妊娠を計画している女性は、乳がんのリスクを軽減するためにノルバデックス(クエン酸タモキシフェン)を服用しないでください.ノルバデックス(クエン酸タモキシフェン)を服用しているすべての閉経前の女性は、効果的な非ホルモン性避妊薬を使用しなければなりません。タモキシフェンは、月経不順があっても不妊症を引き起こしません。出産の可能性のある性的に活発な女性の場合、月経中にNOLVADEX(クエン酸タモキシフェン)療法を開始する必要があります。月経不順のある女性では、治療開始直前の B-HCG が陰性であれば十分です( 警告 - 妊娠カテゴリー D )。
乳がんのリスクを軽減するためのタモキシフェンのヨーロッパでの2つの試験が実施され、タモキシフェン群とプラセボ群の間で乳がんの症例数に違いは見られませんでした.これらの研究は、NSABP P-1 とは異なる試験デザインであり、NSABP P-1 より規模が小さく、P-1 の女性よりも乳癌のリスクが低い女性を登録していました。
ノルバデックス(クエン酸タモキシフェン)治療中のモニタリング
ノルバデックス(クエン酸タモキシフェン)を服用している、または以前に服用していた女性は、新しい乳房のしこり、膣からの出血、婦人科の症状(月経不順、膣分泌物の変化、または骨盤の痛みまたは圧力)、脚の腫れの症状、または圧痛、原因不明の息切れ、または視力の変化。女性は、評価の理由に関係なく、NOLVADEX (クエン酸タモキシフェン) を服用していることをすべての医療従事者に知らせる必要があります。
乳がんの発生率を下げるためにノルバデックス(クエン酸タモキシフェン)を服用している女性は、治療開始前に乳房検査、マンモグラム、婦人科検査を受ける必要があります。これらの研究は、優れた医療行為に合わせて、治療中は定期的に繰り返す必要があります。乳がんの補助療法としてノルバデックス(クエン酸タモキシフェン)を服用している女性は、乳がんの発生率を下げるためにノルバデックス(クエン酸タモキシフェン)を服用している女性と同じモニタリング手順に従う必要があります。転移性乳癌の治療としてノルバデックス(クエン酸タモキシフェン)を服用している女性は、このモニタリング計画を担当の医療提供者と検討し、適切なモダリティと評価スケジュールを選択する必要があります。
臨床検査
血小板数を含む定期的な全血球数と、定期的な肝機能検査を実施する必要があります。
ATAC 試験中、NOLVADEX (クエン酸タモキシフェン) を投与された患者と比較して、アナストロゾールを投与された患者の方が血清コレステロールの上昇が報告されました (それぞれ 9% 対 3.5%)。
発がん
5、20、および 35 mg/kg/日 (mg/m² 基準で、ヒトの 1 日最大推奨用量の約 1、3、および 7 倍) の用量を最大 2 年間強制経口投与したラットの従来の発がん研究)は、すべての用量で肝細胞癌の有意な増加を明らかにしました。これらの腫瘍の発生率は、5 mg/kg/日を投与されたラット (14%) と比較して、20 または 35 mg/kg/日を投与されたラット (69%) で有意に高かった。別の研究では、ラットに 45 mg/kg/日でタモキシフェンを投与しました (mg/m² に基づく 1 日最大推奨用量の約 9 倍)。肝細胞腫瘍は生後 3 ~ 6 か月で現れました。
顆粒膜細胞卵巣腫瘍と間質細胞精巣腫瘍は、2 つの別々のマウス研究で観察されました。マウスにタモキシフェンのトランス型およびラセミ型を 5、20、および 50 mg/kg/日の用量で 13 ~ 15 か月間投与しました (1 mg/m² で人間の 1 日推奨用量の約 1/2、2、および 5 倍)。基本)。
突然変異誘発
薬物代謝系を用いた原核および真核生物試験系を用いた in vivo および in vitro 試験の従来の一連の試験では、遺伝毒性の可能性は見出されなかった。しかし、ラット肝臓および培養ヒトリンパ球由来の DNA では、32P 後標識によって DNA 付加体のレベルの増加が観察されました。タモキシフェンは、ヒトリンパ芽球様細胞株 (MCL-5) の in vitro での小核形成のレベルを増加させることもわかっています。これらの発見に基づいて、タモキシフェンはげっ歯類およびヒト MCL-5 細胞で遺伝毒性を示します。
受胎能障害
タモキシフェンは、交配前の 2 週間から妊娠 7 日まで投与した場合、雌ラットに 0.04 mg/kg/日 (mg/m² 基準でヒトの 1 日最大推奨用量の約 0.01 倍) の用量で受胎能および受胎の障害をもたらしました。 .この用量では、受精率と生殖指数が著しく低下し、総胎児死亡率が上昇した。胎児死亡率も、0.16 mg/kg/日の用量で増加しました (mg/m² に基づく 1 日最大推奨ヒト用量の約 0.03 倍)。タモキシフェンは、ウサギに 0.125 mg/kg/日以上 (mg/m² 基準でヒトの最大推奨用量の約 0.05 倍) を投与した場合、流産、早産、胎児死亡を引き起こしました。ラットまたはウサギのいずれにも催奇形性の変化はありませんでした。
妊娠カテゴリーD
見る 警告 .
授乳中の母親
タモキシフェンは授乳を阻害することが報告されています。 150 人以上の女性を対象とした 2 つのプラセボ対照研究では、タモキシフェンが産後の早期の母乳産生を有意に阻害することが示されています。どちらの研究でも、タモキシフェンは分娩後 24 時間以内に 5 ~ 18 日間投与されました。確立された乳生産に対するタモキシフェンの効果は不明です。
タモキシフェンが母乳に排泄されるかどうかを示すデータはありません。排泄された場合、母乳で育てられた乳児または母乳で育てられた動物に対する母乳中のタモキシフェンの影響に関するデータはありません。しかし、新生児のタモキシフェンへのマウスおよびラットへの直接暴露 (母乳経由ではない) は、1) メスのげっ歯類に生殖管の病変 (ジエチルスチルベストロールへの子宮内暴露後にヒトに見られるものと同様) および 2) オスの生殖管の機能的欠陥を引き起こした。精巣萎縮や精子形成停止などのげっ歯類。
NOLVADEX (クエン酸タモキシフェン) が母乳中に排泄されるかどうかは不明です。ノルバデックス (クエン酸タモキシフェン) による乳児の深刻な副作用の可能性があるため、ノルバデックス (クエン酸タモキシフェン) を服用している女性は授乳しないでください。
DCIS を有するハイリスク女性における乳がん発生率の低下
NOLVADEX (クエン酸タモキシフェン) が母乳中に排泄されるかどうかは不明です。ノルバデックス (クエン酸タモキシフェン) による乳児の深刻な副作用の可能性があるため、ノルバデックス (クエン酸タモキシフェン) を服用している女性は授乳しないでください。
小児用
マキューン・オルブライト症候群および思春期早発症の 2 歳から 10 歳の女児に対するノルバデックス (クエン酸タモキシフェン) の安全性と有効性は、治療開始から 1 年を超えて研究されていません。 NOLVADEX (クエン酸タモキシフェン) 療法の女児に対する長期的な効果は確立されていません。 ノルバデックス(クエン酸タモキシフェン)で治療された成人では、子宮悪性腫瘍、脳卒中、肺塞栓症の発生率の増加が認められています( 囲み警告 、 と 臨床薬理学 - 臨床研究 - マッキューン・オルブライト症候群 サブセクション)。
高齢者の使用
NSABP P-1 試験では、65 歳以上の女性の割合は 16% でした。 70 歳以上の女性が参加者の 6% を占めました。各サブセットの参加者の間で乳がん発生率の低下が見られました。プラセボ群と NOLVADEX(クエン酸タモキシフェン)群の 65 歳以上の参加者の間で、それぞれ合計 28 人および 10 人の浸潤性乳がんが見られました。他のすべての結果において、このサブセットの結果は、50 歳以上の女性のサブセットで観察された結果を反映しています。年長の患者と年少の患者の間で、忍容性の全体的な差は観察されませんでした。 臨床薬理学 - 臨床研究 - ハイリスク女性における乳がん発生率の低下 セクション)。
NSABP B-24 試験では、65 歳以上の女性の割合は 23% でした。 70 歳以上の女性が参加者の 10% を占めました。 65 歳以上の参加者では、プラセボ群で 14 人、NOLVADEX (クエン酸タモキシフェン) 群で 12 人の浸潤性乳がんがそれぞれ見られました。このサブセットは小さすぎて、有効性に関する結論に達することができません。他のすべてのエンドポイント全体で、このサブセットの結果は、この試験に登録された若い女性の結果に匹敵しました。年配の患者と若い患者の間で、忍容性の全体的な違いは観察されませんでした。
過剰摂取
動物の LD50 を決定するための研究の後に最高用量で観察された徴候は、呼吸困難と痙攣でした。
ヒトにおける急性過剰摂取は報告されていません。多剤耐性を逆転させるための非常に高用量の使用を評価する際にノルバデックス(クエン酸タモキシフェン)の最大耐用量を具体的に決定した進行転移性癌患者の研究では、振戦、反射亢進、不安定な歩行およびめまいによって現れる急性神経毒性が認められた.これらの症状は、ノルバデックス(クエン酸タモキシフェン)の開始から 3 ~ 5 日以内に発生し、治療中止後 2 ~ 5 日以内に消失しました。永続的な神経毒性は認められませんでした。 NOLVADEX (クエン酸タモキシフェン) の使用を中止し、神経毒性の症状が解消した数日後に、1 人の患者が発作を起こしました。 NOLVADEX(クエン酸タモキシフェン)療法との発作の因果関係は不明です。これらの患者に投与された用量はすべて 400 mg/m² 以上の負荷量であり、続いて NOLVADEX (タモキシフェンクエン酸塩) の 150 mg/m² の維持用量が 1 日 2 回投与されました。
同じ研究で、心電図の QT 間隔の延長は、患者が 250 mg/m² の負荷用量よりも高い用量を投与され、続いて 80 mg/m² の維持用量のノルバデックス (クエン酸タモキシフェン) が 1 日 2 回投与された場合に認められました。体表面積が 1.5 m² の女性の場合、神経学的症状と QT の変化が起こる最小負荷量と維持量は、最大推奨量の 6 倍以上でした。
過剰摂取に対する具体的な治療法は知られていません。治療は対症療法でなければなりません。
禁忌
ノルバデックス(クエン酸タモキシフェン)は、薬物またはその成分に対する既知の過敏症のある患者には禁忌です。
ハイリスク女性および DCIS の女性における乳がん発生率の低下
ノルバデックス(クエン酸タモキシフェン)は、クマリン系抗凝固療法の併用が必要な女性、または深部静脈血栓症または肺塞栓症の既往歴のある女性には禁忌です。
臨床薬理学
ノルバデックス (クエン酸タモキシフェン) は、動物実験系で強力な抗エストロゲン特性を示した非ステロイド系薬剤です。抗エストロゲン効果は、乳房などの標的組織の結合部位についてエストロゲンと競合する能力に関連している可能性があります.タモキシフェンは、ジメチルベンザントラセン (DMBA) によって誘発されるラット乳癌の誘発を阻害し、すでに確立されている DMBA 誘発腫瘍の退縮を引き起こします。このラットモデルでは、タモキシフェンはエストロゲン受容体に結合することで抗腫瘍効果を発揮するようです。
ヒト乳房腺癌に由来するサイトゾルでは、タモキシフェンはエストロゲン受容体タンパク質についてエストラジオールと競合します。
吸収と流通
タモキシフェン 20 mg の単回経口投与後、投与の約 5 時間後に平均血漿濃度 40 ng/mL (範囲 35 ~ 45 ng/mL) が発生しました。タモキシフェンの血漿濃度の低下は二相性であり、終末半減期は約 5 ~ 7 日です。 N-デスメチルタモキシフェンの平均ピーク血漿濃度は 15 ng/mL (範囲 10 から 20 ng/mL) です。タモキシフェン 10 mg を 1 日 2 回、3 か月間患者に長期投与すると、タモキシフェンの平均定常血漿濃度は 120 ng/mL (範囲 67-183 ng/mL) および 336 ng/mL (範囲 148-654 ng/mL) になります。 mL) N-デスメチル タモキシフェンの場合。タモキシフェン 20 mg を 1 日 1 回 3 か月間投与した後のタモキシフェンおよび N-デスメチル タモキシフェンの平均定常血漿濃度は、122 ng/mL (範囲 71-183 ng/mL) および 353 ng/mL (範囲 152-706 ng) です。 /mL)、それぞれ。治療開始後、タモキシフェンの定常状態の濃度は約 4 週間で達成され、N-デスメチル タモキシフェンの定常状態の濃度は約 8 週間で達成され、この代謝産物の半減期は約 14 日間であることが示唆されます。ノルバデックス (クエン酸タモキシフェン) 錠剤 10 mg を 1 日 2 回投与する場合とノルバデックス (クエン酸タモキシフェン) 20 mg 錠剤を 1 日 1 回投与する場合の定常状態のクロスオーバー研究では、ノルバデックス (クエン酸タモキシフェン) 錠剤 20 mg は 10 mg と生物学的に同等でした。 mg NOLVADEX (クエン酸タモキシフェン) 錠。
代謝
タモキシフェンは、経口投与後に広範囲に代謝されます。 N-デスメチル タモキシフェンは、患者の血漿中に見られる主要な代謝産物です。 N-デスメチル タモキシフェンの生物学的活性は、タモキシフェンの生物学的活性と類似しているようです。 4-ヒドロキシタモキシフェンおよびタモキシフェンの側鎖一級アルコール誘導体は、血漿中の微量代謝物として同定されています。タモキシフェンは、シトクロム P-450 3A、2C9、および 2D6 の基質であり、P 糖タンパク質の阻害剤です。
排泄
20 mg の 14C タモキシフェンを投与された女性を対象とした研究では、投与量の約 65% が 2 週間にわたって体内から排泄され、主な排泄経路は糞便排泄であることが示されました。薬物は主に極性抱合体として排泄され、未変化の薬物と非抱合体の代謝物は糞便放射能全体の 30% 未満を占めます。
特別な集団
タモキシフェンの薬物動態に対する年齢、性別、および人種の影響は特定されていません。タモキシフェンの代謝および薬物動態に対する肝機能の低下の影響は決定されていません。
小児患者
タモキシフェンおよび N-デスメチル タモキシフェンの薬物動態は、NOLVADEX (タモキシフェンクエン酸塩)マッキューンオルブライト症候群の治療に。タモキシフェンの構造的薬物動態モデルを決定するために、閉経後の乳癌女性 59 人が研究を完了した 2 つのクエン酸タモキシフェン薬物動態試験からの豊富なデータが分析に含まれました。 1 コンパートメント モデルは、データに最適です。
小児患者では、平均定常状態ピーク血漿濃度 (Css, max) および AUC は、それぞれ 187 ng/mL および 4110 ng hr/mL であり、Css, max は投与の約 8 時間後に発生しました。女性の小児患者における調整された体重としてのクリアランス (CL/F) は、女性の乳癌患者よりも約 2.3 倍高かった。女性小児科患者の最年少コホート (2 ~ 6 歳) では、CL/F が 2.6 倍高かった。最も古いコホート (7 ~ 10.9 歳) では、CL/F は約 1.9 倍高かった。 N-デスメチル タモキシフェンへの曝露は、小児患者と成人患者の間で同程度でした。 マキューン・オルブライト症候群および思春期早発症の 2 歳から 10 歳の女児に対するノルバデックス (クエン酸タモキシフェン) の安全性と有効性は、治療開始から 1 年を超えて研究されていません。 NOLVADEX (クエン酸タモキシフェン) 療法の女児における長期的な効果は確立されていません。 ノルバデックス(クエン酸タモキシフェン)で治療された成人では、子宮悪性腫瘍、脳卒中、肺塞栓症の発生率の増加が認められています( 囲み警告 )。
薬物間相互作用
In vitro 研究では、エリスロマイシン、シクロスポリン、ニフェジピン、およびジルチアゼムが、それぞれ見かけの K1 が 20、1、45、および 30 μM で、N-デスメチル タモキシフェンの形成を競合的に阻害することが示されました。これらの in vitro 研究の臨床的意義は不明です。
タモキシフェンは、これらの薬剤を併用した場合、レトロゾールの血漿濃度を 37% 低下させました。シトクロム P-450 3A4 インデューサーであるリファンピンは、タモキシフェンの AUC と Cmax をそれぞれ 86% と 55% 減少させました。アミノグルテチミドは、タモキシフェンと N-デスメチル タモキシフェンの血漿濃度を低下させます。メドロキシプロゲステロンは、N-デスメチルの血漿濃度を低下させますが、タモキシフェンは低下させません。
アナストロゾールのアジュバント試験では、アナストロゾールと NOLVADEX (クエン酸タモキシフェン) を乳癌患者に併用投与すると、アナストロゾール単独で達成された値と比較して、アナストロゾールの血漿濃度が 27% 減少しました。しかし、併用投与はタモキシフェンまたは N-デスメチルタモキシフェンの薬物動態に影響を与えませんでした ( 注意事項 -薬物相互作用 )。ノルバデックス(クエン酸タモキシフェン)はアナストロゾールと併用してはいけません。
臨床研究
転移性乳がん
閉経前の女性(ノルバデックス(クエン酸タモキシフェン)とアブレーション)
進行乳癌の閉経前女性を対象に、NOLVADEX(クエン酸タモキシフェン)と卵巣切除(卵巣摘出術または卵巣照射)を比較した 3 つの前向きランダム化研究(Ingle、Pritchard、Buchanan)が行われました。客観的奏効率、治療失敗までの時間、および生存率は両方の治療で類似していましたが、患者の発生が限られているため、同等性を示すことはできませんでした。 3 つの研究の生存データの概要分析では、死亡のハザード比 (ノルバデックス (クエン酸タモキシフェン) /卵巣切除) は 1.00 で、両側 95% 信頼区間は 0.73 ~ 1.37 でした。ノルバデックス(クエン酸タモキシフェン)を服用している閉経前の女性では、血清および血漿エストロゲンの上昇が観察されていますが、無作為化研究のデータは、この増加の悪影響を示唆していません。ノルバデックス(クエン酸タモキシフェン)療法中に疾患が進行した限られた数の閉経前患者は、その後の卵巣切除に反応しました。
男性乳がん
NOLVADEX (クエン酸タモキシフェン) で治療された 122 人の患者 (119 人が評価可能) の公表された結果と 16 人の患者 (13 人が評価可能) の症例報告は、NOLVADEX (クエン酸タモキシフェン) が男性乳癌の緩和治療に有効であることを示しています。これらの 132 人の評価可能な患者のうち 66 人がノルバデックス (クエン酸タモキシフェン) に反応し、客観的反応率は 50% でした。
アジュバント乳がん
概要
Early Breast Cancer Trialists' Collaborative Group (EBCTCG) は、1985 年、1990 年、そして再び 1995 年に、早期乳がんに対する全身補助療法の世界的な概要を調査しました。アジュバント NOLVADEX (クエン酸タモキシフェン) を 1 日あたり 20 ~ 40 mg の用量で 1 ~ 5 年以上使用する。患者の 25% が 1 年以下の試験治療を受け、52% が 2 年、23% が約 5 年受けました。腫瘍の 48% はエストロゲン受容体 (ER) 陽性 (> 10 fmol/mg)、21% は ER 不良 (
約 5 年間の治療を受けた ER 陽性または未知の乳がんとリンパ節陽性の女性の 10 年全生存率は、ノルバデックス (クエン酸タモキシフェン) で 61.4%、対照群で 50.5% でした (ログランク 2p
タモキシフェンの予定された期間の影響は、次のように説明できます。 ER 陽性または未知の乳がんの女性で、ノルバデックス (クエン酸タモキシフェン) を 1 年以内、2 年、または約 5 年間投与された場合、死亡率の比例減少はそれぞれ 12%、17%、26% でした (2p
再発の比例減少がすべての期間を合わせて 10% (2p = 0.007)、または反対側の乳がんが除外された場合は 9% (2p = 0.02) であった、ER が乏しい乳がんの女性の利益はあまり明確ではありません。対応する死亡率の減少は 6% (NS) でした。 NOLVADEX (クエン酸タモキシフェン) の約 5 年間の再発および死亡率に対する効果は、年齢および同時化学療法に関係なく同様でした。 1 日あたり 20 mg を超える用量がより効果的であるという兆候はありませんでした。
アナストロゾールアジュバントATAC試験 - 早期乳がんのアジュバント治療におけるアナストロゾールとノルバデックス(クエン酸タモキシフェン)の比較試験 - アナストロゾールのアジュバント試験が、手術可能な乳癌の閉経後女性 9,366 人を対象に実施され、アナストロゾール 1 日 1 mg、ノルバデックス(クエン酸タモキシフェン)20 mg、またはこれら 2 つの治療の組み合わせによるアジュバント治療を 5 年間または再発まで無作為に割り付けられました。病気の。追跡期間の中央値 33 か月で、アナストロゾールとノルバデックス (クエン酸タモキシフェン) の併用療法は、ノルバデックス (クエン酸タモキシフェン) 単独療法と比較して、すべての患者およびホルモン受容体陽性の部分母集団において有効性を示しませんでした。この治療群は試験から中止されました。を参照してください。 臨床薬理学 - 特殊集団 - 薬物間相互作用 、 注意事項 - 実験室試験 、 注意事項-薬物相互作用 と 有害反応 この治験の安全性情報に関するセクション。この試験に関する追加情報については、ARIMIDEX® (アナストロゾール) 1 mg 錠の完全な処方情報を参照してください。
ATAC 試験の 2 つの単剤療法群の患者は、中央値で 60 か月 (5 年) 治療を受け、中央値で 68 か月追跡されました。 NOLVADEX (クエン酸タモキシフェン) 群と比較して、アナストラゾール群では、intent-to-treat 集団における無病生存率が統計的に有意に改善されました [ハザード比 (HR) = 0.87、95% CI: 0.78、0.97、p=0.0127]。 .
リンパ節陽性 - 個々の研究
つの研究 (Hubay および NSABP B-09) では、NOLVADEX (クエン酸タモキシフェン) が陽性の腋窩リンパ節を有する閉経後の女性または外科的に治癒可能な乳がんの 50 歳以上の女性において、根治的または修正された根治的乳房切除術後の無病生存期間の改善が示されました。補助細胞傷害性化学療法に追加されました。 Hubay の研究では、ノルバデックス (クエン酸タモキシフェン) が「低用量」CMF (シクロホスファミド、メトトレキサート、フルオロウラシル) に追加されました。 NSABP B-09 研究では、メルファラン [L-フェニルアラニン マスタード (P)] とフルオロウラシル (F) にノルバデックス (クエン酸タモキシフェン) が追加されました。
Hubay の研究では、陽性 (3 fmol 以上) のエストロゲン受容体を有する患者は、恩恵を受ける可能性が高くなりました。 50~59 歳の女性を対象とした NSABP B-09 研究では、エストロゲン受容体とプロゲステロン受容体の両方のレベルが 10 fmol 以上の女性のみが明らかに恩恵を受けましたが、エストロゲンとプロゲステロン受容体の両方のレベルを持つ女性では、統計的に有意ではない有害作用の傾向がありました。 10fmol未満。 60〜70歳の女性では、エストロゲンまたはプロゲステロン受容体の状態との明確な関係なしに、ノルバデックス(クエン酸タモキシフェン)の有益な効果に向かう傾向がありました.
NOLVADEX (クエン酸タモキシフェン) を単剤としてアジュバントとして使用した 3 つの前向き研究 (ECOG-1178、トロント、NATO) では、プラセボ/無治療対照群と比較して、肯定的な腋窩リンパ節を有する閉経後女性の全乳房切除術および腋窩郭清後の無病生存期間の改善が実証されました。 . NATO の調査では、全生存率の改善も示されました。
ノード陰性 - 個々の研究
NSABP B-14、プロスペクティブ、二重盲検、無作為化研究は、腋窩リンパ節陰性、エストロゲン受容体陽性 (≥ 10 fmol/mg サイトゾルタンパク質) 乳癌 (補助療法として、全乳房切除術および腋窩郭清、または区域切除の後に
患者情報
投薬ガイド
ノルバデックス(クエン酸タモキシフェン)® (NOLE-vah-dex)錠 一般名:タモキシフェン(ta-MOX-I-fen)
NOLVADEX (クエン酸タモキシフェン) を使用して乳癌になる可能性が高い女性、または非浸潤性乳管癌 (DCIS) を患っている女性のために書かれています。
この投薬ガイドでは、リスクの高い女性および DCIS の治療を受けている女性の乳がんになる可能性を下げるための NOLVADEX (クエン酸タモキシフェン) の使用についてのみ説明します。
ノルバデックス(クエン酸タモキシフェン)を服用している人 治療する 乳がんは、乳がんになる可能性を減らすためにNOLVADEX(クエン酸タモキシフェン)を服用しているハイリスクの女性や非浸潤性乳管がん(DCIS)の女性とは異なる利点と異なる決定を下す.すでに乳がんを患っている場合は、ノルバデックス(クエン酸タモキシフェン)で乳がんを治療する利点と、この文書に記載されているリスクとの比較について、医師に相談してください.
この投薬ガイドを読む必要があるのはなぜですか?
このガイドには、乳がんになる可能性を下げるために NOLVADEX (クエン酸タモキシフェン) を使用するかどうかを決定するのに役立つ情報が記載されています。
あなたとあなたの医師は、乳がんになる可能性が高いNOLVADEX(クエン酸タモキシフェン)の可能性のある利益が、その可能性のあるリスクよりも大きいかどうかについて話し合う必要があります. あなたの医師は、あなたがハイリスクグループに属しているかどうかを判断するための特別なコンピュータープログラムまたはハンドヘルド計算機を持っています. DCIS を患っており、手術と放射線療法による治療を受けている場合、医師は浸潤性 (転移性) 乳がんになる可能性を減らすために NOLVADEX (クエン酸タモキシフェン) を処方することがあります。
NOLVADEX (クエン酸タモキシフェン) を開始する前に、このガイドをよくお読みください。より多くの薬を入手するたびに得られる情報を読むことが重要です。新しいものがあるかもしれません。このガイドでは、ノルバデックス (クエン酸タモキシフェン) についてすべてを説明しているわけではありません。 いいえ あなたの医者と話す代わりに。
ノルバデックス(クエン酸タモキシフェン)があなたに適しているかどうかを判断できるのは、あなたとあなたの医師だけです.
NOLVADEX (クエン酸タモキシフェン) を使用して乳がんになる可能性を減らすために知っておくべき最も重要な情報は何ですか?
ノルバデックス(クエン酸タモキシフェン)は、ある意味でエストロゲン(女性ホルモン)に似ていて、別の意味で異なる処方薬です。乳房では、NOLVADEX (クエン酸タモキシフェン) がエストロゲンの影響をブロックします。これを行うため、NOLVADEX (クエン酸タモキシフェン) は、成長するためにエストロゲンを必要とする乳癌 (エストロゲンまたはプロゲステロン受容体陽性の癌) の成長をブロックする可能性があります。
NOLVADEX (クエン酸タモキシフェン) は、今後 5 年間に乳がんになる可能性が通常よりも高い女性 (ハイリスク女性) および DCIS の女性の乳がんになる可能性を下げることができます。
高リスクの女性はまだ癌にかかっていないため、乳癌になる可能性を低下させるノルバデックス(クエン酸タモキシフェン)の潜在的な利点が、その潜在的なリスクよりも大きいかどうかを慎重に検討することが重要です.
この投薬ガイドでは、リスクの高い女性と DCIS の女性が乳がんになる可能性を減らすために、ノルバデックス (クエン酸タモキシフェン) を使用することのリスクと利点について説明します。このガイドは いいえ すでに乳がんを患っている人々のための特別な利点と決定について話し合う.
女性と男性が NOLVADEX (クエン酸タモキシフェン) を使用するのはなぜですか?
ノルバデックス(クエン酸タモキシフェン)には複数の用途があります。ノルバデックス(クエン酸タモキシフェン)は以下の用途に使用されます:
チャンスを下げる 今後5年間で乳がんになる可能性が通常よりも高い女性(ハイリスク女性)の乳がんになる確率
チャンスを下げる 非浸潤性乳管がん (DCIS) の手術と放射線治療を受けた女性が浸潤性 (拡散性) 乳がんにかかるリスク。 DCIS は、癌が乳管内にのみあることを意味します。
治療する 早期治療を終えた女性の乳がん。早期治療には、手術、放射線、および化学療法が含まれます。ノルバデックス(クエン酸タモキシフェン)は、がんが体の他の部分に広がるのを防ぐことができます.また、女性が新たな乳がんにかかる可能性を減らす可能性もあります。女性と男性で、
治療する 体の他の部分に広がった乳がん(転移性乳がん)。
このガイドでは、NOLVADEX (クエン酸タモキシフェン) を使用して乳がんになる可能性を下げることについてのみ説明します (上記の #1 と #2)。
NOLVADEX (クエン酸タモキシフェン) は、リスクの高い女性や DCIS の治療を受けている女性の乳がんになる可能性を下げる利点は何ですか?
米国の大規模な調査では、 ハイリスクの女性 また、NOLVADEX (クエン酸タモキシフェン) を 5 年間服用した人と、NOLVADEX (クエン酸タモキシフェン) なしでピルを服用した他の人 (プラセボ) を比較しました。高リスクの女性は、特別なコンピューター プログラムに基づいて、今後 5 年間に乳がんになる可能性が 1.7% 以上の女性と定義されました。この研究では:
- リスクの高い女性 1,000 人あたり 誰がプラセボを摂取したか 、毎年約7人が乳がんになりました。
- リスクの高い女性 1,000 人あたり ノルバデックス(クエン酸タモキシフェン)を服用した方 、毎年約4人が乳がんになりました。
この研究では、NOLVADEX (クエン酸タモキシフェン) を服用した高リスクの女性は、平均して乳がんになる可能性が 44% 低下し、1,000 人に 7 人から 1,000 人に 4 人に減少したことが示されました。
別の米国の研究では、 DCISの女性 ノルバデックス(クエン酸タモキシフェン)を5年間服用した人とプラセボを服用した人を比較しました.この研究では:
- DCIS の女性 1,000 人中 誰がプラセボを服用したか 、毎年約17人が乳がんになりました。
- DCIS の女性 1,000 人中 ノルバデックス(クエン酸タモキシフェン)を服用した方 、毎年約10人が乳がんにかかります。
この研究では、ノルバデックス(クエン酸タモキシフェン)を服用した DCIS の女性は、平均して浸潤性(転移性)乳がんになる可能性が 1,000 分の 17 から 1,000 分の 10 に 43% 低下したことが示されました。
これらの研究は、ノルバデックス(クエン酸タモキシフェン)を服用することで、乳がんになる個人的な可能性が低下することを意味するものではありません. NOLVADEX(クエン酸タモキシフェン)を服用して乳がんになる可能性を減らす女性にとって、どのような利点があるかはわかりません.
ノルバデックス(クエン酸タモキシフェン)のリスクは何ですか?
「NOLVADEX (クエン酸タモキシフェン) の利点は何ですか?」で説明されている研究では、NOLVADEX (クエン酸タモキシフェン) を服用したリスクの高い女性は、プラセボを服用した女性よりも高い割合で特定の副作用を経験しました.
これらの副作用のいくつかは、死を引き起こす可能性があります。
ある研究では、子宮がまだ残っている女性を対象に
- プラセボを摂取した 1,000 人の女性のうち、毎年 1 人が子宮内膜がん (子宮内膜のがん) に罹患し、子宮肉腫 (子宮体部のがん) に罹患した人はいませんでした。
- ノルバデックス(クエン酸タモキシフェン)を服用した 1,000 人の女性のうち、毎年 2 人が子宮内膜がんに罹患し、1 人未満が子宮肉腫に罹患しました。
これらの結果は、平均して、ハイリスクの女性において、 まだ子宮がある人 、NOLVADEX(クエン酸タモキシフェン)は、子宮内膜がんになる可能性を1,000人に1人から1,000人に2人に倍増し、子宮肉腫になる可能性を高めました. これは、ノルバデックス(クエン酸タモキシフェン)を服用することで、子宮内膜がんになる個人的な可能性が 2 倍になったり、子宮肉腫になる可能性が高くなったりするという意味ではありません。 このリスクが 1 人の女性にとってどのようなものになるかはわかりません。リスクは、子宮を失った女性では異なります。
この研究に参加したすべての女性で、ノルバデックス(クエン酸タモキシフェン)を服用すると、肺や静脈に血栓ができたり、脳卒中になるリスクが高まりました。 場合によっては、女性がこれらの影響で死亡しました。
ノルバデックス(クエン酸タモキシフェン)は、白内障(眼のレンズの混濁)または白内障手術が必要になるリスクを高めました. (副作用の詳細については、「ノルバデックス(クエン酸タモキシフェン)の副作用の可能性は何ですか?」を参照してください。)
NOLVADEX(クエン酸タモキシフェン)を服用して乳がんになる可能性を減らすことについて、私たちが知らないことは何ですか?
私たちは知りません
- ノルバデックス(クエン酸タモキシフェン)が異常な乳癌遺伝子(BRCA1およびBRCA2)を持つ女性の乳癌になる可能性を下げるかどうか
- ノルバデックス(クエン酸タモキシフェン)を 5 年間服用することで、女性が一生のうちに罹患する乳がんの数が減少する場合、または一部の乳がんを遅らせるだけである場合
- ノルバデックス(クエン酸タモキシフェン)が女性の寿命を延ばすのに役立つかどうか
- ノルバデックス(クエン酸タモキシフェン)をホルモン補充療法(HRT)、経口避妊薬、またはアンドロゲン(男性ホルモン)と併用した場合の効果
- 35 歳未満の場合、NOLVADEX (クエン酸タモキシフェン) を服用する利点
NOLVADEX(クエン酸タモキシフェン)を使用して乳がんになる可能性を減らすことの長期的な利点とリスクについてさらに学ぶための研究が行われています.
NOLVADEX (クエン酸タモキシフェン) の副作用の可能性は何ですか?
ノルバデックス(クエン酸タモキシフェン)の最も一般的な副作用はのぼせです。これは深刻な問題の兆候ではありません。
次に多い副作用はおりものです。分泌物に血が混じっている場合は、深刻な問題の兆候である可能性があります。 [以下の「子宮内膜または子宮体部の変化」を参照してください。
NOLVADEX (クエン酸タモキシフェン) のあまり一般的ではないが深刻な副作用を以下に示します。これらはいつでも発生する可能性があります。以下にリストされている副作用の兆候がある場合は、すぐに医師に連絡してください。
- 子宮内膜(子宮内膜)または子宮体の変化。 これらの変化は、子宮がんなどの深刻な問題が始まっていることを意味している可能性があります。子宮の変化の兆候は次のとおりです。
- さびた色または茶色の可能性のある膣出血または血性おりもの。少量の出血でも医師に連絡してください。
- 出血の量やタイミング、凝固の増加など、毎月の出血の変化。
- 骨盤(おへその下)の痛みや圧迫感。
- 静脈または肺の血栓。 これらは、死を含む深刻な問題を引き起こす可能性があります。 NOLVADEX (クエン酸タモキシフェン) の服用を中止してから 2 ~ 3 か月後に血栓ができることがあります。血栓の兆候は次のとおりです。
- 突然の胸痛、息切れ、喀血
- 片方または両方の脚の痛み、圧痛、または腫れ
- 脳卒中。 脳卒中は、死亡を含む重大な医学的問題を引き起こす可能性があります。脳卒中の兆候は次のとおりです。
- 顔、腕、脚、特に体の片側の突然の衰弱、うずき、またはしびれ
- 突然の混乱、会話や理解の困難
- 片目または両目の突然の視力障害
- 突然の歩行障害、めまい、バランスまたは協調の喪失
- 原因不明の突然の激しい頭痛
- 白内障または白内障手術が必要になる可能性が高くなります。 これらの問題の兆候は、視界がゆっくりとぼやけることです。
- 黄疸を含む肝臓の問題。 肝障害の兆候には、食欲不振や皮膚や白目の黄変などがあります。
これらは、NOLVADEX (クエン酸タモキシフェン) の考えられるすべての副作用ではありません。完全なリストについては、医師または薬剤師にお尋ねください。
ノルバデックス(クエン酸タモキシフェン)を服用してはいけない人は?
次の場合は、何らかの理由で NOLVADEX (クエン酸タモキシフェン) を服用しないでください。
- ノルバデックス(クエン酸タモキシフェン)の服用中、またはノルバデックス(クエン酸タモキシフェン)の服用を中止してから2か月以内に妊娠中または妊娠を計画している.ノルバデックス(クエン酸タモキシフェン)は、胎児に害を及ぼす可能性があります。 ノルバデックス(クエン酸タモキシフェン)が体内から排出されるまで約2ヶ月かかります。妊娠していないことを確認するには、月経中に NOLVADEX (クエン酸タモキシフェン) の服用を開始できます。または、開始前に妊娠していないことを確認するために妊娠検査を受けることもできます。
- 授乳中です。 NOLVADEX(クエン酸タモキシフェン)が母乳を通過して赤ちゃんに害を及ぼすかどうかはわかりません.
- ノルバデックス(クエン酸タモキシフェン)またはタモキシフェンに対してアレルギー反応を起こしたことがある (ノルバデックス(クエン酸タモキシフェン)の別名)、またはその不活性成分のいずれかに.
ノルバデックス(クエン酸タモキシフェン)の服用中に妊娠した場合は、すぐに服用を中止し、医師に相談してください。ノルバデックス(クエン酸タモキシフェン)は、胎児に害を及ぼす可能性があります。次のような場合は、乳がんになる可能性を下げるためにノルバデックス (クエン酸タモキシフェン) を服用しないでください。
- 治療が必要な血栓ができたことがあります。
- ワルファリン(Coumadin®* とも呼ばれます)など、血液を薄くする薬を服用しています。
- 起きている時間のほとんどは、動き回る能力が制限されています。
- 血栓のリスクがあります。医師は、血栓のリスクが高いかどうかを教えてくれます。
- 乳がんになる可能性は通常よりも高くありません。あなたがリスクの高い女性であるかどうかは、医師が教えてくれます。
ノルバデックス(クエン酸タモキシフェン)の服用方法は?
- 錠剤全体を、水または他の非アルコール性の液体と一緒に飲み込んでください。 NOLVADEX (クエン酸タモキシフェン) は食事の有無にかかわらず服用できます。毎日薬を服用してください。毎日同じ時間に服用すると覚えやすいかもしれません。
- 1回分を飲み忘れた場合は、思い出したときに服用し、次の1回分を通常どおり服用してください。次の服用時間が近い場合、または次の服用時に覚えている場合は、忘れた分を補うために余分な錠剤を服用しないでください.
- 医師の指示がない限り、NOLVADEX (クエン酸タモキシフェン) を 5 年間服用してください。
ノルバデックス(クエン酸タモキシフェン)を服用している間、何を避けるべきですか?
- ノルバデックス(クエン酸タモキシフェン)の服用中、または中止後2か月間は妊娠しないでください。 ノルバデックス(クエン酸タモキシフェン)は、ホルモン避妊法が機能するのを止めることができます.ホルモン療法には、経口避妊薬、パッチ、注射、指輪、インプラントなどがあります。そのため、ノルバデックス(クエン酸タモキシフェン)を服用しながら、 ホルモンを使用しない避妊法を使用し、 コンドーム、殺精子剤を含む横隔膜、単純な IUD など。妊娠した場合は、ノルバデックス(クエン酸タモキシフェン)の服用をすぐに中止し、医師に連絡してください。
- 授乳しないでください。 NOLVADEX(クエン酸タモキシフェン)が母乳を通過できるかどうか、また赤ちゃんに害を及ぼす可能性があるかどうかはわかりません.
ノルバデックス(クエン酸タモキシフェン)を服用している間はどうすればよいですか?
- 定期的な婦人科検診(「女性検診」)、乳房検診、マンモグラムを受けてください。医師が頻度を教えてくれます。これらは、乳癌および子宮内膜(子宮内膜)の癌の徴候をチェックします。ノルバデックス(クエン酸タモキシフェン)はすべての乳がんを予防するわけではなく、他の種類のがんを発症する可能性があるため、がんをできるだけ早く見つけるためにこれらの検査が必要です.
- ノルバデックス(クエン酸タモキシフェン)は深刻な副作用を引き起こす可能性があるため、体に細心の注意を払ってください.あなたが探すべき徴候は、「NOLVADEX(クエン酸タモキシフェン)の起こりうる副作用は何ですか?」にリストされています。
- ノルバデックス(クエン酸タモキシフェン)を服用していることをすべての医師に伝えてください。
- 新しい乳房のしこりがある場合は、すぐに医師に相談してください。
ノルバデックス(クエン酸タモキシフェン)の安全で効果的な使用に関する一般情報
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。あなたの医師は、NOLVADEX(クエン酸タモキシフェン)をあなただけに処方しました。他の人が同様の状態であっても、害を及ぼす可能性があるため、与えないでください。処方されていない状態には使用しないでください。
この投薬ガイドは、ノルバデックス (クエン酸タモキシフェン) を使用して乳癌になる可能性が高い女性または DCIS を有する女性のための、ノルバデックス (クエン酸タモキシフェン) に関する情報の要約です。ノルバデックス(クエン酸タモキシフェン)について詳しく知りたい場合は、医師または薬剤師にお尋ねください。 NOLVADEX (クエン酸タモキシフェン) についての情報を、医療専門家向けに書かれています。 NOLVADEX (クエン酸タモキシフェン) または乳がんに関する詳細については、www.NOLVADEX (クエン酸タモキシフェン) .com をご覧いただくか、1-800-236-9933 までお電話ください。
成分:クエン酸タモキシフェン、カルボキシメチルセルロースカルシウム、ステアリン酸マグネシウム、マンニトール、デンプン。
この投薬ガイドは、米国食品医薬品局によって承認されています
